中国健康受试者中特拉唑嗪的安全性分析
2023-07-31张培雯樊莲莲甘春燕申屠建中
张培雯,樊莲莲,甘春燕,申屠建中,2
(1.四川省德阳市人民医院临床研究中心,四川 德阳 618000;2.浙江大学医学院附属第一医院临床药学研究中心,浙江 杭州 310003)
盐酸特拉唑嗪为新型选择性α1-肾上腺能受体阻滞剂,作用于外周血管、膀胱颈部平滑肌、前列腺表面等,主要用于治疗高血压和改善良性前列腺增生症患者的排尿症状[1,2]。最早于20世纪80年代由美国Abott制药公司研制开发,并于1999年在我国批准上市,目前市售品种包括片剂、胶囊、滴丸。人体生物等效性试验是评价仿制药制剂质量的重要手段,开展试验前通常已积累大量的有效性和安全性临床数据[3],但考虑种族差异、健康受试者与适应症患者之间对不良反应的差异等因素,仿制药与原研药在试验验证阶段仍可能出现药物安全风险[4,5]。本研究旨在比较两种盐酸特拉唑嗪胶囊在健康受试者中空腹与餐后给药条件下的安全性,为临床合理用药提供参考。
1 资料与方法
1.1 一般资料德阳市人民医院I期临床研究中心在2020~2021年开展的2项生物等效性临床试验。纳入标准:①18~45岁的中国健康受试者;②体重指数(BMI)在19~26 kg/m2,男性体重≥50 kg,女性体重≥45 kg;③同意有效避孕6个月。排除标准:①有药物过敏史;②有重大疾病史;③有晕针、晕血史;④有吸烟、酗酒史;⑤体格检查、生命体征检查、实验室检查、心电图及胸部CT检查异常有临床意义者;⑥试验前3个月内参加过其他药物临床试验者。入选68例受试者随机分成空腹组、餐后组各34例。本研究纳入实际参加2项试验的68例受试者,男37例(54.41 %),年龄(25.04±4.80)岁,身高(163.74±8.59)cm,体重(58.77±7.51)kg,BMI(21.84±1.87)kg/m2,汉族66例(97.06 %),两组受试者基本情况比较,差异无统计学意义(P>0.05),见表1。本研究获得德阳市人民医院伦理委员会审批,所有受试者均自愿签署知情同意书。
1.2 方法每组均在给药前禁食10 h以上。空腹试验受试者在给药当天早晨空腹状态下,用240 ml温水送服2 mg原研盐酸特拉唑嗪胶囊(厂家:Sandoz Inc,批号:HK0175)或仿制特拉唑嗪胶囊(厂家:重庆华森制药股份有限公司,批号:2001002),服药后4 h内禁食,4、10 h后统一进食标准餐。餐后试验受试者在给药前30 min进食高脂(提供食物中约50 %的热量)高热(800~1000 kcal)饮食,用餐20 min,给药方法相同。按照随机原则,空腹试验的受试者第1周期服用仿制药,第2周期服用原研药;餐后试验受试者服药顺序相反。服药后,所有受试者住院观察60 h,两次给药之间有7 d清洗期。试验期间,严密监测生命体征(体温、呼吸、脉搏、血压),每周期结束时均进行安全性检查,包括病史问询、体格检查、生命体征、心电图及实验室检查(血常规、血生化、凝血功能、尿液分析、女性血妊娠)。
1.3 观察指标收集入选受试者人口学资料、试验期间发生的所有不良事件(adverse event,AE)。AE定义为受试者接受一种药品后出现的不良医学事件,并不一定与试验药物有关,包括实验室检查、体检等诊断方法的异常结果[6]。根据AE与试验药物的相关性分为:与药物无关的AE(uncorrelated AE,UAE,包括肯定无关和可能无关)、与药物相关的AE(correlative AE,CAE,包括可能有关、很可能有关、肯定有关)。本研究对发生率≥10%的CAE进行特点分析,比较仿制药与原研药、空腹与餐后发生CAE的发生时间(CAE开始时间距离末次给药时间的差值)与持续时间(CAE开始时间与结束时间的差值),探讨特拉唑嗪用药安全性的影响因素。
1.4 统计学方法采用SPSS 26.0统计软件对试验数据进行统计分析。计量资料以均数±标准差表示,两组间比较采用t检验,计数资料用例数(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 发生AE概况本研究中共有47例(69.12 %)受试者发生116例次AE,未发生严重不良事件。根据AE与药物相关性,有41例受试者(60.29 %)发生100例次CAE。其中,33例受试者(48.53 %)服用仿制药后发生50例次CAE,餐后试验组CAE发生率(61.76 %)略高于空腹试验组(35.29 %)。24例受试者(35.29 %)服用原研药后发生50例次CAE,餐后试验组CAE发生率(29.41 %)略低于空腹试验组(41.17 %)。见表2。按照国际医学用语词典(MedDRA)术语集,CAE主要为血管与淋巴管类疾病、各类检查、神经系统疾病。发生率≥10 %的CAE依次为:低血压(38.24 %)、头晕(16.18 %)与臂部脉搏增快(14.71 %)。所有AE均经密切观察,未给予药物治疗,症状缓解或痊愈。
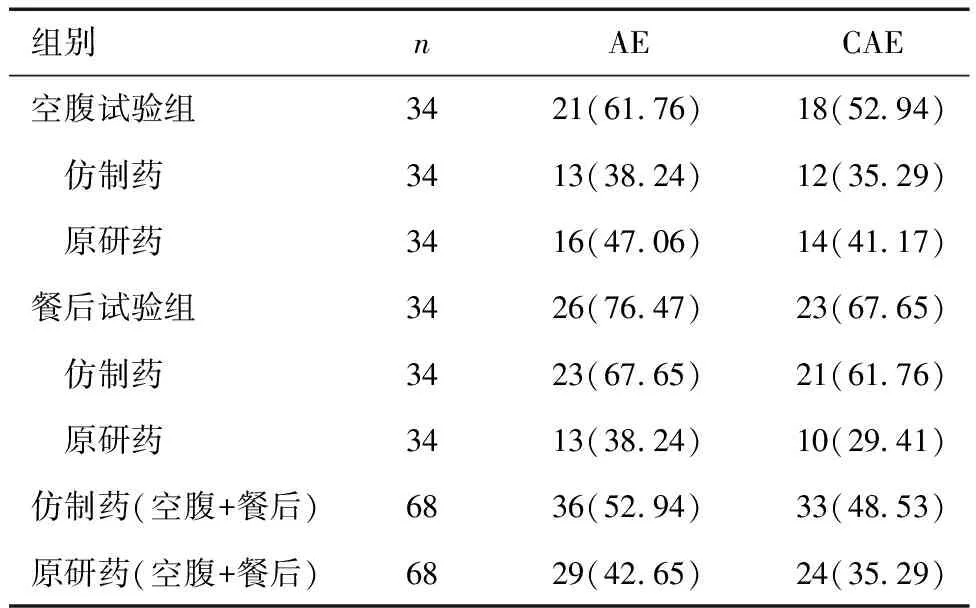
表2 仿制药与原研药的AE/CAE比较 [n(%)]
2.2 特拉唑嗪安全性数据的特点分析低血压、头晕与脉搏增快事件的发生时间大多在给药后12 h内。低血压与脉搏增快事件的平均持续时间在4~10 h。头晕事件的持续时间较短,0.5~1 h内症状缓解或恢复。仿制药与原研药比较,空腹或餐后状态下给药后发生各类CAE的发生时间、持续时间差异无统计学意义(P>0.05)。受试者分别服用仿制药或原研药后,餐后试验组发生低血压事件后的持续时间均显著高于空腹试验组(P<0.05);受试者服用仿制药后,餐后试验组发生脉搏增快事件的时间较空腹试验组更短(P<0.05)。见表3。
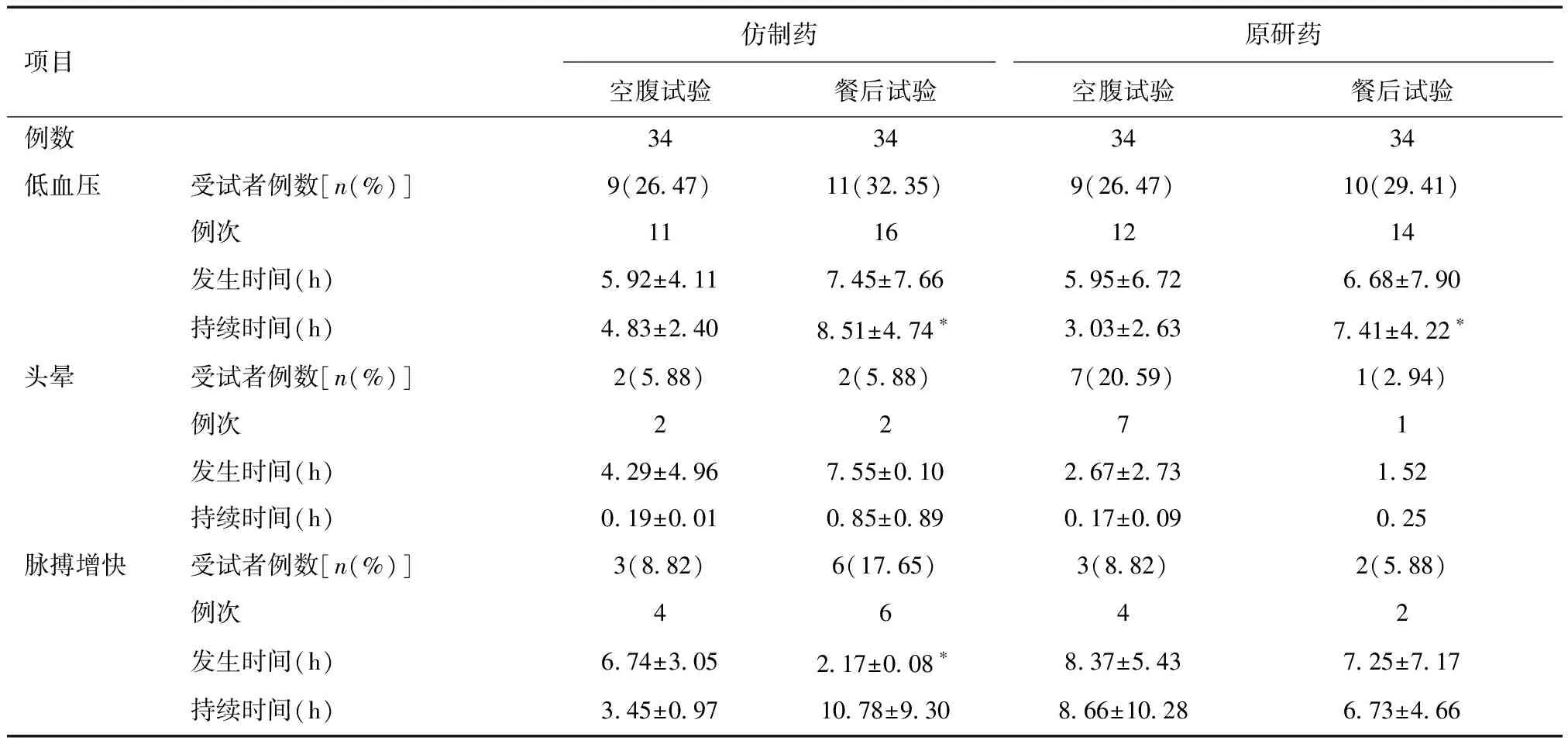
表3 仿制药与原研药的CAE特点分析
3 讨论
对比国内外既往开展的特拉唑嗪生物等效性试验,国内研究报道发生药物相关的AE有10例次,发生率最高为27.78 %[7~10];FDA批准ANDA申请的临床试验中AE发生率最高为57.89 %[11]。本研究纳入的2项生物等效性试验中发生药物相关AE为100例次,发生率(60.29 %)明显高于国内既往报道的安全性数据。分析原因,笔者认为一方面是随着药物临床试验监管政策法规的严格落实,研究者逐渐重视实施过程的质量控制,强调原始数据观察与记录的重要性,收集到更全面的安全性数据;另一方面,随着临床试验全球化趋势以及我国医药研发环境变化,国内临床试验实施标准已与国外基本同步,研究者常规应用常见不良事件评价标准,更为客观准确地判定异常结果。
特拉唑嗪说明书列举的主要不良反应有:头痛、头晕、无力、心悸、恶心、体位性低血压等,通常反应轻微,继续用药症状可自行消失[12]。本研究中药物相关AE主要为低血压、脉搏增快和头晕,Strom等[13]发现特拉唑嗪初始治疗阶段,可观察到心率增快,与阻断α受体导致血管外周阻力降低,压力感受器介导的代偿性交感神经放电有关。Campanero等[14]报道特拉唑嗪可选择性阻断突触后α1受体,但不影响突触前α2受体,由于其本身并不激动或减弱肾上腺素受体,不会引起严重的心动过速。即便如此,本研究纳入的健康受试者中仍发现高发生率的脉搏增快事件,由于此项并未列入药品说明书中,临床用药阶段需警惕首次使用特拉唑嗪对心脏带来的不良影响。
口服药物吸收受诸多因素影响,与食物同服可能会改变药物的疗效和毒性反应[15]。此前国内外报道的特拉唑嗪生物等效性临床试验均采用空腹给药的试验设计,本研究团队报道了中国健康受试者在空腹或餐后状态下给药后的药代动力学研究[16],但未探讨食物对特拉唑嗪用药安全的影响。笔者认为食物影响低血压的缓解,可能与餐后肠系膜上动脉血流增加而导致全身血流动力学改变有关[17]。试验设计采用的高脂高热餐中含有大量脂肪和碳水化合物,进食这两类营养物质可引起内脏血流急剧变化而降低血压和引起头晕[18]。Somberg等[17]报道肠系膜动脉搏动指数与年龄正相关,高龄患者的搏动指数可快速增加,极易发生餐后低血压。因此,对于老年患者服用特拉唑嗪更应警惕低血压的发生,避免与脂肪或碳水化合物同服。
综上,人体生物等效性试验中的不良事件主要来源于药物本身的安全性风险,制剂质量得到生物等效验证后,临床用药阶段仍需持续关注药物安全。此外,本研究纳入人群为中国健康受试者,未考虑种族、年龄与合并疾病对特拉唑嗪安全性的影响,在后续临床研究中拟作进一步探索。
