黄河口盐碱地大豆根瘤菌分离鉴定及田间应用
2023-07-17王庆玲霍雪雪张豪黄艳华郝永任李哲郑泽慧郭凯
王庆玲,霍雪雪,张豪,黄艳华,郝永任,李哲,郑泽慧,郭凯
(齐鲁工业大学(山东省科学院)生物研究所,山东济南 250014)
大豆是重要的食用与饲用作物,可为人类提供优质的油脂和蛋白质。 随着生活水平的提高和饮食结构的变化,畜禽产业对大豆饲料的需求逐年增加,我国大豆消费量逐年攀升,稳居世界第一[1]。 但国内大豆自给率仅有13%,对外依存度极高,且进口渠道狭窄,给国家粮食安全埋下重大隐患[2]。 2019 年农业农村部启动大豆振兴计划,通过扩大大豆种植面积、提高单产水平、改善产品品质,努力增加大豆有效供给,从而提高我国大豆产业质量效益和竞争力[3]。
我国耕地资源十分有限,大豆的单产低于主粮作物,为了保障粮食总产量不下降,扩大大豆种植面积必须在不与粮争地的情况下完成[2]。 盐碱地是我国重要的不可或缺的后备土地资源,其中具有农业利用潜力的达345 万公顷[4],占我国耕地总面积的24%[5]。 增加盐碱地大豆种植面积和产量是振兴我国大豆产业的有力途径。 但盐碱地高盐高碱的不利条件胁迫大豆生长,限制大豆产量[6],因此通过技术手段提高大豆抗性或改良盐碱地成为当前必须努力攻克的难点。
根瘤菌是一类广泛分布于土壤中的革兰氏阴性细菌,能与豆科植物根茎形成根瘤或茎瘤,将空气中的氮素固定为植物可吸收利用的氨,从而促进作物生长[7],并在土壤肥力的改良和保持中发挥重要作用[8]。 研究表明接种根瘤菌可增强大豆对盐胁迫的耐受性,从而提高盐碱地大豆的产量[9-12]。 对根瘤菌的生物地理学研究发现,在特定环境条件下,根瘤菌会与宿主植物协同进化,且优良菌种多来自于宿主植物种植的同一地区[13]。因此,在盐碱地原位筛选土著大豆根瘤菌并应用是促进盐碱地大豆增产的有效措施。 本研究拟从黄河三角洲大豆实验田分离筛选与耐盐碱大豆高效结瘤的根瘤菌,并评价其在盐碱地的促生增产作用,以期为盐碱地大豆高效种植技术的发展提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试土壤 供试土壤于2021 年1 月12 日采自山东省东营市黄河口镇大豆种植实验田(N37°40′49″,E118°50′50″)。 随机间隔20 ~30 m取地表至地下10 cm 盐碱土层,共27 份盐碱土样品。 室温保存待用。
1.1.2 供试大豆 供试大豆由中国科学院遗传与发育生物学研究所提供,共12 个品种,见表1。其中,根瘤菌分离、促生试验和大田试验所用大豆品种为TZX-805,其余品种仅用于根瘤菌回接验证。
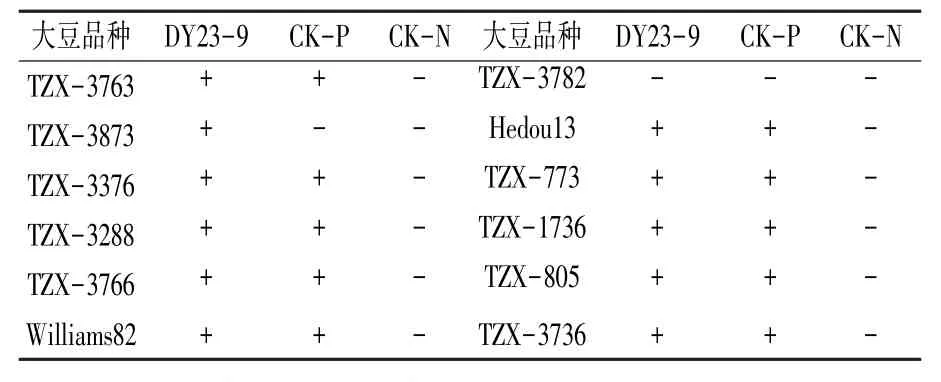
表1 菌株DY23-9 接种不同品种大豆的结瘤情况
1.1.3 供试培养基 酵母甘露醇琼脂(YMA)固体培养基: 甘露醇10 g,酵母提取物1 g,MgSO40.2 g,NaCl 0.1 g,K2HPO40.5 g,琼脂15 g,pH 7.0,蒸馏水1 000 mL。 不加琼脂的培养基(YM 培养基)用于根瘤菌的液体培养。
1.2 试验方法
1.2.1 根瘤菌的分离、纯化和形态学鉴定 于2021 年1—2 月进行根瘤菌分离试验。 取大小适中、结构完整的大豆种子,95%乙醇处理1 min,无菌水洗2~3 次,2%次氯酸钠溶液处理5 min,无菌水洗5 ~7 次,置于0.7%琼脂培养基28℃催芽48 h。 之后胚根朝下植入盛有供试土壤的穴盘,在种子周围施加4 mL 无菌低氮营养液[14],于人工气候箱(6 000 lx、25℃光照14 h, 20℃黑暗处理10 h)中培养,不定期浇无菌水保持土壤湿润。每个土壤样品设3 个重复。 待大豆植株进入三叶期后,用无菌水洗出全部根系,并对根瘤进行消毒,消毒操作与大豆种子相同。 在超净工作台,挑取根瘤内部粉色组织,在YMA 培养基上划线,28℃恒温培养,直至清晰菌落出现。 挑取单菌落在新的YMA 培养基划线纯化,挑取纯化后的单菌落以涂片法制作玻片标本,经革兰氏染色后在电子显微镜(OLYMPUS BX53 型)100 倍油镜下观察菌体形态。
1.2.2 根瘤菌的分子生物学鉴定 利用细菌通用引物对27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)扩增根瘤菌的16S rRNA 基因。 PCR 反应体系(50 μL):菌悬液1 μL,上下游引物各2 μL,2×TaqMix DNA 聚合酶25 μL,Triton(×100) 1 μL,灭菌ddH2O 19 μL。 反应条件:95℃预变性3 min;94℃变性15 s,56℃退火15 s,72℃延伸45 s,35 个循环;72℃终延伸5 min。 扩增产物经琼脂糖凝胶电泳检测后,由生工生物工程(上海)股份有限公司进行双向测序,以cExpress 3.0 软件拼接双向测序所得序列,剪切掉序列两端峰图不清楚的约20 bp 碱基,将所得序列在美国生物信息中心(NCBI)进行同源性比对,选择相似性高的模式菌作为参比菌株,利用MEGA 11 软件中的邻接法构建16S rRNA 基因系统发育树。
1.2.3 根瘤菌的回接鉴定 于2021 年3—4 月进行根瘤菌回接试验。 将根瘤菌接种于YMA 培养基28℃培养72 h 后接种于YM 培养基,28℃、150 r/min 培养72 h,所得菌液转移至无菌离心管中8 000 r/min 离心5 min,去上清加入无菌水制成菌悬液备用(OD600=1.0)。 将27 份供试土壤混合后过5 mm 筛去除土壤中的薄膜和枯枝等杂物,混入体积分数10%的蛭石,121℃灭菌20 min后放置室温24 h,重复灭菌一次待用。 大豆的消毒、育芽等操作同1.2.1,待大豆种子胚根发育超过1 cm 时移栽进穴盘中,加入10 mL 低氮营养液和1 mL 根瘤菌菌悬液,以不接菌为阴性对照(CK-N),以接模式菌株USDA110 菌悬液为阳性对照(CK-P),每个处理6 个重复。 培养条件同1.2.1,培养至第三片三出复叶展开(30 d 左右),用无菌水洗出全部根系,统计大豆根部的结瘤情况。
1.2.4 根瘤菌的生理特性测定 碳源利用情况测定:将根瘤菌接种至YM 培养基中,28℃、150 r/min培养72 h,将菌液按每孔200 μL 加到Biolog ECO 板中,28℃培养10 d,观察培养基颜色变化。
生长曲线和世代时间测定:用酶标仪(Read-Max 1900 型)于每日固定时间测定ECO 板的OD590值和OD750值,实际OD 值为OD590-OD750,统计根瘤菌对不同碳源的利用情况,并绘制生长曲线,由对数生长期OD 值的翻倍时间计算出菌株的世代时间[15]。
抗生素抗性测定:用无菌镊子夹取6 片不同种类的抗生素药敏纸片(Oxoid)等距放置于涂有培养72 h 的根瘤菌菌液的YMA 培养基,28℃培养72 h,测量抑菌圈直径,观察根瘤菌抗生素抗性情况。
1.2.5 根瘤菌抗逆性测定 考察根瘤菌对温度、高盐和酸碱度的耐受能力,并与模式菌株USDA110 和USDA205 对比。 每个处理设3 个重复。
温度适应性:将根瘤菌接种于YMA 培养基后分别放置在7、14、21、28、35、42℃培养72 h,记录根瘤菌的生长情况。
耐盐性:以普通YMA(NaCl 含量为0.01%)为对照,制备含1%、2%、3%、4%、5% NaCl 的YMA 培养基,接种根瘤菌,28℃静置培养72 h 后观察生长情况。
酸碱适应性:以普通YMA 为对照,制备pH值为3、5、7、9、11 的YMA 培养基,接种根瘤菌,28℃静置培养72 h 观察生长情况。
1.2.6 根瘤菌的促生作用测定 于2021 年5—6月进行根瘤菌促生试验。 选取结瘤较好的TZX-805 品种大豆做促生试验,大豆消毒、育芽等与1.2.1同,根瘤菌的培养方法与1.2.3 同。 促生试验采取滤纸水培法:(1)将直径11 cm 滤纸卷起塞入底部开口的50 mL 离心管,121℃灭菌20 min,冷却。 (2)将发芽的大豆种子胚芽向下插进滤纸卷,将离心管放进无菌离心管盒中,用无菌水打湿滤纸,保证胚芽能够紧贴滤纸。 (3)每管加入1 mL 根瘤菌菌悬液(OD600=1.0),10 mL 低氮营养液,最后盒中加满无菌水,并定期补足水分。以加入无菌水代替菌悬液为空白对照,每个处理设12 个重复。 (4)在单叶期追加菌悬液1 mL,低氮营养液10 mL。 在培养至第三片三出复叶展开后,测定植株的株高、茎粗、根长、根瘤数、鲜重和干重等。
1.2.7 根瘤菌的大田增产作用 于2021 年6—10 月在山东省东营市黄河口镇大豆种植实验田(N37°40′49″,E118°50′50″)进行。 试验地为盐碱土荒地,土壤盐含量0.3%~0.6%,土壤pH≥8.0,有机质含量为0.61%~1.01%。 播种前一次性基施氮磷钾复合肥(山东青上化工有限公司红狮复合肥15-15-15 型)420 kg/hm2。 小区面积为30 m2(8 m × 3.75 m),长边方向种植6 行大豆,行间距0.5 m。 小区间设置1.25 m 间距,重复6 次。以常规种植为对照组(CK),根瘤菌处理组在播种时种子周围土壤施加6 L/hm2YM 培养7 d 的根瘤菌菌液(OD600>1.0)。 种植期共100 天,在第80天进行田间调查,测量株高、茎粗、根瘤数等生长指标。 收获期测定大豆产量、单株粒重和百粒重,计算大豆每公顷产量。
1.3 数据统计与分析
用Microsoft Excel 2016 和Origin 2021 软件处理数据与作图,运用IBM SPSS Statistics 21 进行单因素方差分析,用LSD 检验法进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 根瘤菌的分离鉴定
从27 份土壤样品中共分离出267 株菌。 采用形态学鉴定、分子生物学鉴定和回接鉴定相结合的方式筛选目标根瘤菌,共筛得10 株根瘤菌,以下结果以菌株DY23-9 进行说明。
2.1.1 根瘤菌的形态学和分子生物学鉴定DY23-9 菌株在光学显微镜下呈短杆状,长约2~4 μm,革兰氏染色后呈红色,为革兰氏阴性细菌,不产芽孢,菌体内部有被番红染色液染红的横膈(图1A)。 它在YMA 培养基上形成圆形或近似圆形、粘稠、光滑、湿润、微微凸起的淡粉色菌落(图1B)。 这些形态特征与大豆根瘤菌的已知特征相符[16],初步判断菌株DY23-9 为大豆根瘤菌。
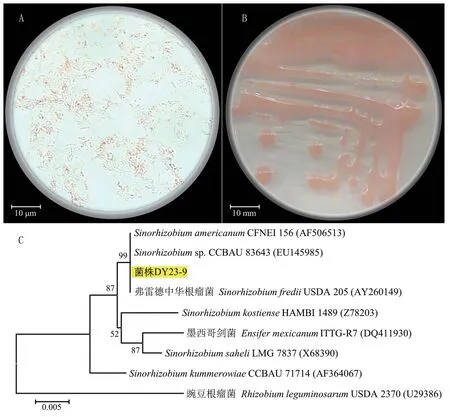
图1 菌株DY23-9 的显微形态(A)、菌落形态(B)和16S rRNA 基因系统发育树(C)
将菌株DY23-9 的16S rRNA 序列扩增和测序后,在NCBI 数据库中进行同源性比对看出,该菌株与登录号为EU145985.1 的中华根瘤菌属(Sinorhizobiumsp.)菌株序列同源性最高,达到99.78%。运用Mega 11 软件以邻接法建立系统发育树(图1C)显示,菌株DY23-9 与弗雷德中华根瘤菌(Sinorhizobium fredii)同属一个遗传分枝,亲缘关系较近。 结合形态学和分子生物学鉴定结果,确定菌株DY23-9 为弗雷德中华根瘤菌(Sinorhizobium fredii),属于快生型大豆根瘤菌。2.1.2 根瘤菌的回接鉴定 将菌株DY23-9 回接于12 个不同品种的大豆,结瘤情况如表1 所示。除TZX-3782 外,其他品种的大豆都有结瘤现象,说明菌株DY23-9 是一株能够与大豆匹配结瘤的根瘤菌。
2.2 菌株DY23-9 的生理特性
2.2.1 菌株DY23-9 的碳源利用情况 利用图2所示的单一碳源ECO 板对菌株DY23-9 进行培养和观察,孔内含有四唑紫染料,若孔内颜色变紫则说明菌株可利用孔内碳源,紫色深浅代表了菌株对孔内碳源的利用能力大小。 结果表明,菌株DY23-9 可以利用糖类(A2、G1、H1)、酸类(B3、E3、F2、H3)、氨基酸类(A4、B4、C4、D4、E4、F4)、酯类(A3、B1)、醇类(D2、H2)、胺类(E2)共18 种不同类型的单一碳源。
2.2.2 菌株DY23-9 的生长曲线和世代时间 由图3 可知,最有利于菌株DY23-9 生长繁殖的5种单一碳源为D-苹果酸(H3)、L-天冬酰胺酸(B4)、L-丝氨酸(D4)、D-甘露醇(D2)和N-乙酰基-D-葡萄胺(E2),呈典型的S 型生长曲线,说明菌株经历了生长繁殖的迟缓期、对数期和稳定期。 以对数期OD 值的翻倍时间推算的世代时间分别为4.19 h(H3)、6.11 h(B4)、5.77 h(D4)、6.62 h(D2)和9.49 h(E2)。
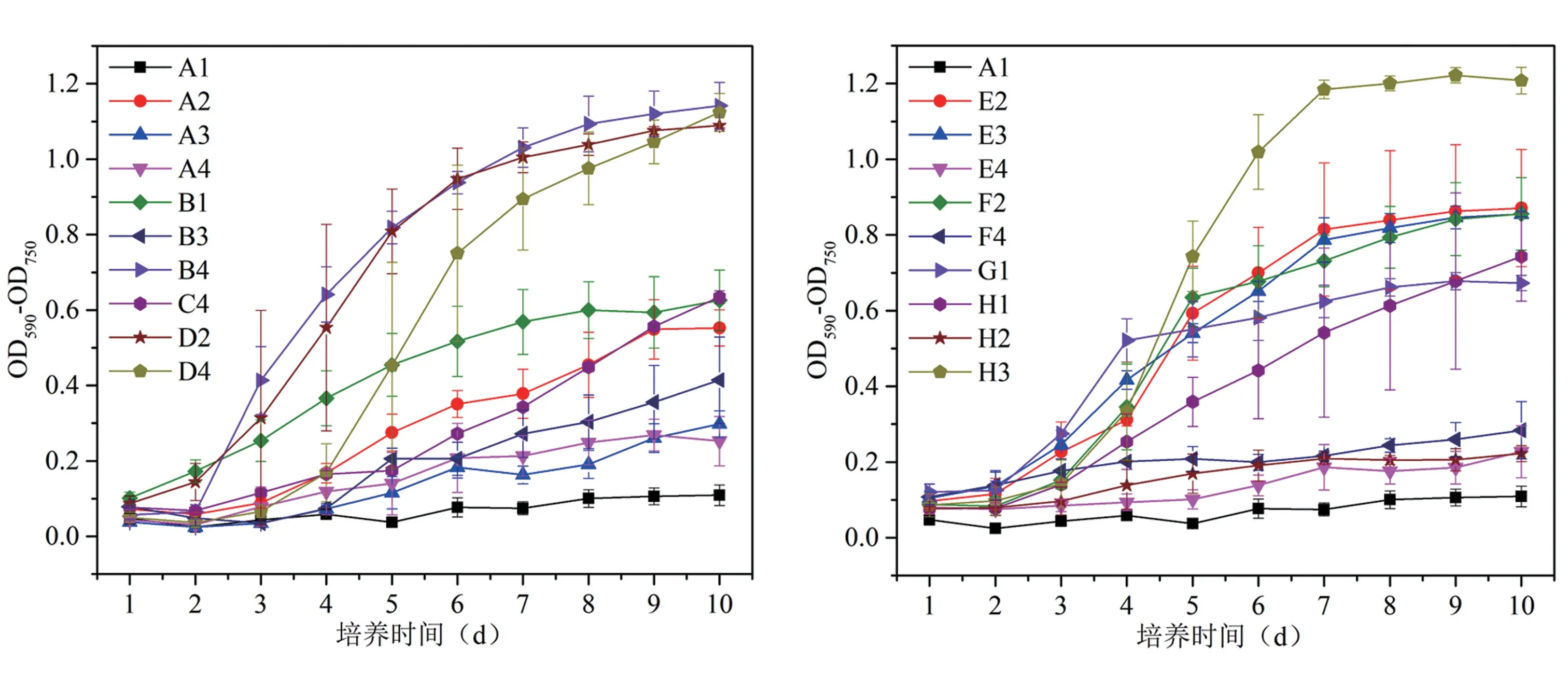
图3 菌株DY23-9 可利用碳源生长曲线
2.2.3 菌株DY23-9 的抗生素敏感性 抑菌圈直径9~15 mm 为中介,低于9 mm 为耐药,高于15 mm 为敏感。 由表2 可知,四环素抑菌圈最大,直径达63.5 mm,同浓度下氯霉素抑菌圈仅16.2 mm。 红霉素的抑菌圈直径为25.0 mm,与庆大霉素相差不大。 菌株DY23-9 对头孢哌酮的敏感性较低,其抑菌圈直径为12.2 mm,对低浓度的青霉素耐药。
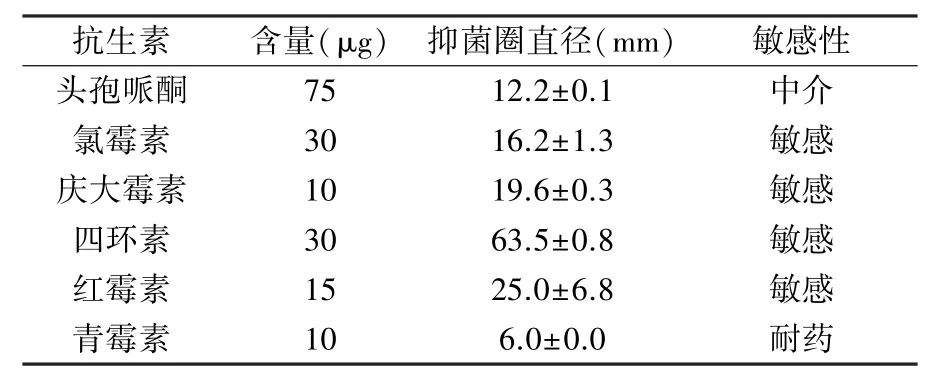
表2 菌株DY23-9 的抗生素敏感性
2.3 根瘤菌的抗逆性
由图4A 可知,菌株DY23-9 能够在14~35℃间生长,而模式菌株USDA110 仅能在28℃和35℃下生长,与DY23-9 亲缘关系较近的模式菌株USDA205 在21℃下也能生长,但生物量明显下降。 与模式菌株相比,菌株DY23-9 具有更广泛的温度适应性,并且在较低温度下具有生长优势。

图4 菌株DY23-9 对温度(A)、盐浓度(B)和酸碱度(C)的适应性
不同盐浓度下的培养情况如图4B 所示,模式菌株USDA110 对盐胁迫敏感,菌株DY23-9 和USDA205 能够耐受2%的盐浓度,但DY23-9 在2% NaCl 的培养基中菌落生物量高于USDA205,说明菌株DY23-9 比模式菌USDA205 在盐胁迫下更具生长优势。
不同酸碱度下的培养情况见图4C,菌株DY23-9 和USDA205 对酸胁迫敏感,在pH 值为7~9时生长旺盛,USDA205 在pH 值为11 时仍能够保持一定生物量,具有耐受强碱的能力。 模式菌株USDA110 则相反,其能在pH 值为5 时生长繁殖,但不能适应碱性环境。
2.4 根瘤菌对大豆生长的影响
基于2.1.2 回接试验结果,选取结瘤效果较好的TZX-805 大豆进行促生试验,考察菌株DY23-9 在实验室条件下对大豆的促生作用。 结果表明,接种菌株DY23-9 处理组的大豆株高大于未接菌的对照组(图5A),处理组根系有明显的根瘤,根毛数量多,根长比对照组短(图5B)。分析植株生长指标可知,处理组株高和鲜重显著高于对照组,分别比对照提高13.1%和18.7%(图5C、G)。 根长显著低于对照组,但处理组平均每株结瘤(9.3±1.5)个,对照组未结瘤(图5E、F)。茎粗和干重与对照组没有显著差异(图5D、H)。这说明菌株DY23-9 可以促进大豆根系结瘤,减少根系长度,从而促进植株地上部生长。
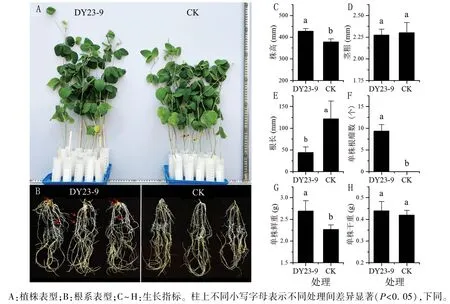
图5 菌株DY23-9 对大豆TZX-805 的促生作用
2.5 根瘤菌对盐碱地大豆生长和产量的影响
在大豆生育期第80 天,测量大豆的株高、茎粗和单株根瘤数。 结果(图6A ~C)表明,接种菌株DY23-9 能促进盐碱地大豆生长,株高比对照组显著提高29.9%,茎粗提高4.4%。 对照组大豆的单株根瘤数平均为62.2 个,接种DY23-9 后单株根瘤数显著提高37.6%,表明DY23-9 对大豆结瘤和生长具有显著的促进作用。
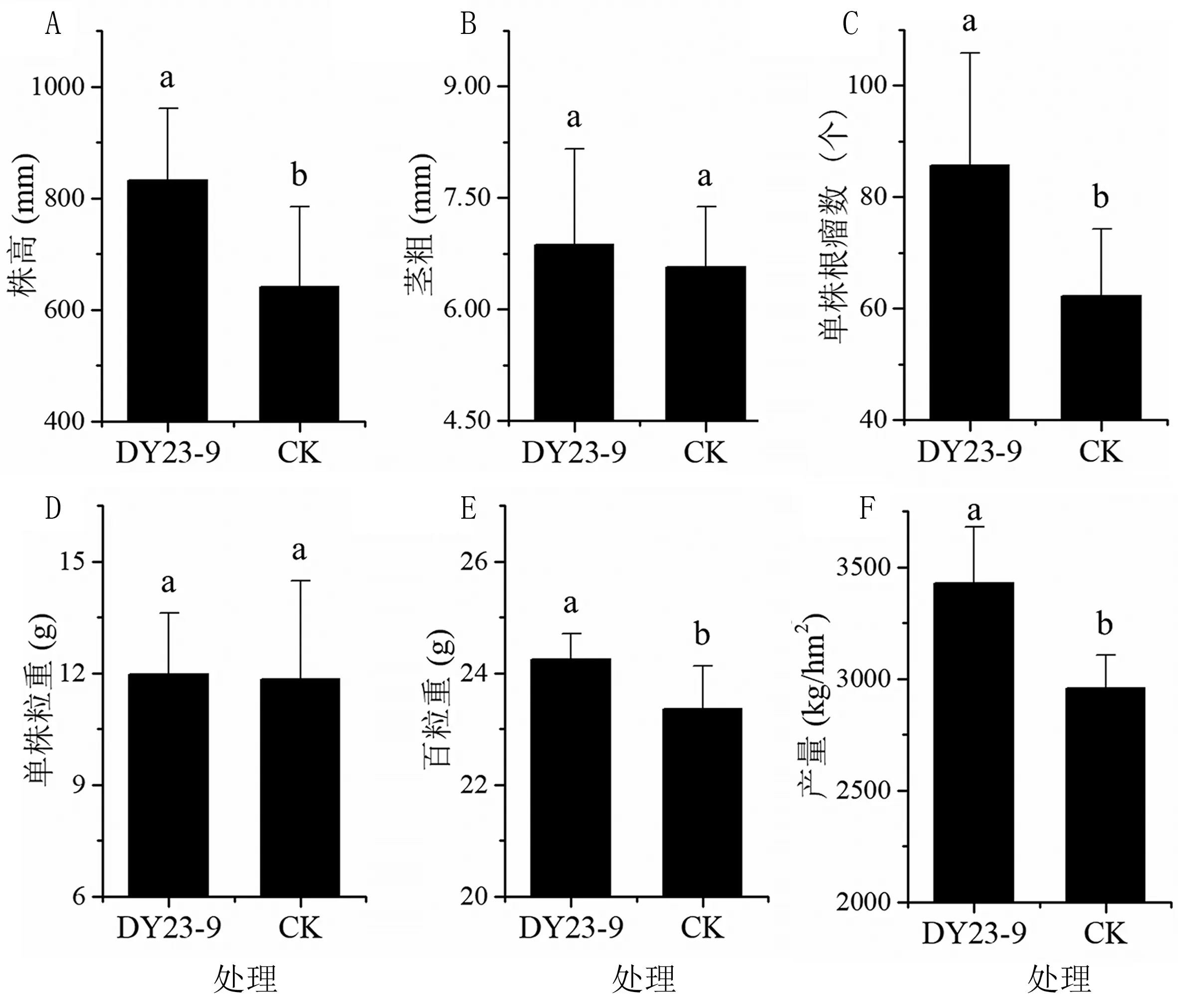
图6 盐碱地大田条件下菌株DY23-9 的促生增产作用
在大豆生育期第100 天收获大豆,测其单株粒重、百粒重和产量(图6D ~F)。 接种DY23-9后大豆的单株粒重、百粒重和产量分别为11.97 g、24.25 g 和3 429.13 kg/hm2,分别比CK 增加1.0%、3.8%和15.9%。 其中,单株粒重差异不显著,百粒重和产量均显著提高,表明菌株DY23-9可以增加盐碱地大豆产量。
3 讨论与结论
本研究以耐盐碱大豆为宿主,从黄河三角洲东营黄河口地区的盐碱土中分离和纯化大豆根瘤菌,利用形态学、分子生物学等方法,得到一株弗雷德中华根瘤菌属(Sinorhizobium fredii)的快生型大豆根瘤菌菌株DY23-9。 齐文静[17]对野生大豆根瘤菌多样性的研究表明,中华根瘤菌是黄河三角洲的优势菌群;张红侠[18]研究显示,快生型根瘤菌S.fredii是黄土高原地区的优势菌群。 这说明弗雷德中华根瘤菌在黄河流域中下游具有广泛的分布,对该种群的深入研究将有利于黄河流域大豆种植。
在回接试验中,并非所有大豆品种都能与菌株DY23-9 结瘤,这体现了根瘤菌与大豆品种之间具有宿主选择性[19]。 史清亮等[20]在对S.fredii菌株结瘤性能的研究中发现其对大豆品种的选择性较强,并且与当地品种具有较好的匹配性。 原因可能为:(1)根瘤菌通过结瘤因子的形成、细菌侵染和释放相关的脂多糖或胞外多糖以及细菌效应因子的特异性等使其能够被大豆识别匹配[21];(2)大豆通过相关信号调节根部结瘤的数目[22]。近期也有研究表明光照也是大豆结瘤的关键因素[23]。 高运来等[24]的研究显示,植株结瘤数量能够影响植株的生物量,结瘤数量过多过少都对生物量的增加有不利影响。 因此,在选择根瘤菌时,考察菌种与大豆品种之间能否形成良好的共生关系是必要的。
在生理特性和抗逆性方面,根瘤菌DY23-9最短的世代时间是4.13 h,生长繁殖速度较快;能够利用β-甲基D-葡萄糖苷等18 种单一碳源,说明其能在多种营养条件下生长;菌株DY23-9 的最适生长温度在14 ~35℃之间,在盐浓度0.01%~2%、pH 值为7 ~9 环境下能正常生长,并能够耐受低剂量的青霉素和头孢哌酮,环境适应性较强。胡千德等[25]从湖北灰潮土中分离得到的一株S.fredii具有耐受1%盐浓度和pH 值为8 的碱性环境的能力。 根瘤菌的最适pH 值一般为6.7 ~7.5[26]。S.fredii在实验室培养条件下可以产酸以及分泌酸性胞外多糖,这可以帮助其在碱性土壤中生存[27]。 根瘤菌的最适生长温度一般在25 ~30℃[26]。S.fredii能够耐受较低的温度可能与体内尿嘧啶核苷酸激酶、乙酰辅酶A 乙酰基转移酶等蛋白表达上调有关[28]。
本研究从实验室和大田两方面评估了菌株DY23-9 对盐碱地大豆生长发育的促进作用和对大豆产量的影响。 接种根瘤菌DY23-9 能够显著增加结瘤率,株高和鲜重也有明显增加,但根长比对照组短,根毛数量比对照组多,推测菌株DY23-9 可能通过增加根毛数量、减弱根毛长势来增强植株结瘤能力、增加根瘤数量,促进植株地上部的生长。 梁静[10]研究表明,大豆在受到胁迫时,除大豆自身系统的调节外,根瘤菌可加强与大豆的共生结瘤,为植株提供更充足的生长条件,并通过调节1-氨基环丙烷-1-羧酸(ACC)脱氨酶的合成、植物激素的生物合成、诱导系统耐受性和渗透保护等参与并加强大豆抵御不利生长环境的能力。 本研究大田试验表明,接种根瘤菌DY23-9显著提高株高、茎粗、单株根瘤数,证明根瘤菌DY23-9与耐盐碱大豆品种TZX-805 具有优异的共生匹配性能,能在盐碱地大田环境下发挥作用。虽然大豆单株粒重未发生明显变化,但大豆的百粒重和产量显著高于对照组,表明根瘤菌DY23-9 对盐碱地大豆有明显的增产作用。 综上,DY23-9 菌株可作为优势土著菌株接种,具有推广应用价值。
