黄瓜肌醇半乳糖苷合成酶基因GolS2 克隆与表达调控
2023-07-17袁晓杨盼迪朱云娜王玉昆王斌
袁晓,杨盼迪,朱云娜,王玉昆,王斌
(韶关学院生物与农业学院/广东省粤北食药资源利用与保护重点实验室,广东韶关 512005)
非生物胁迫如干旱、重金属、高低温、盐渍、水浸等会对植物的生长发育和地理分布、作物产量和品质等造成严重影响[1,2]。 随着全球气候变暖,各种极端天气频繁发生,加剧了非生物胁迫对农作物生产的影响[3]。 与动物可随时移动不同,植物一旦在特定介质上固着,便不能自主移动[4],因此,植物与动物应对非生物胁迫的方式有着很大不同,植物必须依靠自身的防御系统抵抗或适应非生物胁迫。 植物适应非生物胁迫的途径主要包括:激活自身的抗氧化防御系统,诱导抗逆相关基因转录和蛋白积累,促进渗透物质的积累以保持细胞内外渗透平衡[5]。
在遇到非生物胁迫时,植物细胞内可溶性糖等渗透性物质的合成积累,被认为是植物增强非生物胁迫抗性的重要方式[6]。 增加细胞内渗透性物质的含量,能提高细胞渗透势,增强植物对逆境胁迫的耐受性[7]。 棉子糖系列寡糖(raffinose family oligosaccharides, RFOs)是重要的渗透调节物质[8],同时也是葫芦科植物同化物的主要运输形式[9]。 因此,RFOs 在葫芦科植物中具有双重作用,既起到渗透调节的作用,还负责同化物的运输。 肌醇半乳糖苷合成酶(galactinol synthase,GolS)是催化RFOs 合成第一步反应的关键调节酶,直接催化肌醇和UDP-半乳糖形成肌醇半乳糖苷[6]。 因此,GolS 在调控RFOs 合成和增强葫芦科植物抗逆性中具有重要作用。
黄瓜(Cucumis sativus)是葫芦科黄瓜属一年生攀援性草本植物,喜温,是我国重要的经济作物[10,11]。 黄瓜对高低温、盐碱等非生物胁迫的耐受能力较差,盐胁迫和高低温胁迫严重影响其生长发育,甚至降低采后黄瓜的品质和耐贮性,往往导致严重的经济损失[12,13]。 据报道,黄瓜基因组中共含有4 个GolS基因,它们在多种非生物胁迫处理后在黄瓜叶片中显著上调表达,其中GolS1表达上调能在低温胁迫条件下促进同化物在韧皮部的装载,提高叶片光合作用效率,促进RFOs 积累[9]。 低温和干旱胁迫处理诱导黄瓜GolS4基因在叶片中的表达,过表达GolS4基因提高RFOs 含量,降低活性氧(reactive oxygen species, ROS)含量;相反,沉默GolS4基因表达的转基因黄瓜在干旱胁迫处理后更容易萎蔫[14]。 这些研究结果表明,GolS基因在黄瓜抵抗低温和干旱等非生物胁迫过程中具有重要作用。 采后黄瓜属于离体器官,黄瓜GolS基因的功能在离体器官和非离体器官中是否保守,目前仍不清楚。
本研究从黄瓜中克隆了GolS2基因,分析了其氨基酸序列特性及与其他植物GolS2 的序列差异,并研究了GolS2基因在黄瓜幼苗和采后黄瓜中响应非生物胁迫的差异,以期为揭示黄瓜GolS2基因的生物学功能奠定理论基础。
1 材料与方法
1.1 试验材料和试验处理
所用黄瓜品种为“翠夏”和“津春2 号”,克隆载体为pMD18-T,VIGS 实验载体为pTRV1 和pTRV2,均由本实验室自行扩繁保存。 大肠杆菌DH5α 感受态细胞购自上海唯地生物有限公司,高保真PCRTaq酶和植物总RNA 提取试剂盒由北京天根生化科技有限公司提供,cDNA 合成试剂盒购自上海翌圣生物科技股份有限公司。
于2020 年5 月在本地黄瓜种植基地采收即将上市的黄瓜果实,室温条件下一小时内运回实验室。 挑选成熟度基本一致、大小均一的黄瓜果实作为试验材料。 将挑选好的采后黄瓜分成两组,每组含有3 个独立的生物学重复,每个生物学重复含有10 根黄瓜。 采后黄瓜装框,并用塑料薄膜保鲜袋密封包装,分别在5℃和10℃贮藏库(相对湿度95%~98%)中贮藏72 h。
1.2 试验方法
1.2.1 黄瓜GolS2基因全长克隆 在黄瓜基因组数据库(http:/ /www.cucurbitgenomics.org/)中检索GolS2(登录号:CsaV3_1G015730)基因,并根据mRNA 序列设计特异引物。 引物由生工生物工程(上海)有限公司广州分公司合成,序列如表1 所示。 使用植物RNA 提取试剂盒(北京天根生化科技有限公司)提取黄瓜总RNA,运用反转录试剂盒(上海翊圣生物科技有限公司)合成cDNA。以cDNA 为模板,采用RT-PCR 扩增黄瓜GolS2全长序列。 PCR 反应程序:94℃预变性5 min;94℃变性35 s,58℃退火35 s,72℃延伸5 min,35个循环;最后72℃延伸10 min。 PCR 产物经琼脂糖凝胶电泳确认长度后,回收并连接到pMD18-T(日本Takara 公司) 载体上,并转化DH5α 感受态细胞。 挑取阳性单菌落扩繁,并送至生工生物工程(上海)有限公司广州分公司测序鉴定。
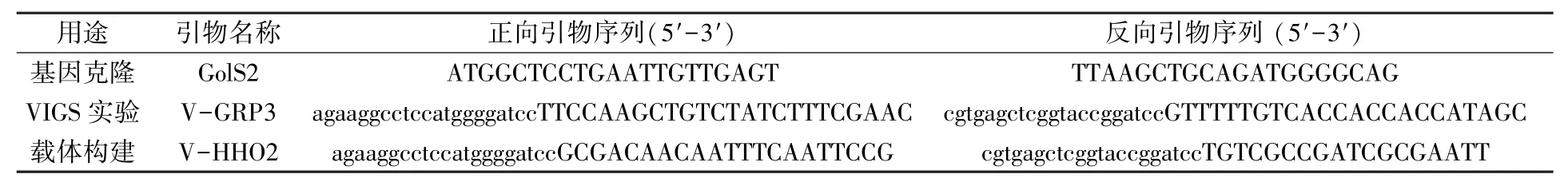
表1 引物信息
1.2.2 生物信息学分析 在ExPASy 平台完成黄瓜GolS2 蛋白理化性质分析,利用Cell-PLoc 2.0在线预测蛋白的亚细胞定位。 在黄瓜基因组中调出GolS2翻译起始密码子ATG 上游1 500 bp 长度的DNA 序列,提交PlantCARE 分析其启动子中的顺式作用元件,并用TBtools 软件绘制作用元件在启动子中的定位[15]。 在NCBI 数据库中同源比较,挑选出同源性较高的同源蛋白。 使用DNAMAN 软件比对氨基酸序列,并用MEGA 软件(Neighbor-Joining 法)构建系统进化树。 本研究用到的生物信息学分析软件或在线工具见表2。

表2 本研究用到的生物信息学分析工具
1.2.3 采后黄瓜VIGS 沉默实验 黄瓜HHO2(hypersensitive to low Pi - elicited primary root shortening homologue 2)是一个MYB like 转录因子,GRP3(glycine-rich RNA-binding protein 3)是一个RNA 结合蛋白,他们对低温应答基因的表达具有调节作用[16-19]。 为研究两基因对黄瓜GolS2基因表达的调节作用,对采后黄瓜进行VIGS 沉默实验。
在HHO2和GRP3基因全长序列的3′端附近设计引物,并在上、下游引物序列的5′端加入BamH Ⅰ酶切位点序列,引物信息见表1。 以cDNA 为模板,使用高保真PCRTaq酶扩增目的片段。 目的片段经酶切和凝胶电泳分离后,与pTRV2 质粒相连接。 重组质粒转化DH5α 感受态细胞,经测序鉴定后,提取重组质粒并转化农杆菌感受态GV3101 细胞。
将含有pTRV1 空载的农杆菌分别与含pTRV2-HHO2 和pTRV2-GRP3 重组质粒的农杆菌单独或同时等体积混匀,室温静置2 h。 使用医用注射器,将农杆菌分别注射在黄瓜果实的三个部位(远离果蒂5 cm、远离果柄5 cm、果柄和果蒂之间的最中间部位)。 然后将果实装在果篮中,用聚乙烯塑料薄膜袋包装果篮。 室温(25℃)暗培养48 h,使农杆菌恢复活性,充分沉默目的基因。 将整个果篮转移至5℃冷库贮藏72 h,检测沉默HHO2和GRP3基因对采后黄瓜GolS2基因表达的影响。
1.2.4 基因的表达分析 由北京百迈客生物科技有限公司完成处理样品的总RNA 提取和测序建库,并利用Illumina next seq 2500 测序平台完成转录组测序工作,测序流程和数据处理方法见参考文献[20]。 用FPKM(fragments per kilobase per million mapped reads) 值表示GolS2的表达水平。
1.3 数据分析
在Mircrosoft Excel 2016 软件中整理数据,利用SPSS 22.0 软件分析数据之间的差异显著性。
2 结果与分析
2.1 黄瓜GolS2 基因克隆及结构分析
如图1A 所示,从黄瓜中克隆出了一条约1 000 bp的DNA 片段,总体与黄瓜GolS2基因长度(981 bp)一致。 将该DNA 片段与pMD18-T 载体相连接,转化DH5α 感受态细胞扩繁,经测序验证,目的产物正是CsGolS2基因。 该基因定位在1号染色体,ORF 由4 个不同长度的外显子构成(图1B),第一个外显子最长(406 bp),第三个外显子长度只有135 bp。
图1 黄瓜果实GolS2 全长PCR 电泳图(A)及其在染色体上的定位(B)
2.2 CsGolS2 基本特征分析
CsGolS2基因ORF 全长981 bp,编码326 个氨基酸(图2)。 理论分子量为37.83 kDa,等电点为5.51。 氨基酸中带负电荷的残基总数为42 个,带正电荷的残基总数为32 个。 编码蛋白质的不稳定系数为41.45,属于不稳定蛋白,脂肪族指数为78.31,平均疏水指数为-0.34。

图2 黄瓜CsGolS2 开放阅读框序列及推导的氨基酸序列
CsGolS2 蛋白的氨基酸序列中含有5 个保守的丝氨酸磷酸化位点,在C 端还含有1 个疏水性APSAA 五肽结构(图2),这些是植物GolS 蛋白的典型特征[21]。 亚细胞定位预测结果显示,Cs-GolS2 蛋白可能定位在细胞壁、叶绿体、细胞质和线粒体等亚细胞器中。
2.3 多序列比对与进化分析
CsGolS2 与葫芦科其他4 种植物GolS2 的氨基酸序列一致性很好(图3),表明葫芦科植物GolS2 蛋白保守性很高,推测葫芦科植物GolS2 蛋白的生物学功能可能保守。 其中,CsGolS2 与甜瓜(Cucumis melo)CmeGolS2 蛋白(XP_008463593.1)的序列一致性最好。

图3 5 种葫芦科植物GolS2 蛋白的氨基酸多序列比对
CsGolS2 与其他8 种植物GolS2 蛋白的同源性分析结果如表3 所示,可见CsGolS2 与其他8种植物GolS2 蛋白的氨基酸序列同源性介于73.06%~97.85%之间,与甜瓜GolS2 的同源性最高,为97.85%。 说明植物GolS2 在进化过程中高度保守,暗示着它们具有相似的生物学功能。
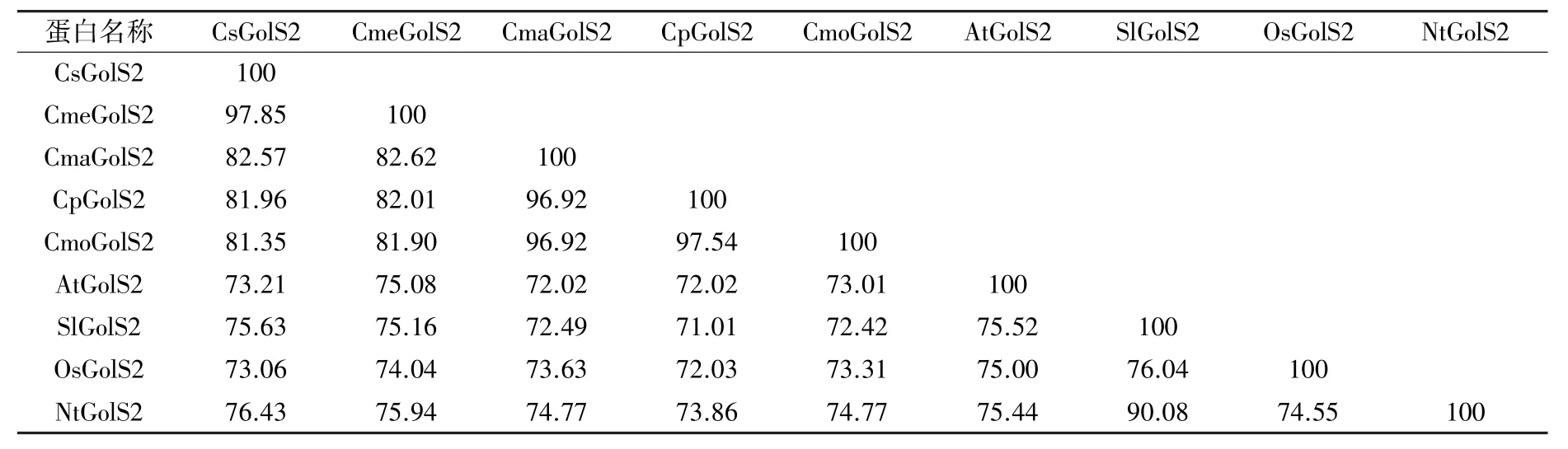
表3 不同植物GolS2 蛋白同源性比较 (%)
比较了CsGolS2 蛋白与4 种模式植物GolS2蛋白的氨基酸序列相似性和结构域保守性,结果(图4)显示,尽管5 种植物GolS2 蛋白的氨基酸序列长度有所不同,但序列中均含有一个糖基转移酶保守结构域,属于糖基转移酶超级家族;且保守结构域的氨基酸序列一致性很高,表明保守结构域的保守性很高。

图4 黄瓜与4 种模式植物GolS2 蛋白的氨基酸序列比对
在拟南芥(Arabidopsis thaliana)基因组数据中共鉴定出了9 个GolS基因,分别命名为At-GolS1~AtGolS9。 拟南芥通常被作为研究候选基因功能的模式植物,相关基因的功能已研究的比较清楚,因此,比较了CsGolS2 蛋白与拟南芥GolS家族蛋白的进化关系(图5),以期在一定程度上推测CsGolS2 蛋白的生物学功能。 可以看出,拟南芥GolS 家族蛋白可分为两组,AtGolS8 和At-GolS9 聚在一组,黄瓜GolS2 与其他7 个拟南芥GolS 蛋白聚在另一分支,CsGolS2 与AtGolS2 和AtGoLS3 的亲缘关系最近。
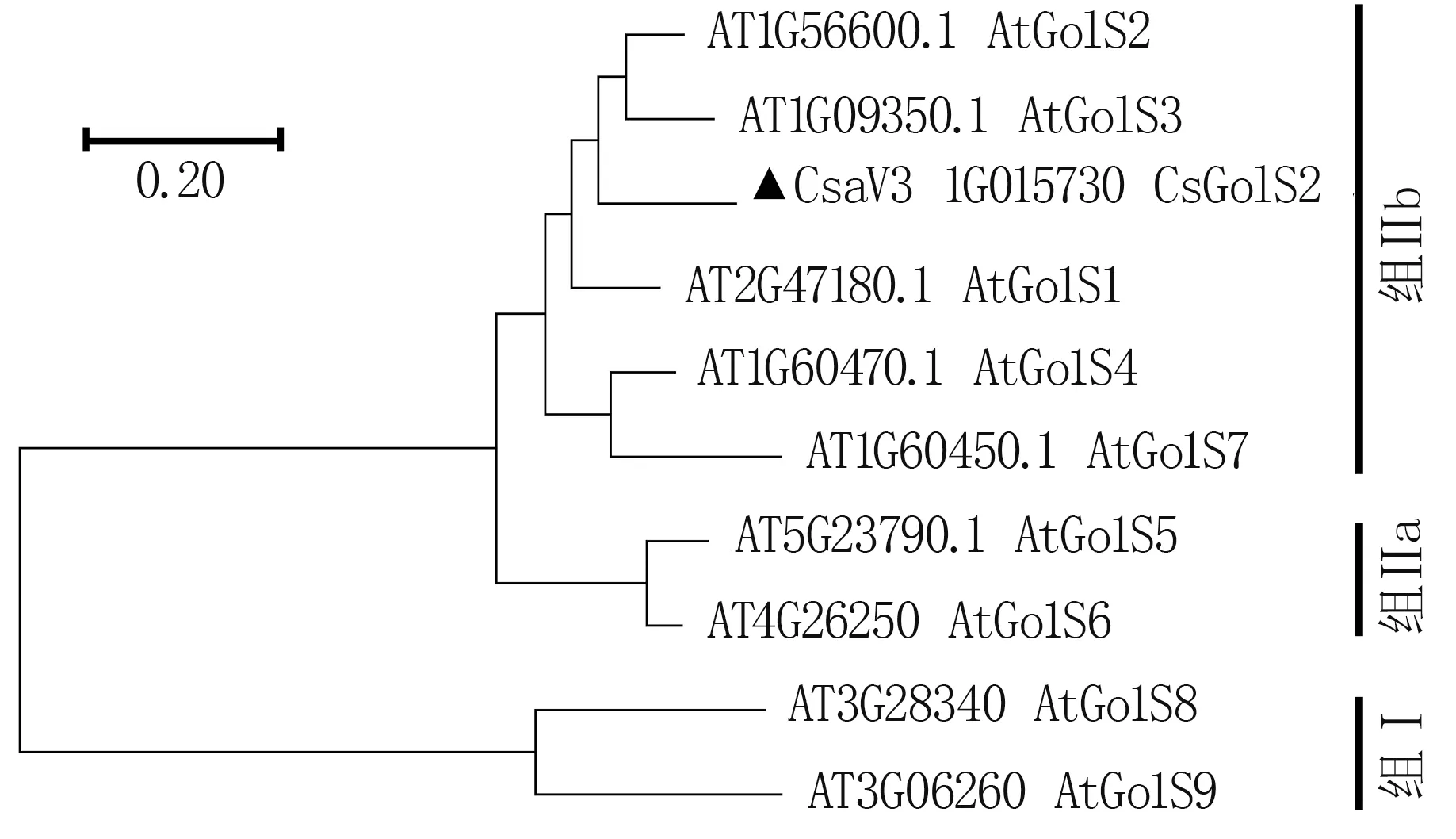
图5 黄瓜GolS2 蛋白与拟南芥GolS 家族的亲缘关系
2.4 基于文献的盐胁迫和低温胁迫对黄瓜幼苗GolS2 基因表达的影响
前人利用转录组测序分析了黄瓜基因组中所有基因的表达水平,我们从中挑选了黄瓜幼苗GolS2基因在盐胁迫和低温胁迫后的表达数据[22],结果(图6)显示,盐胁迫显著上调GolS2基因在黄瓜幼苗中的表达,表达量比对照(CK)高42.10 倍;低温处理显著诱导GolS2基因表达,处理6 h 和12 h 的表达量显著高于处理2 h。 表明黄瓜GolS2是一个抗逆性相关基因,其表达可能与黄瓜幼苗对盐胁迫和低温胁迫的应答密切相关。
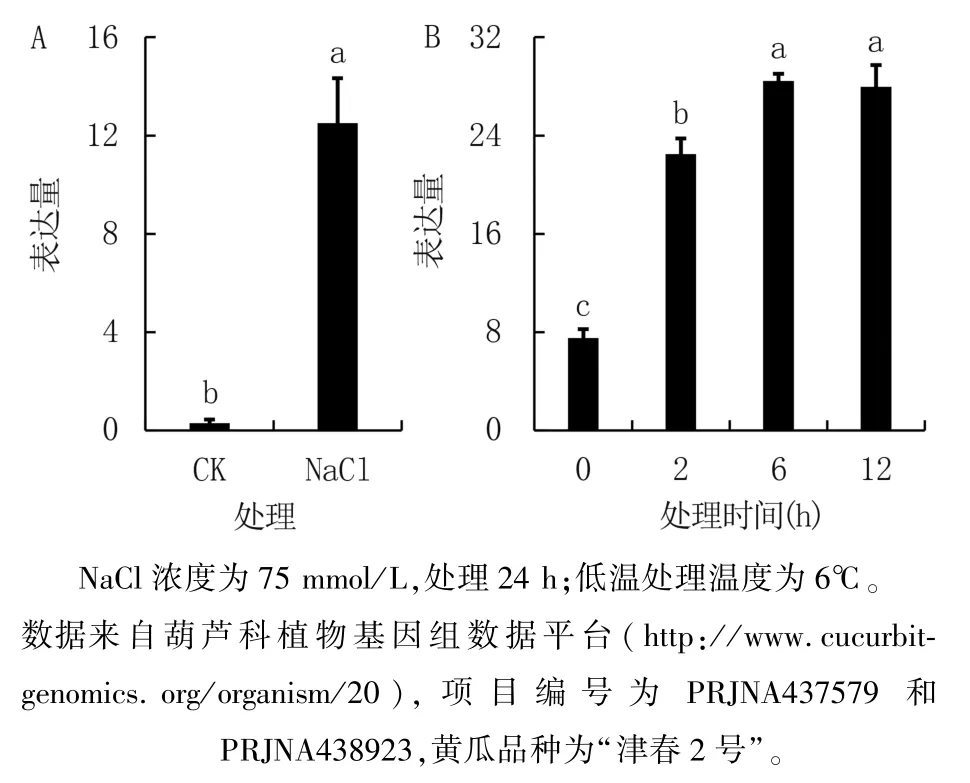
图6 盐胁迫(A)和低温胁迫(B)处理对黄瓜幼苗GolS2 表达的影响
2.5 黄瓜GolS2 基因启动子分析
由于盐胁迫和低温胁迫显著上调GolS2基因在黄瓜幼苗中的表达,推测该基因启动子中可能含有逆境响应元件。 因此,从基因组数据中调出位于起始密码子上游1 625 bp 长度的DNA 序列,分析启动子中的瞬时作用元件,结果(图7)显示,CsGolS2基因启动子中含有丰富的逆境胁迫响应相关元件。 其中,有2 个元件与昼夜节律(circadian)调节相关,有9 个光响应元件(4 个G-Box、2 个Box 4、1 个TCT-motif、1 个LAMP-element、1个chs-CMA1a),3 个厌氧诱导元件ARE,2 个茉莉酸甲酯响应元件(TGACG-motif 和CGTCA-motif),6 个乙烯响应元件(4 个ERE 和2 个Wbox),3 个ABA 响应元件ABRE。 这些结果再次证明黄瓜GolS2是一个典型的逆境胁迫相关基因。 此外,启动子中还鉴定出多个转录因子结合位点,比如8 个MYB 转录因子结合位点,3 个MYC 结合位点,表明黄瓜GolS2基因的表达可能受到MYB 和MYC 类转录因子的调控。
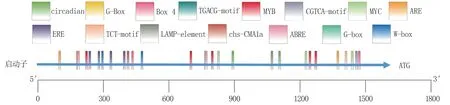
图7 黄瓜GolS2 启动子中与逆境相关的顺式作用元件分析
2.6 低温处理对采后黄瓜GolS2 基因表达的影响
与黄瓜幼苗不同的是,采后黄瓜由于脱离了母体,没有营养供应来源,只能通过呼吸代谢维持生命活动[7,16]。 在响应低温胁迫过程中,GolS2在采后黄瓜和黄瓜幼苗中的表达模式是否一致,目前未见相关报道。 鉴定能同时提高植株和采后果实耐冷性的功能基因,对于培育耐冷黄瓜新品种具有重要意义。 为此,本研究分析了GolS2在采后黄瓜中响应低温处理的表达模式,结果(图8)显示,与幼苗中的表达模式不同,GolS2表达水平在5℃和10℃低温处理后显著下降,且处理时间越长,下降越明显;10℃低温处理对GolS2表达的抑制作用强于5℃低温处理。 表明低温处理抑制采后黄瓜GolS2表达,可能负调控采后黄瓜耐冷反应。
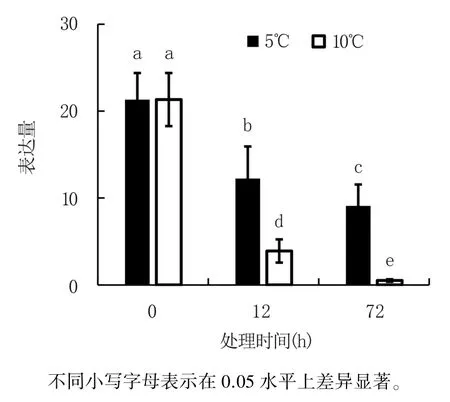
图8 低温处理对采后黄瓜果实GolS2 表达的影响
2.7 沉默GRP3 和HHO2 基因对采后黄瓜GolS2基因表达的影响
为研究HHO2和GRP3是否对GolS2基因表达具有调节作用,分析了沉默GRP3和HHO2基因对采后黄瓜GolS2表达的影响,结果(图9)显示,不论单独沉默GRP3或HHO2基因,还是同时沉默GRP3和HHO2基因,均显著下调GolS2表达,表明GRP3 和HHO2 蛋白可能调控GolS2表达。
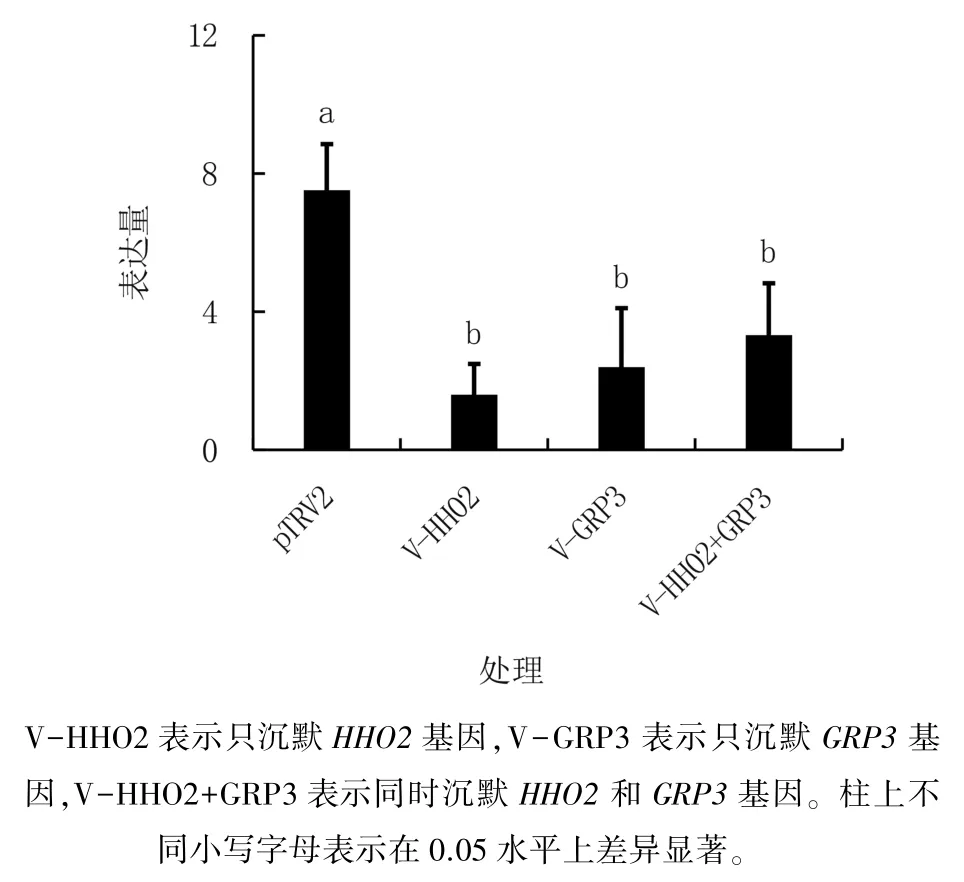
图9 GRP3 和HHO2 沉默对采后黄瓜GolS2 表达的影响
3 讨论与结论
肌醇半乳糖苷合成酶是调节棉子糖系列寡糖合成的关键酶,对细胞渗透调节具有重要作用[23]。 因此,克隆黄瓜GolS家族基因,并分析其响应非生物胁迫的表达模式,有助于丰富和完善植物GolS家族基因的功能。 本研究从黄瓜中克隆了GolS2基因,其编码326 个氨基酸残基。 序列分析结果显示,黄瓜GolS2 与拟南芥GolS 家族蛋白的亲缘关系较近,与其他植物GolS 蛋白的同源性也很高,序列中均含有一个糖基转移酶保守结构域。 同时,黄瓜GolS2 蛋白氨基酸序列具有植物GolS 蛋白的典型特征,比如在氨基酸序列C端含有保守的疏水性APSAA 五肽结构。 这些结果证实,黄瓜GolS2 属于植物GolS 大家族。
植物GolS家族基因的表达受多种非生物胁迫因子诱导,表达上调可促进RFOs 积累和增强抗逆性。 在大豆[Glycine max(L.) Merr.]幼苗中,包括高低温、干旱及高盐等在内的多种非生物胁迫可不同程度地诱导GmGolS1基因表达,且高温胁迫对GmGolS1基因表达的诱导作用最强烈[24]。 干旱和高盐胁迫显著诱导AtGolS1和At-GolS2基因的表达,而AtGolS3基因表达受低温胁迫诱导,超表达AtGolS2基因的转基因拟南芥抗旱性显著提高[25]。 干旱胁迫诱导芝麻(Sesamum indicumL.)SmGolS6基因的表达,在拟南芥中异源超表达该基因,提高了转基因拟南芥的抗旱性[26]。 盐胁迫和低温胁迫处理显著诱导黄瓜幼苗GolS2基因表达,且该基因启动子中含有丰富的逆境胁迫响应元件,表明黄瓜GolS2是一个逆境响应基因,其表达上调可能是黄瓜幼苗适应非生物胁迫的重要机制。
尽管植物GolS 蛋白的功能在进化中保守性较好,但同一基因在不同类型器官中的功能是否存在明显差异,目前仍不明确。 在黄瓜幼苗中,干旱和低温胁迫处理显著诱导GolS2基因的表达;但在离体的采后黄瓜中,低温处理却显著下调GolS2基因的表达,且10℃处理比5℃处理的抑制更强。 此外,黄瓜GolS2基因启动子中含有丰富的光响应元件。 这些结果表明,黄瓜GolS2基因的生物学功能可能在不同类型器官中存在较大差异,非生物胁迫对黄瓜GolS2基因表达的诱导作用可能依赖于光照;也意味着在采后黄瓜中增强GolS2基因表达,或许并不能增强采后黄瓜的耐冷性,若需要通过转基因的方法提高采后黄瓜耐冷性,GolS2基因可能不是一个有效的候选基因。叶片是植物进行光合作用的主要器官,黄瓜GolS1和GolS4基因在叶片中表达上调,能提高叶片的光合作用效率,促进RFOs 的积累[9,14]。 而果实是养分贮藏器官和生殖器官,采收后一般贮藏在密闭或黑暗空间中[27],采后黄瓜在贮藏过程中很难进行光合作用,尽管黄瓜果实中也含有叶绿体[20],表明黄瓜GolS2促进RFOs 积累与同化物转运效率的提高有关。
植物GolS家族基因的表达还受转录调节因子的调控。 旋蒴苣苔(Boea hygrometrica)WRKY1转录因子可直接与BhGolS1基因启动子中的Wbox 元件结合,调控其表达[28]。 葡萄(Vitis viniferaL.)AQUILO 是一个MYB like 转录因子,其通过调节VvGolS家族基因的表达促进RFOs 合成和积累[29]。 本研究中,黄瓜GolS2基因启动子中发现了多个MYB 和MYC 转录因子的结合位点,沉默HHO2基因显著下调采后黄瓜GolS2表达,表明HHO2 可能是直接调控GolS2基因表达的MYB转录因子。 HHO2 是否直接调控GolS2表达,以及具体的调控机制是怎样的,尚需更多研究进一步探明。 植物GRP 蛋白具有类似分子伴侣的功能,对mRNA 的稳定性调节具有重要作用[30]。 本研究中,沉默GRP3显著抑制采后黄瓜GolS2基因表达,表明GRP3 蛋白可能同时在转录和转录后水平上调控GolS2基因表达。
总之,本研究从黄瓜中克隆了GolS2基因,其属于植物GolS基因超级家族。GolS2是一个逆境应答相关基因,高盐和低温处理诱导GolS2基因在黄瓜幼苗和叶片中的表达,但低温处理却下调其在采后黄瓜中的表达,表明其可能通过提高黄瓜光合效率和同化物转运效率促进RFOs 积累。由于采后黄瓜在贮藏期间很难进行光合作用,若利用分子育种方法培育果实耐冷性强的转基因黄瓜,GolS2可能不是一个有效的目标基因。
