梨矮化砧木中矮1 号组培快繁技术研究
2023-07-17王艺衡冯静涵于春亮李涛李金斗赵健霄张海霞张玉星马辉许建锋
王艺衡,冯静涵*,于春亮,李涛,李金斗,赵健霄,张海霞,3,张玉星,3,马辉,3,许建锋,3
(1. 河北农业大学园艺学院,河北保定 071051;2. 威县农业农村局,河北威县 054700;3. 河北省梨技术创新中心,河北保定 071051)
矮化密植栽培具有早果丰产、优质高效、省地易管等优点,利用矮化砧木是实现梨矮化密植的重要途径,但是国外选育的梨矮化砧木大都因其适应性差而不宜在我国推广应用。 梨矮化砧木中矮1 号的代号为S2,由中国农业科学院果树研究所在1980 年从‘锦香’梨(南果梨×巴梨) 的实生后代中选育而成,具有果实品质优良、树冠矮化紧凑、丰产稳产、抗病性强(强抗腐烂病和枝干轮纹病)等特性,是我国北方梨园矮化密植的常用砧木[1-3]。
由于梨属植物具有童期较长、自交不亲和、杂合程度高等特质,其实生繁殖易造成果园整齐度差和苗木良莠不齐,这严重影响建园效果和优良砧木在生产上的应用推广,所以无性系砧木成为现代果园生产的基础,无性育苗成为现代果业发展的关键技术环节。 在无性繁殖中,嫁接、扦插等营养繁殖存在成本高、速度慢、质量差、品种混杂、病毒感染严重等诸多弊端[4,5],最关键的是中矮1号极难扦插成活。 组培快繁与之相比则具有增殖系数高、病害率少、基因型一致、不受季节和环境影响、短期大规模生产等众多优势,已被广泛应用于植物的快速繁殖、品种改良、基因工程育种和种质资源保存等方面,在梨无性系砧木生产和现代生物育种中具有重要作用[6-9]。 但目前,组培快繁技术仍存在增殖系数低、生根率低、重复性差等问题。 所以本试验以梨矮化砧木中矮1 号为试材,研究筛选其适宜的外植体种类及消毒方式、继代和生根培养基及生根条件,以建立起一种增殖系数高、生根效果好的组培快繁技术,为建立高效、稳定的组培快繁体系提供依据,为梨的转基因研究和遗传转化体系奠定基础。
1 材料与方法
1.1 材料
2021 年3 月于河北省邢台市威县香花营种质资源圃,剪取芽体饱满但未萌发的一年生中矮1 号健壮枝条,置于河北农业大学梨中心温室中进行水培催芽,隔日换水以促进萌发。
1.2 试验方法
1.2.1 中矮1 号外植体种类及消毒时间筛选将萌发后的芽体完整地取下(不破坏生长点)并作为外植体,将其分为茎段芽、混合芽、无花芽混合芽、叶芽四种(图1A ~D)。 首先用洗洁精水清洗外植体2 min,然后将其置于烧杯中并用双层纱布封口后用自来水冲洗30 min,最后在超净工作台中用75%酒精涮洗30 s→0.1%升汞涮洗(3、5、7)min→无菌水冲洗30 s→用滤纸吸干水分后接种于初代培养基(MS+1.5 mg/L 6-BA+0.1 mg/L NAA+0.4 mg/L GA3+30 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA,pH=6.0)中。 培养室条件:光照强度为4 000 lx,光照时间为16 h,温度为24℃,下同。 30天时统计其成活率、污染率和褐变率。

图1 四种外植体和两种幼化程度的苗
1.2.2 中矮1 号组培苗继代培养基筛选 切取初代培养30 天时长势一致的1.5 cm 长茎尖,分别接种于表1 正交设计的①~⑨号继代培养基(MS+30 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA+表1中的激素组合,pH =6.0)中。 每个处理接种20株,重复3 次,30 天时统计其增殖系数、芽长、苗高、叶片数、节间数和节间长度。
1.2.3 中矮1 号组培苗生根培养基筛选 生根培养采用两步生根法,即第一步先切取继代培养30 天时长势一致且健壮的3.5 cm 长组培苗,分别接种于表2 正交设计的①~⑨号生根培养基(1/2 MS+15 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA+表2 中的生根调节物质组合,pH=6.0)中诱导7 天,其中前5 天进行暗培养,后续转为全光照培养;第二步将诱导后的组培苗转接至不含激素的培养基(1/2MS+15 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA,pH=6.0)中培养33 天。 每个处理接种20 株,重复3 次,40 天时统计其生根率、根数、根长和生根所需天数。
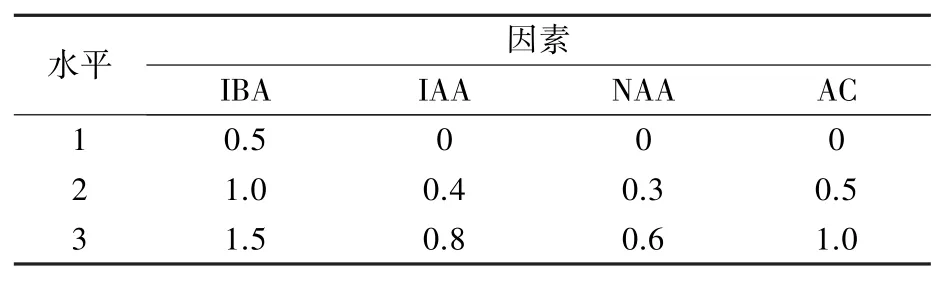
表2 生根培养基调节物质L9(34)正交试验设计(mg/L)
1.2.4 光照对中矮1 号组培苗生根的影响 将组培苗接种于⑨号生根培养基(1/2MS +15 g/L蔗糖+7 g/L 琼脂+2 g/L PVA+1.5 mg/L IBA+0.8 mg/L IAA+0.3 mg/L NAA,pH=6.0)后,分别在强光(4 000 lx)、弱光(无灯管直照处)、微光(开口箱子中)、黑暗(暗箱中)四种光照环境下培养5天,其它条件同上。 每个处理接种30 株,40 天时统计生根指标。
1.2.5 组培苗幼化程度对中矮1 号组培苗生根的影响 分别将刚完成继代培养的幼嫩苗(图1E)和经过一次生根培养但未生根的成熟苗(图1F)接种于⑤号生根培养基(1/2MS +15 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA+1.0 mg/L IBA+0.4 mg/L IAA+0.6 mg/L NAA,pH=6.0)中,其它条件同上。 每个处理接种30 株,40 天时统计生根指标。
1.2.6 一步生根法对中矮1 号组培苗生根的影响 选取30 株组培苗使用一步生根法来进行生根培养,即全程在⑨号生根培养基中培养(前5天为暗培养),期间不更换培养基,40 天时统计生根指标。 以使用两步生根法进行生根培养的组培苗为对照,比较二者生根过程中的差异。
1.3 指标计算及方法
褐化率(%)=外植体褐化数/外植体接种数×100;污染率(%)=外植体污染数/外植体接种数×100;成活率(%)=外植体成活数/外植体接种数×100。
增殖系数=增殖芽总数/接种株数;平均株高=苗干总高/接种株数;平均叶片数=完全展开的叶片总数/接种株数;平均芽长=增殖芽总长/接种株数。
生根率(%)=生根株数/接种株数×100;平均根数=总根数/生根株数;平均根长=总根长/总根数;平均生根天数=(生根日期-接种日期)/生根株数。
1.4 数据处理与分析
试验数据用SPSS Statistics 25 进行方差分析,用Duncan’s 新复极差法进行多重比较,用Microsoft Excel 制图。
2 结果与分析
2.1 中矮1 号外植体种类及消毒时间筛选结果
由表3 可以看出,0.1%升汞消毒3 min 时,叶芽成活率(91.7%)最高,其次为无花芽混合芽(44.4%);消毒5 min 时,无花芽混合芽成活率(34.5%)高于叶芽(25.8%);消毒7 min 时,只有无花芽混合芽成活,成活率为33.3%;三个消毒时段下茎段芽和混合芽均无成活株。除茎段芽,另外三种外植体的褐化率随消毒时间延长而升高。无花芽混合芽和叶芽的成活率随消毒时间的延长而下降。
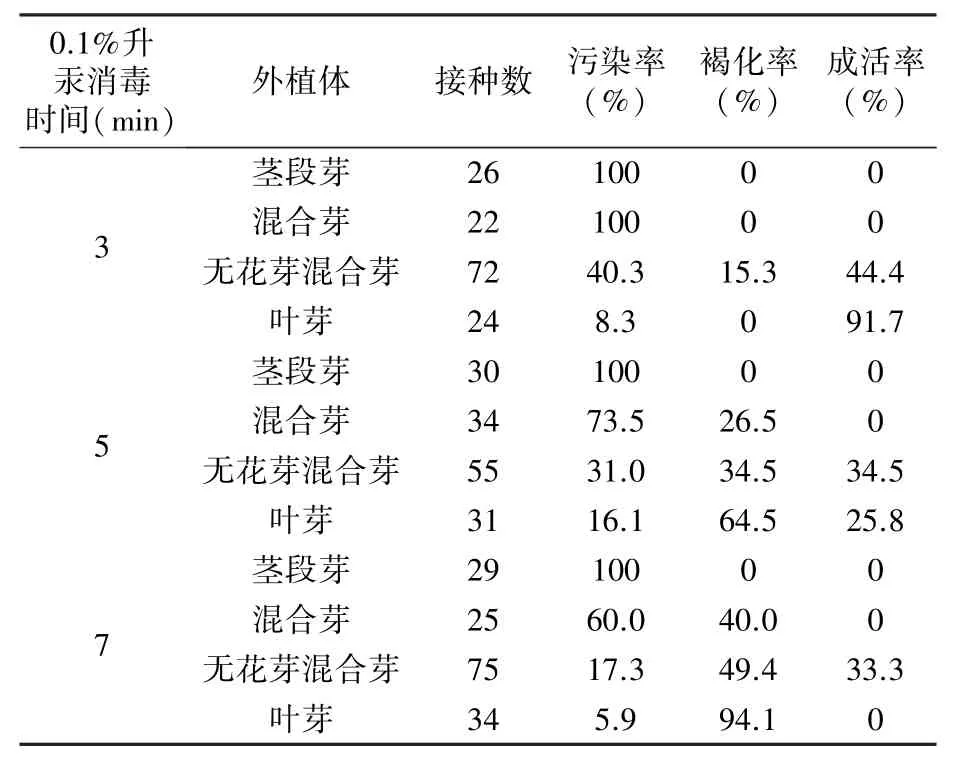
表3 不同消毒时间和外植体种类对外植体引入的影响
综上,叶芽和无花芽混合芽较适合作为中矮1 号的外植体,引外植体时的最佳升汞消毒时间为3 min,总消毒时间为4 min。
2.2 中矮1 号组培苗继代培养基筛选结果
图2 显示,⑦号继代培养基(MS+30 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA+1.8 mg/L 6-BA+0.1 mg/L NAA+0.2 mg/L GA3,pH =6.0)组培苗的增殖系数(5.52)最高,显著高于其它处理;⑥号培养基(MS+30 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA+1.4 mg/L 6-BA+0.2 mg/L IBA+0.1 mg/L NAA,pH =6.0)组培苗的平均芽长(1.15 cm)最长,9 个处理间无显著差异;⑦号培养基组培苗的平均苗高(4.14 cm)最高,与⑧号培养基(MS+30 g/L 蔗糖+7 g/L琼脂+2 g/L PVA +1.8 mg/L 6-BA +0.1 mg/L IBA+0.2 mg/L NAA,pH=6.0)无显著差异,显著高于其它处理;⑦号培养基组培苗的平均叶数(20.28 片)最多,与⑧号、⑨号培养基(MS+30 g/L蔗糖+7 g/L 琼脂+2 g/L PVA+1.8 mg/L 6-BA+0.2 mg/L IBA+0.1 mg/L GA3,pH =6.0)无显著差异,显著多于其它处理;⑦号培养基组培苗的平均节间数(4.89 节)最多,与⑥号、⑨号培养基无显著差异,显著多于其它处理;⑤号培养基(MS+30 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA+1.4 mg/L 6-BA+0.1 mg/L IBA+0.2 mg/L GA3,pH =6.0)组培苗的平均节间长度(1.23 cm)最长,9 个处理间无显著差异。
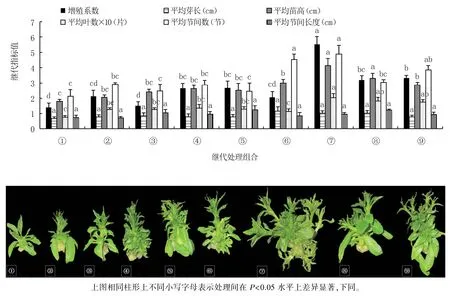
图2 不同增殖激素组合对组培苗继代培养的影响
极差分析结果(表4)表明,四种激素中6-BA对继代增殖的影响最大,主要影响增殖系数、苗高、叶片数和节间数;NAA 主要影响芽长和节间长度;GA3对芽长、苗高和节间长度也有一定影响。 方差分析筛选出的最佳继代培养基激素组合为:1.8 mg/L 6-BA +0.1 mg/L NAA +0.2 mg/L GA3,再结合图2 的单因素分析结果认为,1.8 mg/L 6-BA+0.1 mg/L NAA+0.2 mg/L GA3为最佳继代培养基激素组合。
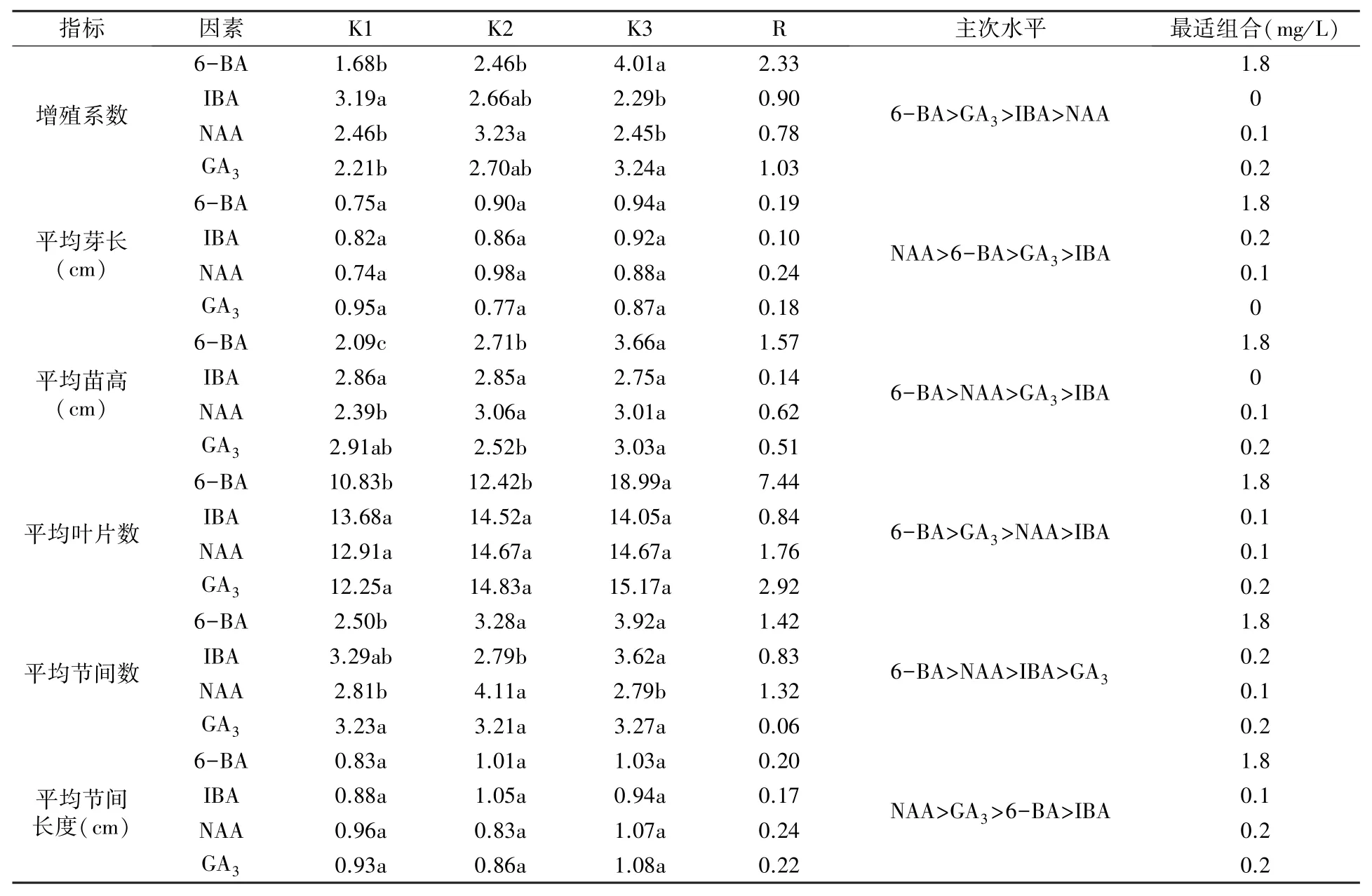
表4 增殖激素正交试验的方差分析及极差分析
2.3 中矮1 号组培苗生根培养基筛选
图3 显示,⑤号生根培养基(1/2MS+15 g/L蔗糖+7 g/L 琼脂+2 g/L PVA+1.0 mg/L IBA+0.4 mg/L IAA+0.6 mg/L NAA,pH =6.0)组培苗的生根率(72.22%)最高,显著高于其它处理;⑨号培养基(1/2MS +15 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA+1.5 mg/L IBA +0.8 mg/L IAA +0.3 mg/L NAA,pH=6.0)组培苗的平均根数(5.36 条)最多,仅显著多于②号培养基(1/2MS +15 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA+0.5 mg/L IBA+0.4 mg/L IAA +0.3 mg/L NAA +0.5 mg/L AC,pH =6.0),与其余7 个处理无显著差异;⑨号培养基组培苗的平均根长(7.74 cm)最长,与⑤号培养基无显著差异,显著高于其它处理;⑨号培养基生根所需天数(13.65 天)最少,与①号(1/2MS+15 g/L蔗糖+7 g/L 琼脂+2 g/L PVA +0.5 mg/L IBA,pH=6.0)、③号(1/2MS+15 g/L 蔗糖+7 g/L 琼脂+2 g/L PVA+0.5 mg/L IBA+0.8 mg/L IAA+0.6 mg/L NAA+1.0 mg/L AC,pH=6.0)、④号(1/2MS+15 g/L蔗糖+7 g/L 琼脂+2 g/L PVA+1.0 mg/L IBA+0.3 mg/L NAA+1.0 mg/L AC,pH =6.0)、⑤号培养基无显著差异,显著少于其它处理。
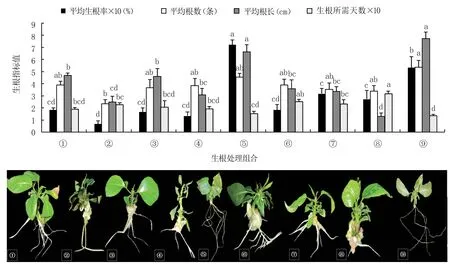
图3 不同生根调节物质组合对组培苗生根的影响
极差分析结果(表5)表明,四种生根调节物质中AC 对组培苗生根的影响最大,为四项生根指标的最主要影响因素,高浓度的AC 会影响组培苗的生长状态,可能造成组培苗叶片枯黄、顶梢发黑、基部不长愈伤;IBA 主要影响生根率;IAA 主要影响根数和根长;NAA 主要影响生根所需天数。 方差分析筛选出的最佳生根调节物质组合为:1.0 mg/L IBA+0.8 mg/L IAA+0.6 mg/L NAA,结合图3 的单因素分析结果认为,1.0 mg/L IBA+0.4 mg/L IAA+0.6 mg/L NAA 为最佳生根调节物质组合。
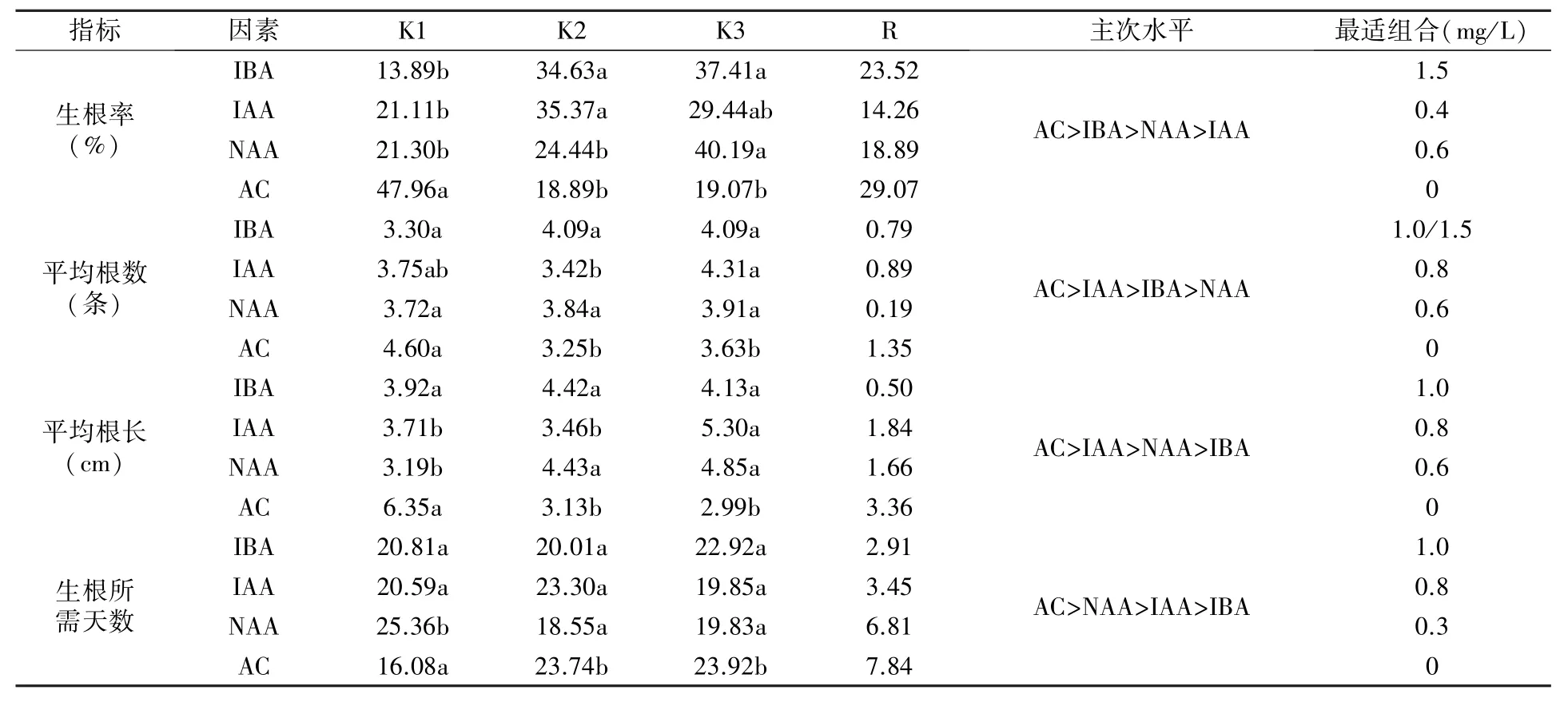
表5 生根调节物质正交试验的方差分析及极差分析
2.4 光强对中矮1 号组培苗生根的影响
由图4 可以看出,组培苗生根培养前期暗培养5 天的平均生根率(60.00%)最高,显著高于其它处理,强光培养的生根率(6.67%)最低;微光培养组培苗的平均根数(4.40 条)最多,暗培养(3.67条)其次,4 个处理间无显著差异;暗培养组培苗的平均根长(5.55 cm)最长,与微光和弱光培养无显著差异,显著长于强光培养。 表明,4 个处理在各自光照强度下培养5 天,其愈伤生成速率随光照强度的减弱而增加,暗培养下愈伤组织的生成量最多,强光培养则几乎不产生愈伤。
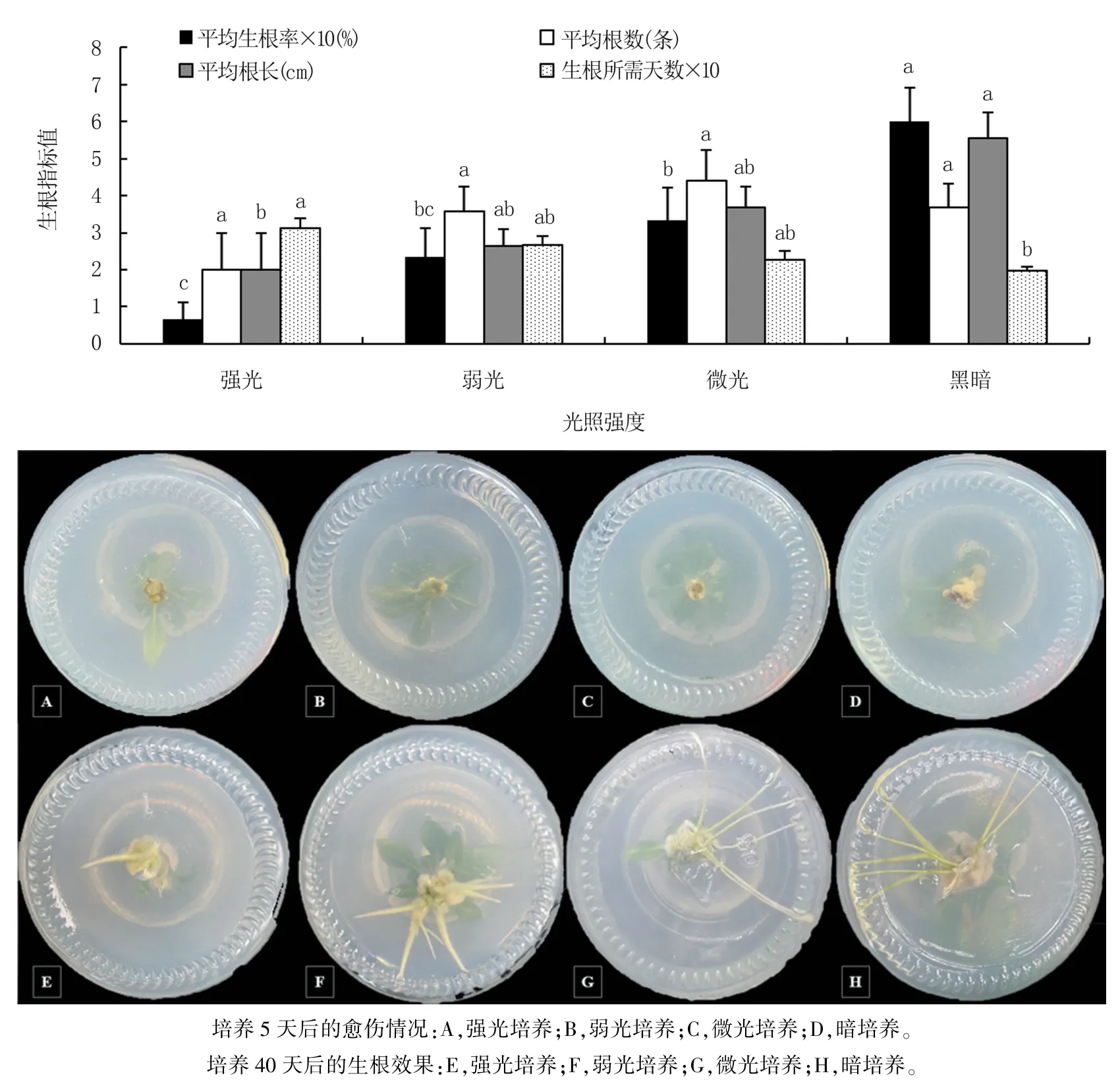
图4 不同光强对组培苗生根的影响
4 个处理生根培养40 天后,总体的生根效果随光照的减弱而变好,强光培养组培苗的生根效果较差,根数少且短粗,暗培养的生根质量较好,根数多且细长。
综上,生根培养前期暗培养5 天更有益于中矮1 号组培苗生根。
2.5 苗幼化程度对中矮1 号组培苗生根的影响
由表6 可以看出,幼嫩苗的生根率、平均根数、平均根长都要高于成熟苗,生根速度也更快。幼嫩苗茎段基部的愈伤组织大小适中,根系细软(图5A),而成熟苗的愈伤组织则较小,根系粗硬(图5B)。 综上,继代培养40 天的幼嫩苗生根效果更好。
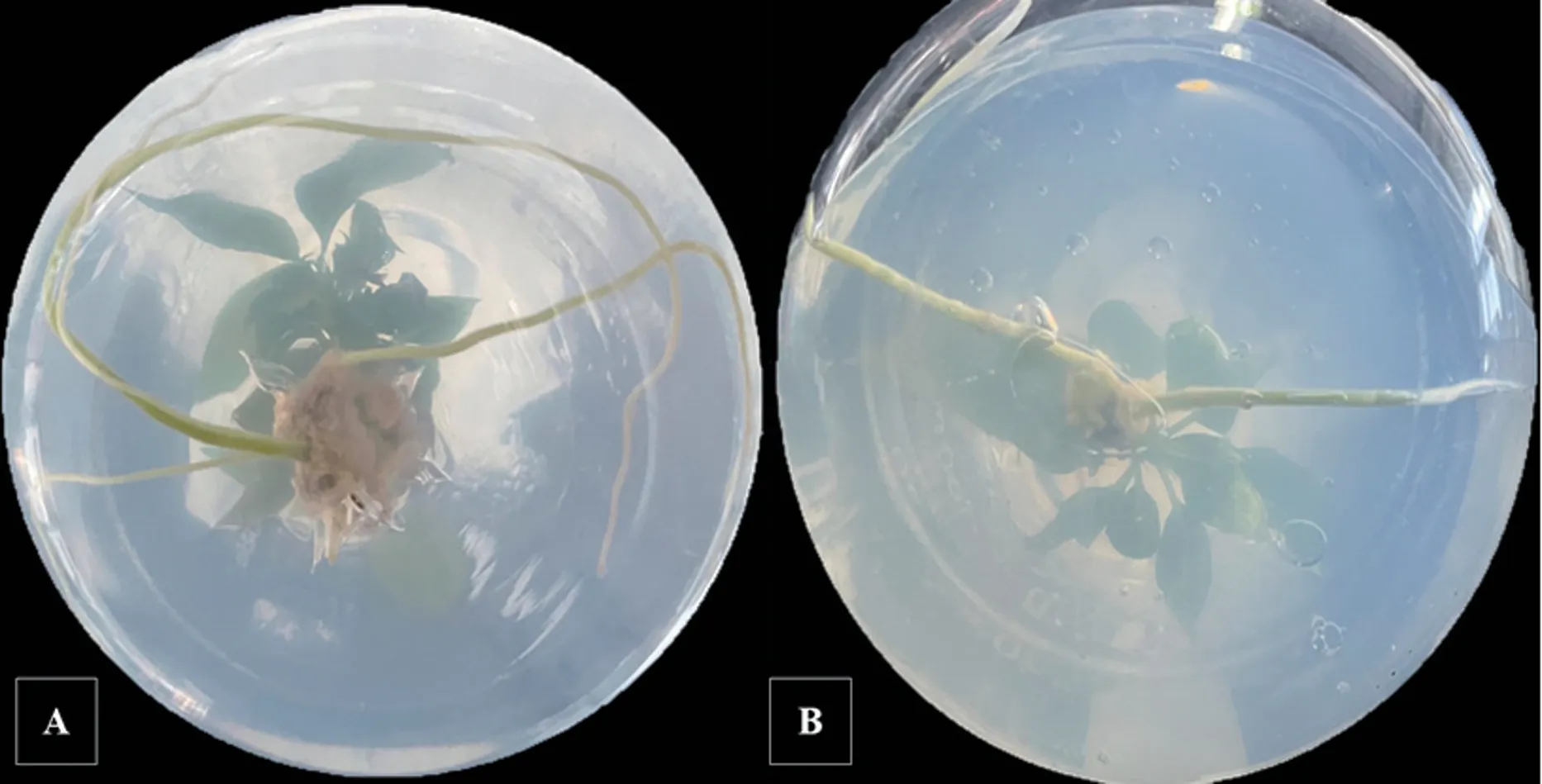
图5 幼嫩苗(A)和成熟苗(B)的生根效果对比
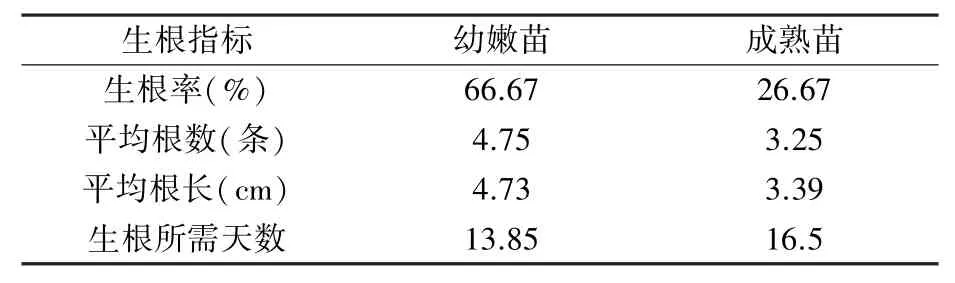
表6 幼嫩苗和成熟苗的生根指标对比
2.6 一步生根法对中矮1 号组培苗生根的影响
图6 A 显示,组培苗用一步生根法生根培养后的愈伤组织生成量极大,生长状态较差,出现苗细弱、叶焦边、枯尖等现象,没有出现生根苗。 两步生根法的组培苗愈伤组织大小正常,苗健康粗壮,根系状态较好(图6B)。 所以两步生根法更适合中矮1 号的生根培养。

图6 一步生根苗(A)和两步生根苗(B)的生根效果对比
3 讨论与结论
外植体的高效引入是建立组培快繁技术的关键,外植体种类和灭菌方法的选择将直接影响其成活率。 本试验采用的外植体为早春时温室中水培萌发的嫩梢,其本身携带的病菌、酚类物质较少,酶活性较弱,所以污染率、褐变率不高[6,10]。本试验用于筛选的四种外植体中,混合芽多在花芽和花穗处滋生真菌,茎段芽则在茎部滋生真菌,二者与叶芽、无花芽混合芽相比灭菌难度较大,灭菌时间难以把握。 如果灭菌时间过长,植物细胞会受到伤害,导致生长点死亡,褐化率增高;灭菌时间太短,外源菌无法被完全消灭,导致污染率增高[4,7]。 因此合理的灭菌时间将直接关系到外植体的成活。
植物激素是促进植物组织分化的重要调节物质,不同的激素组合及浓度配比可能会刺激不同基因控制的酶类,从而影响内源激素的分布水平,进而影响不定芽的增殖效果和植株的生长状态,因此筛选适宜的激素组合是建立组培快繁技术的关键[4,10,11]。 6-BA 可促使腋芽萌发和抑制顶端优势,对组培苗增殖的影响最大,但当其浓度超过2.0 mg/L 时会加剧组培苗的玻璃化,抑制芽和茎的伸长[1,12,13];低浓度的GA3可促进植物细胞分裂和伸长,进而影响组培苗的增殖数和苗高[14];低浓度的NAA 能促进茎干上腋芽的分生,且对苗高起一定的主导作用[15,16]。 本研究结果与以上论述相一致。 前人研究中,蔡猛[17]筛选的中矮1号继代培养基(MS+1.0 mg/L 6-BA +0.3 mg/L IBA+30 g/L 蔗糖+6 g/L 琼脂)的增殖系数为3.38;及华等[18]筛选的继代培养基(MS+1.0 mg/L 6-BA+0.2 mg/L IBA+0.1 mg/L GA3+20 g/L 蔗糖+6.5 g/L 琼脂)的增殖系数为3.4;罗娅等[19]筛选的继代培养基(MS +3.0 mg/L BA +0.2 mg/L IBA+2.0 mg/L GA3+30 g/L 蔗糖+6 g/L 琼脂)的增殖系数为3.88。 本试验筛选出的继代培养基的平均增殖系数为5.52,较前人研究结果有明显提高,且组培苗继代30 天的平均苗高可达4.14 cm。高壮苗可以更早地进行后续的生根培养,从而加速育苗进程。
生长素的种类及浓度是影响组培苗生根的关键因素[20]。 首先,对于生根困难的果树材料,两步生根法要好于一步生根法,其原因可能为根原基诱导、根和茎的生长对生长素的需求浓度不同,根原基的形成需要在高浓度生长素下进行诱导,而根的生长发育阶段,高浓度的生长素反而会抑制幼根生长[21-23];一步生根法较省时省力,可降低移瓶过程中组培苗污染的可能性,但组培苗的茎段基部易生成大团愈伤组织,不利于其诱导生根和移栽成活。 其次,组培苗在混合生长素下培养其生根效果要好于单一生长素:IBA 可以诱发根原基形成,促进内源激素IAA 的运输,可在辅酶作用下转化成IAA 来发挥作用[7];罗嘉亮等[8]认为IBA 的生根诱导效果最佳,但李晓刚[12]和方明[9]等认为IBA 对组培苗的生根无显著性影响;IAA 是影响不定根形成的重要因子,但其易被氧化酶氧化,性质不稳定且作用持续的时间较短[8];NAA 可以促进组培苗储存的淀粉水解为还原糖,有利于不定根的形成,但高浓度NAA 会使组培苗基部产生较大的愈伤,诱导出的根较粗短,不利于移栽成活[8,23,24];活性炭(AC)可以吸附某些有害物质,为组培苗提供暗环境,提高组培苗的可溶性蛋白和总糖含量,从而有利于根的诱导和根系生长,但活性炭浓度太高时则可能减少愈伤组织的生成,吸附大部分的生长调节物质及对生根有利的物质,从而抑制根的发生[24]。 栾晓龙等[25]在生根培养基中添加1.0 g/L AC,显著提高山梨的生根率和生根条数;王宏伟等[15]研究表明豆梨组培苗的增殖系数和株高随着活性炭浓度的提高而降低;刘翠琼[26]试验表明0.5 g/L AC 可提高巴梨的生根率,1.0 g/L AC 则会起到抑制作用。本研究表明,AC 对组培苗生根的影响最大,0.5、1.0 g/L AC 均对中矮1 号的生根起明显抑制作用;IBA 主要影响生根率;IAA 主要影响根数和根长;NAA 主要影响生根所需天数。 前人研究中,蔡猛[17]筛选的中矮1 号生根培养基(1/2MS+0.1 mg/L NAA+30 g/L 蔗糖+7 g/L 琼脂)的生根率为50.1%,平均根数为2.99 条;罗娅等[19]筛选的培养基(1/2QL+5.0 mg/L IBA+5.0 g/L 蔗糖上暗培养10 d→1/2QL+5.0 g/L 蔗糖+0.5 g/L AC)为67%,平均根数为1.5 条;及华[27]筛选的培养基(ASH+2.0 mg/L IBA+20 g/L 蔗糖+6.5 g/L 琼脂上暗培养7 ~9 d→ASH+蛭石+20 g/L 蔗糖+6.5 g/L 琼脂)为70%,平均根数为3 条。 本试验优选出的生根培养基其生根率为72.22%,平均根数为5.36 条,明显多于前人研究中的诱导结果,生根效果较好。
暗培养时间、光强、苗的幼化程度等也是影响组培苗生根的重要因素。 暗培养时间受组培苗生长状态、继代次数和培养环境等因素影响,合适的时间有助于组培苗根的形成,但时间过长易造成组培苗细弱、叶焦边、枯尖等现象[23,26]。 培养时的光强不同,生根效果也有很大差异。 本试验中,光强越弱,生根越早,根系质量越好。 分析其原因可能是,暗环境更有利于根原基的诱导,更早的形成愈伤组织。 本研究认为,中矮1 号组培苗的生根能力还与其幼化程度有关,与成熟组织相比,幼龄组织和过渡态组织具有更强的再生能力,因为其细胞具有强大的分裂能力,这是根原基形成的前提条件[27]。
综之,本试验通过对梨矮化砧木中矮1 号组培快繁影响因素的研究而建立的离体快繁技术为:以中矮1 号一年生枝条水培萌发的叶芽或无花芽混合芽为外植体,采取75%酒精30 s→0.1%升汞3 min→无菌水30 s 的消毒方式进行灭菌,然后接种于启动培养基(MS +30 g/L 蔗糖+1.5 mg/L 6-BA+0.1 mg/L NAA+0.4 mg/L GA3+7 g/L琼脂,pH =6.0)上;30 天时转接入继代培养基(MS+30 g/L 蔗糖+1.8 mg/L 6-BA +0.1 mg/L NAA+0.2 mg/L GA3+7 g/L 琼脂,pH =6.0)上增殖培养,增殖系数可达5.52;30 天时转接入生根培养基(1/2 MS+15 g/L 蔗糖+1.0 mg/L IBA+0.4 mg/L IAA+0.6 mg/L NAA+7 g/L 琼脂,pH =6.0)上培养7 天(前5 天为暗培养),再转入无激素培养基中,最终生根率可达72.22%。
