高稳定性Mn:ZnO/Mn2O3纳米复合光催化剂的制备及光催化特性
2023-07-12柏明辉刘苋张秋平宋曼黎健鸿孙翼飞余飞袁欢苏元捷徐明
柏明辉 ,刘苋 ,张秋平 ,,宋曼 ,黎健鸿 ,孙翼飞 ,余飞 ,袁欢 ,苏元捷,徐明
(1 西南民族大学 电子信息学院 信息材料四川省高校重点实验室,成都 610041)
(2 电子科技大学 电子科学与工程学院 电子薄膜与集成器件国家重点实验室,成都 610054)
0 引言
随着科技和经济的迅速发展,环境污染问题愈发严重,已经对人类健康造成了极大的危害,并且逐渐侵蚀着人类生存的环境。为了应对这种挑战,减少排放量和清除现有污染物就成为世界各国共同的职责。近些年,随着化学原料逐步替代原有天然原料,工业生产过程中排放的水体污染物成分越发复杂,生物可降解性也越差,特别是印染废水,其含有大量毒性强的偶氮键或多环芳烃结构有机成分(如染料、添加剂等),已无法被传统的物理吸附和化学氧化技术彻底去除[1]。最近,基于纳米金属氧化物半导体材料的光催化氧化技术有望取代传统的物理和化学氧化技术,实现高效和彻底去除印染废水中微量、难降解有机污染物,并且该技术具有廉价、易操作性、无二次污染等优点[2]。
在光催化氧化技术中,光催化剂材料的性能决定着印染废水中有机污染物降解的效率,因此高效光催化剂的设计和制备是将该技术推向工业化应用的关键。其中,氧化锌(Znic oxide, ZnO),一种直接带隙(3.37 eV)半导体[3],作为具有高催化活性、优异稳定性、低合成成本的光催化剂,已广泛应用于降解各种微量有机污染物[4-7]。然而,宽禁带半导体特性和差的抗光腐蚀性限制了ZnO对太阳光的利用以及催化稳定性,此外在单一成分的催化剂表面无法实现高效率的光催化氧化反应,这源于单一成分催化剂中光生电荷载流子的快速复合。为此,一些有效的措施,如过渡金属掺杂[8]、其它半导体复合[9]、贵金属修饰等[10-12],广泛开发用于改善上述单一ZnO光催化剂的性能缺陷[13,14]。过渡金属掺杂是一种利用其它过渡金属原子取代ZnO晶体基质中Zn原子或引入间隙原子,以改变各原子的局域配位环境,调节ZnO的晶体和电子结构的方法。这种方法通过在禁带中引入杂质能级的方式有效地减小ZnO的带隙能,提高其对可见光的吸收[15],但是一些金属元素(如Fe、Mn等)的引入会诱导深杂质能级的形成,促进了光生电子和空穴的复合,降低ZnO的光催化活性[16]。为了抑制过渡金属掺杂的副作用,XU Ming等[17-19]通过结合过渡金属掺杂和贵金属修饰的方法开发了一系列Ag纳米颗粒修饰的过渡金属掺杂ZnO复合纳米光催化剂(如Cu:ZnO/Ag[17]、Fe:ZnO/Ag[18]、Mn:ZnO/Ag[19]),相比单一 ZnO、纯掺杂 ZnO 和 ZnO/Ag,这些光催化剂在模拟太阳光照射下,对MB、MO、RhB等常见染料的光降解表现出优异的性能。增强的光催化性能源于以下两方面:1)掺杂过渡金属引入的杂质能级诱导低能量电子跃迁和ZnO表面修饰的Ag纳米颗粒的局域表面等离子体共振效应,协同增强了复合纳米光催化剂的可见光捕获能力;2)ZnO和Ag之间形成的纳米异质结促进了界面电荷转移,抑制了光生电子和空穴的快速复合[20,21]。
尽管这些复合纳米光催化剂已经在印染废水中有机染料的光催化降解方面表现出优越性,但是贵金属的使用不利于该类催化剂成本的降低。为此,利用其它廉价的窄带隙金属氧化物半导体替代贵金属与过渡金属掺杂ZnO复合,不仅能够保证复合纳米光催化剂较强的可见光吸收和其光生电荷载流子高效的分离率,而且降低了催化剂的成本[22-26]。最近,XU Ming等[27]发现Mn掺杂能够大幅度提高ZnO的可见光吸收,而且Mn2O3的带隙能很小(约为1.4 eV),其导带电位略比ZnO的导带电位高,与ZnO复合能够形成良好的Ⅱ型异质结结构[28,29]。因此,将Mn掺杂和Mn2O3复合相结合构建Mn2O3复合Mn掺杂ZnO异质结构(Mn:ZnO/Mn2O3),能否进一步优化ZnO基纳米光催化剂的性能将有待研究。
本文基于修饰的高分子网络凝胶法,分别制备了纯ZnO、Mn:ZnO、ZnO/Mn2O3、Mn:ZnO/Mn2O3纳米光催化剂,比较研究了这些催化剂在模拟太阳光下对RhB和MB染料的光降解特性。通过一系列材料表征分析了样品的物相成分、微观结构、表面化学态以及光电特性等。最后,基于这些表征结果并结合光催化剂光降解特性,分析并讨论了所合成光催化剂的光生电荷转移机制和光催化降解机理。
1 实验部分
1.1 样品试剂
1.1.1 所需化学试剂
材料合成所需化学试剂包括:六水合硝酸锌(Zn(NO3)·26H2O)、丙烯酰胺(C3H5NO)、N,N′-亚甲基双丙烯酰胺(C7H10N2O2)(均为分析纯,购于成都科隆化学品有限公司)、无水葡萄糖(C6H12O6,分析纯,天津福晨化学试剂有限公司)、酒石酸(C4H6O6,分析纯,天津科密欧化学试剂有限公司)、四水合硝酸锰(Mn(NO3)·24H2O)、三氧化二锰(Mn2O3)(均为分析纯,购于成都化夏化学试剂有限公司)。
光催化降解所需化学试剂包括:罗丹明B(RhB,分析纯,成都科隆化学品有限公司)、亚甲基蓝(MB,指示剂,天津福晨化学试剂有限公司),用于模拟有机污染物;异丙醇(IPA,分析纯,天津致远化学试剂有限公司)、乙二胺四乙酸钠(EDTA-2Na,分析纯,天津福晨化学试剂有限公司)、对苯醌(BQ,上海阿拉丁生化科技有限公司),用于开展牺牲剂实验。去离子水(电阻率18.25 MΩ)用于所有样品的合成和处理。
1.1.2 纳米ZnO的制备
纳米ZnO的制备采用修饰的高分子网络凝胶法。具体过程如下:首先,依次称取约6.01 g六水合硝酸锌、4.53 g酒石酸、12.00 g无水葡萄糖、10.77 g丙烯酰胺和4.97 g N,N′-亚甲基双丙烯酰胺,并在水浴磁力搅拌下按先后顺序将称量好的药品加入到90 mL的去离子水中,直到搅拌均匀形成透明的前驱液后,再水浴加热至90 °C,形成白色状凝胶;接着,将白色凝胶捣碎后置于干燥箱中,恒温(温度为120 ℃)干燥24 h,得到干凝胶;最后,将干凝胶研磨成细粉并在马弗炉中进行煅烧(温度为650 °C,升温和保温时间分别为400 min和200 min),待煅烧完毕后研磨得到纳米ZnO粉体,记为ZnO。
1.1.3 掺杂及复合纳米材料的制备
掺杂纳米材料的制备工艺类似于1.1.2节所述。其中,保持所有制备条件不变,仅在六水合硝酸锌和酒石酸之间加入适量的四水合硝酸锰(摩尔百分含量为0.1 mol%),所得样品记为Mn:ZnO。复合纳米材料的制备工艺:基于上述修饰的高分子网络凝胶法,分别用所制得的纳米ZnO和Mn:ZnO粉末取代六水合硝酸锌,接着添加一定量的Mn2O(3摩尔百分含量为0.2 mol%),其它条件不变,所得样品分别记为ZnO/Mn2O3和Mn:ZnO/Mn2O3。
1.2 材料表征
实验采用DX-2000型X射线衍射(X-ray Diffraction, XRD)仪(丹东浩元仪器有限公司)测定样品的物相成分,其辐射源为Cu靶Kα射线,波长为0.154 056 nm,管电压为40 kV,管电流为30 mA,扫描速率设定为0.02°·s-1,扫描范围设定为 20°~80°。分别采用 Hitachi SU8220 型场发射式扫描电子显微镜(Scanning Electron Microscope, SEM, 日立高新技术公司)和Talos F200X G2型场发射式透射电子显微镜(Transmission Electron Microscope, TEM, 美国Thermo Fisher公司)表征样品的形貌及微结构,其运行加速电压分别为15 kV和200 kV。此外,在TEM测试样品期间,采用Mapping模式对样品进行元素扫描。采用ESCALAB Xi+型X射线光电子能谱(X-ray Photoelectron Spectroscopy, XPS)仪(美国Thermo Fisher公司)分析样品的表面化学态,其辐射源为Al靶Kα射线。采用配备了积分球的Lambda 750型紫外/可见/近红外分光光度计(美国PerkinElmer公司)记录样品的紫外-可见(UV-Vis)漫反射光谱,通过Kubelka-Munk公式将反射光谱转化为吸收光谱。采用LS55型荧光发光光谱仪(美国PerkinElmer公司)测量样品的光致发光(Photoluminescence, PL)光谱。采用 TRISTAR 3000 型全自动多站比表面积和孔隙度分析仪(美国Micromeritics 公司)分析样品的 BET(Brunauer-Emmett-Teller) 比表面积。采用ZEN 3690型Zeta电位及纳米粒度分析仪(DLS,英国Malvern公司)分析样品的零点电位。
1.3 有机污染物光降解特性测试
首先,量取96 mL去离子水置于250 mL干净烧杯中,再量取4 mLRhB或MB水溶液(浓度为100 mg/mL)加入到去离子水中配置成初始浓度为4 mg/mL的溶液;接着,取50 mg制备好的光催化剂分散在配置好的污染物溶液中,磁力搅拌5 min,超声处理5 min,并置于暗处静止20 min。待催化剂达到吸附-解吸平衡后将其置于室内模拟太阳光(北京泊菲莱 PLS-SXE300D 型高压氙灯)下进行光催化反应,整个反应在持续的磁力搅拌下进行,其中反应液的pH值约为7,光源距液面约15 cm,辐照强度约为200 mW·cm-2,温度为室温。每隔一定的时间,取5~8 mL溶液,经离心(离心速度为6 000 r·min-1,离心时间为5 min)后取少量上清液置于比色皿中,通过可见分光光度计测量出相应的吸光度,最后利用式(1)计算其降解率。
式中,C0为初始浓度,Ct为t时间后溶液的浓度,A0和At为光照前后污染物溶液的吸光度。此外,对实验数据进行了一级动力学拟合,拟合表达式为
式中,k为拟合曲线的斜率,称为表观速率常数。
2 结果与讨论
2.1 物相成分分析
图 1分别为 ZnO、Mn:ZnO、ZnO/Mn2O3、Mn:ZnO/Mn2O3样品的 XRD 图谱。如图所示,位于 2θ为31.89°、34.54°、36.34°、47.66°、56.70°、62.94°、66.50°、68.02°、69.22°处的特征衍射峰分别对应于六方纤锌矿结构 ZnO 的(100)、(002)、(101)、(102)、(110)、(103)、(200)、(112)、(201) 晶面(JCPDS No.36-1451)。除此之外,未探测到其它XRD特征衍射峰,表明所制备样品仅含有纯的ZnO六方纤锌矿单相。同时,所有掺杂及复合材料(Mn:ZnO、ZnO/Mn2O3、Mn:ZnO/Mn2O3)的XRD图谱中未出现与Mn元素相关的特征衍射峰,这是因为Mn掺杂量和Mn2O3复合量过少。相比纯ZnO样品,其它样品的XRD特征衍射峰的强度存在一定程度的减弱,表明掺杂和复合会导致ZnO晶体质量下降,增加晶体缺陷。
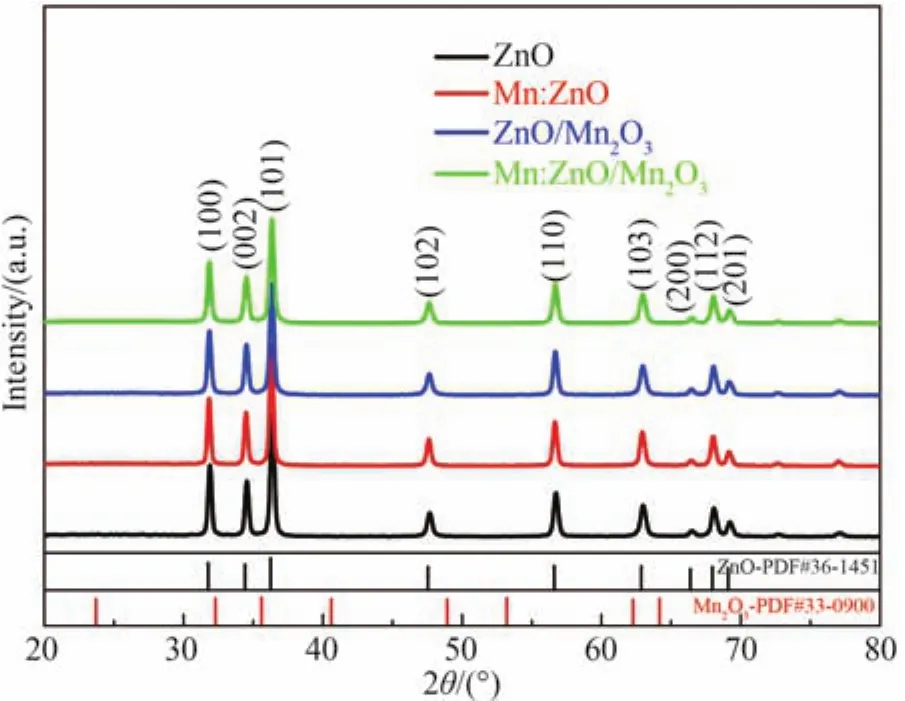
图1 ZnO及复合样品的XRD图谱Fig.1 XRD patterns of ZnO and composite samples
为了分析Mn离子掺杂和Mn2O3复合对ZnO晶体参数的影响,依据谢乐公式和晶格常数计算公式[30]对所有样品的晶格参数和晶粒尺寸进行了计算,结果如表1。计算表达式为
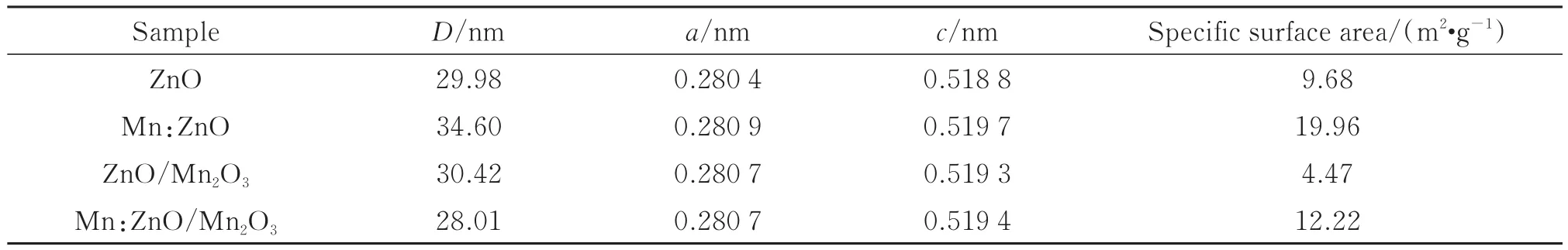
表1 根据XRD图谱计算得到的微结构参数和样品的比表面积Table 1 Microstructure parameters calculated according to XRD patterns and specific surface of the samples.
式中,D是微晶尺寸,λ是X射线的辐射波长,约为0.154 059 81 nm,θ是布拉格角,β是半峰宽,k值为0.89。h、k、l为晶面指数,d为晶面间距,a、c为晶胞的晶格常数。
如表1所示,Mn离子掺杂导致ZnO的晶体尺寸和晶格常数增大,这可能归因于离子半径较大(Mn2+和Zn2+的半径分别为0.083 nm和0.074 nm)的Mn2+被掺杂到ZnO的晶格中以替代Zn2+。此外,在所有Mn2O3复合的样品中未发现ZnO晶粒尺寸发生明显变化,然而其晶格常数增大。晶格常数的增大意味着ZnO晶体中的晶格紊乱程度增加,缺陷增多,与上述结果一致。
2.2 形貌及微结构分析
图 2展示了 ZnO、Mn:ZnO、Mn:ZnO/Mn2O3样品的 SEM 图像以及 Mn:ZnO/Mn2O3样品的 HRTEM 图像。可以看出,所有样品均由100 nm以下的准球形颗粒组成,随着Mn离子掺杂和Mn2O3复合,ZnO的颗粒尺寸明显减小,并且颗粒分散性得到了提高。通常,对于纳米颗粒状催化剂而言,颗粒分散性和颗粒尺寸决定着催化剂的有效比表面积,从而影响其光催化活性[31]。从表 1中可知,ZnO、Mn:ZnO、ZnO/Mn2O3、Mn:ZnO/Mn2O3样品的 BET比表面积分别约为 9.68、19.96、4.47、12.22 m2·g-1。
如前所述,由于Mn掺杂量(0.1 mol%)和Mn2O3复合量(0.2 mol%)过低,XRD图谱中未探测到掺杂和复合的迹象,同样在图2(d)中的HRTEM图像(图中标注的0.260 nm和0.247 nm的晶格条纹间距对应于六方纤锌矿结构ZnO( 002)、(101)晶面之间的距离)中也未发现与Mn元素相关的信息。为此,对Mn:ZnO/Mn2O3样品进行了元素Mapping扫描,结果如图3。图3(b)~(d)表明,样品中含有大量的Zn和O元素,来源于样品中的ZnO,此外还探测到了微量的Mn元素,证实样品中Mn元素的存在,其可能以Mn离子掺杂和Mn2O3复合的形式出现,其中微量的Mn2O3可能与ZnO形成异质结。

图2 样品的扫描电子显微镜图及透射电子显微镜图Fig.2 SEM and HRTEM images of simples

图3 Mn:ZnO/Mn2O3样品的元素映射图Fig.3 EDS images of Mn:ZnO/Mn2O3 simple
2.3 表面化学态分析
图4给出了ZnO、Mn:ZnO、Mn:ZnO/Mn2O3样品的XPS全谱以及Zn 2p、O 1s、Mn 2p的高分辨XPS图谱。如图4(a),除了C元素(主要来源于XPS仪器自身以及样品在煅烧过程中残留的微量有机物)以外,样品中只含有Zn、O、Mn元素,与Mapping的结果相一致,进一步表明了样品未掺入其他杂质元素。图4(b)中位于结合能为1 021.9 eV和1 045.1 eV处的峰分别归属于Zn 2p3/2和Zn 2p1/2,两峰之间约23.1 eV的结合能差值表明所有样品中的Zn元素是以Zn2+离子的形式存在[32]。此外,相比纯ZnO样品,Mn:ZnO和Mn:ZnO/Mn2O3样品的Zn 2p峰向高结合能方向偏移,这可能是由于Mn离子进入ZnO晶格所致[33]。图4(d)分别显示了高分辨率的Mn 2p XPS图谱以及掺杂和复合样品的Mn 2p3/2峰的拟合分峰结果。如图4(d),位于结合能为640.4 eV和641.3 eV处的峰分别对应于Mn的+2和+3价态[16],证实样品中Mn元素以多种价态存在,并且随着Mn2O3的复合Mn3+含量增高。

图4 ZnO、Mn:ZnO、Mn:ZnO/Mn2O3的XPS图谱Fig.4 XPS spectra of ZnO, Mn:ZnO, Mn:ZnO/Mn2O3
图4(c)为所有样品的高分辨率O 1s XPS图谱,图谱显示O 1s谱线不对称,存在明显的肩峰,表明样品中含有多种形态的氧物种。基于高斯拟合对O 1s谱线进行了分峰处理和分析,结果如表2。其中,O 1s谱线被分解成两个峰,分别位于结合能为530.1 eV和531.7 eV处,分别归因于ZnO晶体中的晶格氧(OL)和表面氧空位(OV)[34]。就金属氧化物而言,科学家普遍认为:由于化学工艺的随机性,在合成过程中很难得到完美无缺的氧化物晶体,特别是纳米晶体,其表面很容易缺失氧原子,形成丰富的表面氧空位缺陷[35]。当这些富含表面氧空位缺陷的金属氧化物纳米晶体暴露在空气中时,H2O分子会在表面空位缺陷位点上发生物理和解离吸附,解离吸附会导致羟基基团(·OH)形成[36]。从表2中的数据可以看出,尽管样品表面富含吸附氧物种,但是Zn与O的原子比均大于1,这表明所合成的样品表面存在严重的氧缺失。进一步分析发现,随着Mn离子掺杂和Mn2O3复合,样品的表面氧空位缺陷明显增加(OL:OV比值分别为1.33、0.65、0.93)。增加的表面氧空位缺陷作为催化活性位点,不仅能够加快光生载流子的分离,而且可以促进目标分子的吸附,最终提高光催化剂的活性[37-38]。
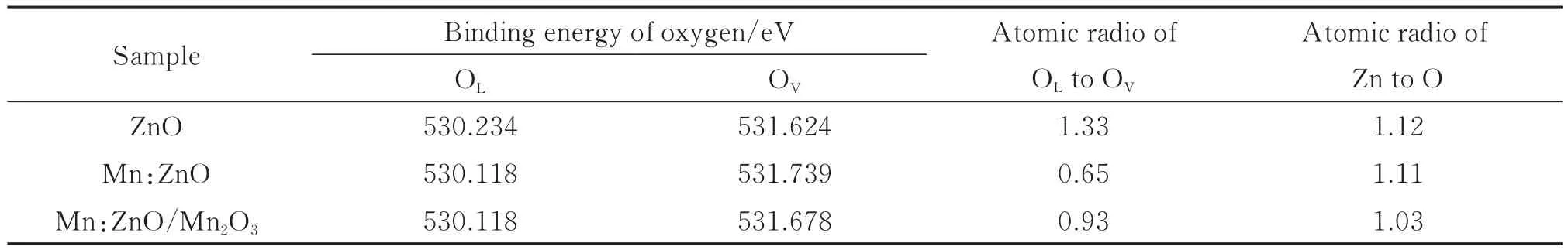
表2 不同纳米材料表面氧和锌元素的XPS数据Table 2 XPS data of oxygen and zinc on the surface of different nanomaterials
2.4 光学特性分析
为了分析样品光吸收能力和光生载流子分离行为随其形貌、微结构和表面化学态演变的规律,对所有样品进行了UV-Vis漫反射和PL光谱分析,如图5。显然,随着Mn离子掺杂和Mn2O3复合,掺杂及复合样品的紫外光吸收有所下降,然而其可见光吸收大幅度增强[39],特别是复合样品(ZnO/Mn2O3和Mn:ZnO/Mn2O3),样品从白色到深棕色的颜色变化也证明了该观点(如图5(d))。相比纯ZnO,Mn:ZnO可见光吸收的增强是因为Mn离子掺杂和表面氧空位缺陷的增加,从而增加了所诱导的缺陷能级与ZnO导带或价带之间的低能量跃迁(跃迁所需的能量与可见波段光能量匹配);Mn:ZnO/Mn2O3可见光吸收的增强主要归因于窄带隙(Eg≈ 1.40 eV)[22]Mn2O3的带间跃迁。图 5(b)展示了由 Kubelka-Munk公式[40]计算得到的各样品的带隙能,由于氧空位缺陷的存在[41],所合成的ZnO样品的带隙能(Eg≈ 3.21 eV)略低于其理论值(Eg≈ 3.37 eV)[42-43]。此外,Mn2O3的引入降低了复合样品的带隙能。
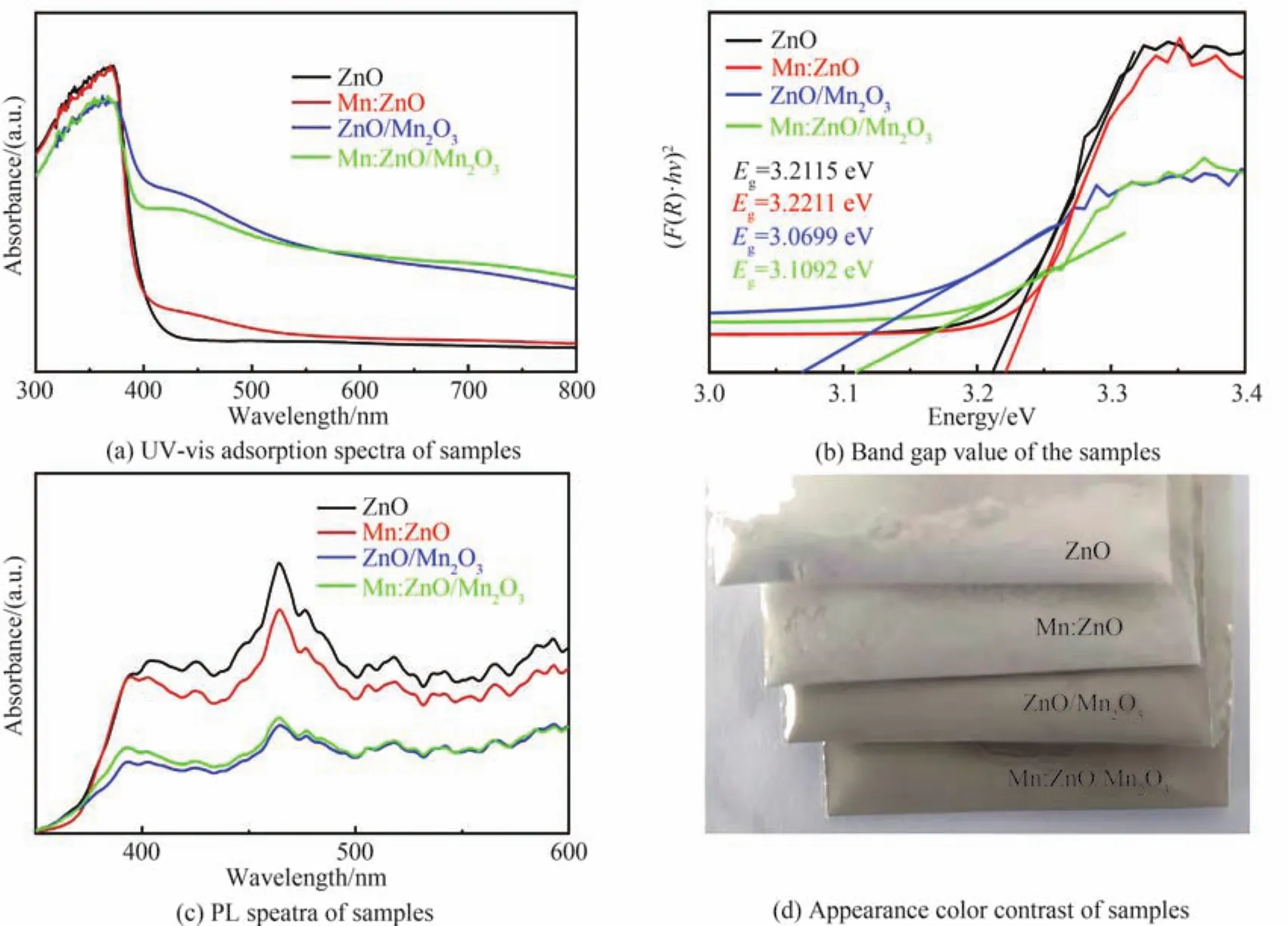
图5 样品的光谱及外观颜色对比Fig.5 Spectrum and appearance color contrast of the sample
事实上,增强可见光吸收有助于提高催化剂的可见光活性,但是光生电子-空穴对的分离率才是决定光催化剂性能的关键因素[12]。PL光谱能够反映催化剂受光激发后电子-空穴对的分离率,如图5(c)所示,所有样品在可见光区域(400~600 nm)均展现出宽且强的发光谱带,表明样品中存在大量的晶体缺陷[31,34]。其中,391 nm处的紫外发射峰源于ZnO的本征激发,而464 nm处的蓝绿色发射峰源于样品表面氧空位缺陷捕获的电子与光生空穴的复合辐射[44-45]。随着Mn离子掺杂,增加的表面氧空位缺陷提高了电子空穴的分离[46-47],因此Mn:ZnO样品的PL强度降低;当Mn2O3复合后,ZnO和Mn2O3之间会形成能级匹配的异质结构,因此形成的内建电场会加剧电荷在界面处的转移,提高了光生电子-空穴对的分离率,ZnO/Mn2O3和Mn:ZnO/Mn2O3样品的PL强度急剧下降。
2.5 光催化降解效率及机理讨论
Mn:ZnO和Mn:ZnO/Mn2O3样品在模拟太阳光照射下对RhB染料表现出增强的降解效率,光照60 min后RhB染料可被完全降解,且Mn:ZnO/Mn2O3样品具有更快的降解速率,如图6(a)和6(b)。增强的效率归因于以下两方面:1)表面氧空位缺陷的增加诱导[48]增强可见光吸收和提高光生电子-空穴对分离率;2)Mn2O3复合导致Mn:ZnO/Mn2O3样品中的纳米颗粒尺寸变小,有效比表面积增加。然而,ZnO/Mn2O3样品表现出低的降解效率,归因于Mn2O3过窄的带隙和过高的价带边[49]。此外,还开展了所有样品对MB染料的光降解实验,结果如图6(c)和6(d)。不幸的是,Mn离子掺杂和Mn2O3复合恶化了ZnO对MB染料的光降解效率。由此可见,Mn:ZnO和Mn:ZnO/Mn2O3样品对RhB和MB染料的光降解具有明显的选择性。
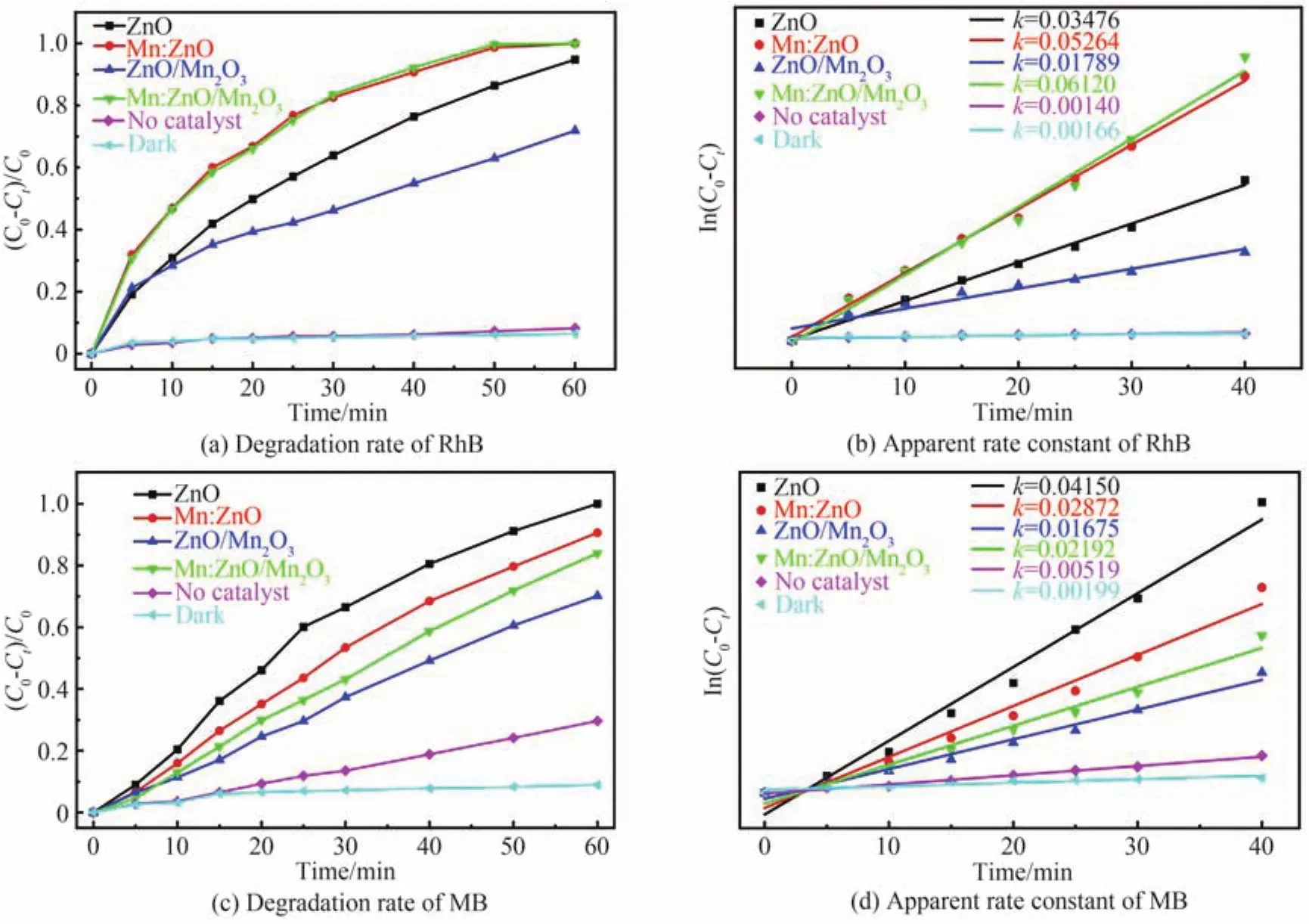
图6 模拟太阳光下样品对模拟污染物的降解率及表观速率常数Fig. 6 Degradation rate and apparent rate constant of simulated pollutants by samples under simulated sunlight
为了详细阐述Mn离子掺杂和Mn2O3复合对ZnO光催化活性影响的原理,开展了Mn:ZnO/Mn2O3样品的牺牲剂实验,分别使用EDTA-2Na、BQ和IPA作为光生空穴(h+)、超氧自由基(·O2-)和羟基自由基(·OH)的清除剂[50]。如图7,对于 RhB染料的光降解(见图 7(a)),随着 3种牺牲剂的加入,Mn:ZnO/Mn2O3样品对RhB染料的光降解效率显著下降,特别是在EDTA-2Na和BQ存在下,RhB染料几乎无法被光降解,这表明 h+、·O2-和·OH在RhB染料光降解过程中均发挥着重要的作用,但前两者的作用更明显[51];对于MB染料的光降解(见图7(b)),随着适量EDTA-2Na和IPA的加入,Mn:ZnO/Mn2O3样品对MB染料的光降解效率显著下降,而随着适量BQ的加入光降解效率反而上升,这表明h+和·OH在MB染料光降解过程中起决定性作用。

图7 牺牲剂对RhB和MB染料光催化降解的影响Fig.7 Effects of the sacrificial agents on photocatalytic degradation of RhB and MB dyes
显然,在光催化降解过程中,这种活性物种作用之间的明显差异是Mn:ZnO/Mn2O3样品选择性光降解RhB和MB染料的原因之一。图8分别给出了模拟太阳光下Mn:ZnO/Mn2O3样品光催化降解RhB和MB的机理。如图8所示,掺杂的Mn离子引入的缺陷能级比Mn:ZnO价带边高约2.1 eV[52],其作为深能级会诱导光生电子和空穴的复合[16];然而表面氧空位缺陷引入的缺陷能级处于Mn:ZnO价带边附近(甚至高浓度的表面氧空位会导致局域化的缺陷能级变得连续,价带边上移),其作为浅能级会抑制光生电子和空穴的复合[35]。此外,由于Mn2O3的导带边比Mn:ZnO的更负[16],因此两者之间会形成良好的Ⅱ型异质结结构,进一步促进光生电子和和空穴的分离。

图8 模拟太阳光下Mn:ZnO/Mn2O3样品光催化降解Fig.8 Photocatalytic degradation of Mn:ZnO/Mn2O3 samples under simulated sunlight
当太阳光照射在Mn:ZnO/Mn2O3催化剂表面时,紫外光激发Mn:ZnO的带间跃迁,产生大量的光生电子和空穴。同时在可见光激发下,Mn:ZnO缺陷能级与其导带和价带之间的跃迁以及Mn2O3的带间跃迁进一步增加了光生电子和空穴。此时,迁移到表面的光生电子和空穴经过一系列反应[16]分别产生·O2-和·OH等活性氧物种,其中·O2-、·OH和h+快速地将催化剂表面吸附的RhB分子分解成CO2和H2O。与此同时,Mn2O3复合Mn:ZnO后,两者界面处的电荷转移满足Ⅱ型异质结电荷转移行为,即部分光生电子聚集在ZnO的导带,而部分光生空穴聚集在Mn2O3的价带,这导致空穴的氧化电势大幅度降低,且电势低于·OH的氧化还原电位,使得氧化能力更强的·OH无法经过h+生成(见图8中反应过程②)[53]。这种情况下,·O2-的作用更加明显,其不仅能够直接氧化分解染料分子,而且能够经过多步反应后生成·OH(见图8(a)中反应过程③)[50],这就可以解释图 7所示的结果,抑制·O2-的生成导致RhB的光催化氧化降解反应最缓慢(该氧化过程中,·OH起决定性作用,其次是h+,最后是·O2-,而·O2-又决定着·OH生成),随着时间的推演RhB染料中的部分水分蒸发,RhB的浓度增加,降解率为负值。然而,在Mn:ZnO/Mn2O3光催化降解MB染料过程中,只有·OH和h+起氧化分解的作用,因此抑制·O2-的生成未影响MB的催化氧化降解反应。如图8(b),该氧化过程中,·OH和h+的作用相当,·O2-虽然不起作用,但其通过图8(b)中反应①进一步促进了光生电子和空穴的分离。
此外,选择性光催化降解特性可能还与催化剂的零电荷点(ZPC)和初始染料溶液的pH值有关[43]。当溶液pH值大于催化剂ZPC时,催化剂表面带负电,可以促进阳离子染料分子的吸附,从而加快其光降解;当溶液pH值小于催化剂ZPC时,催化剂表面带正电,会阻碍阳离子染料分子吸附,从而减缓其光降解。如图9,Mn:ZnO/Mn2O3样品的ZPC值为7.67,测得RhB和MB水溶液的pH值分别为6.3~6.6和6.0,即在这些水溶液中Mn:ZnO/Mn2O3带正电,均不利于阳离子染料RhB和MB分子的吸附;但是,RhB水溶液的pH值更接近Mn:ZnO/Mn2O3样品的ZPC值,RhB分子在其表面的吸附强于MB分子的吸附。因此,Mn:ZnO和Mn:ZnO/Mn2O3对RhB和MB染料的光降解具有明显的选择性。事实上,Mn离子掺杂会促进光生电子和空穴的复合,不利于光催化氧化反应的进行,这已经被之前的工作证明[16]。但是,本文制备的Mn:ZnO在RhB光降解方面却表现出优于纯ZnO的性能,因为Mn离子掺杂导致的氧空位缺陷增加起着决定性作用,抑制了Mn离子掺杂的副作用,进一步提高了光催化效率。其次,随着Mn2O3复合后,纳米颗粒尺寸减小,导致表面活性位点增多,并且表面氧空位诱导的缺陷能级抑制了光生空穴向Mn2O3价带的聚集,因此Mn:ZnO/Mn2O3对RhB的光催化降解效率优于纯ZnO。至于ZnO/Mn2O3,比ZnO都差的RhB和MB光降解效率源于其Ⅱ型异质结结构导致参与RhB光降解的表面活性物种(h+和·OH)减少。
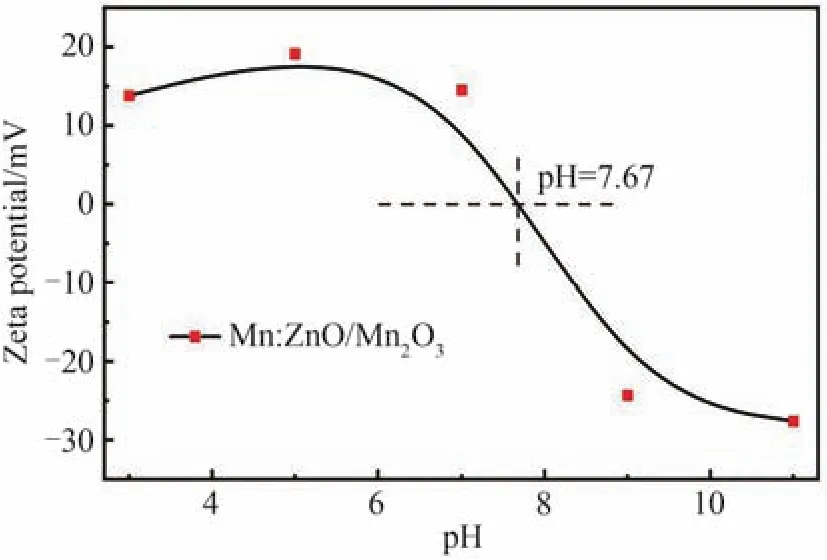
图9 Mn:ZnO/Mn2O3样品的零点电荷位置Fig.9 Zero-point charge position of Mn:ZnO/Mn2O3 sample
最后,还开展了Mn:ZnO/Mn2O3催化剂在模拟太阳光照射下对RhB染料循环光降解的实验。如图10,随着循环降解次数的增加,Mn:ZnO/Mn2O3样品光催化降解RhB染料的性能略微下降,经过10次循环光降解后,其对RhB染料的降解效率仍然很高,表明所合成的催化剂具有较高的稳定性。
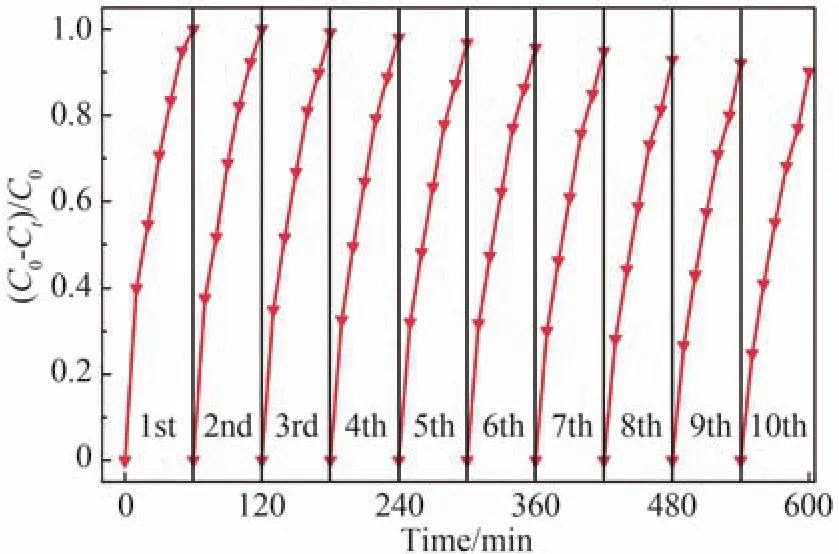
图10 Mn:ZnO/Mn2O3样品光催化降解RhB染料的可重复性Fig.10 Reusability of RhB dye degradation using Mn:ZnO/Mn2O3 sample under simulated sunlight
3 结论
基于修饰的高分子网络凝胶法成功合成了一系列不同的纳米光催化剂(包括ZnO、Mn:ZnO、ZnO/Mn2O3、Mn:ZnO/Mn2O3),并详细研究了催化剂的物相成分、微观结构、表面化学态、光电特性以及其在模拟太阳光照射下对RhB和MB染料的光催化降解特性。当微量的Mn离子(0.1 mol%)掺杂时,Mn:ZnO的颗粒分布更加均匀,表面氧空位缺陷大幅增加,这使得其可见光吸收能力和光生电子-空穴对分离率得到了提高。随着微量Mn2O(30.2 mol%)的再复合,Mn:ZnO/Mn2O3中的纳米颗粒尺寸减小,有效比表面增大。此外,窄带隙(Eg≈ 1.4 eV)Mn2O3的引入进一步增强了Mn:ZnO/Mn2O3的可见光吸收能力和光生电子-空穴对分离率。这些积极的变化提高了Mn:ZnO和Mn:ZnO/Mn2O3对RhB染料的光降解效率。然而,它们对MB染料的光降解效率比纯ZnO更差。基于牺牲剂存在下Mn:ZnO/Mn2O3对RhB和MB染料的光催化降解实验结果,分析了这种选择性光降解行为背后的原理:1)在RhB光降解过程中,催化剂表面起作用的强氧化性物种(·O2-、·OH和h+)比MB光降解过程中的强氧化性物种(·OH和h+)更多;2)Mn:ZnO/Mn2O3的ZPC值为7.67,其在弱酸性的RhB(pH = 6.3~6.6)和MB(pH = 6.0)染料水溶液中表面均带正电荷,但RhB水溶液的pH值更接近Mn:ZnO/Mn2O3的ZPC值,因此催化剂表面更容易吸附阳离子RhB染料分子。此外,ZnO/Mn2O3对RhB和MB染料的光降解效率均比纯ZnO差很多。恶化的原因在于ZnO和Mn2O3之间形成的Ⅱ型异质结结构导致h+的氧化性能力降低,并且抑制了·OH的形成。在重复光催化降解RhB染料的实验过程中,Mn:ZnO/Mn2O3表现出优异的光稳定性。
