不同灭菌工艺对香菇培养料理化特性与微生物菌群动态变化的影响
2023-07-11宋吉玲陈星坤何爱珍袁卫东陆中华
宋吉玲 陈星坤 陈 青 何爱珍 袁卫东,* 陆中华,*
(1杭州市农业科学研究院,浙江 杭州 310024;2山东农业大学农学院,山东 泰安 271000;3浙江省农业技术推广中心,浙江 杭州 310020;4淳安县农业农村发展服务中心,浙江 淳安 311700)
香菇[Lentinusedodes(Berk.)Pegler],隶属于担子菌纲(Basuduimycota)伞菌目(Agaricales)口蘑科(Tricholomataceae)香菇属(Lentinula),又称香蕈、香菰[1],富含蛋白质、维生素、矿物质、多糖、多酚和人体所必需的多种氨基酸等多种营养物质,是一类营养丰富的食药兼用型真菌[2]。
香菇作为浙江省主要栽培的食用菌品种之一,其培养基质以阔叶类木屑、麸皮等农业生产下脚料为主,但这些原料中含有大量的细菌、放线菌、病毒等微生物和虫害,会与香菇争夺营养成分,从而对香菇的生长产生影响[3]。因此,在香菇等食用菌的栽培过程中,培养料的灭菌处理是保障高效生产的一个重要环节[4]。在生产中,培养料的灭菌处理主要采用湿热灭菌法,依据压力的不同分为高压灭菌、微压灭菌和常压灭菌[5]。在规模化生产中,一般采用高压灭菌和微压灭菌,即培养基质完成装袋后在一定的压力和温度条件下进行灭菌,以达到杀灭大部分微生物的目的;而在一些香菇的主产区,依然延续着传统的常压灭菌方式。不同的灭菌方式不仅会对培养料质量性状和食用菌的生长造成一定的影响[6],还会影响微生物的种类和结构[7]。在食用菌的生长过程中,微生物作为分解有机物的主要参与者,在养分循环利用、改善培养基质结构和提高食用菌产量方面均表现出良好的效果[8-9]。然而,目前关于不同灭菌处理方式对食用菌生长影响的研究主要集中在其对培养料酶活大小[10]、氨基酸含量[11]、微量营养素的多少[12]和灭菌效果的好坏[13]等,鲜见有关不同灭菌方式对香菇培养料理化特性和微生物菌群动态变化影响的相关研究。
因此,本研究通过检测培养料的理化特性探究不同灭菌工艺对香菇培养料营养变化的影响,通过Illumina MiSeq 高通量测序技术分析不同灭菌工艺对微生物菌群动态变化的改变,结合相关生物学分析手段,对培养料理化特性与微生物菌群进行相关性分析,以期明确不同灭菌处理对香菇生长发育的影响,为香菇的精准化栽培奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 香菇菌株为浙香6 号,由武义食用菌创新公司提供。
1.1.2 栽培方法 于2021年7月—2022年4月在杭州桐庐和诚食用菌专业合作社开展香菇栽培试验。试验配方采用木屑79%、麸皮20%、石膏1%,含水量50%~55%。分别采用三种灭菌工艺进行灭菌,灭菌具体参数见表1。栽培袋规格采用15 cm×55 cm×0.045 cm 的聚乙烯袋,每棒干料重1.2 kg。其中在高压灭菌时,栽培袋刺小孔(直径0.5 cm)后贴透气膜进行灭菌。按照常规方法进行接种、培养、出菇。试验随机分组,3次重复,每个重复300个菌棒。
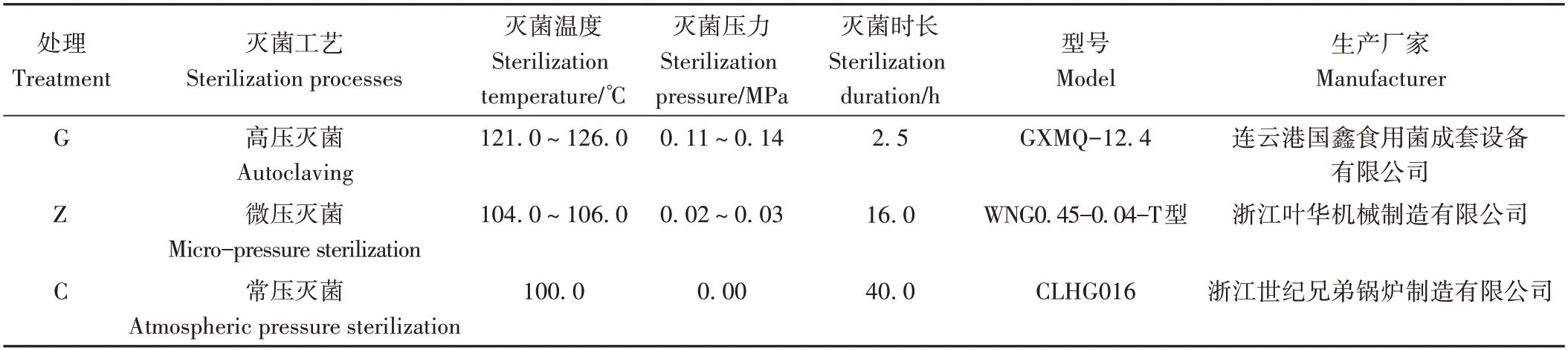
表1 不同灭菌工艺及技术参数Table 1 Different sterilization processes and technical parameters
1.1.3 试验仪器 HiFi Hotstart PCR 试剂盒(Kapa Biosystems,南非),文库定量试剂盒Illumina®平台(Kapa Biosystems,南非),AGENCOURT®AMPURE®XP Kit(Beckman Coulter Inc.,美国),QIA 快速凝胶萃取(Qiagen,德国),T100TM热循环PCR 仪(Bio-Rad Inc.,美国),Qseq100 DNA 分析仪(Bioptic Inc.,台湾),LightCycler®96 实时荧光定量PCR 仪(Roche Inc.,瑞士),Qubit®Fluorometers 荧光定量仪(Thermo Fisher Scientific,美国),PE300 MiSeq®测序系统(Illumina Inc.,美国),PE250 Novaseq 6000®测序系统(Illumina Inc.,美国)。
1.2 取样
取样时期包括灭菌前空白菌棒(0)、灭菌后空白菌棒(1)、满棒期(2)、转色期(3)、原基期(4)、成熟期(5)。每个时期随机选取30 个菌棒,使用无菌铲分别对每个菌棒上、中、下部的中心处培养料进行采样。按每个处理分别混合均匀后取300 g,一部分用于微生物测序,于-80 ℃保存备用;一部分风干、磨粉后用于有机碳、全氮、纤维素、木质素、半纤维素等理化特性指标的测定;一部分直接用于培养料含水量测定。
1.3 试验方法
1.3.1 农艺性状测定 待菌丝萌发后,随机抽取10个菌棒,每隔7 d 测量1 次菌丝生长速度,并记录菌丝长势(菌丝浓密程度、颜色)和各潮次产量。待菌丝满棒后,统计污染菌棒的数量,计算菌棒成品率。
菌棒成品率=污染菌棒数量/全部菌棒数量×100%。
1.3.2 理化特性指标测定 对不同灭菌工艺处理下培养料的理化特性进行测定,其中采用重铬酸钾容量法测定有机碳含量[14];凯氏定氮法测定全氮含量[15];蒽酮比色法测定纤维素含量[16];乙酰溴法测定木质素含量[17];培养料经酸性水解后采用蒽酮法测定半纤维素含量[18]。按照下式计算培养料中碳氮比(C/N):
C/N=(SOC/SAN)×100%
式中,SOC为培养料中有机碳(organic carbon,OC)含量(g·kg-1),SAN 为培养料中全氮(total nitrogen,TN)含量(g·kg-1)。
1.3.3 基质DNA提取与微生物测序 样品中DNA使用DP336 土壤DNA 提取试剂盒(上海三黍生物科技有限公司)进行提取,并选择16S rRNA 基因高变区序列进行菌落测序,引物序列B341F:5′-CCTACGGGNG GCWGCAG-3′;B785R-5′GACTACHVGGGTATCTAAT-3′,测序区域V3~V4 区,目的片段长450 bp。PCR 扩增反应体系共25 µL:50 ng·µL-1DNA、2×Kapa hifi hotstart ready mix 1.25 µL、特异性上、下游引物各0.25 µL、用PCR级无菌去离子水补至25 µL。
PCR 反应参数:95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,25 个循环;72 ℃孵化5 min;4 ℃保持。反应结束后的产物使用AMPure XP Beads 纯化后用2% 琼脂糖凝胶电泳回收。采用Illumina Novaseq 6000 PE250 模式对样品进行高通量测序。
1.4 数据统计与分析
使用Vsearch 2.22.1 对序列进行质量控制,以相似度大于97% 的序列聚到同一个操作分类单元(operational taxonomic units,OTU)中,使用Mothur 1.48.0软件、Rdp 和Unite 数据库对OTU 进行注释,并在各分类学水平上统计样本中的群落组成[19]。根据统计的OTU结果采用Origin 8.0软件完成门、属水平丰度图绘制。并计算Shannon 指数、Simpson 指数、Chao1 指数和ACE 指数分析群落的丰富度和多样性[20]。同时对不同灭菌工艺条件下微生物菌群变化与培养料理化特性的相关性进行分析。
2 结果与分析
2.1 不同灭菌工艺对香菇生长的影响
不同灭菌工艺下的香菇菌丝生长、产量和菌棒成品率均存在显著差异(表2),其中Z工艺的菌丝生长速度最快,为3.690 mm·d-1;G 工艺的生长速度次之,为3.270 mm·d-1,C 工艺的生长速度最慢,仅为2.340 mm·d-1。产量与菌丝生长的变化趋势有所不同,C 工艺总产量最高,为0.611 kg/棒;Z 工艺次之,为0.585 kg/棒;G工艺总产量最低,为0.535 kg/棒。从各潮次产量情况来看,G 工艺的第一潮产量相对较高,后期产量相对较弱,出菇持续性表现较差;而C 工艺和Z 工艺的变化趋势相似,以第一潮和第四潮产量较高,第二和第三潮产量稍低,整体表现相对平稳、持久。从菌棒成品率情况来看,G 工艺和Z 工艺的菌棒成品率较高,分别为98.98%和97.08%,C 工艺的菌棒成品率较低,仅为88.87%。综合分析可知,C 工艺的产量表现较好,但整体的成品率较低;G 工艺的产量相对较低,主要集中在第一潮,后期出菇能力表现相对较弱;而Z工艺在菌丝生长速度、菌棒成品率和产量方面整体表现相对较好。
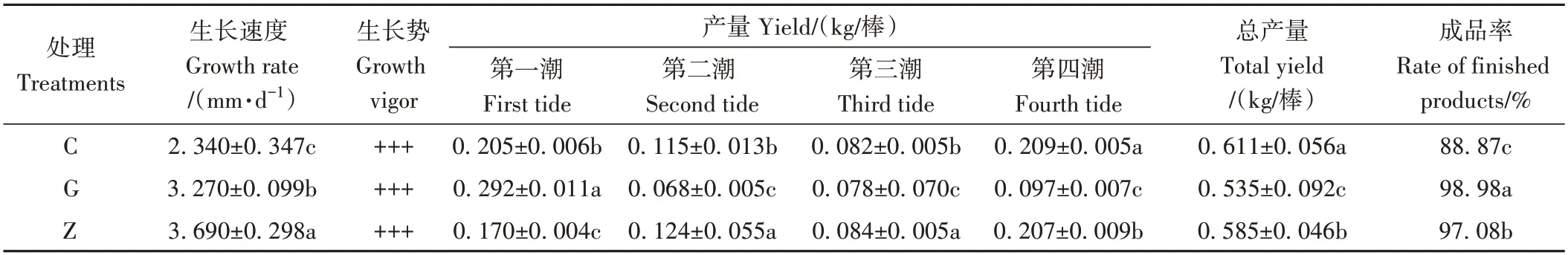
表2 不同灭菌工艺对香菇生长情况的影响Table 2 Effects of different sterilization processes on the growth of Lentinula edodes
2.2 不同灭菌工艺对培养料理化特性的影响
栽培过程中培养料含水量的变化如图1-a 所示:在灭菌前后的空白菌棒阶段,C 工艺的含水量稍有增加,由灭菌前的50.48%提高到51.46%;而G 工艺和Z工艺的含水量均有所下降,其中G 工艺由灭菌前的50.48%下降到47.86%,Z 工艺由灭菌前的50.48%下降到49.28%,这可能与不同灭菌工艺灭菌时温度和灭菌时间存在一定的差异有关。而经过满棒期、转色期、原基期和采收期后,G 工艺和Z 工艺的培养料含水量变化趋势相近,均在原基期达最高,分别为73.37%和73.19%;C 工艺呈逐渐上升趋势,成熟期时达最高,为71.57%。综合分析来看,C 工艺的含水量变化幅度相对较小,而Z工艺和G工艺的整体变化幅度相对较大。
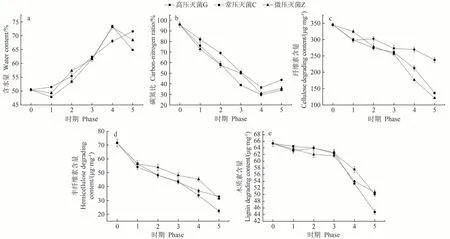
图1 培养料理化特性Fig.1 Physicochemical properties of culture medium
栽培过程中培养料碳氮比的变化如图1-b 所示:香菇整个生长过程中,碳氮比的变化整体呈先降后升的趋势,均在原基期达最低值,其中C工艺由灭菌前的95.94%下降为36.41%;Z 工艺由灭菌前的95.94%下降为30.98%;G 工艺由灭菌前的95.94% 下降为29.56%。
图1-c、d、e 分别为纤维素、半纤维素和木质纤维素含量的变化,随着生育进程的推进,整体均呈现逐渐降低的趋势。在菌丝生长阶段(时期1~3)降解较慢,进入生殖生长阶段(时期4~5)降解较快,尤其是木质素。在香菇的生长发育阶段,纤维素含量表现为C 工艺>G 工艺>Z 工艺,其中G 工艺和Z 工艺两者相差不大;半纤维素含量表现为Z 工艺>C 工艺>G 工艺;木质素含量表现为G工艺>Z工艺>C工艺。
综上所述,不同灭菌工艺对培养料的含水量、碳氮比和木质纤维素降解存在一定的影响。随着灭菌压力的逐渐增强,含水量的上升幅度和碳氮比的下降幅度均逐渐增强。而在木质纤维素方面的差异主要表现在不同组分上,其中G 工艺在纤维素和半纤维素降解方面表现较强,Z 工艺在纤维素降解方面表现较强,而C工艺则是在木质素降解方面表现较强。
2.3 不同灭菌工艺培养料中菌群多样性比较分析
通过Alpha 多样性分析发现,3 种不同灭菌工艺细菌群落的Shannon 指数无显著差异,而在Simpson 指数、Chao1 指数、ACE 指数水平上存在显著性差异,其中Simpson 指数表现为C 工艺>G 工艺>Z 工艺,Chao1和ACE 指数均表现为Z 工艺>C 工艺>G 工艺。综上,C工艺在菌群多样性方面显著高于G 工艺和Z 工艺(Simpson 指数);Z 工艺在菌群丰富度方面显著高于G工艺和C工艺(Chao1指数和ACE指数)(表3)。

表3 不同灭菌工艺培养料中细菌的丰度和多样性Table 3 Abundance and diversity bacteria in culture media by different sterilization on processes
2.4 不同灭菌工艺对培养料中微生物菌群的影响
相对丰度较大的优势菌群可以直接反映样本自身的特性或与周围环境之间的关系[21]。不同灭菌工艺培养料中微生物菌群动态变化结果如图2 所示。结果表明,不同灭菌工艺条件下,不同物种的相对丰度存在较大的差异。
三种灭菌工艺门水平(图2-a)的优势细菌菌群组成有较高的相似性,均为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)等,但表现在不同的培养时期。C工艺中,相比于C1时期,C2的Proteobacteria丰度升高,替代Firmicutes、Bacteroidetes 和Actinobacteria 等,其中Firmicutes 的丰度下降幅度最大。在G工艺中,G1时期的Proteobacteria 和Firmicutes 丰度较高,在随后的时期,Firmicutes的丰度逐渐降低,而Proteobacteria的丰度逐渐升高,至G4时成为丰度最高的门。在Z工艺中,Z1时期Firmicutes等丰度较高,其次为Proteobacteria,在随后的培养时期中,Proteobacteria在Z2时期丰度达最高,随后逐渐降低,至Z5 时期又有所上升,而Firmicutes 的丰度随培养时间的延长呈现逐渐下降的趋势。
三种灭菌工艺条件下相对丰度排名前16 的优势菌属如图2-b 所示,不同灭菌工艺和不同培养时期均有所不同。在C工艺中,在C1(空白期)丰度最高的3个属为不动杆菌属(Acinetobacter,17.71%)、魏斯氏菌属(Weissella,17.33%)、乳植杆菌属(Lactiplantibacillus,8.05%);经发菌满棒后,醋酸杆菌科未知属(Acetobacteraceae_unclassified,98.62%)替换Acinetobacter、Weissella、Lactiplantibacillus成为C2 时期丰度最高的属,而C3(转色期)时期丰度最高的3 个属则为伯克氏菌科未知属(Burkholderiaceae_unclassified,14.23%)、帕拉伯克霍尔德菌属(Paraburkhoideria,8.67%)、假单胞菌属(Pseudomonas,6.53%);C4(原基期)嗜酸菌属(Acidisoma,9.98%)替换Pseudomonas,与Burkholderiaceae_unclassified(17.73%)、Paraburkholderia(11.45%)成为C4时期丰度最高的3个属;子实体成熟后,Paraburkholderia的丰度有所提高,为15.92%,与Burkholderiaceae_unclassified(13.83%)和Acidisoma(5.48%)组成丰度较高的3个属。
G 工艺中,G1 与C1 丰度最高的3 个属相同,即为Acinetobacter(21.09%)、Weissella(20.08%)、Lactiplantibacillus(10.54%),但丰度表现有所提高;G2 时期,Pseudomonas(7.96%)和嗜盐单胞菌属(Halomonas,6.62%)替换Weissella、Lactiplantibacillus,与Acinetobacter(42.27%)成为满棒期丰度最高的属;G3(转色期)丰度最高的3 个属则为Burkholderiaceae_unclassified(23.13%)、颗粒杆菌属(Granulibacter,22.09%)、Paraburkholderia(7.38%);G4(原基期)以Acetobacteraceae_unclassified(39.83%)替换Granulibacter,与Burkholderiaceae_unclassified(13.78%)和Paraburkholderia(8.75%)成为丰度最高的3个属;G5时期的优势属与G4时期表现相一致,但丰度表现有所差异,其中Burkholderiaceae_unclassified 为22.11%、Paraburkholderia为13.46%、Acetobacteraceae_unclassified为9.82%。
Z 工艺中,Z1 时期丰度最高的3 个优势属为Weissella(6.95%)、拟杆菌属(Bacteroides,6.19%)、Acinetobacter(6.01%);Z2 时期丰度较高的优势菌属为Acinetobacter(39%)、Acetobacteraceae_unclassified(34.08%)、Pseudomonas(6.55%);而Z3时期丰度较高的优势菌属为Paraburkholderia(13.36%)、Burkholderiaceae_unclassified(12.54%)、伯克氏菌属(Burkholderia,7.25%);Z4时期,Acidisoma(8.3%)替换Burkholderia,与Burkholderiaceae_unclassified(17.63%)和Paraburkholderia(10.19%)成为丰度最高的3个属;而Z5时期的优势菌属为Burkholderiaceae_unclassified(6.95%)、Paraburkholderia(6.19%)、Burkholderia(4.76%)。
综上所述,在门水平,三种灭菌工艺在不同时期样品中的优势菌为Proteobacteria、Firmicutes、Bacteroidetes、Actinobacteria等。在属水平,每个灭菌工艺不同阶段都有各自的优势菌,分别为Acetobacteraceae_unclassified、Burkholderiaceae_unclassified、Acinetobacter、Paraburkhoideria、Weissella等。
2.5 碳氮比、纤维素各组分含量与细菌属相对丰度的相关性
SparCC 相关性热图如图3 所示。在3 种灭菌工艺中,Z工艺中排名前16的细菌属与碳氮比、木质纤维素各组分含量具有较高的相关性,其中Burkholderiaceae_unclassified、Gryllotalpicola、Paraburkholderia、Granulibacter、Burkholderia、Alacligenaceae_unclassified、Acidisoma和Bordetella相对丰度与木质素含量呈显著负相关,相关系数均为-0.999;Phocaeicola、Weissella和Lactiplantibacillus相对丰度与纤维素含量呈显著正相关,相关系数均为0.999,而与碳氮比和半纤维素含量之间无显著相关性。C 工艺中Pseudomonas相对丰度与纤维素、Burkholderia相对丰度与木质素含量呈显著正相关,相关系数为0.999 和0.963,在G 工艺中,Lactiplantibacillus相对丰度与半纤维素含量呈显著负相关,相关系数为-0.994。
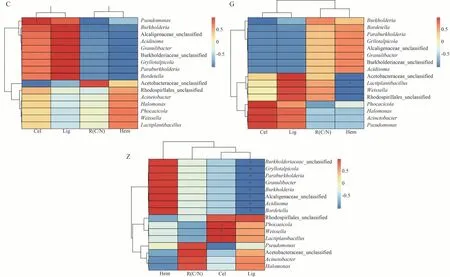
图3 碳氮比、木质纤维素各组分含量与细菌前16个优势属的SparCC相关性热图Fig.3 Heat map of SparCC correlation between carbon-nitrogen radio,content of lignocellulose components and top 16 dominant bacteria
2.6 细菌间的相关性
通过SparCC 分析法分析细菌菌群间相关性(属水平丰度大于0.5%,相关系数阈值0.1)网络图结果如图4 所示。C 工艺中的物种有28 个,建立了156 条连接,其中有135 条为正相关连接,正相关率为86.5%。而在G 工艺中(图4-b)的物种有28 个,建立了214 条连接,其中有166 条正相关连接,正相关率为77.6%;Z工艺中的物种有35 个,建立了285 连接,其中有234 条正相关连接,正相关率为82.1%。综合来看,与G工艺和C 工艺相比,Z 工艺会使物种间建立更多、更复杂的相关性连接,这与表2 中Z 工艺中物种的丰富性表现较好的结论相一致。
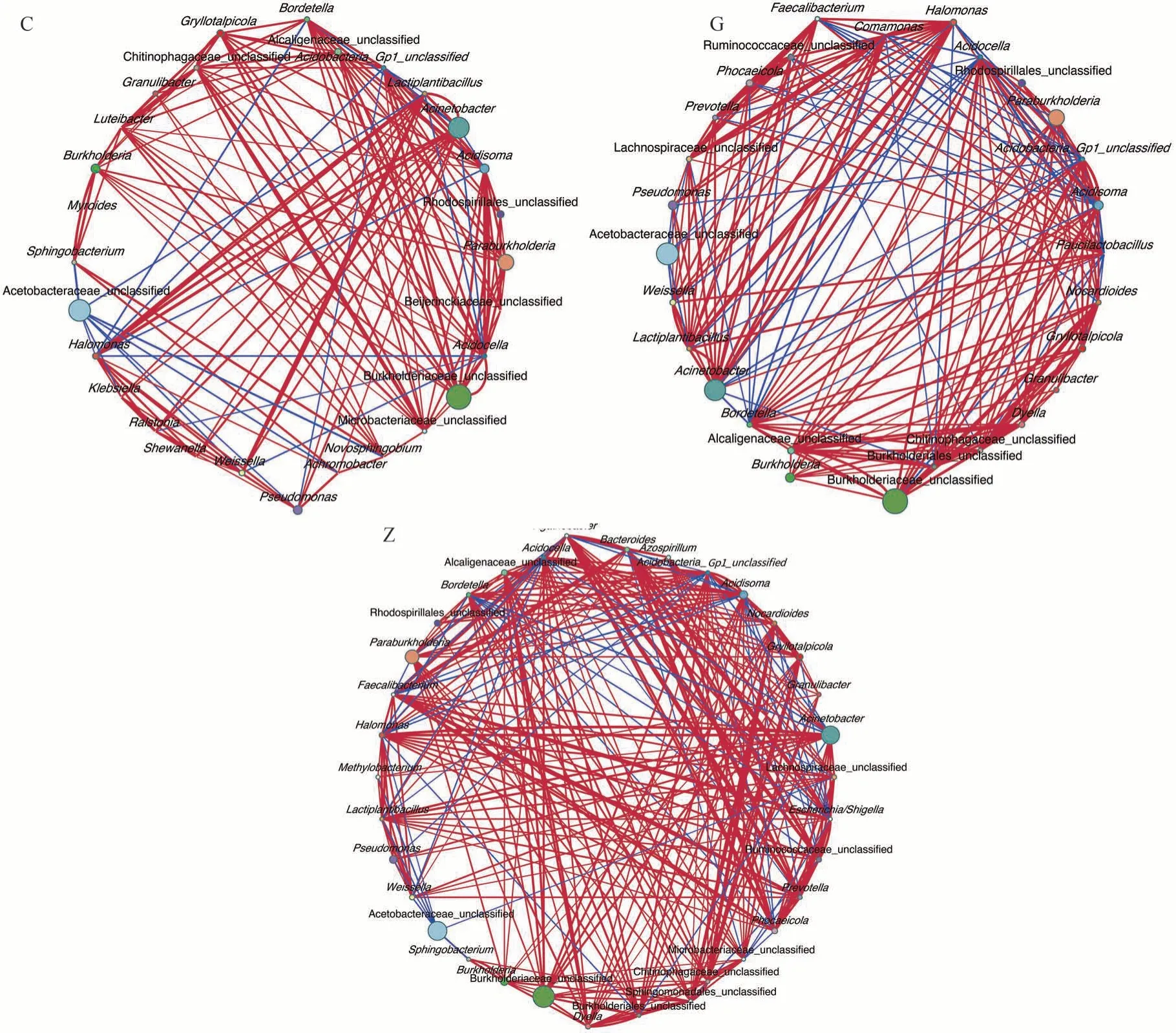
图4 基于SparCC分析属水平各物种间的相关性网络图Fig.4 Analysis of correlation network among species at genus level based on SparCC
3 讨论
食用菌的生长主要依靠培养料提供营养,从菌丝生长、产量和成品率等方面能够直观了解到不同灭菌工艺对食用菌的影响[22],但目前缺少相对系统的试验数据支撑。本研究发现,高压灭菌(G)、微压灭菌(Z)和常压灭菌(C)在香菇菌丝生长、菌棒成品率和产量方面存在较大的差异,其中Z 工艺和G 工艺的菌丝生长速度和菌棒成品率优于C 工艺,而C 工艺和Z 工艺在产量方面的表现优于G 工艺。综合分析来看,Z 工艺在菌丝生长、菌棒成品率和产量方面整体表现较好。推测是因为Z工艺处理的培养料在理化特性和微生物环境方面更适合香菇的生长。
理化特性是评价食用菌培养料的一个重要指标[23]。本研究结果表明,3 种灭菌工艺在含水量、碳氮比和木质纤维素各组分之间均存在一定差异。随着生育进程的推进,C 工艺灭菌后的菌棒含水量呈上升趋势,而G 工艺和Z 工艺则呈一定的下降趋势,这可能是由于G工艺的灭菌温度高、压力大,容易造成培养料中的水分流失,而C 工艺的灭菌过程压力低、时间长,灭菌用的水蒸气在一定程度上会促进水分在培养料中的累积。在香菇生长阶段,G 工艺和Z 工艺的含水量要显著高于C 工艺,初步推测G 工艺和Z 工艺在提高菌丝生长代谢方面优于C 工艺,这与曹娜等[7]的研究结果一致,即:食用菌在生长过程中会产生大量的水分,从而导致培养料中的含水量升高。碳氮比作为食用菌生长发育的关键营养元素之一,其比值过高时会抑制细菌和其他微生物的生长代谢,分解有机物的速度放慢,进而影响菌丝生长和产量[24-25],从3个灭菌工艺中碳氮比的变化过程来看,G 工艺和Z 工艺菌丝代谢优于C工艺,对培养料有机物降解有较好的促进作用。
培养料是食用菌与外界环境进行物质与能量交换的主要场所,培养料微生物群落与基质降解和食用菌生长密切相关[7]。高通量测序技术的飞速发展为研究培养料微生物群落的物种组成、多样性及群落结构提供了先进的方法和手段[26]。隽加香等[27]报道指出双孢蘑菇二次发酵和三次发酵能够显著提高培养料Chao1 指数、ACE 指数、Shannon 指数和Simpson 指数。本研究表明,Z 工艺中的细菌总OTU 数量以及Chao1、ACE 和Shannon 等细菌多样性指数相较于C 工艺和G工艺均有不同程度增加,说明Z 工艺能够在一定程度上提高培养料细菌群落丰富度和多样性。3 个灭菌工艺条件下细菌群落组成总体相似,在门水平中主要是以能够降解木质素、纤维素的变形菌门、厚壁菌门和放线菌门[28]为主。其中Z 工艺的变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)优势较强;C 工艺的变形菌门优势较强;G 工艺的厚壁菌门优势较强。而在属水平中,相对丰度较高的包括变形菌门中的醋杆菌科-未分类(Acetobacteraceae_unclassified)、不动杆菌属(Acinetobacter)、伯克氏菌科-未分类(Burkholderiaceae_unclassified)和伯克霍尔德菌属(Paraburkholderia);厚壁菌门(Firmicutes)中的魏斯氏菌(Weissella)和植物乳杆菌(Lactiplantibacillus);拟杆菌门中的拟杆菌属(Bacteroides)。其中变形菌门不仅在碳氮循环及木质纤维素的生物降解中发挥重要作用,还在葡萄糖、丙酸和丁酸等小分子代谢与转化过程中起着关键性作用[29]。厚壁菌门中的魏斯氏菌(Weissella)在调节细菌环境和抑制致病菌方面具有显著作用[30],拟杆菌门与有机物的利用密切相关,能够分解碳水化合物,将纤维素、半纤维素及其他多糖类物质分解成为小分子物质[31]。本研究中,木质纤维素在3 个灭菌工艺中均呈现逐渐降低的趋势。在灭菌后至采收阶段,C 工艺的木质素降解速率较快,由63.20µg·mg-1下降至44.77 µg·mg-1;G工艺的纤维素和半纤维素降解较快,分别由299.10 µg·mg-1下降至136.23µg·mg-1、56.40 µg·mg-1下降至22.33 µg·mg-1;Z 工艺的纤维素降解速率较快,由324.30 µg·mg-1下降至121.20 µg·mg-1。这可能是由于C工艺中含有丰度更高的Klebsella(10.05%)[32]和Novosphingobium(4.19%)[33],能降解木质素的细菌,Z 工艺中含有丰度更高的Acinetobacter(39%)[34],能降解纤维素的细菌,G 工艺中含有丰度更高的Acinetobacter(42.7%)、Weissella(20.08%)[35],能降解纤维素和半纤维素的细菌。结合细菌菌群间的相关性网络图发现,Z 工艺排名前16 的细菌群落丰度与纤维素和木质素含量具有较强的相关性,可以使物种建立更丰富、更复杂的连接,为香菇的生长提供较好的微生物环境。
4 结论
不同灭菌工艺处理的菌棒在香菇菌丝生长速度、产量、成品率上存在显著差异,Z 工艺处理的香菇菌棒成品率和菌丝生长速度高于C 工艺,在产量方面高于G工艺。综合分析表明,Z工艺处理下的培养料具有更好的微生物环境和较高的纤维素降解能力,但其对香菇产量的影响机制尚不明确,有待进一步深入研究。
