坛紫菜丝状体不同诱变方法的比较研究
2023-07-11陈娟娟许万涛骆其君
秦 欣 陈娟娟 杜 响 许万涛 骆其君
(宁波大学海洋学院,浙江 宁波 315211)
在传统的紫菜养殖过程中,伴随着品种退化、产量质量下降、多发病害等问题。紫菜的优良品种对其产业的发展起着重要作用,而培育新品种的基础是种质资源[1]。因此,加强紫菜优质种质资源的培育对坛紫菜产业的可持续发展具有重要意义。其中,辐射诱变能诱导新种质和新材料、增加突变频率、缩短育种周期、丰富突变类型,是品种改良的重要途径[2-3]。
目前,关于作物的辐射敏感性[4-5]、辐射生物学效应[6-7]和分子细胞生物学变异已有相关研究报道。辐射诱变育种已广泛应用于种质的创新。如陈竞天等[8]利用60Co-γ 射线辐射甜叶菊,获得了综合性状优良的耐盐突变体材料。各类诱变育种技术已广泛应用于紫菜中,成为提高育种效率、获得优良紫菜种质的主要手段。赵爽等[9]用紫外线(ultraviolet,UV)诱导圆紫菜(Pyropiasuborbiculata)野生型叶状体,分离到了可稳定遗传的色素突变体。张倩等[10]研究发现紫外线对皱紫菜(Pyropiacrispata)叶状体具有良好的诱变效果,成功分离出了四个皱紫菜的色素突变品系。Ding 等[11]利用60Co-γ 射线诱变条斑紫菜(Pyropiayezoensis),筛选出了耐高温、光合色素含量高、孢子产量高的突变株ST-2。双因子诱变可以扩大突变的类型、增加突变谱,诱变处理的顺序发生改变,获得的基因类型也随之改变,因此双因子诱变往往更有利于筛选出有利突变藻株[12],双因子诱变方式在微藻和农作物中广泛使用[13],如谢凤行等[14]采用甲基磺酸乙酯(ethyl methane sulfonate,EMS)-紫外复合诱变技术选育出了蛋白含量高且生长较快的小球藻(Chlorella sorokiniana)突变株H10,但目前坛紫菜的诱变方式主要聚焦于单因子诱变选育出具有良好生产性能的突变株、利用环境条件(如高温)筛选出具有抗逆性的突变株,关于坛紫菜自由丝状体有高突变率的诱变方法组合鲜见报道。
坛紫菜(Neoporphyrahaitanensis)浙东1 号为群体选育的品种(国家水产新品种证书编号:GS-01-013-2014),具有壳孢子放散量高、叶片厚、产量高的优势[15]。本试验通过对坛紫菜浙东1号的自由丝状体进行3种单因子和2种双因子诱变处理,比较不同诱变方式的效果,以期筛选出合适有效的诱变方法,为坛紫菜遗传育种提供技术参考。
1 材料与方法
1.1 材料与试剂
坛紫菜浙东1号(ZD-1)自由丝状体来源于浙江省海洋生物技术重点实验室,藻体颜色正常,形态良好。甲基磺酸乙酯(EMS)、五水合硫代硫酸钠,购自中国上海国药化工有限公司。
1.2 仪器与设备
Eclipse Ti 倒置荧光显微镜,尼康仪器(上海)有限公司;手持搅拌料理棒,飞利浦家电(中国)投资有限公司;GXZ 型智能光照培养箱,宁波江南仪器厂;WATER-PAM 叶绿素荧光仪,德国Walz 公司;TUV PL-L36 W/4P 紫外线杀菌灯,上海赖氏电子科技有限公司。
1.3 试验方法
1.3.1 丝状体的诱变
1.3.1.160Co-γ 射线单因子诱变 于浙江辐照中心(浙江省农业科学院作物与核技术利用研究所)进行60Co-γ 射线辐射处理,辐射后的丝状体参照文献[16]的方法培养。用手持搅拌料理棒将丝状体打碎,并用60 目筛绢过滤,得到长度为100~300 µm 的藻丝,在黑暗条件下恢复1 d,对材料进行前处理。用0、50、125、400、1 000、1 600 Gy剂量的60Co-γ射线进行诱变,诱变时间为30 min,处理后的藻丝使用灭菌海水清洗3次,再转入灭菌海水培养液中,培养条件为温度25 ℃,光照强度18 µmol·m-2·s-1,光周期为光照∶黑暗=12 h∶12 h,培养时间为2个月,每个试验组设置5个重复。
1.3.1.2 UV单因子诱变 将丝状体放入开盖的培养皿中,置于36 W 紫外灯垂直距离为35 cm 处,照射30、60、180、360 min,以不做UV 处理的丝状体作为对照,诱变后的藻丝处理与培养同1.3.1.1。
1.3.1.3 EMS 单因子诱变 前期通过预试验,确定2 h 为EMS 诱变效果较好的处理时间。将藻丝用0.1、0.2、0.4 mol·L-1的EMS 在4 ℃黑暗条件下浸泡2 h,以黑暗条件下浸泡在自然海水中的丝状体作为对照,诱变后的藻丝处理与培养同1.3.1.1。
1.3.1.460Co-γ-UV 双因子诱变 将60Co-γ 射线辐射组丝状体预培养2 个月,对材料进行前处理后进行UV诱变,UV诱变方法同1.3.1.2。
1.3.1.560Co-γ-EMS 双因子诱变 将60Co-γ 射线辐射组丝状体预培养2 个月,对材料进行前处理后进行EMS诱变,EMS诱变方法同1.3.1.3。
1.3.2 形态观察 取经过诱变处理的丝状体,用0.1%埃文斯蓝染色液避光染色15 min,进行漂洗,置于倒置荧光显微镜下观察。将出现色泽变异和具有生长优势(长度大于500 µm)的藻丝确定为突变藻丝。
1.3.3 致死率和突变率的计算 以致死率达到50%(半致死率)作为诱变丝状体的适宜条件[17-18],致死率和突变率的计算公式如下:
丝状体致死率=已染色自由丝状体数目/被镜检的自由丝状体总数×100%;
突变率=突变藻丝数量/(非突变型藻丝存活数量+突变型藻丝存活数量)×100%。
1.3.4 叶绿素荧光参数的测定 取诱变处理组的丝状体,用吸水纸吸取多余水分后置于培养皿中,用叶绿素荧光仪测定光系统Ⅱ(photosystem Ⅱ,PSⅡ)的最大光化学量子产量(maximal photochemical quantum yield of PSⅡ,Fv/Fm),测定方法参考文献[19]。
1.4 数据处理
采用Excel 2007 进行数据处理,用SPSS 20.0 软件进行相关性分析,Origin 2018软件绘图,显著水平为P<0.05。
2 结果与分析
2.1 60Co-γ射线单因子诱变
2.1.160Co-γ射线对形态的影响 与未辐射组(图1-a)相比,50 Gy(图1-b)、125 Gy(图1-c)、400 Gy(图1-d)、1 000 Gy(图1-e)辐射组营养藻丝的色素片弥散,分枝顶端的细胞体积开始变大,呈纺锤形或其他不规则形状,色素体由片状变为弥散状,继而呈颗粒状。说明50、125、400、1 000 Gy 的辐射剂量促进了这些藻丝的发育和成熟,1 600 Gy(图1-f)辐射组可见较成熟的孢子囊枝,说明1 600 Gy 的辐射剂量促进了营养藻丝转向孢子囊枝的生长。由此可见,60Co-γ 射线辐射处理可以促进自由丝状体的生长发育。

图1 自由丝状体辐射诱变后的形态Fig.1 Morphology after free-living conchocelis radiation mutagenesis
2.1.260Co-γ射线对致死率和突变率的影响 由图2可知,ZD-1 在不同剂量的60Co-γ 射线辐射下,都出现了突变的藻丝,在最低剂量50 Gy处理下,ZD-1的致死率为17.2%,突变率为0.002%,随着辐射剂量的增加,坛紫菜自由丝状体ZD-1 的突变率呈现先上升后下降的趋势,致死率呈现逐渐上升的趋势,在1 000 Gy 时,突变率到达峰值,为0.024%,致死率为49.3%,接近半致死率。综合致死率和突变率的结果,初步判定采用1 000 Gy 剂量60Co-γ 射线进行诱变处理是最有利于筛选出突变体的辐射剂量。
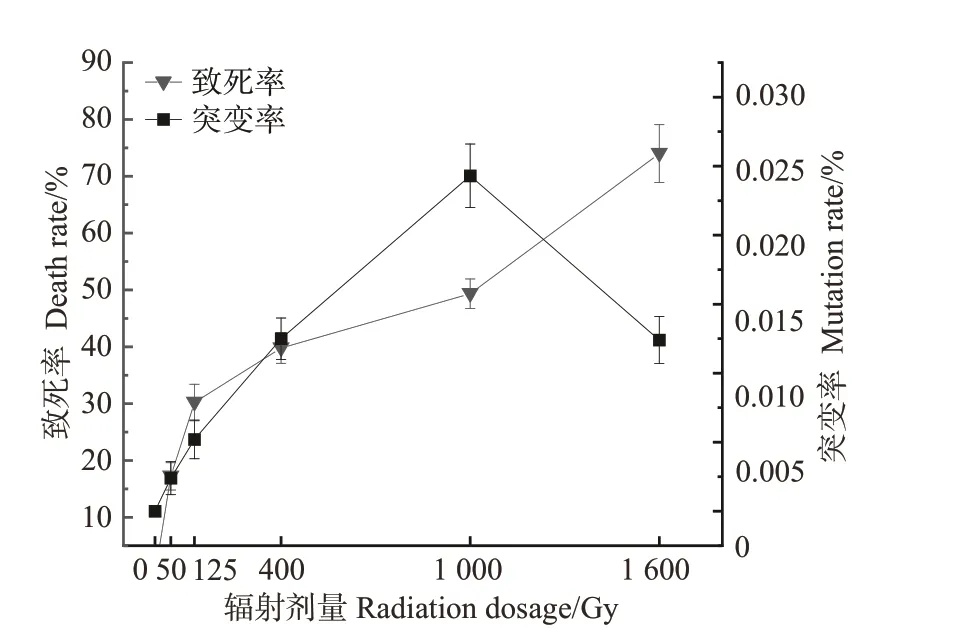
图2 60Co-γ射线诱变对坛紫菜ZD-1致死率及突变率的影响Fig.2 Effect of 60Co-γ ray mutagenesis on the lethality and mutation rate of N. haitanensis ZD-1
2.1.360Co-γ 射线对Fv/Fm的影响 由图3可知,随着辐射剂量的增加,ZD-1 的Fv/Fm呈现先上升后逐渐下降的趋势。与未辐射组相比,当辐射剂量达到50 Gy时,ZD-1 的Fv/Fm极显著升高(P<0.01),当辐射剂量达到1 000 Gy 时,Fv/Fm显著降低(P<0.05),当辐射剂量达到1 600 Gy 时,该值下降至最低,为0.13 左右。由此可见,1 600 Gy 的60Co-γ 射线辐射剂量削弱了坛紫菜自由丝状体的最大光化学量子产量,综合致死率的指标,判定60Co-γ射线的适宜诱变剂量为1 000 Gy。
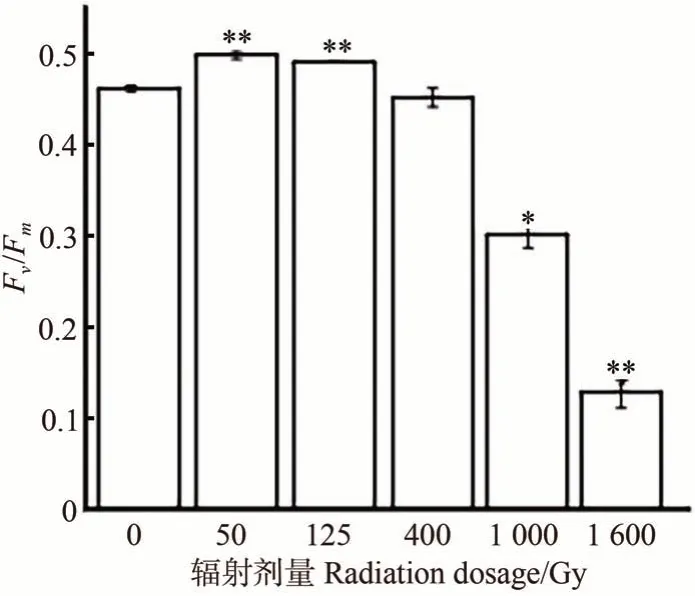
图3 60Co-γ射线诱变对坛紫菜ZD-1 Fv/Fm的影响Fig.3 Effect of 60Co-γ ray mutagenesis on Fv/Fm of N. haitanensis ZD-1
2.2 UV单因子诱变
2.2.1 UV 对致死率和突变率的影响 如图4 所示,随着UV照射时间的延长,ZD-1的致死率缓慢增加,突变率持续上升后下降。在30 min时,ZD-1的致死率为18.7%,突变率为0.008%;在180 min时,致死率和突变率分别增加至51.7%、0.025%,突变率达到峰值,致死率接近50%;在360 min时,突变率下降至0.012%,致死率持续上升至70.0%。综合上述结果,初步判定紫外照射时间180 min是最有利于筛选出突变体的处理时间。
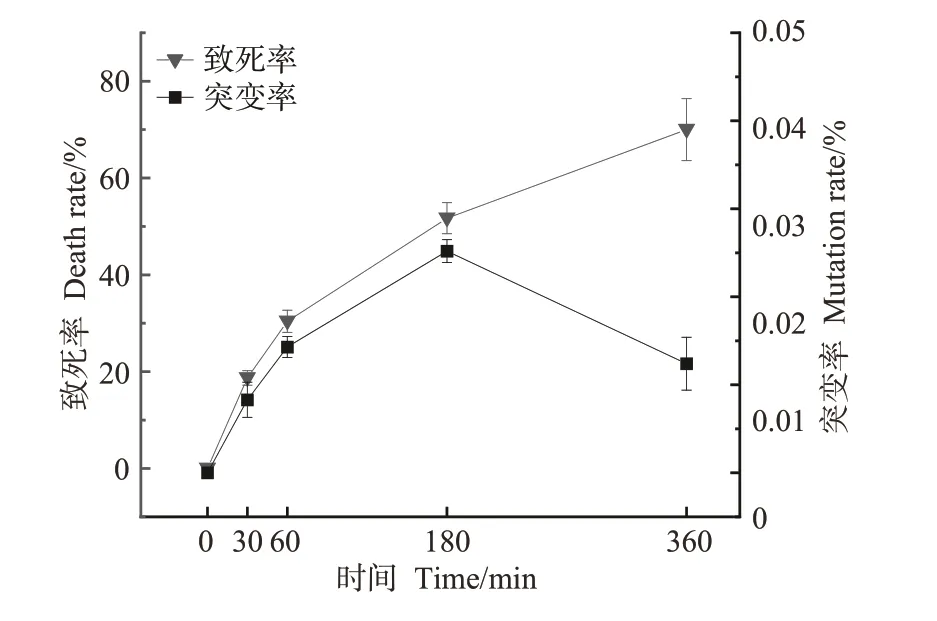
图4 UV诱变对坛紫菜ZD-1致死率及突变率的影响Fig.4 Effect of UV mutagenesis on the lethality and mutation rate of N.haitanensis ZD-1
2.2.2 UV 对Fv/Fm的影响 如图5 所示,随着紫外照射时间的延长,未辐射组ZD-1 的Fv/Fm持续下降,与对照组相比,紫外照射30 min 时,ZD-1 的Fv/Fm显著降低至0.377,照射时间延长至60 min 时,ZD-1 的Fv/Fm极显著降低至0.288。照射时间达到360 min时,ZD-1的Fv/Fm降低至最小值0.218,由此可见,长时间的紫外照射减弱了ZD-1的光合作用。综合致死率指标,判定适宜的UV诱变时长为180 min。
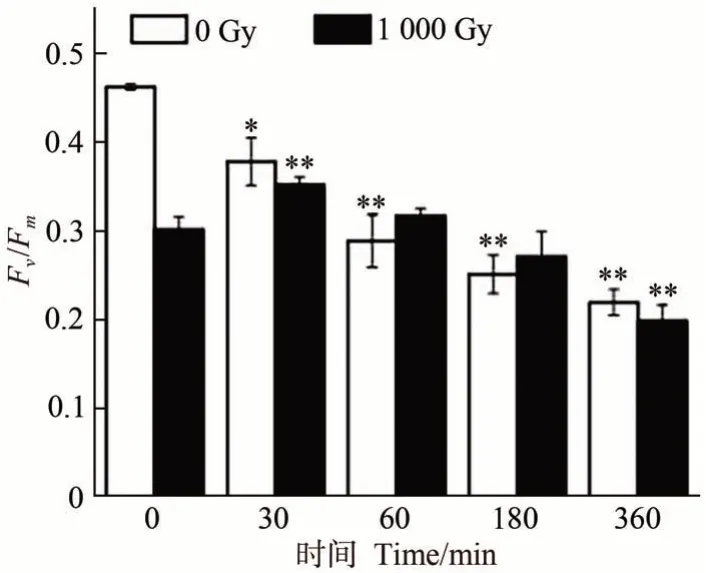
图5 UV及60Co-γ射线-UV双因子诱变对坛紫菜ZD-1 Fv/Fm的影响Fig.5 Effect of UV and 60Co-γ-ray and UV two-factor mutagenesis on Fv/Fm of N. haitanensis ZD-1
2.3 EMS单因子诱变
2.3.1 EMS 对致死率和突变率的影响 如图6 所示,在不同浓度EMS 处理2 h 的诱变条件下,ZD-1 都出现了突变的藻丝,在最低浓度0.1 mol·L-1的处理下,ZD-1 的致死率为4.9%,突变率为0.005%,随着浓度的增加,ZD-1的突变率先上升后下降,致死率呈现逐渐上升的趋势,在0.4 mol·L-1诱变处理下,致死率达到峰值,为99.2%,接近全部死亡,因此该浓度不适合作为诱变条件。在0.2 mol·L-1诱变处理下,致死率为46.8%,接近半致死率,突变率由0.1 mol·L-1条件下的0.005%增加至0.032%,初步判定采用0.2 mol·L-1EMS进行诱变是筛选出突变体的有利条件。
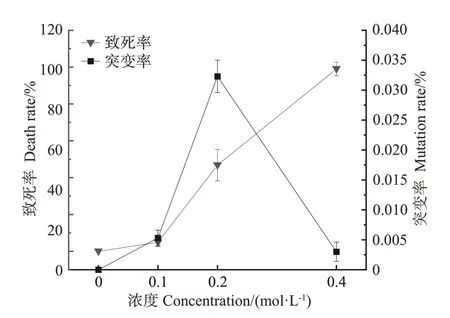
图6 EMS诱变对坛紫菜ZD-1致死率及突变率的影响Fig.6 Effect of EMS mutagenesis on the lethality andmutation rate of N.haitanensis ZD-1
2.3.2 EMS 对Fv/Fm的影响 由图7 可知,随着EMS浓度的增加,未辐射组ZD-1 的Fv/Fm逐渐下降。当EMS 的浓度为0.1 mol·L-1时,ZD-1 的Fv/Fm降低至0.380,与对照组相比具有极显著差异,当EMS 的浓度增加至0.2 mol·L-1时,ZD-1 的Fv/Fm仅为0.004。由此可见,0.2 和0.4 mol·L-1的处理浓度对ZD-1 造成了剧烈的损伤,此浓度不适宜作为诱变筛选的条件。综合致死率指标,最终判定使用EMS 浓度为0.1 mol·L-1、处理时间为2 h是筛选出突变体的有利条件。
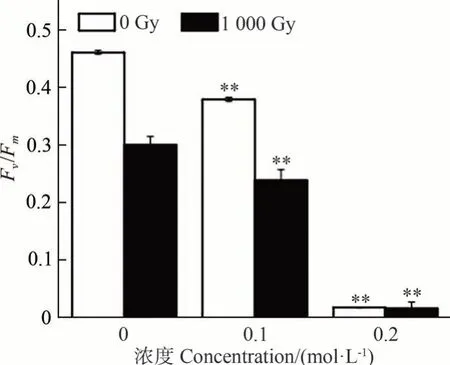
图7 EMS及60Co-γ射线-EMS双因子诱变对坛紫菜ZD-1 Fv/Fm的影响Fig.7 Effect of EMS and 60Co-γ-ray and EMS two-factor mutagenesis on Fv/Fm of N. haitanensis ZD-1
2.4 60Co-γ射线-UV双因子诱变
2.4.160Co-γ 射线-UV 双因子诱变对致死率和突变率的影响 将辐射剂量为1 000 Gy 的ZD-1 预培养2 个月,作为双因子诱变的初始藻丝,下一步进行UV照射,由图8-a 可知,与单因子UV 诱变相似,60Co-γ 射线-UV 双因子诱变条件下的ZD-1 突变率随紫外照射时间的延长先增加后减小,UV辐射180 min时,致死率为52%,接近半致死率,突变率比单因子UV在180 min处理下增加至0.082%,表明与单因子诱变相比,双因子诱变增加了突变的概率,初步判定UV 辐射180 min为60Co-γ 射线-UV 双因子诱变中UV 的适宜诱变时长。
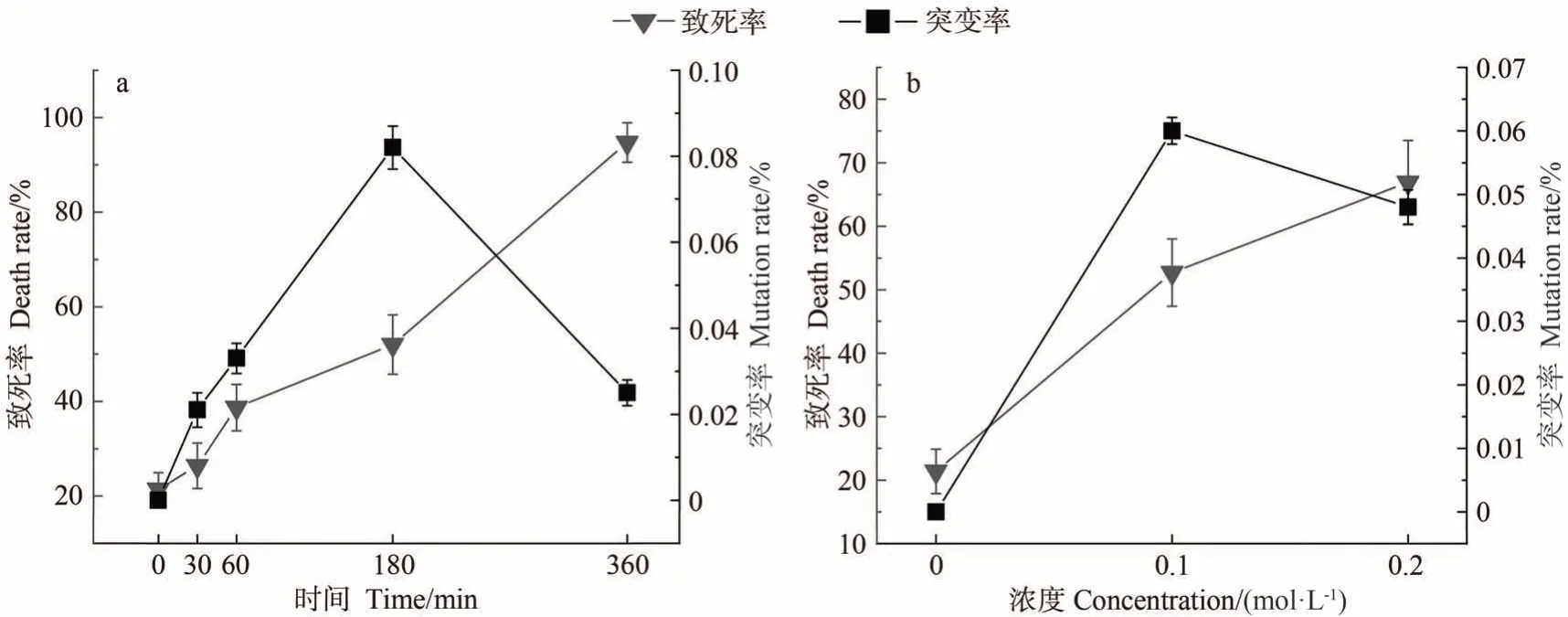
图8 双因子诱变对坛紫菜ZD-1致死率及突变率的影响Fig.8 Effect of double factor mutagenesis on the lethality and mutation rate of N. haitanensis ZD-1
2.4.260Co-γ 射线-UV 双因子诱变对Fv/Fm的影响60Co-γ 射线和UV 双因子诱变中,与单因子UV 诱变相似,随着UV 辐射时间的延长,ZD-1-1 000 Gy 组Fv/Fm呈现先上升后下降的趋势(图5)。UV 辐射30 min 时,ZD-1-1 000 Gy 组的Fv/Fm显著高于对照组(P<0.01),为0.351,UV 辐射时间为60 min 时,Fv/Fm比对照组高0.016,但无显著差异,随着UV 辐射时间的增加,Fv/Fm持续下降,UV 辐射180 min 时,Fv/Fm低于对照组但无显著差异,在360 min 时极显著低于对照组,为0.198,表明持续的UV 辐射会削弱植物的光合作用。综合致死率指标,判定UV 辐射180 min 为60Co-γ 射线-UV 双因子诱变中UV的适宜诱变时长。
2.5 60Co-γ射线-EMS双因子诱变
2.5.160Co-γ射线-EMS双因子诱变对致死率和突变率的影响 对双因子诱变的初始藻丝进行下一步EMS诱变处理,由图8-b可知,ZD-1的突变率在0.1 mol·L-1的诱变浓度下最大,为0.06%,较单因子EMS 诱变明显增加,同时,该浓度下的致死率为52.7%,接近半致死率。在0.2 mol·L-1的诱变浓度下,ZD-1的致死率较单因子EMS 诱变增加至66.9%,突变率较单因子EMS诱变增加至0.048%,表明60Co-γ射线和EMS双因子诱变对ZD-1造成的损伤高于单因子EMS诱变,诱变的效果优于单因子EMS诱变,初步判定0.1和0.2 mol·L-1都可作为60Co-γ 射线-EMS 双因子诱变中EMS 的适宜诱变浓度。
2.5.260Co-γ 射线-EMS 双因子诱变对Fv/Fm的影响60Co-γ 射线和EMS 双因子诱变中,随着EMS 浓度的增加,ZD-1 的Fv/Fm总体呈现下降的趋势(图7)。当EMS的浓度为0.1 mol·L-1时,ZD-1-1 000 Gy组的Fv/Fm下降幅度为21%,高于单因子EMS 诱变。当EMS 的浓度为0.2 mol·L-1时,ZD-1-1 000 Gy 组的Fv/Fm下降幅度为73%,Fv/Fm达到最低值,为0.039,极显著低于对照组(P<0.05),表明0.2 mol·L-1的EMS强烈抑制了ZD-1的光合作用。综合致死率指标,判定0.1 mol·L-1的EMS为60Co-γ 射线-EMS 双因子诱变中EMS 的适宜诱变浓度。
2.6 坛紫菜突变丝状体的生长状况
坛紫菜丝状体经单因子和双因子诱变后,继续培养,对出现的不同突变特性进行统计,在后续的培养过程中,有的丝状体色素突变特性消失,颜色恢复至野生色,有的丝状体出现新的色素突变特性,有的具有色素突变特性的丝状体生长停滞,藻丝逐渐变白,最后死亡,突变率有所降低,详见表1。表明在此培养条件下,有突变特性的藻丝不能达到最佳生长发育水平,突变表型有所减少。

表1 不同诱变方式处理坛紫菜ZD-1的诱变结果Table 1 Mutagenesis results of N. haitanensis ZD-1 treated with different mutagenesis methods/%
本研究中,60Co-γ 射线、UV、EMS 在其最佳诱变处理条件下达到了最高突变率,分别为0.024%、0.025%、0.032%,表明ZD-1 在单因子EMS 诱变下可以得到较多的突变体。60Co-γ 射线-UV 和60Co-γ 射线-EMS 在其最佳诱变处理条件下达到了最高突变率,分别为0.082%、0.048%,综合考虑5种诱变方法的突变率,表明ZD-1 在60Co-γ 射线-UV 双因子诱变下可以得到较多的突变体,提高突变的概率。
2.7 诱变条件与致死率和光合参数的相关性分析
由表2 可知,不同诱变条件与致死率和光合参数之间存在不同程度的相关性。致死率与60Co-γ射线诱变剂量-EMS 浓度呈正相关,与EMS 浓度、UV 照射时间呈显著正相关,与60Co-γ射线诱变剂量、60Co-γ射线诱变剂量-UV照射时间呈极显著正相关。光合参数与EMS浓度、UV 照射时间、60Co-γ射线诱变剂量-EMS浓度呈负相关,与60Co-γ 射线诱变剂量-UV 照射时间呈显著负相关,与60Co-γ射线诱变剂量呈极显著负相关。
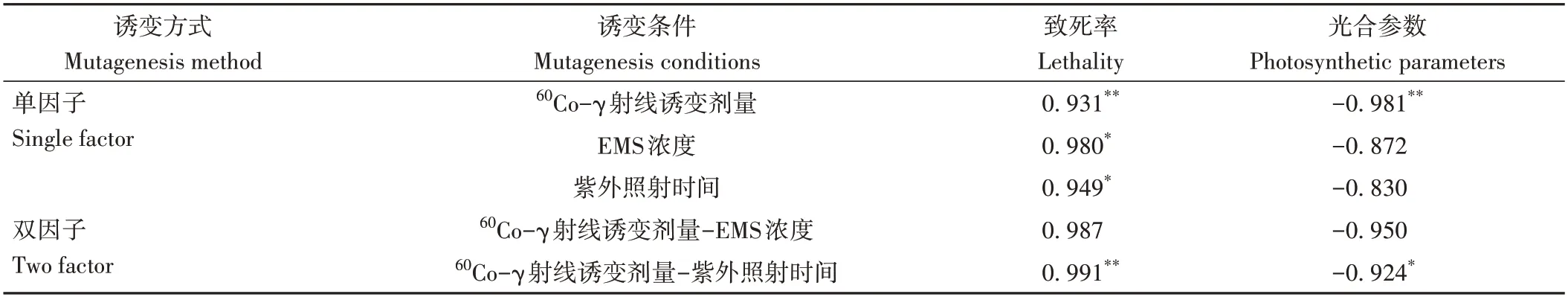
表2 不同诱变条件处理与致死率和光合参数的相关性分析Table 2 Correlation analysis of different mutagenesis conditions with lethality and photosynthetic parameters
60Co-γ 射线诱变剂量-EMS 浓度双因子诱变与致死率的相关系数为0.987,高于EMS浓度单因子诱变与致死率的相关系数(0.980),60Co-γ射线诱变剂量-EMS浓度双因子诱变与光合参数的相关系数为0.950,高于EMS 浓度单因子诱变与光合参数的相关系数(0.872);60Co-γ射线诱变剂量-UV 照射时间双因子诱变与致死率的相关系数为0.991,高于UV 照射时间单因子诱变与致死率的相关系数(0.949),60Co-γ射线诱变剂量-UV辐射时间双因子诱变与光合参数的相关系数为0.924,高于UV 单因子诱变与光合参数的相关系数(0.830)。可见,双因子诱变与光合参数和致死率的相关系数均大于单因子诱变,表明对丝状体光合作用及存活率影响较大的诱变方式为双因子诱变,致死率和光合参数可以作为衡量不同诱变效果的参考指标。
3 讨论
60Co-γ 射线具有很强的穿透能力,能够影响细胞体内的各种生理生化反应,改变叶绿体类囊体的基本结构,并调控抗氧化系统,诱导次生代谢物质的累积,从而达到变异效果[20-22]。射线诱变在一定剂量下可以促进生物体的生长发育,本研究发现,ZD-1 经不同剂量60Co-γ射线辐射后,出现了不定型细胞和孢子囊枝,说明射线辐射促进丝状体由营养藻丝向孢子囊枝的转化,可能是藻丝在不利条件下,倾向于生长繁殖,而非营养生长,这样的选择有利于藻丝在逆境环境下繁殖后代,在生产实践中可以缩短育苗的时间,具有良好的栽培性状。这与陈昌生等[23]发现60Co-γ 射线辐射对坛紫菜自由丝状体形成的孢子囊枝数量有显著增加的结果相符。所有诱变处理组丝状体的致死率均较对照有所上升,推测过高的辐射剂量扰乱了生物体的正常代谢[24-25]。
60Co-γ射线辐射会直接或间接地影响植物体内叶绿素含量,从而在不同程度上影响植物的光合作用[26]。Fv/Fm反映了植物的潜在最大光能转换效率,可衡量植物是否处在健康的生理状态。本研究中,ZD-1Fv/Fm在低剂量(50 Gy)辐射下增加,这与许超丽等[27]发现40 Gy 的低剂量X 射线辐射能够提高水稻光合作用的结果一致,推测藻体内多种抗氧化物酶系统在抵御逆境下产生的多种活性氧主要用于维持细胞的正常生理功能和光合作用的代谢;而1 600 Gy 辐射下光合速率下降,推测是由于辐射剂量超过了藻体抵御逆境的最大能力。
EMS 作为化学诱变剂,能诱发更多基因位点的变异,不同植物对EMS的敏感性存在差异[28]。马颖超[29]通过设置不同EMS 浓度和时间组合的结果显示,条斑紫菜丝状体在0.2 mol·L-1浓度下处理1 h 时致死率超过50%,而本研究中坛紫菜丝状体在0.2 mol·L-1浓度下处理2 h时接近半致死率,表明诱变的效果与诱变材料和诱变条件有关。
UV照射能够造成染色体的断裂随机分布,使生物体出现较多的染色体结构变异[30]。随着紫外辐射强度的增加,藻体内部会产生多种活性氧,对藻体的光合器官造成损伤,降低光合参数[31]。本研究中,短时间的UV 照射条件下,21 d 后出现了生长较快的藻丝,这与前人利用紫外线联合60Co-γ射线选育出产量高的突变株的研究结果一致[32]。推测是由于低强度的UV 辐射能够促进藻体的固碳作用[33-34],使得藻体的生长加快,理论上可以选育出生长较快的藻丝,有利于生产实践。因此,有待对藻丝进行下一步的培养,观察研究生长优势是否有可遗传性。
为提高诱变育种的效果,常采用多种诱变方式组合,最典型的是先进行物理诱变,破坏生物膜的完整性,增大其渗透性,增大生物对化学诱变剂的吸收能力后,再进行化学诱变。理论上物理和化学诱变方式相结合能发挥各自的优势,更快地获得有益的突变体[35]。本研究发现,双因子诱变的Fv/Fm显著高于单因子诱变,推测60Co-γ 射线辐射在一定程度上增加了ZD-1 的抗辐射能力,在UV 低时长诱变条件下有了一定的耐受力。双因子诱变的最大突变率高于单因子诱变,表明双因子诱变的效果优于单因子诱变。这与胡建华等[36]的研究结果一致,即:利用二次重离子诱变选育出的枯草芽孢杆菌核黄素产量比一次诱变提高77.7%。本试验采用3 种单因子和2 种双因子诱变方法,得出在辐射剂量为1 000 Gy60Co-γ射线和UV照射180 min双因子诱变方式下的诱变率最大,为0.082%,表明双因子诱变可以极大丰富突变的概率,创造多种突变特性,有利于种质的培育,是一种高效的诱变方法。
由于突变特性的表型受环境影响较大,在后续的培养条件中易消退。为避免上述情况,一方面需要扩大诱变的数量,尽可能获得更多有突变特性的丝状体,一方面需要设置不同的培养温度和光照,初步探究最适生长条件,保留丝状体的突变特性,进行扩大培养和研究。此外,由于同一生物的不同生长阶段对诱变的敏感性不同,因此本研究具有一定的局限性,有必要对丝状体的不同生长阶段进行研究,从而获得更加全面、高效、多样的诱变方法。
4 结论
本研究结果表明,辐射剂量为1 000 Gy 的60Co-γ射线和UV 照射180 min 的双因子诱变方式可得到较多的突变体,突变率为0.082%,致死率为52%,有良好的突变效应。诱变对ZD-1 造成了损伤,Fv/Fm下降至0.270。突变具有一定的非定向性,因此突变后的丝状体具有不稳定性,在后续的培养过程中,突变率有所下降,适应生长的稳定的突变特性将会被保留下来。
