VEGF及其相关低氧因子在不同发育阶段牦牛肾脏中的表达分布研究
2023-07-11周熳琳董仕慧张伊阳杨映雪柴雅静乔自林
周熳琳 董仕慧 张伊阳 李 睿 杨映雪 柴雅静 乔自林 杨 琨,*
(1西北民族大学生命科学与工程学院,甘肃 兰州 730030;2西北民族大学生物医学研究中心甘肃省动物细胞技术创新中心,甘肃 兰州 730030;3西北民族大学生物医学研究中心生物工程与技术国家民委重点实验室,甘肃 兰州 730030)
牦牛(Bosgrunniens)是高原地区的特有牛种,具有耐低氧、低温和强紫外辐射的特点[1]。由于牦牛具有与低氧适应的解剖特征和生理特征的多种器官,如较大的心和肺、较厚的体表覆盖物和无功能的汗腺,使其能够适应高海拔低氧环境[2-3]。肾脏在诸多脏器中更易受到缺氧影响,这是由于缺氧条件下氧气在肾血管和动脉血管之间扩散分流,引起肾髓质的供氧量降低,同时肾小管耗氧量较高,从而无法维持正常生理功能[4]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)又称为血管通透因子(vascular permeability factor,VPF),是Senger 等[5]在肿瘤分泌物中发现的一种糖基化分泌性多肽因子,分子量约为34~45 kDa,是一种生物活性强烈、结构高度保守的糖蛋白[6]。有研究发现VEGF 在肾脏组织中含量较高,主要由肾小球足细胞合成并在生理环境中通过旁分泌和自分泌发挥生理功能,如肾胚胎的生长发育、保护肾小球内皮细胞完整性和肾毛细血管的再生与修复[7]。VEGF 的生物学功能是通过与内皮细胞中存在的特异性受体血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)相结合来促进内皮细胞的增殖、提高血管通透性以及促进新血管生成,有研究表明VEGF/VEGFR-2 与低氧引起的肾脏疾病密切相关[8-9]。VEGF是低氧诱导因子-1α(hypoxiainduciblefactor-1α,HIF-1α)的下游靶基因,低氧状态中HIF-1α与VEGF基因的5′-端增强子结合位点相互作用,调节VEGF的转录激活以及表达[10-11]。缺氧过程中,肾脏中VEGF与HIF-1α的mRNA 同步变化,上调HIF-1αmRNA 可激活VEGF基因转录,促进血管重塑,便于将血液运送至肾小管的缺氧区域,减少肾损伤[12]。有研究表明,VEGF可通过细胞外信号调节激酶1/2(extracellular signalregulated kinase,ERK1/2)和激活转录因子-2(activating transcription factor,ATF-2)的磷酸化特异性刺激血管细胞粘附因子-1(vascular cell adhesion mole-1,VCAM-1)的表达,可介导细胞间或细胞与基质间的接触与结合,进而促进细胞黏附和增殖,并与缺氧引起血管的重塑密切相关[13-14](图1)。
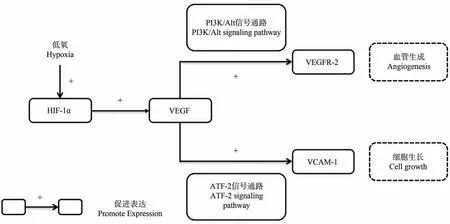
图1 VEGF及其相关低氧因子相互关系示意图Fig.1 Correlation diagram of VEGF and its related hypoxic factors
目前对肾脏的研究主要集中在成年动物肾脏的结构特征,如大鼠、小鼠和狗等[15];对不同年龄段肾脏的研究主要集中在小鼠和大鼠[16-17];关于VEGF 等因子在牦牛肾脏发育过程中的高原低氧适应性仍鲜见报道。因此,本试验通过伊红-苏木精(hematoxylin-eosin,H&E)染色、免疫组织化学染色(immunohistochemical staining,IHC)和实时荧光定量PCR(quantitative realtime PCR,qRT-PCR)方法检测不同发育阶段牦牛肾脏VEGF 及其受体VEGFR-2、HIF-1α 和VCAM-1 的表达分布差异,结合VEGF 的生物学功能推测其与牦牛高原低氧适应的关系,以期为进一步探究牦牛肾脏对高原低氧环境的适应性提供基础资料。
1 材料与方法
1.1 试验动物及样品
研究对象为15 头高原牦牛,均采集自甘肃省甘南藏族自治州某屠宰场。将15 头临床表现正常的牦牛分为三个年龄组:新生牦牛(1~7 d,n=5)、9 月龄牦牛(9 月,n=5)和成年牦牛(6 岁,n=5)。所有组均包括雄性和雌性。在牦牛放血后15 min内立即采集肾脏组织并用4%的多聚甲醛固定。
1.2 试验试剂
磷酸盐缓冲液(phosphate buffered saline,PBS)、0.01 mol·L-1柠檬酸钠缓冲盐、伊红、苏木精、Histostatim Plus 试剂盒(SP-0023)、抗VEGF 多克隆抗体(BS-1665R)、抗VEGFR-2 多克隆抗体(BS-0565R)、抗HIF-1α 多克隆抗体(BS-20398R)、抗VCAM-1 多克隆抗体(BS-8994R),北京博奥森生物技术有限公司;抗体结合用二氨基联苯胺(diaminobenzidine,DAB)底物试剂盒(DA1010),北京索莱宝科技有限公司;反转录试剂盒(AG11711),湖南艾科瑞生物工程有限公司。
1.3 H&E染色检测及指标测定
1.3.1 H&E 染色 将牦牛肾脏组织切成体积为1 cm3的小块后按照石蜡包埋的常规方法进行包埋,再对包埋好的蜡块进行修块和切片(厚度为5 µm),用于后续处理。使用H&E 染色方法观察样本的组织学特征。
1.3.2 指标测定 随机选取不同发育阶段牦牛肾脏组织切片各5 张,在400 倍视野下随机选取5 个不同区域拍摄,用Image J 软件观察并测量不同发育阶段牦牛肾脏皮质中肾小球和肾小管直径及肾小球和肾小管上皮细胞、肾间质细胞面积。
1.4 免疫组化检测
使用Histostatim Plus 试剂盒进行免疫组化染色,用于研究VEGF、VEGFR-2、HIF-1α 和VCAM-1 的表达水平,肾组织切片在二甲苯中脱蜡,并通过梯度酒精水化。经PBS冲洗后,放入0.01 mol·L-1柠檬酸钠缓冲液(pH 值6.0)对切片进行高压灭菌(在微波炉中15 min),以回收抗原。内源性过氧化物酶在37 ℃下用3% H2O2灭活10 min。然后用抗VEGF 多克隆抗体、抗VEGFR-2 多克隆抗体、抗HIF-1α 多克隆抗体和抗VCAM-1 多克隆抗体(1∶200 稀释度)在湿润的4 ℃室内过夜培养。抗体结合用DAB 底物试剂盒染色,用苏木精对细胞核进行复染。对照组使用牛血清蛋白作为一抗,其他步骤和条件保持不变。
1.5 qRT-PCR 检测肾组织内VEGF、VEGFR-2、HIF-1α和VCAM-1表达
1.5.1 引物的设计与合成 根据GenBank 中的VEGF、VEGFR-2、HIF-1α和VCAM-1基因序列,采用Primer Premier 6.0 设计VEGF、VEGFR-2、HIF-1α和VCAM-1基因引物,同时以ACTB基因为内参基因,引物序列信息见表1,送至湖南艾科瑞生物工程有限公司合成。

表1 引物序列信息Table 1 Primer sequence information
1.5.2 qRT-PCR 检测肾组织内VEGF、VEGFR-2、HIF-1α和VCAM-1表达 按照反转录试剂盒说明书提取总RNA并将其反转成cDNA后进行qRT-PCR。反应总体系为20 µL:H2O 8.2 µL,正反引物各0.4 µL,2×Universal SYBR Green Fast qPCR Mix 10 µL,cDNA 1 µL。反应程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火35 s,40 个循环。qRT-PCR 反应在Applied Biosystems 7500荧光定量PCR仪(伯乐,上海)中进行,所得数值均用内参ACTB进行标准化。qRT-PCR结果采用2-ΔΔCt运算方法进行分析。
1.6 统计学分析
通过光学显微镜(奥林巴斯,日本)观察并捕获染色组织切片图像,并通过图像分析软件Image Pro Plus 6.0 进行定量检测VEGF、VEGFR-2、HIF-1α 和VCAM-1 阳性表达结果。使用GraphPad Prism8.0 进行统计分析,P<0.05为差异显著。
2 结果与分析
2.1 H&E染色结果
观察H&E 染色结果可知,不同发育阶段牦牛肾脏的结构组织完整,发育状况良好,无病变部位(图2)。并且如表2 所示,肾小球和肾小管直径、肾小球和肾小管上皮细胞以及肾间质细胞面积均随年龄增长而逐渐增加,其中,新生和9 月龄牦牛的肾小球直径、肾小球面积显著低于成年牦牛(P<0.05),而肾小管直径、肾小管上皮细胞面积和肾小管间质细胞面积在3 个发育阶段之间均有显著差异(P<0.05)。

表2 不同发育阶段牦牛肾组织学指标测量数据Table 2 Measurement data of kidney histological indicators in yaks at different developmental stages
2.2 免疫组织化学染色和光密度分析结果
免疫组织化学和光密度分析结果显示,与阴性对照组相比,VEGF、VEGFR-2、HIF-1α 和VCAM-1 主要表达在不同发育阶段牦牛肾脏近端小管和远端小管上皮细胞、肾小球细胞中。VEGF 在成年组表达最强,9 月龄组次之,新生组最弱(图3-A~C),三组之间均存在显著差异(P<0.05)(图4-A);VEGFR-2的表达随着年龄的增长而增加,成年组表达最强,其次为9 月龄组,新生组最弱(图3-D~F),三组之间均存在显著差异(P<0.05)(图4-B);HIF-1α 在成年组表达最强,其次为9 月龄组,新生组最弱(图3-G~I),三组之间均存在显著差异(P<0.05)(图4-C);VCAM-1 在不同发育阶段牦牛肾脏中均有表达(图3-J~L),在9 月龄和成年组的表达量较高,两者差异不显著,在新生组表达量较低,与其他两组相比差异显著(P<0.05)(图4-D);不同发育阶段牦牛肾脏阴性对照如图3-M~O所示。
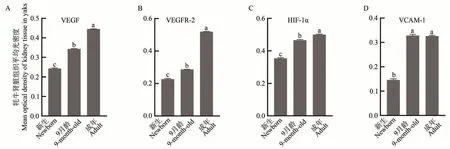
图4 不同发育阶段牦牛肾脏VEGF、VEGFR-2、HIF-1α和VCAM-1的平均光密度值Fig.4 Mean optical density value of VEGF,VEGFR-2,HIF-1α and VCAM-1 in the kidneys of yaks at different developmental stages
2.3 qRT-PCR检测结果
qRT-PCR 结果显示,VEGF、VEGFR-2、HIF-1α和VCAM-1在新生、9 月龄和成年组肾脏组织中均有表达。VEGF相对表达量在新生组最高,与9 月龄和成年组之间差异显著(P<0.05),9 月龄组和成年组之间表达差异不显著(图5-A);VEGFR-2相对表达量在新生组和成年组较高,两者差异不显著,在9 月龄组的表达量最低,与其他两组相比差异均显著(P<0.05)(图5-B);HIF-1α相对表达量在新生组最高,与其他两组相比差异显著(P<0.05),9 月龄组和成年组之间差异不显著(图5-C);VCAM-1的相对表达量在9 月龄组和新生组较高,两组相比差异不显著,在成年组的表达量最低,与其他两组相比均差异显著(P<0.05)(图5-D)。
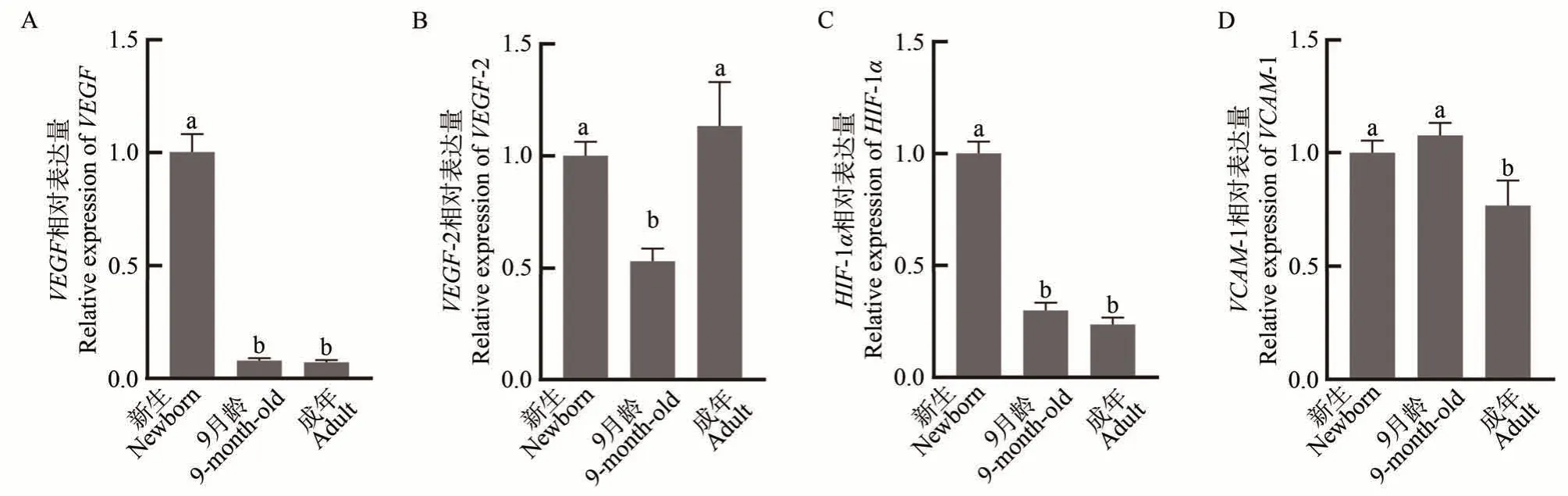
图5 不同发育阶段牦牛肾脏VEGF、VEGFR-2、HIF-1α和VCAM-1的相对表达量Fig.5 Relative expression levels of VEGF,VEGFR-2,HIF-1α and VCAM-1 in the kidneys of yaks at different developmental stages
3 讨论
本研究H&E 染色结果发现,不同发育阶段牦牛肾脏的肾小球和肾小管直径、肾小管上皮和肾小球细胞面积均随年龄的增长而增大,这与Goyal等[18]和Davies等[19]对增龄小鼠肾小球和肾小体的组织结构观察,以及王婷等[20-21]对新生至成年时期的牦牛肾小管的形态结构观察结果一致。肾间质细胞可以分泌多种因子,如表皮生长因子(epidermal growth factor,EGF),促红细胞生成素(erythropoietin,EPO)等,参与调控红细胞生成和肾脏生长发育[22-23]。本试验结果发现,牦牛肾脏发育过程中,肾小管间质成分逐渐增多,与上述报道相符。可见,随着年龄的增长,牦牛肾小管和肾小球逐渐增大,肾间质细胞增多,肾功能逐渐成熟,以适应高原的低氧环境。
IHC 结果显示,VEGF、VEGFR-2、HIF-1α 和VCAM-1主要分布在肾小管上皮细胞和肾小球细胞胞质,且表达量与年龄呈正相关。在低氧环境下,肾脏通过调控促血管生成、红细胞生成和糖酵解的因子来适应环境[24]。VEGF 是血管生成和血管发育的中枢,缺氧时,靶组织响应缺氧而调控多种血管生成因子产生[25]。低氧刺激下,VEGF 激活血管内皮细胞上的受体VEGFR-2,以促进血管内皮细胞的增殖、迁移和血管形成[26]。HIF-1α 信号传导参与低氧条件下VEGF介导的血管生成,且在肾脏微血管发育过程中起着重要作用[27],例如Kotch 等[28]发现HIF-1α完全缺乏会引起鼠胚胎在低氧时不能诱导VEGFmRNA的生成,导致肾微血管生成异常。VEGF 通过ATF-2 刺激VCAM-1的表达以及内皮细胞和白细胞的粘附与迁移[14]。本研究中,牦牛VEGF 蛋白及其受体VEGFR-2 在肾脏不同发育阶段的肾小球和肾小管中均高表达。这与Doi等[29]报道的VEGF主要分布于人类肾中肾小球的足细胞、远曲小管和近曲小管的结果基本相符。肾脏在缺氧刺激下调控VEGF 和VEGFR-2 蛋白表达以维持肾小球和肾小管毛细血管网络和肾小球滤过屏障[24,26-27,30]。据此推测,VEGF 及其受体在发育阶段可能对牦牛肾血管及肾小球维持器官正常生理功能发挥作用。而牦牛肾脏中VEGF 及VEGFR-2 蛋白的表达与年龄呈正相关,这与郭洁等[16]和张雪光等[17]报道的鼠肾组织内VEGF 及VEGFR-2 表达量随着年龄的增长而增加的结果相一致。推测VEGF 及VEGFR-2 蛋白在成年牦牛肾脏高表达可能与肾脏的低氧适应性以及预防低氧引起的肾损伤有关。Freeburg 等[31]研究了肾小球足细胞中HIF 产生的机制,并证实了在发育期间,集合管和大部分肾小管处于较严重的低氧状态,这与本试验结果中HIF-1α 蛋白高表达于牦牛肾小管上皮细胞相一致。Xu 等[32]研究显示,在10%的氧浓度中,VEGF 的表达趋势与HIF-1α 相同,均随缺氧时间的延长和缺氧程度的增加而增加。这与本试验结果相同,即:VEGF 及其受体VEGFR-2 蛋白的表达趋势与HIF-1α 相同,其表达量均随年龄的增长而增加,在成年组表达最高。据此推测,在发育期间,低氧刺激HIF-1α 诱导VEGF 及VEGFR-2 的表达上调并增加向组织的氧气输送来使牦牛适应低氧环境。本试验发现,VCAM-1 蛋白在牦牛肾脏中的表达与年龄成正相关,且主要分布于肾小管上皮细胞。这与Hill 等[33]发现在人正常肾脏中,VCAM-1 的表达仅限于壁上皮细胞和少数近端小管细胞的基底外侧表面的结果基本相符,不同的是牦牛肾小管上皮细胞表达更为丰富且均匀。而新生牦牛肾脏VCAM-1 蛋白的表达较低,可能与新生牦牛仍未适应低氧环境有关。VCAM-1的表达受低氧和VEGF 的调控,由此推测低氧刺激肾小球分泌VEGF,进而特异性诱导VCAM-1 的表达,以促进细胞的黏附和分化,在牦牛肾脏适应低氧过程中起促进作用。
本试验qRT-PCR 结果表明,随着年龄的增长,HIF-1α和VEGF表达量呈递减趋势,VEGFR-2在成年表达较高,VCAM-1在成年表达最低,与免疫组化光密度分析蛋白结果有所不同。推测造成这种差异的原因,首先可能是由于两种试验方法分析的角度不同,qRT-PCR 分析的是肾组织平均表达量,而免疫组化分析的是特定区域细胞组织的蛋白表达量。其次,VEGF等因子是调节血管生成及血管重塑的主要调控因子,VEGF、VEGFR-2、HIF-1α和VCAM-1表达减少可能使肾血管随增龄出现生成异常现象[18-19]。再次,通过H&E 和IHC 观察发现,随着年龄增长,肾间质细胞面积增加,由于其几乎不表达上述相关蛋白,所以对qRT-PCR结果会产生影响。
4 结论
本研究发现,VEGF、VEGFR-2、HIF-1α和VCAM-1的表达与年龄呈正相关,其表达分布特点相似,主要分布于牦牛肾脏的近端小管和远端小管上皮细胞及肾小球细胞的胞质中。推测在低氧条件下,VEGF、VEGFR-2、HIF-1α 和VCAM-1 通过调控促进血管生成、红细胞生成和糖酵解过程,对牦牛肾脏发育过程中适应低氧环境起重要作用,但具体调控机制还需进一步深入研究。
