不同LED处理对油桃果实采后类胡萝卜素及可溶性糖代谢的影响
2023-07-11孙亚静郝雅婧周丹丹
孙亚静 王 燕 郝雅婧 周丹丹 屠 康 ,*
(1南京农业大学食品科技学院,江苏 南京 210095;2南京林业大学轻工与食品学院,江苏 南京 210037)
油桃(Prunuspersicavar.nectarine)表面光滑、无毛,果实色泽亮丽,果肉厚而脆嫩、香味浓郁,富含维生素C及多酚、类胡萝卜素等多种生物活性物质,深受广大消费者的喜爱[1-2]。油桃属于呼吸跃变型果实,成熟期在高温季节,采后易衰老、质地变软、风味变差,严重影响果实的感官、质构品质和商品价值,因此采后选择合适的贮藏保鲜技术以延长其货架期显得尤为重要[3-4]。
类胡萝卜素是油桃果实主要的呈色物质,包含胡萝卜素类和叶黄素类,不仅是重要的维生素A原,还具有预防疾病及保健的作用[5-6]。类胡萝卜素分子中含有共轭双键,该结构对400~500 nm 波长的光有较强的吸收,从而使果实呈现从黄色、橙色到红色不同的色泽[7]。类胡萝卜素的生物合成主要通过异戊二烯途径,可溶性糖经过糖酵解途径可以产生丙酮酸和3-磷酸甘油醛(3-phosphoglyceraldehyde,3-GAP),然后通过2-C-甲基-D-赤藓糖醇-4-磷酸(2-C-methyl-Derythritol-4-phosphate,MEP)途径为类胡萝卜素的合成提供前体物质——异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)[6,8]。因此,果实中的可溶性糖含量对类胡萝卜素的积累至关重要,同时,果实中类胡萝卜素的组成和含量也会对果实的色泽产生影响。
目前已开发多种技术用于丰富采后贮藏期间果实中的生物活性物质,其中,发光二极管(light-emitting diode,LED)照射作为一种无残留的物理方法,已被广泛应用于番茄[9-10]、柑橘[11]、甜橙[12-13]、蓝莓[14]、草莓[15]和樱桃[16]等果实的采后保鲜,并证明对果实中一些生物活性物质产生了积极影响[17]。例如,采用紫外线(ultraviolet,UV)和LED 联合处理番茄果实,果实中的类胡萝卜素含量几乎增加了一倍[18-19]。果实中酚类化合物柚皮素、芦丁、咖啡酸等含量在LED 光照下也会增加[20]。Ma 等[12]发现,LED 蓝光可以诱导橙皮中叶绿素和总类胡萝卜素的积累,并改变类胡萝卜素的组成。此外,采后蓝光照射还可促进甜樱桃中花青素的积累[16]。然而,目前采用不同LED 光照处理油桃的研究较少,对LED 如何影响采后油桃果实中类胡萝卜素的代谢及其与果实色泽和可溶性糖含量之间的关联性研究还鲜见报道。因此,本研究以紫金红3 号油桃为试材,通过对其进行不同光质的LED 处理,探究不同LED 光照处理对油桃果实采后色泽、类胡萝卜素组成和含量及可溶性糖的影响,并分析类胡萝卜素与果实色泽及可溶性糖含量之间的相关性,以期建立果实色泽、营养及风味品质之间的联系,为LED 更好地应用于油桃果实采后品质的调控提供理论依据。
1 材料与方法
1.1 材料与试剂
紫金红3号油桃,2021年6月3日采摘于江苏省南京市栖霞区八卦洲红杜鹃农业生态园。样品选用盛花期后95 d 左右的果实,采摘后用20 ℃空调车于1 h 内运回实验室,选择色泽、大小一致,无机械损伤,无病害的360个油桃果实用于试验。
紫黄质标准品,美国Sigma 公司;叶黄素、玉米黄素、β-胡萝卜素标准品,上海源叶生物科技有限公司;β-隐黄质标准品,北京索莱宝科技有限公司;甲醇、乙腈(色谱纯),美国天地有限公司;甲基叔丁基醚(色谱纯),美国阿拉丁工业公司;葡萄糖、果糖、蔗糖标准品,上海源叶生物科技有限公司;提取试剂正己烷、丙酮、无水乙醇、甲基叔丁基醚、甲醇、氢氧化钾、丙酮、氯化钠均为国产分析纯。
1.2 仪器与设备
LB-300-Ⅱ型光照培养箱(带有红、蓝、白色光源灯板),上海龙跃仪器设备有限公司;LC-20A型高效液相色谱仪(配有SPD-M20A PDA 检测器及ELSD 检测器),日本岛津公司;YMC-C30色谱柱(4.6 mm×250 mm,5 µm),日本YMC公司;碳水化合物分析柱,美国Agilent公司;Multiskan FC 型酶标仪,美国赛默飞世尔科技公司;ZGDCY-24SY 水浴氮吹仪,上海梓桂仪器有限公司;3K15 冷冻离心机,德国Sigma 公司;BS-1F 型恒温振荡培养箱,常州国华电器有限公司;CR-10型便携式色差仪,日本Minolta公司。
1.3 试验方法
1.3.1 样品处理 油桃散除田间热后,随机分为4组,置于光照培养箱中,采用蓝光(400~500 nm,445 nm)、红光(600~690 nm,655 nm)和白光(400~690 nm)3 种LED光源处理,设定光照强度为40 µmol·m-2·s-1,将果实中缝线平行于灯板放置,果实上表面距离灯板20 cm,以黑暗(不进行光照处理)条件作为对照。果实在温度(20±1.5)℃、相对湿度85%条件下处理8 d。处理期间,每12 h将油桃垂直翻转180°,以确保果实的所有部分都暴露在相同水平的光照强度下。每隔2 d取样,每次随机选取15个果实,试验重复3次。取样选取光照射面靠近果皮1 cm 厚的果肉,液氮速冻后保存于-80 ℃冰箱。以采摘散除田间热后不做任何处理的果实作为第0 天的样本,并于取样当天测定果肉颜色参数,每个分析设置3个重复。
1.3.2 油桃果肉颜色的测定 采用CR-10 型便携式色差仪测定油桃果肉的L*、a*和b*值。油桃果实去掉果皮后,选择果实中缝线对称的4 个点进行测定,每组测定10 个果实。L*、a*、b*分别表示果实的亮暗、红绿程度(+a*表示偏红,-a*表示偏绿)及黄蓝色差(+b*表示颜色偏黄,-b*表示颜色偏蓝)。色彩饱和度C*、色调角h°及色泽指数(color index of red grape,CIRG)根据式(1)~(3)计算:
1.3.3 油桃果实中类胡萝卜素的提取和测定
1.3.3.1 类胡萝卜素的提取 参考Han 等[21]的方法并稍加修改。称取6 g 油桃果肉在液氮中充分研磨成粉末。精确称取0.6 g 油桃果肉粉末于10 mL 离心管中,加入3.0 mL正己烷/丙酮/无水乙醇[2∶1∶1,V/V/V,含0.1% 2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluence,BHT)]提取液,立即涡旋30 s 以充分混匀,然后于4 ℃、12 000 r·min-1条件下离心10 min,收集上层黄色有机相液体于新的10 mL 离心管中。剩余液体再次加入3.0 mL 提取液,重复提取2 次,合并3次提取液,氮吹至干。以上操作均在避光或弱光条件下进行。
1.3.3.2 类胡萝卜素含量的测定 总类胡萝卜素含量的测定采用分光光度法,将氮气吹干后的样品溶于600 µL甲醇/丙酮(1∶1,V/V,含0.1% BHT)中,于450 nm下测定溶液的吸光值。根据β-胡萝卜素标准曲线计算样品中类胡萝卜素含量。油桃果实中各组分类胡萝卜素含量的测定需进行皂化,具体参考朱运钦[5]和卢娟芳[6]的方法并稍加修改。氮吹至干的样品用2.0 mL甲基叔丁基醚(含0.1% BHT)溶解,然后加入2.0 mL 10%KOH-甲醇溶液(W/V),轻摇后于25 ℃、130 r·min-1条件在振荡培养箱中皂化30 min。皂化后加入2.0 mL 10% NaCl 水溶液(W/V)洗3 次至pH 中性,每次水洗后弃去水层,最后将溶液氮吹至干用于高效液相色谱(high performance liquid chromatography,HPLC)分析。样品分析前复溶于200 µL 甲醇/丙酮(1∶1,V/V)溶液中,过0.22 µm有机滤膜至液相小瓶进行HPLC检测。
1.3.3.3 HPLC 分析条件 采用岛津LC-20A 高效液相色谱仪,仪器配置SPD-M20A PDA 检测器,选用YMC-C30 (4.6 mm×250 mm,5 µm)色谱柱;流动相为A相:乙腈/甲醇(3∶1),B相:100% MTBE。洗脱程序参考Han 等[21]和朱运钦[5]的方法并稍加修改:0~10 min:A∶B(95∶5);10~19 min:A∶B(86:14);19~29 min:A∶B(75∶25);29~35 min:A∶B(50∶50);35~45 min:A∶B(95∶5)。柱温25 ℃,流速1.0 mL·min-1,进样量20 µL,检测波长450 nm。
1.3.3.4 各组分类胡萝卜素的定性定量分析 依据类胡萝卜素标准品以及相关文献对油桃果实中各组分类胡萝卜素进行鉴定,对于有标准品的组分采用外标法进行定量,无标品的组分定量参考文献[5,22]中报道的替换计算方法。
1.3.4 可溶性糖的提取和测定 可溶性糖含量的测定参考Zhou等[23]的方法并稍加修改。称取9 g油桃果肉在液氮中充分研磨,精确称取2.0 g研磨样品于50 mL离心管中,加入30 mL蒸馏水涡旋混匀,80 ℃水浴提取1 h,冷却至室温后于8 000 r·min-1离心20 min,取上清液1.0 mL准确稀释至2.0 mL,吸取1.0 mL过0.45 µm水系滤膜后进行测定。可溶性糖的分析采用配有蒸发光散射检测器(evaporative light scattering detector,ELSD)的岛津LC-20A 1260型高效液相色谱系统,色谱柱为碳水化合物分析柱(250 mm×4.6 mm,5 µm),流动相为乙腈/水(75∶25,V/V),柱温35 ℃,进样量20 µL,流速1.0 mL·min-1。
1.4 数据处理与分析
结果均以3 次重复试验的平均值±标准差表示。运用Excel 2019 进行数据整理,SPSS 18.0 软件进行相关性分析,SAS软件进行单因素方差分析,采用Duncan多重比较法(Duncan’s multiple range tests)进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同LED 处理对油桃果实总类胡萝卜素含量的影响
由图1 可知,在处理期间,随着贮藏时间的延长,对照组和处理组油桃果实中总类胡萝卜素含量均呈不断上升趋势。其中,除第8 天外,白光处理组总类胡萝卜素含量均显著高于其他处理组。而蓝光处理组总类胡萝卜素含量在第8 天达到最高,为28.29 µg·g-1,是对照组的1.5倍,是采收初期含量的2.3倍。所有LED处理组中果实类胡萝卜素总量均高于对照组,表明油桃采后予以适当的LED 光照,可以有效促进果实中类胡萝卜素的积累。
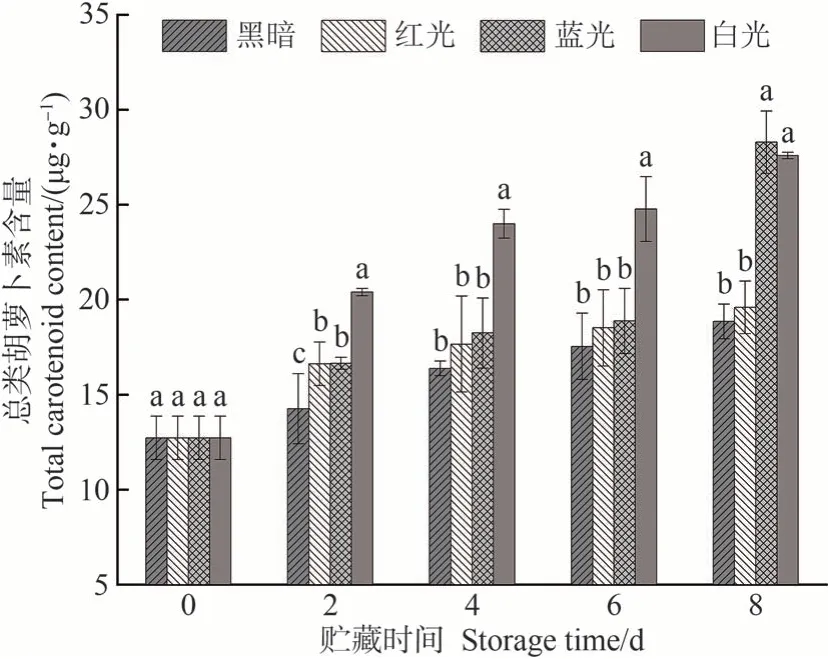
图1 不同LED处理下油桃果实总类胡萝卜素含量的变化Fig.1 Changes of total carotenoids content in nectarine fruit under different LED treatments
2.2 不同LED 处理对油桃果实中各组分类胡萝卜素含量的影响
在油桃果实中共检测到9种类胡萝卜素,如图2所示,包括紫黄质、9-顺式-紫黄质、黄体黄质、花药黄质、叶黄素、玉米黄素、β-胡萝卜素、顺式-β-胡萝卜素和β-隐黄质,以β-胡萝卜素、紫黄质、黄体黄质为主,在处理初期分别占到27.05%、24.75%和19.97%。

图2 不同LED处理对油桃果实中紫黄质(A)、9-顺式-紫黄质(B)、黄体黄质(C)、花药黄质(D)、叶黄素(E)、玉米黄素(F)、β-胡萝卜素(G)、顺式-β-胡萝卜素(H)、β-隐黄质(I)含量的影响Fig.2 Effects of different LED treatments on the content of violaxanthin (A),9-cis-violaxanthin (B),luteoxanthin (C),antheraxanthin (D),lutein (E),zeaxanthin (F),β-carotene (G),cis-β-carotene (H) and β-cryptoxanthin (I) in nectarine fruit
不同处理组中各类胡萝卜素含量存在差异。在处理期间,随着贮藏时间的延长,紫黄质含量呈现先下降后上升的趋势,处理第4 天达到最低值,处理末期蓝光处理组含量达到最高值8.53 µg·g-1,是对照组的1.9倍,表明蓝光处理在后期促进了油桃果实中紫黄质的积累。9-顺式-紫黄质是紫黄质的顺式异构体,其含量在LED 处理组中呈现波动变化,在对照组中呈现先下降后上升的趋势,处理末期,对照组和LED 处理组之间无显著差异。黄体黄质含量的变化趋势和紫黄质类似,整体亦呈现先下降后上升的趋势,除第4 天外,蓝光处理组中的黄体黄质含量均高于其他处理组,且在末期达到最高值9.27 µg·g-1。
随着贮藏时间的延长,花药黄质含量在各LED 处理组中均呈现下降趋势,均高于对照组,且白光处理组含量始终高于其他处理组,表明白光处理有利于维持果实中花药黄质的含量。叶黄素含量在油桃果实处理前期和后期变化较小,白光处理组呈现先上升后下降的趋势,在处理第4天达到最高值,且处理期间始终高于其他处理组;对照组中叶黄素含量始终较低,且呈下降趋势。处理组和对照组中玉米黄素含量变化趋势相同,均在0~2 d 上升、2~4 d 下降,在第4 天达到最低值,后期逐渐上升;蓝光处理组中玉米黄素含量始终高于其他处理组,且在第6~第8 天急剧积累,末期达到2.73 µg·g-1,是对照组的3.3倍。
β-胡萝卜素是油桃果实中主要的类胡萝卜素,在处理前期,果实中β-胡萝卜素积累缓慢,白光处理组第2 天含量较高,然后缓慢下降,第8 天达到最低值。第6~第8 天,蓝光处理组中β-胡萝卜素迅速积累,处理末期含量达到18.47 µg·g-1,占总类胡萝卜素含量的40.72%,达到贮藏初期的2.6倍。因此,白光处理在前期有利于β-胡萝卜素的积累,而蓝光处理在后期促进作用更显著。处理期间,白光和对照组中顺式-β-胡萝卜素含量整体变化较小,但白光处理组中含量始终高于对照组,蓝光组在处理2天后至第8天均显著高于对照组。β-隐黄质含量变化和β-胡萝卜素含量变化相似,蓝光处理组中,β-隐黄质在处理初期和中期缓慢上升,后期(6~8 d)急剧上升,显著促进了油桃果实中β-隐黄质的积累。整个处理期间,红光对油桃果实中类胡萝卜素各组分变化影响较小。
2.3 不同LED处理对油桃果肉颜色的影响
光照影响色素的合成,不同LED 处理对采后油桃果肉的色泽也有一定影响。由图3可知,处理期间,随着贮藏时间的延长,果肉L*值呈下降趋势。第4 天,白光组L*值显著高于对照组,表明油桃果肉亮度较高。处理前期,对照组L*值较低,而在第6~第8天高于LED处理组,表明黑暗处理在贮藏后期有助于维持油桃果肉亮度。果肉a*值整体呈上升趋势,表明果肉红度在处理期间有所增强,但各处理组间差异不显著。果肉b*值在整个贮藏过程中呈现先下降后上升的趋势,处理前期,蓝光处理组显著低于对照组,而红光和白光处理组与对照组无显著差异;处理末期,对照组b*值显著高于蓝光和红光处理组,表明在黑暗条件下果肉黄度较好。色泽指数CIRG 可以评价果实的色泽深浅和成熟度,CIRG值越大,果实颜色越深[24]。由图3-D可知,果肉CIRG 值逐渐增大,说明随着贮藏时间的延长,油桃果肉颜色逐渐加深。其中,蓝光处理组CIRG值显著高于对照和其他处理组,表明蓝光处理下果肉着色较好,且第4~第8天LED处理组CIRG值均显著高于对照组,因此果实采后给予适当LED光照,有利于其着色。
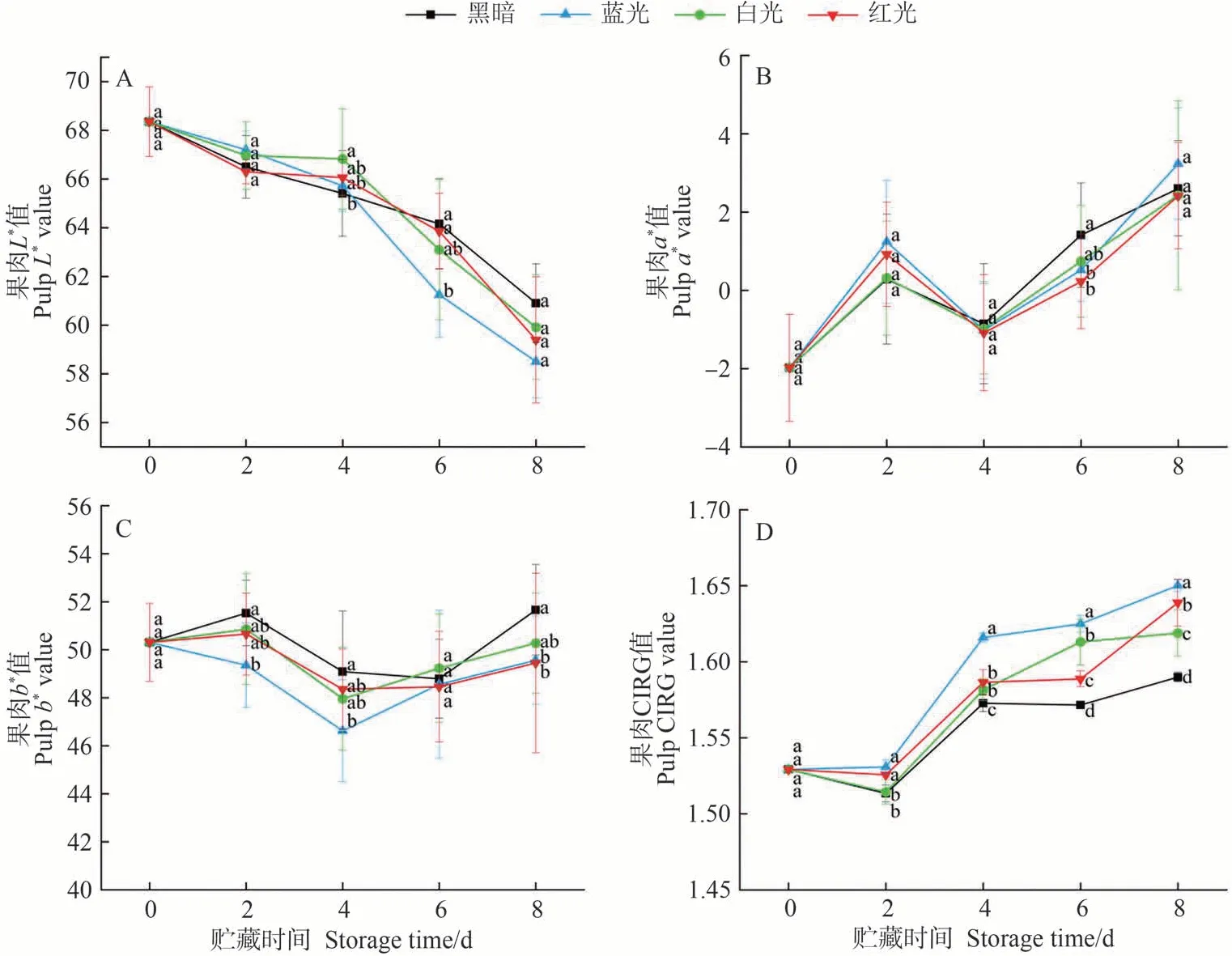
图3 不同LED处理下油桃果肉L*(A)、a*(B)、b*(C)和CIRG(D)的变化Fig.3 Changes of L*(A),a*(B),b*(C)and CIRG(D) in nectarine flesh under different LED treatments
2.4 油桃果实颜色特征值与类胡萝卜素含量的相关性分析
利用皮尔逊相关系数对油桃果肉色泽特征值与类胡萝卜素含量进行相关性分析,结果如表1 所示。L*值与花药黄质含量呈极显著正相关,与玉米黄素含量呈显著负相关,与β-隐黄质和总类胡萝卜素含量呈极显著负相关,即玉米黄素、β-隐黄质和总类胡萝卜素含量越高,果肉亮度越低。a*值与花药黄质含量呈极显著负相关,与9-顺式-紫黄质含量呈显著负相关,而与玉米黄素、β-隐黄质及总类胡萝卜素含量呈极显著正相关,这和L*值与三者的关系正好相反,表明玉米黄素、β-隐黄质和总类胡萝卜素含量越高,果肉红度越高。b*值与紫黄质含量呈极显著正相关,与黄体黄质含量呈显著正相关,即果实中紫黄质和黄体黄质含量越高,果肉黄度越高。油桃果实CIRG 值与花药黄质含量呈显著负相关,与β-隐黄质含量呈显著正相关,而与总类胡萝卜素含量呈现极显著正相关,即果实中总类胡萝卜素含量越高,果实颜色越深。

表1 油桃果实果肉色泽特征值与类胡萝卜素含量相关性分析Table 1 Correlation analysis between flesh color characteristic values and carotenoids content of nectarine fruit
2.5 不同LED 处理对油桃果实中可溶性糖含量的影响
蔗糖、果糖和葡萄糖是油桃果实中主要的3种可溶性糖,其中,蔗糖含量最高。新鲜采摘的油桃蔗糖含量占总可溶性糖的80.59%。果实在采摘后,呼吸作用仍在进行,通过呼吸及其他一系列生理生化活动,蔗糖分解成葡萄糖和果糖。由图4可知,对照组中果糖和葡萄糖含量均在采后初期上升,中期下降,后期再次上升,在处理第8天分别达到10.42和13.74 mg·g-1。LED处理组中果糖和葡萄糖含量均随贮藏时间的延长而上升,在第8天达到最高值。蓝光处理组的果糖和葡萄糖含量始终高于对照组,处理第8天达到最高值12.19 和13.98 mg·g-1,表明蓝光处理促进了果实中果糖和葡萄糖的积累。这一现象在杨梅[25]果实中也有发现。白光处理组中果糖含量在贮藏后期显著高于对照组,表明白光处理在后期促进了油桃果实中果糖的积累。然而,红光处理对果实中果糖和葡萄糖的积累影响较小。不同处理组中蔗糖含量呈现先下降后上升的趋势。在处理后期,LED 处理组中蔗糖含量显著低于对照,表明LED处理促进了油桃果实中蔗糖的分解代谢,一定程度上促进了果实采后生理代谢活动的进行。
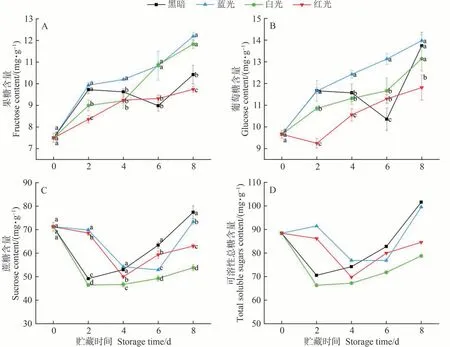
图4 不同LED处理对油桃果实果糖(A)、葡萄糖(B)、蔗糖(C)和可溶性总糖(D)含量的影响Fig.4 Effects of different LED treatments on the content of fructose (A),glucose (B),sucrose (C) and soluble total sugar (D) in nectarine fruit
依据果实中3 种可溶性糖的含量对可溶性总糖进行了分析,结果如图4-D 所示。采后处理期间可溶性总糖含量的变化与蔗糖一致,呈现先下降后上升的趋势。对照组和白光处理组在第2 天降到最低值,而红光和蓝光处理组分别在第4和第6天降至最低,蓝光和红光处理可溶性总糖含量在前期高于对照,而白光处理组却始终低于对照,表明蓝光和红光处理在前期促进了油桃果实中可溶性总糖的积累,而白光在整个处理期间促进了可溶性总糖的代谢。
2.6 油桃果实中类胡萝卜素与可溶性糖含量的相关性分析
由表2 可知,果实中类胡萝卜素与可溶性糖含量存在一定相关性,不同的LED 处理对两者相关性产生不同影响。对照组和处理组中均显示出,花药黄质与果糖和葡萄糖含量呈显著负相关,推测果糖和葡萄糖通过糖酵解途径和MEP 途径生成类胡萝卜素代谢前体,进而促进果实中花药黄质的积累。β-隐黄质与果糖和葡萄糖含量均呈现显著正相关,即β-隐黄质的含量会随着果糖和葡萄糖含量的升高而增加。同时,果实中总类胡萝卜素含量与果糖和葡萄糖含量存在较强的正相关性。
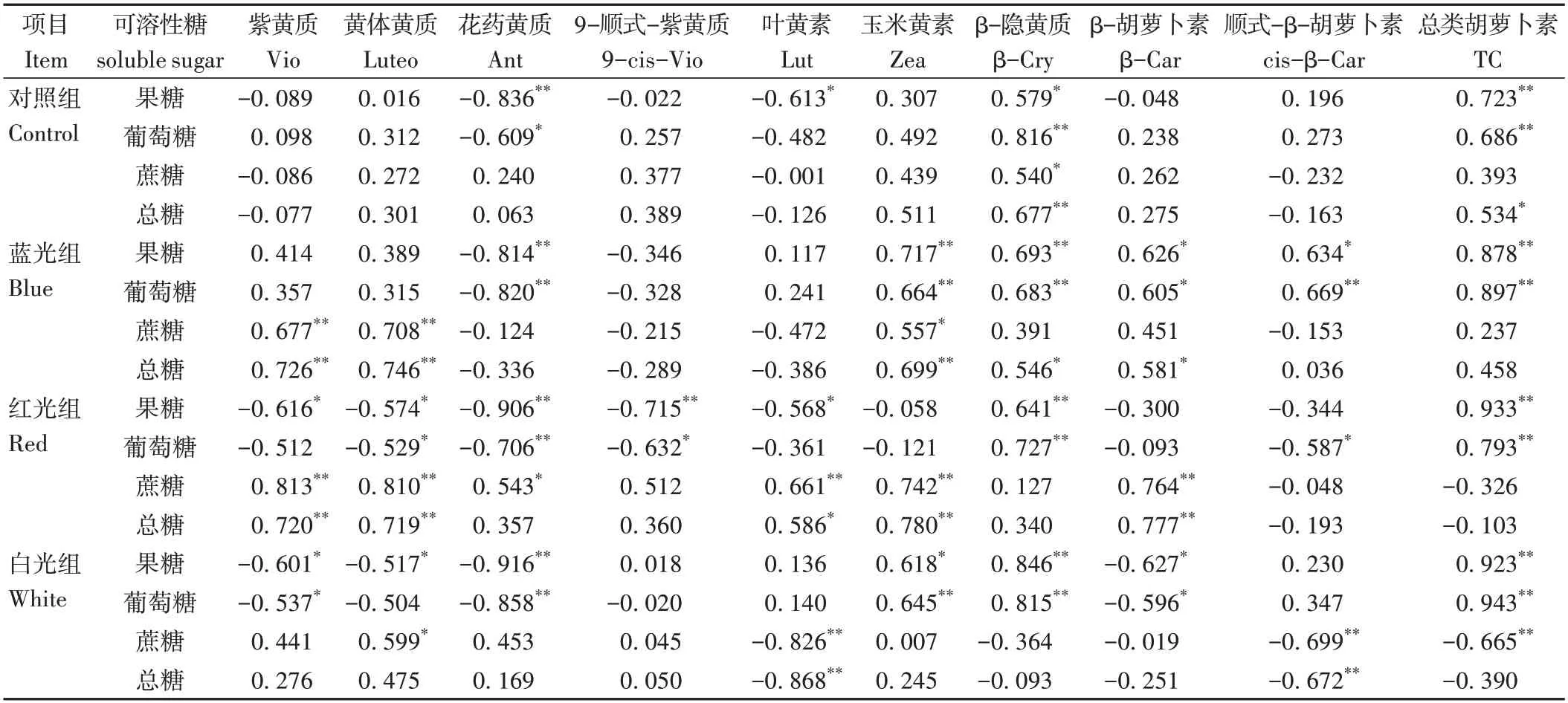
表2 类胡萝卜素与可溶性糖含量相关性分析Table 2 Correlation analysis between carotenoids and soluble sugars content
3 讨论
研究表明,果实的货架期与其生物活性物质的含量有关,而这些生物活性物质多具有抗氧化活性,因此提高水果中的天然抗氧化剂水平可能是保持水果品质的一项有价值的策略[16]。类胡萝卜素作为一种天然抗氧化剂,在黄肉油桃中分布广泛。本研究采用蓝光、红光和白光3种LED 光源对采后贮藏期间的油桃进行处理,发现LED 处理在一定程度上促进了果实中类胡萝卜素的积累,白光和蓝光促进作用最显著。研究发现,类胡萝卜素对蓝紫光有较强的吸收,而白光波长范围较宽(包含可见光波长),这可能是果实中类胡萝卜素在蓝光和白光处理下积累的重要原因。这与Hu等[13]的研究结果不同,即:仅红光和暗光处理显著诱导了哈姆林甜橙中类胡萝卜素的积累,而其他光照处理不利于果实中类胡萝卜素的积累。Cano-Molina 等[18]发现,与UV-LED 联合处理相比,LED 单独使用就足以引起成熟绿番茄中类胡萝卜素含量的显著增加,这被认为是一种优势,因为LED 相比于UV 更加节能、安全和环保。因此,适当的LED 光照是保持和改善果实采后品质的有效途径,油桃果实贮藏期间施以适当的白光和蓝光照射,可以提高果实中类胡萝卜素的含量。
果实成熟过程中色素的变化是叶绿素降解和类胡萝卜素积累的结果,类胡萝卜素含量和组成是决定大多数成熟水果特征颜色的主要因素[8,20,26]。本研究发现,油桃果肉的色泽与其类胡萝卜素组成和含量具有一定相关性。其中,L*值与玉米黄素含量呈显著负相关,与β-隐黄质和总类胡萝卜素含量呈极显著负相关。与L*值相反,a*值与玉米黄素、β-隐黄质和总类胡萝卜素含量均呈极显著正相关。这与米佳等[27]在枸杞中的研究结果一致。类胡萝卜素的吸收光谱主要取决于其分子中共轭双键的数量,发色团越长,最大吸收波长越大,对于黄色类胡萝卜素,其a*值会随着类胡萝卜素分子中共轭双键数量的减少而降低,因此不同种类的类胡萝卜素会在不同的LED 光下呈现不同的颜色[28]。甜橙颜色的差异不仅与果皮中类胡萝卜素的含量直接相关,而且与每种类胡萝卜素的比例也有很大关系,而与甜橙相比,柑桔果实色泽较深主要是因为红色β-柠乌素和橙色β-隐黄素含量丰富,这也是引起果实不同品种间色泽差异的重要原因[26]。
油桃果实的甜味源于蔗糖、葡萄糖和果糖的积累,蔗糖在果实成熟时占主导地位,其次是葡萄糖和果糖[29]。蓝光处理在后期显著促进了果糖和葡萄糖的积累,而对于蔗糖,蓝光和红光在处理前期促进了其积累,后期则显著促进了其代谢。整个处理期间,白光组中蔗糖和可溶性总糖含量较低,可能是由于白光的波长可涵盖其他多种单色光,其对果实中多种生理生化活动如呼吸、蒸腾作用等,有广泛影响,进而导致可溶性糖的代谢大于积累,致使果实中可溶性糖含量下降。糖组分的积累是果实品质形成的关键,可溶性糖可为类胡萝卜素提供合成前体物质IPP[13,30]。通过分析两种物质的相关性发现,不同LED 处理下,多数类胡萝卜素与可溶性糖含量之间呈现较强的相关性,其中,总类胡萝卜素与果糖、葡萄糖含量呈极显著正相关,因此后续可进一步探究通过调控果实中的可溶性糖来提高类胡萝卜素含量。
4 结论
本研究结果表明,蓝光处理对果实中类胡萝卜素和可溶性糖的积累具有显著促进作用,处理末期蓝光处理组中总类胡萝卜素含量达到采收初期含量的2.3倍,果糖和葡萄糖含量达到最高值;果肉b*值与紫黄质和黄体黄质含量分别呈极显著和显著正相关;多数类胡萝卜素组分与可溶性糖含量之间均呈现出较强的相关性,所有光照处理组中果糖和葡萄糖与总类胡萝卜素含量呈极显著正相关。因此,油桃采后予以适当的蓝光处理,可维持较高的类胡萝卜素和果糖、葡萄糖含量;可溶性糖与类胡萝卜素含量呈现一定关联性,后期可进一步探究其对果实中类胡萝卜素的调控作用。
