水稻低磷胁迫响应及其调控机制的研究进展
2023-07-11孙志伟徐月梅许荣越朱宽宇杨建昌
孙志伟 徐月梅 许荣越 朱宽宇 杨建昌
(扬州大学农学院/江苏省作物遗传生理重点实验室/江苏省作物栽培生理重点实验室/江苏省粮食作物现代产业技术协同创新中心,江苏 扬州 225009)
磷(phosphorus,P)是植物生育过程中必需的三大营养元素之一,具有重要的生理生化作用[1]。世界上缺磷耕地面积约为43%,我国有近2/3 耕地土壤缺磷[2]。研究表明,土壤中富集的无效态磷经径流、渗透等途径进入生态循环,降低了土壤中磷含量。同时,土壤约有70%~90%的无机磷会以有机或无机形式与金属阳离子螯合形成不可溶的络合物,并吸附在土壤颗粒的表面,降低田间磷肥当季利用率[3-4]。因此,缺磷已经成为限制作物产量提高的重要因素之一。提高作物对土壤中有效磷的吸收利用成为了当前农业生产中亟待解决的问题,对保障粮食安全与绿色农业、可持续发展具有重要意义。
水稻(OryzasativaL.)是世界上最重要的粮食作物之一,其中化肥对水稻增产具有举足轻重的作用。然而,化肥施用量的持续增长对水稻高产的贡献率日趋降低,化肥当季利用率低与粮食高速增产之间矛盾日益突出[5]。磷是水稻体内重要有机化合物的组成部分,在营养物质代谢、能量合成与传递、信号接收与传导等方面发挥不可替代的作用[6]。选育磷高效或耐低磷水稻品种并通过合理的水肥管理来活化土壤磷库和提高磷肥利用率,是减少磷肥投入、协同水稻产量提高的一条重要途径。深入认识水稻耐低磷性的农艺和生理与分子机制,对于筛选和培育耐低磷水稻品种具有重要的指导意义。鉴于此,本文从根系和地上部形态生理变化以及分子信号传导等方面概述了水稻对低磷胁迫的响应机制,讨论了提高水稻耐低磷性的栽培调控措施,并对今后的研究重点提出了建议。
1 水稻耐低磷的形态生理机制
1.1 植株形态性状
水稻植株形态变化是植物响应低磷胁迫的适应性策略之一。根系作为植物养分吸收的重要器官,其在土壤中的分布与养分吸收紧密相关[7]。磷在土壤中分布不均且不易移动,主要集中在土壤表层并通过扩散的方式迁移到根系表层。此外,磷在土壤中扩散系数低,植物只能吸收距离根系表面1~4 mm范围内的有效磷。在低磷胁迫下,水稻根系会通过增加与土壤颗粒的接触面积帮助植物获取更多的磷养分,而侧根和根毛的形态变化与根系磷吸收面积具有密切联系[6]。侧根形成于原生木质部的中柱鞘建成细胞,低磷胁迫可诱导苗期水稻的侧根发育,抑制主根伸长,具体表现为侧根长度与数量的增加,这一形态的变化与水稻磷吸收量呈极显著正相关[8]。再者,低磷胁迫下水稻单位侧根长度的伸长与单位根活跃吸收表面积的增加呈显著正相关,但侧根数量增加与单位根表面积增加并无显著相关性[9]。根毛是根系特异表皮细胞向外延伸形成的管状突出物,易与根际土壤环境产生较大的养分浓度梯度促进植株对低浓度养分的吸收。有研究指出,低磷会促进日本晴(模式水稻)根毛长度和密度的增加[10]。但低磷环境下水稻根毛长度变化比密度在磷吸收方面更为重要,主要在于根毛密度的增长超过临界密度后并不会为根部磷吸收带来更多收益[11]。因此,根毛长且密是水稻耐低磷的一个重要根系特性。
地上部的形态变化是直观反映低磷胁迫对植株生长发育的指标之一。低磷环境下水稻植株矮小、分蘖数、幼穗长度和地上部干物重会显著下降,叶片中核酮糖二磷酸羧化酶、茎中蔗糖磷酸合酶(sucrose phosphosynthase,SPS)和籽粒中蔗糖合酶(sucrose synthase,SUS)活性受到抑制,导致植株绿叶数和叶面积指数下降,不利于水稻生育期光合同化物的积累和籽粒灌浆[12-13]。此外,与弱耐低磷品种相比,强耐低磷品种具有较高的叶面积指数和茎蘖成穗率,较高的花后茎鞘非结构性碳水化合物(non-structual carbohydrate,NSC)转运率、叶片光合速率和籽粒灌浆速率,这些性状的改善减轻了低磷胁迫对水稻产量的不利影响[14-15]。
1.2 植株生理性状
1.2.1 有机酸 根系分泌物是实现植物地上部与土壤互作的重要媒介,其中有机酸的分泌既可以改善根际土壤性质,也可以调控根际微生物的群落组成,是一种普遍且有效的土壤磷活化途径[16-17]。低磷胁迫下水稻根系细胞膜通透性下降或代谢产物的积累引发根系有机酸大量分泌。研究表明,低磷胁迫下水稻根系有机酸含量增加主要来源于苹果酸、乙酸、柠檬酸、琥珀酸含量的上升[18]。Bhattacharyya 等[19]认为,低磷胁迫下水稻根系分泌最主要的有机酸为苹果酸,其次是酒石酸、柠檬酸和乙酸,并发现分蘖期(21 d)根系有机酸渗出速率最快,生育后期有机酸的总渗出量最多。但有研究者观察到,一些旱稻品种根系分泌物中柠檬酸渗出速率最快,并认为柠檬酸相较于其他有机酸可以有效调动土壤结合态磷,且碳投入较低[20]。此外,磷高效基因型水稻根系分泌有机酸总量显著高于磷敏感基因型[21]。总体而言,低磷环境中水稻根系分泌物中的有机酸会大量增加,有机酸类型和含量对磷胁迫的响应因品种和土壤环境而异,其主要作用是加速土壤中难溶性磷酸盐化合物溶解,改变磷在土壤中的迁移和转化,进而改善根系对磷的吸收。目前大多数研究多集中于低磷条件下作物根系有机酸分泌种类和含量的研究,而有机酸是如何影响土壤有机磷活化的深层机理仍不清楚。
1.2.2 丛枝菌根 丛枝菌根共生体系是丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)定殖在植物根系皮层细胞内形成的一种在自然界中广泛存在的陆生共生体,也是植物根系与AMF 长期协同进化的结果[22]。在该共生关系中,宿主植物通过光合作用反馈给AMF己糖等作为碳源,AMF 将菌丝延伸到宿主植物的“无根区”,通过水解无机磷和矿化有机磷两条途径改善土壤磷有效性,诱导磷转运蛋白基因表达,形成比宿主植物根更大的吸收网络来吸收磷等营养元素[23]。相比于水稻根系,AMF 对土壤中磷具有更高的亲和力,土壤中的磷会主动运输至AMF 中,以多聚磷形式大量储存在AMF 中。此时,菌丝与根系产生磷浓度梯度,磷被动运输到根际临界面,根系消耗能量将磷转运至体内[23]。前人研究指出,水稻根系与AMF共生形成的菌根网络可以促进侧根形成,减少稻田磷的径流损失,提高水稻抵抗生物及非生物胁迫能力[24]。针对传统稻田水稻根系由于缺氧环境不易感染AMF 的情况,Zhang 等[25]通过对比菌根和非菌根水稻田间磷损失量发现,菌根水稻的种植能有效减少稻田中溶解态和颗粒态磷的损失,提升对土壤中磷的吸收。此外,适当控制土壤含水量有助于水稻与AMF 共生菌根网络的构建,增强旱稻作物对土壤中难溶性磷的吸收[26]。总体上,接种AMF 可促进土壤磷的释放,也实现了磷从土壤菌丝再到根系的快速传递,是水稻适应低磷胁迫的有效措施之一。目前,对AMF 的研究多集中于对无机磷的吸收利用,深入阐明AMF 对土壤中有机磷组分的影响以及磷迁移转化的机制仍是科研工作者面临的挑战之一。
1.2.3 内源激素 内源激素是植株内部合成的微量有机物,在植物生长发育和代谢方面发挥着信号传导和调节的重要作用。其中生长素在植物抵御低磷胁迫过程中的作用尤为独特。生长素是响应水稻根系中低磷胁迫信号最重要的植物激素之一,其含量和极性运输与根系生长发育密切相关[27]。首先,低磷胁迫促进了水稻体内生长素合成与生长素从地上部到根系的极性运输,通过改变根系形态加强对土壤中有效磷的吸收以及无机磷的转运。以往研究表明,低磷胁迫下生长素在根系的运输增强,较高浓度的生长素促进了主根伸长、侧根长度和密度增加以及根毛形成等形态变化以适应低磷环境[28-29]。但冯凡等[10]观察到,不同磷处理下施加外源生长素和生长素极性运输抑制剂后,水稻根毛的长势并没有发生显著变化,可见低磷胁迫下水稻根毛的发生是由多种信号通路共同调节的。同时,生长素参与水稻磷信号传导进而影响植株中磷动态平衡,其中生长素受体1(TRANSPORTINHIBITORRESPONSE1,TIR1)和ARFs转录因子(AUXINRESPONSEFACTOR)在调节信号传递方面发挥着重要作用[30]。Ding 等[28]在对水稻根部进行转录组学检测后发现,低磷胁迫下生长素信号通路发生变化,具体表现为根部生长素合成限速酶诱导被抑制,生长素受体TIR1表达上调,转录过程被激活,根系中生长素响应基因的表达增强。此外,低磷胁迫促进了水稻根部无活性生长素(与氨基酸结合的生长素)向活性生长素的转化,对非活性生长素向游离生长素的转化加以抑制,从而通过改变根部的生长素含量来提高根系对低磷环境的适应[31]。
独脚金内酯或其衍生物(strigolactones,SLs)作为近些年研究的新型激素,在调节根系发育方面发挥关键作用,其合成和分泌受低磷胁迫的诱导[32]。大量研究表明,低磷环境下SLs 合成相关基因表达上升,根系和根系分泌物中SLs 水平含量的上升会诱导水稻根系伸长,根毛发生,降低侧根密度,抑制水稻分蘖发生。同时,SLs 含量的提升会促进真菌在根系的定殖,有利于植株对根际环境中有效磷的吸收。大量研究发现,低磷胁迫下SLs 可以通过影响生长素从地上部向根系的转运,调节局部生长素含量和极性运输来影响水稻根系生长[32-34]。所以,独脚金内酯可能通过与生长素互作调控水稻形态变化是适应低磷环境的策略之一。目前,对SLs 的具体生物学机制尚不清楚,进一步研究SLs 与其他激素之间的相互关系,对于阐明低磷条件下SLs 对水稻根系生长的影响机制具有重要作用。
低磷胁迫下水稻形态生理变化见表1。
2 水稻无机磷吸收机制
水稻主要通过根系从土壤中吸收无机磷,但土壤中多数磷是以有机磷的形式进行储存,需要被水解为无机磷才能被植物吸收利用。酸性磷酸酶可以将土壤中复杂的有机磷化合物水解成无机磷来缓解植物低磷情况。在低磷环境下,水稻根系紫色酸性磷酸酶10c基因(OsPAP10c)表达增强,根际酸性磷酸酶活性升高,使得植株体内磷脂化物分解速率增强,促进根系无机磷的吸收和磷素从衰老组织向幼嫩组织转运[35]。在水稻体外,低磷环境根系会直接通过酸性磷酸酶的释放和间接增加根系的酸性磷酸酯酶分泌促进根际微生物活性和对外界有机磷的水解作用,从而提升土壤无机磷含量和根系微生物中磷的有效性[36]。不仅如此,水稻根系还可以通过糖酵解的支路途径避开需要磷或腺苷酸的步骤,诱导合成底物特异性酶,如酸性磷酸酶、核糖核酸酶(ribonuclease,RNase)和无机焦磷酸酶等来加快根系磷吸收和内部磷的运转,同时脂质代谢体系的调整、细胞壁化合物的重组和叶片内淀粉累积也是维持细胞内磷水平的重要方式[37]。
植物磷信号调控网络中多种转录因子和非编码RNA 通过正向或负向调控下游的磷酸盐转运蛋白表达来调节磷的吸收与转运以维持植株内部磷素的平衡[35]。例如转录因子OsMYB4P可以正向调控PHT1(PHOSPHATE TRANSPORTER 1)家族,使根和茎中磷含量维持在较高水平[38]。缺磷条件下miR827 被诱导,能够负调控水稻细胞液泡中磷酸盐转运蛋白。由此可见,植物通过大量转录因子,磷酸盐转运蛋白以及非编码RNA 之间协同配合来完成对磷素的吸收与运输。在水稻体内,PHT1家族磷转运蛋白主要负责将土壤溶液中的无机磷转运至根系表皮和皮层细胞中,经质外体和共质体两种运输途径到根中维管束,在磷转运蛋白的介导下装载到木质部的质外体空间,通过根压和叶片的蒸腾作用长距离运输至地上部,最后经过不同磷酸盐转运蛋白的分配、转移和再分配等复杂过程到达所需部位进行吸收利用,而多余的无机磷将会被存储在液泡内以维持细胞内无机磷的平衡[35]。
目前在水稻中已鉴定出13个PHT1家族磷转运蛋白,命名为OsPHT1;1~OsPHT1;13,除了OsPHT1;2 属于低亲和力磷转运蛋白之外[米式常数(Km值)在毫摩尔浓度范围内],其余成员都是高亲和力磷转运蛋白(Km值在微摩尔浓度范围内)。其中,除了OsPHT1;11和OsPHT1;13 在水稻与菌根共生体系中被强烈诱导外,其余磷酸盐转运蛋白,例如OsPHT1;1、OsPHT1;4、OsPHT1;6、OsPHT1;8、OsPHT1;9 和OsPHT1;10 等均在磷吸收和转运方面发挥重要作用[35]。其中OsPHT1;1、OsPHT1;8的表达不受外界磷水平调控,在根部和地上部都呈现组成型表达。OsPHT1;1不响应磷胁迫信号,但OsPHT1;1表达变化会通过促进根毛发育等根系形态变化加速根细胞膜对磷的吸收进而改变植株体内磷的浓度和分布;而OsPHT1;8的过表达则可以促进根系磷的吸收以及向地上部运输[39-40]。此外,有学者敲除OsPHT1;4基因后观察到水稻植株主根数目和分蘖数显著减少,各器官磷积累量也显著下降[41]。以上结果表明,PHT1家族的部分成员可以影响植株形态的改变来促进根系磷的吸收。
水稻对磷的吸收主要由根系完成。但一些研究观察到,水稻与真菌形成的共生体系供给植株需磷量的70%以上,特别是OsPHT1;11和OsPHT1;13参与AMF与水稻的共生过程。正常情况下水稻根系中OsPHT1;11和OsPHT1;13并不表达,但当水稻被AMF 定殖后形成菌根时,OsPHT1;11 和OsPHT1;13 被特异性诱导增强磷的吸收。同时OsPHT1;11 是唯一参与水稻共生系统中磷吸收的转运蛋白。丛枝菌根真菌菌丝将土壤中有效磷吸收并释放到具有树状结构的从枝周围,使其可被宿主根系细胞吸收利用。而OsPHT1;13 则作为环境传感器监测菌根周围环境磷水平来调控水稻与菌根共生过程[42],只有在两者的协同作用下才能维系水稻与菌根复杂的共生关系。
3 水稻体内无机磷利用机制
水稻从土壤中吸收大量无机磷后,位于根系维管束中的PHOSPHATE1(PHO1)负责将无机磷装载到木质部,然后由木质部运输至地上部,最后通过节间组织转移分配至各器官中以满足水稻生长发育对磷素的需求[43]。
在植株体内磷素的长距离运输中,水稻PHT1 家族中OsPHT1;1,OsPHT1;2,OsPHT1;3,OsPHT1;6,OsPHT1;8在磷从根部向地上部的运输过程中发挥重要作用。研究人员利用核糖核酸干扰(RNA interference)技术影响OsPHT1;2和OsPHT1;6表达后发现,磷从根向茎的转运效率会显著下降[44]。同时,植株中OsPHT1;8过度表达时,根部和茎中磷积累量和磷转运能力都会显著升高[40]。说明PHT1 家族不仅参与植株无机磷的吸收,也介导了植株中无机磷的长距离转运。有学者发现,水稻中PHO 家族有3 个与拟南芥AtPHO1同源的基因OsPHO1;1、OsPHO1;2和OsPHO1;3,它们对磷素的转运同样至关重要,其中OsPHO1;2主要作用在无机磷加载到地上部转运过程[44-45]。水稻OsPHO1;2突变体中无机磷从根系向地上部运输受到阻碍,会导致磷在根部积累而地上部磷减少。而OsPHO1;1和OsPHO1;3在水稻根部的表达较弱,其功能还有待开发,例如,这些基因是否对根部以外的组织中的磷稳态中起调控作用仍有待研究[46]。
当磷素通过植株木质部长距离运输至节间组织后,在水稻节间中表达丰富的硫酸盐转运蛋白样磷分配转运蛋白基因(SULTR-likephosphorusdistribution transporter,SPDT)成为控制磷素向叶片和籽粒进一步分配的开关[47]。SPDT主要作用是把无机磷从大维管束的木质部转运到分散维管束的木质部,最后运输至新叶和生殖器官中。当敲除SPDT基因时,本该通过磷酸盐转运蛋白分配到新叶和籽粒的磷素大量滞留在木质部,导致老叶中磷含量显著上升,改变了磷素在叶片和籽粒间的分配规律[47]。在PHT1 家族中部分成员参与地上部磷的再分配。例如,在磷含量极低时会诱导叶片OsPHT1;3表达,加速磷素从茎向叶片的分配。当该基因突变时会导致节间组织磷积累而叶片磷含量下降[48]。类似的,抑制OsPHT1;8的表达会导致穗轴磷含量的上升和未灌浆颖壳磷含量的降低,影响磷从穗轴向籽粒的转运和籽粒灌浆过程。同时,OsPHT1;8还参与磷在老叶到幼叶以及种子胚和胚乳之间的再分配[40]。在水稻衰老叶片中,核糖核酸酶编码基因OsRNS3、OsRNS4、OsRNS5、OsRNS7和OsRNS8表达增强,促进了RNA 重塑和磷循环[49]。在核糖核酸酶、磷脂酶的协同作用下,加速了胞内核酸和磷脂等有机磷化合物中磷的活化以及胞外磷脂向细胞质的回流,上述过程在PHO1s的协助下通过共质体和质外体途径装载到衰老叶片的韧皮部,再通过磷酸盐转运蛋白卸载到库或源组织中继续发挥作用[43]。此外,通过对比OsPHO1;1、OsPHO1;2突变体和野生型材料籽粒中含磷量变化,观察到OsPHO1;1和OsPHO1;2在节间组织向籽粒中磷运输以及种皮向胚磷转移中具有重要调控作用[46]。
在亚细胞层面,定位在细胞质膜上的PHT1s 将磷转运至细胞质内,水稻液泡膜上含SPX 结构域的OsSPX-MFSs 进一步将胞质磷转运至液泡中储存,当植物遭遇低磷胁迫时,同样定位于液泡膜OsVPE1 和OsVPE2转运蛋白负责把液泡中磷向胞质输出以维持细胞内外磷浓度平衡[49]。同时,PHT1s在伴侣蛋白PHF1(PHOSPHATE TRANSPORTER TRAFFIC FACILITATOR1)协同作用下,可以根据植株各组织的需磷量实时调整磷酸盐转运蛋白在细胞中的位置,合理分配磷素。例如,磷充足情况下,OsPHT1;8 无法与PHF1 相结合,导致OsPHT1;8 停留在内质网中,极大减缓了水稻对无机磷的吸收;当植株处于低磷环境时,磷酸盐转运蛋白在PHF1 协同下从内质网运往质膜速率加快,保障了植株充足的磷供应。此外,定位在叶绿体的内膜上的PHT2 家族和定位在线粒体内膜上PHT3 家族对细胞中磷的运输具有重要意义,其中低磷环境下OsPHT2;1表达增强,促进了叶片中磷的积累[50]。水稻PHT3 家族中的6 个同源基因OsPHT3;1~OsPHT3;6主要负责线粒体基质和胞浆之间的磷酸盐交换,作用机制尚不清晰[51]。PHT4 家族中部分成员定位在高尔基体膜上,目前有关水稻中OsPHT4s 的报道较少,但发现鉴定的PHT4 家族成员可能与种子中磷转运和抗病性有关[52]。
多磷酸肌醇(inositol polyphosphate,InsPs)是一种广泛存在于动植物体内的重要信号分子,参与多种细胞过程,如能量传递、激素信号传导以及对生物和非生物胁迫的响应,且InsPs 含量与细胞内Pi 浓度呈正相关[53]。在磷信号传导途径中,磷饥饿诱导蛋白SPX1无法直接感知无机磷信号,而是直接与InsPs 结合,通过调控SPX1 与PHR1(phospate starvation response 1)的相互作用来维持细胞内Pi 的稳定。磷充足情况下,充足的InsPs含量可以促进SPX1与PHR1的相互作用,阻断了PHR1 与目标启动子序列P1BS(PHR1 binding sequence)的结合,抑制PHR1 的转录活性。在低磷条件下,由于InsPs含量较低,SPX1无法与PHR1结合,从而使PHR1 在转录水平上激活磷获取效率(Pi acquisition efficiency)和磷利用效率(Pi use efficiency)相关基因表达[54-55]。水稻籽粒作为粮食稳产增收的关键,植株吸收的磷经过磷转运蛋白的分配与运输,最终会将60%~85%分配给作物籽粒中,并以植酸(六磷酸肌醇,InsP6)的形式进行储藏[43]。低磷胁迫下植株吸磷量降低,籽粒灌浆速率减弱,植酸含量显著下降。还有研究表明,InsP8是植物细胞内磷浓度的重要信号分子。磷充足会促进VIH1(diphosphoinositol pentakisphosphate kinase)和VIH2 催化InsP8 的合成,进而抑制了PSI(Pi starvation-induced)基因的激活和Pi 的过度积累。在低磷条件下,InsP8 含量的降低削弱了SPX1 和PHR1之间的相互作用,进而激活了PSI基因的表达,促进植株磷的吸收与积累[54-55]。水稻植株磷素吸收利用与再活化机制如图1所示。
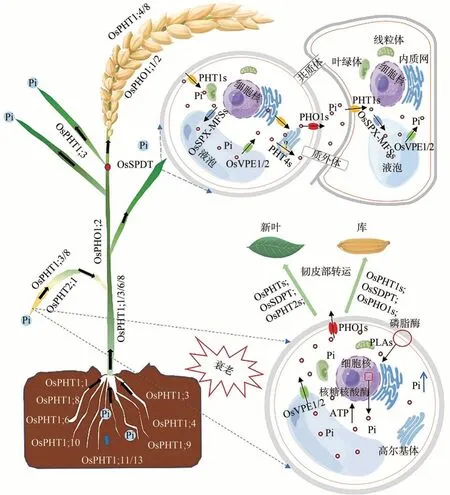
图1 水稻植株磷素吸收利用与再活化机制综合模式图Fig.1 A comprehensive model diagram of the mechanism of phosphorus uptake and utilization and reactivation in rice plant.
4 水肥管理对水稻根系磷吸收与转运的调节
4.1 水分管理
不同水分管理方式通过改变土壤的湿润区域、土壤氧化还原电位和土壤含氧量等进而调控根系水肥吸收能力,提高作物水肥耦合效率[56]。目前研究较多的是干湿交替灌溉对水稻磷吸收利用的调控作用。水稻干湿交替灌溉是指在水稻生育期进行淹水-落干-复水-落干,如此反复的一种节水灌溉措施[57]。与传统保持水层灌溉相比,干湿交替灌溉有利于水稻根系生长、籽粒灌浆和同化物向籽粒的运转,对农业稳产增收具有重要意义。“开源”与“节流”两种途径相互配合提高了水稻磷吸收效率。在“开源”方面,干湿交替灌溉通过增强水稻根系溶解氧含量和酸性磷酸酶活性来实现土壤难溶有机磷向无机磷的转化,进而促进水稻根系磷吸收和各器官磷的累积。具体表现为:干湿交替灌溉下水稻磷素运转和代谢效率高,茎中非结构性碳水化合物向籽粒的转运增加,营养器官中磷素向库运输效率高。同时,干湿交替灌溉也增强了籽粒中的蔗糖合酶活性,催化蔗糖向淀粉转化,缓解了低磷胁迫对籽粒灌浆的影响[58-59]。在“节流”上,干湿交替灌溉措施可以提高植株的磷利用效率,降低稻田磷素径流、渗漏和淋溶的损失。目前有学者提出干湿交替灌溉在实行严格水分控制的同时,可能会导致根系缺水进而减弱了水稻对磷素的吸收,阻碍植株生长[56]。但李汉常等[58]指出,干湿交替灌溉可以显著提高水稻对磷的利用效率,进而抵消水分控制导致磷吸收效率下降带来的不利影响,在实际生产中可以提高产量和磷利用率。
4.2 肥料运筹
磷的高效吸收不仅取决于作物本身遗传因素,不同养分间的协同和拮抗关系也是影响磷吸收和利用的主要原因。农田有效磷含量的提升在依靠磷肥施用的同时也可以通过混合施用其他肥料来促进水稻磷的吸收。首先,田间肥料施用量与损失量呈显著正相关,减少化肥施用量与完善施肥结构能够显著提高肥料利用率和农学效率。因此,在保证水稻稳产的同时,要适量减施化肥,提高肥料利用率[60]。有学者曾指出,当施氮量分别为225 kg·km-2,施磷量与施钾量均为30 kg·km-2时,肥料利用率与农学效率最高,产量与施磷钾量为60 kg·km-2时的产量无显著差异。这表明适当减施化肥对产量无显著影响,但可显著提高、氮、磷、钾的肥料利用率。再者,适宜氮磷钾肥配比(氮磷钾肥用量比为1∶0.4∶1)可提高农作物的光合性能并改善源库关系和稻米品质,能够有效促进光合产物及茎叶中储存的碳水化合物向籽粒转运,提高作物产量[61]。有研究表明,适当减施化肥和配施有机肥能够有效发掘作物本身潜能,减少田间氮磷钾的渗漏淋失,但不宜过度减施化肥,否则不利于水稻籽粒灌浆以及产量的形成。其次,通过合理的氮肥钾肥运筹结合干湿交替灌溉有利于水稻对氮磷钾的协同吸收并促进生长中心磷素积累[62]。王静等[63]研究表明,相较于传统施肥方式,减施氮肥和尿素配施硝化抑制剂等措施可以提高磷肥回收率和磷素利用效率,增加水稻生育期的磷吸收量和器官磷积累量。同时,合理的氮肥运筹(例如氮肥后移)也提高了水稻植株磷素积累总量和穗部磷的增加量,有利于籽粒灌浆。需要指出的是,钾在整个植物木质部的水分和养分运输中发挥主要作用。土壤中缺钾会导致植株叶片总面积减少,降低光合磷酸化活力和电子传递活力,降低光合关键酶核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)活性和含量,进而影响植株光合效率和低磷环境下根系对磷的吸收与积累。所以田间适当增施钾肥能有效缓解低钾胁迫导致水稻磷吸收量的减少[64]。但有学者观察到,缺钾会导致作物体内磷含量的上升,其可能原因是体内蛋白质代谢紊乱导致磷的积累[65]。综上,合理施用氮磷钾肥能充分发挥不同肥料之间协同作用,加速土壤中难溶性磷分解,能够有效缓解由低磷胁迫而导致的作物减产。
5 存在问题与展望
虽然国内外关于水稻对低磷胁迫的适应性机制及提高磷利用率的调控途径等作了较多研究,但有些问题仍有待探究,例如,根系与土壤相互作用以及植物激素特别是新型植物激素调控水稻磷的吸收、转运和分配的机理;通过栽培栽培措施协同提高水稻产量、品质和磷利用率的机制。深入研究这些问题,对于近一步揭示水稻对低磷胁迫的适应性机制,培育和选用耐低磷(磷高效)品种,构建协同提高水稻产量、品质和磷利用效率的栽培调控途径,具有重要意义。为此,今后可以从以下三个方面进行重点研究:
(1)研究水稻根系与土壤互作对土壤有机磷释放的影响。以根系-微生物-土壤为研究主线,从根系形态生理性状、功能微生物(如丛枝菌根真菌、解磷细菌)和土壤理化因子等方面探究根-土作用与土壤中有效磷含量的内在联系及其对无机磷向有效磷转化的作用机制。
(2)研究植物激素特别是新型激素对水稻磷吸收、转运及分配的调控作用及其机制。重点研究独脚金内酯(strigolactones,SLs),油菜素甾醇(brassinosteroids,BRs),茉莉酸(jasmonic acid,JAs)等新型激素在水稻响应低磷胁迫过程中的作用机制及其对水稻中磷的时(不同生育期)空(根、茎、叶、穗)分布的调控作用。应用分子生物学技术深入阐明植物激素对水稻磷吸收利用的调控机制。
(3)开发磷高效水稻品种和提高磷利用效率的栽培调控途径。深入研究磷利用效率不同水稻品种对低磷胁迫的响应机制,培育或筛选高产与磷高效利用的水稻品种;研究灌溉方式、肥料运筹对水稻磷素吸收、转运和分配的调控作用及其原理,构建在低磷胁迫条件下协同提高水稻产量、品质和磷吸收利用效率的栽培调控途径和技术。
