加味水牛角地黄汤对过敏性紫癜血热妄行证生物标志物的影响
2023-07-11高旭光张辉任献青刘华李伟霞翟文生郭庆寅河南中医药大学儿科医学院河南郑州450046河南中医药大学第一附属医院河南郑州450003
高旭光,张辉,任献青,刘华,李伟霞,翟文生,郭庆寅(. 河南中医药大学儿科医学院,河南 郑州 450046;. 河南中医药大学第一附属医院,河南 郑州 450003)
过敏性紫癜(Henoch-Schönlein purpura,HSP)是儿童时期最常发生的血管炎,主要以小血管炎为病理改变的全身综合征[1-2],以血液溢于皮肤、黏膜之下,出现瘀点瘀斑、压之不褪色为临床特征,常伴有腹痛、胃肠出血、关节痛、血尿蛋白尿等症状[3-4]。尽管HSP 作为一种血管炎的概念已深入人心,但对其发病机制的认识有限,目前西医对该病无特效的治疗手段。HSP 是中医的优势病种,血热妄行证是儿童HSP 最常见的证型[5-7],采用清热凉血法治疗效果良好,加味水牛角地黄汤是其临床常用方药,但是探寻加味水牛角地黄汤的作用机制是回答临床疗效问题的难点。代谢组学是研究疾病期间代谢变化的有力工具,与基因组学和蛋白质组学相比较,代谢组学可以诠释治疗情况下疾病变化的全局图景,在鉴定对生物学干扰或疾病状态具有高度差异性的标志物方面具有巨大潜力。目前大多数代谢组学研究HSP 在于鉴定其不同证型之间的差异物或预测HSP 发展为紫癜性肾炎(HSPN)的相关研究[8-9],而药物治疗HSP 的代谢组学研究较少,尤其中医药治疗HSP 前后代谢组学变化的研究更少。本研究采用超高效液相色谱-四级杆飞行时间质谱(UPLC-Q-TOF/MS)技术,对加味水牛角地黄汤治疗HSP 血热妄行证患儿前后的尿液标本进行非靶标代谢组学检测,为深入认识HSP 血热妄行证经加味水牛角地黄汤治疗后内源性物质的变化规律奠定基础。
1 资料与方法
1.1 研究对象及分组 本研究收集2020 年12 月-2021 年5 月在河南中医药大学第一附属医院住院的HSP 血热妄行证患儿63 例为试验组,其中男31 例,女32 例,平均年龄7.62 岁;试验组患儿予加味水牛角地黄汤(生地黄10 g、水牛角15 g、牡丹皮10 g、赤芍10 g、紫草10 g、当归10 g、积雪草15 g、白鲜皮10 g、徐长卿10 g、炒麦芽10 g、炙甘草6 g,为江阴天江药业有限公司的配方颗粒剂),开水300 mL 冲服,早晚各150 mL 温服,治疗3 周。以健康体检的小学生设为健康组(50 例),其中男23 例,女27 例,平均年龄6.71 岁,各组例数、性别、年龄比较差异无统计学意义(P>0.05)。本研究经河南中医药大学第一附属医院伦理委员会批准(编号:2019HL-143-01),所有受试者在纳入研究前均由其监护人签署知情同意书。
1.2 诊断标准
1.2.1 诊断标准 参照2017 年中国中医药出版社新世纪教材《中医儿科学》及2011 年国家中医药管理局发布的《过敏性紫癜中医诊疗指南》[4]制定。血热妄行证:主证:①皮肤紫癜数量较多,色泽鲜红;②烦躁;③口干欲饮;④舌质红或红绛。次证:①面红唇赤;②便秘、或便血;③小便色黄;④舌苔黄;⑤脉数有力。评价标准:除皮肤紫癜外,满足其余主证2 项;或主证1 项+次证2 项即为血热妄行证。
1.2.2 纳入标准 符合HSP 诊断标准和血热妄行证中医辨证标准;年龄4~14 岁,初发或复发者;临床无肾损伤者,即尿常规、24 h 尿蛋白定量正常;监护人知情同意者。健康组纳入标准:选择年龄4~14 岁,近1 周内无感染或无特殊用药史的健康体检儿童,法定监护人同意并签署知情同意书。
1.2.3 排除标准 肾脏损伤者;凝血功能障碍者;结核、乙肝、狼疮、心肌炎等慢性疾病者;HSP 伴肠穿孔、肠套叠等重症病例;已经参加其他药物的临床试验者。
1.3 样本采集 试验组患儿治疗前后及健康组儿童早上08∶00 左右留取晨起中段尿5~10 mL,装尿管,加叠氮化钠防腐剂后立即将尿液放置碎冰盒送达实验室。采用高速冷冻离心机将尿液样品于4 ℃,3 000 r·min-1离心10 min(离心半径为10 cm),取离心后尿液上清部分3 份,每份1 mL,分别转移至1.5 mL 冻存管中;然后转移至-80 ℃冰箱中冷冻保存,避免反复冻融。
1.4 仪器和试剂
1.4.1 仪器 Waters AcquityTMUPLC 液相系统、Xevo G2-XS-Q-TOF 质谱仪(配有Lock-spray 接口,ESI离子源,MassLynx v4.1 质谱工作站),美国Waters公司;Neofuge 1600R 型台式低温高速离心机,力康生物医疗科技控股集团。
1.4.2 试剂 甲酸,北京迪马科技公司,批号:1308751;乙腈、甲醇,德国Merck 公司,批号:JB125230、I1099407026;亮氨酸脑啡肽,美国Waters 公司,批号:W15071909;超纯水为娃哈哈纯净水;其他试剂均为分析纯。
1.4.3 样品预处理 将-80 ℃冰箱中冷冻的尿液样本取出,在室温下自然解冻,每例尿液样本取200 μL装入离心管,加入200 μL 预冷后的甲醇混合,震荡涡旋1 min 后备用。以离心机在4 ℃、14 000 r·min-1离心10 min(离心半径为10 cm);取离心后上清液80 μL,每次进样4 μL,用UPLC-Q-TOF/MS 仪进行分析。同时将全部样品各取10 μL,按上述方法充分混匀后制成质控样本(QC)。
1.5 测定方法
1.5.1 色谱条件 色谱柱为ACQUITY UPLC®HSS T3 C18色谱柱(2.1 mm×100 mm,1.8 μm);流动相A 为0.1%甲酸水溶液,流动相B 为0.1%甲酸乙腈溶液,梯度洗脱:0~12.0 min,5%~40% B;12.0~13.0 min,40%~80% B;13.0~15.0 min,80%~95% B;15.0~17.0 min,95% B;17.0~17.1 min,95%~5% B;17.1~20 min,5% B。柱温:40 ℃,流速:0.3 mL·min-1,进样量:3 μL。
质谱条件:电喷雾(ESI)离子源,以MSE Continuum 模式进行数据采集。准确质量法测定采用亮氨酸脑啡肽(Leucine Enkephalin,ESI-m/z554.261 5,ESI+m/z556.277 1)溶液为锁定质量溶液;毛细管电压:ESI-2.5 kV、ESI+3.0 kV;离子源温度:140 ℃;脱溶剂气温度:450 ℃;锥孔电压:40 V;锥孔气流量:50 L·h-1,脱溶剂流量:800 L·h-1,碰撞能量:10~45 V,间隔扫描时间:0.2 s。质量扫描范围(m/z):50~1 200。
1.5.2 数据分析 采用MassLynx 4.1 软件进行数据采集,运用Progenesis QI 2.4 软件对采集的数据进行数据对齐、峰提取、样品分组、去卷积及归一化等处理,结合SIMCA 14.0 对各组数据进行多元变量分析,其中包括非监督的主成分分析(PCA)、有监督的偏最小二乘-判别分析(PLS-DA)和正交偏最小二乘-判别分析(OPLS-DA)模型。满足变量权重值(VIP)>1 及P<0.05 的化合物被认为是潜在生物标志物,利用置换检验对PLS-DA 模型进行过拟合验证。通过HMDB 网站、Progenesis QI 在线数据库、KEGG 通路数据库以及相关中英文献比对,鉴定确认潜在的生物标志物,将差异代谢物名称导入MetaboAnalyst 5.0网站进行代谢通路分析,将影响较大的通路定为相关代谢通路。
2 结果
2.1 多元统计分析 采用SIMCA 13.0 软件对实验尿标本质谱信息进行PCA 和PLS-DA 多元统计分析。从PCA 得分图(见图1)可以看出,健康组、试验组治疗前和治疗后尿液样本分别相对地聚集在一起,说明健康组、试验组治疗前和治疗后的尿液样品的代谢轮廓存在差异。QC 样本密集分布,说明仪器稳定,重复性良好,数据可靠。从PLS-DA 得分图(见图2)可见,健康组、试验组治疗前和治疗后的尿液样本呈现较好的聚类效果,3 组样本区分明显,采用置换检验对PLS-DA 模型进行验证,Q2在纵轴上的截距为负值,说明所建立的PLS-DA 模型未过度拟合。

图1 各组尿液样本PCA 得分图Figure 1 PCA score plot of urine samples from each group
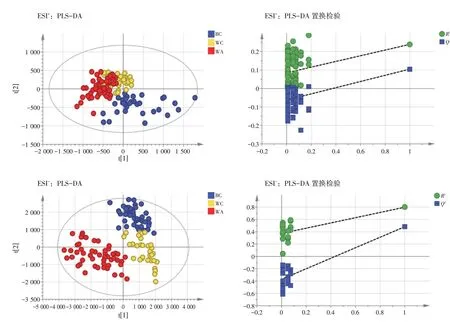
图2 各组尿液样本PLS-DA 得分图及置换检验图Figure 2 PLS-DA score plot and permutation test plot of urine samples from each group
采用有监督的OPLS-DA 方法,试验组治疗前和健康组样本得到了很好的分离。正离子模式下,参数R2Y(cum)=0.875,Q2(cum)=0.746;负离子模式下,参数R2Y(cum)=0.794,Q2(cum)=0.485,上述参数表明OPLS-DA 模型具有良好的质量和准确性。见图3。进一步处理得到反映组间贡献率的S-plot 图及VIP 图。见图4。

图3 各组尿液样本OPLS-DA 得分图及置换检验图Figure 3 Urine samples OPLS-DA score plot and permutation test plot

图4 尿液样本正负离子模式下S-plot 图及VIP 图Figure 4 S-plot and VIP diagram of urine samples in positive and negative ion modes
2.2 潜在生物标志物的鉴定 从OPLS-DA 模型分析,试验组治疗前与健康组各聚为一类,且分离明显。选取对分组贡献度较大即VIP>1 且代谢物的相关系数(S-plot)≥0.5 的化合物作为潜在生物标志物(见图4)。利用二级质谱信息,通过HMDB 代谢数据库、KEGG 在线数据库等进行检索、匹配,结合文献及标准品比对等方法最终鉴定出98 个差异代谢2物,包括硫酸盐(Sulfate)、L-组氨酸(L-Histidine)等。结果见表1。
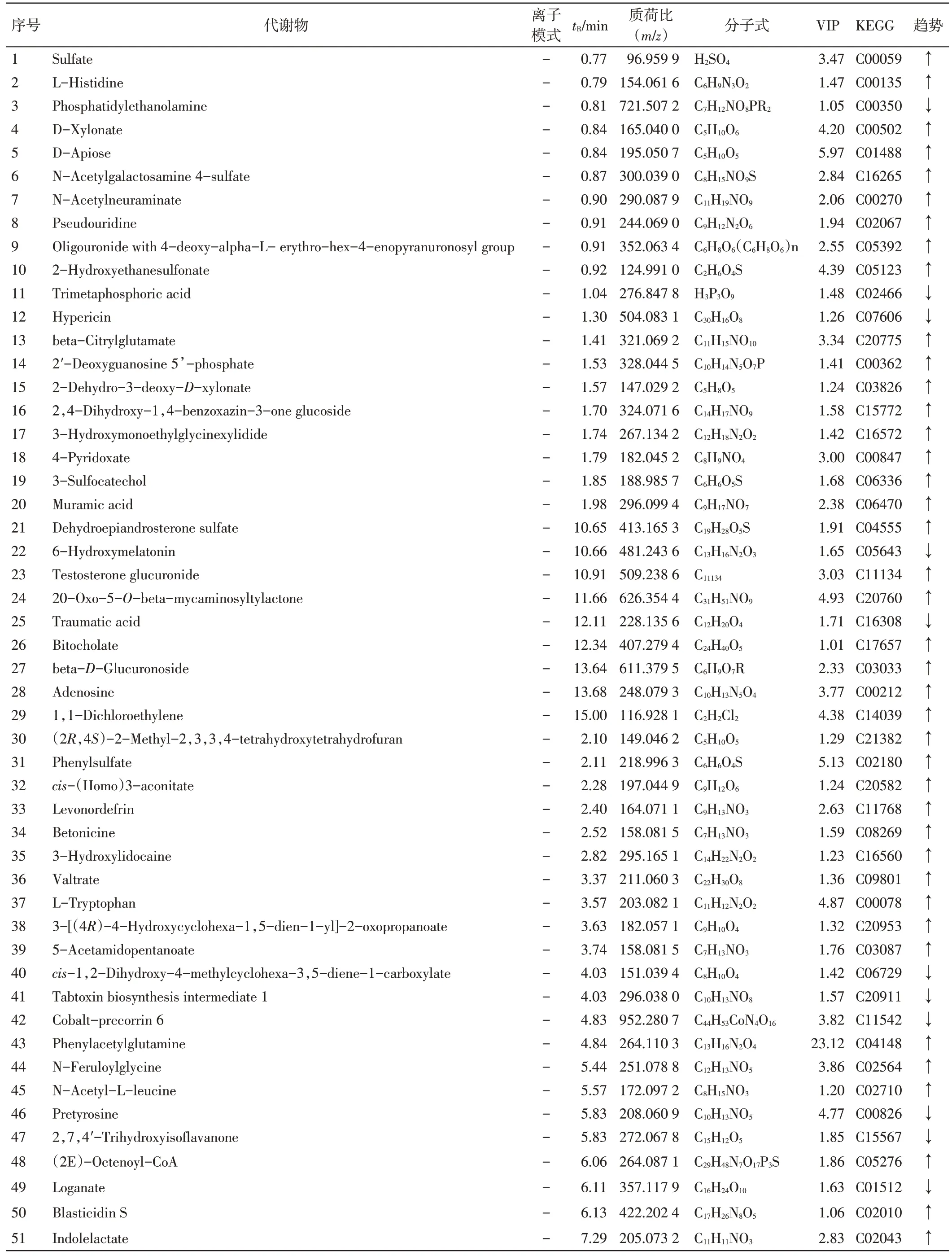
表1 过敏性紫癜血热妄行证患儿尿液中潜在的生物标志物Table 1 Potential biomarkers in urine of HSP with blood heat inducing extravasation of blood syndrome
2.3 治疗前后潜在生物标志物的鉴定 见图5。试验组经加味水牛角地黄汤治疗后与治疗前比较,98 个差异代谢物中有6 个出现显著的变化。硫酸盐(Sulfate)、磷脂酰乙醇胺(Phosphatidylethanolamine)显著上调(P<0.05),经治疗后有显著下降(P<0.05);L-组氨酸(L-Histidine)、L-色氨酸(L-Tryptophan)、6-羟基褪黑激素(6-Hydroxymelatonin)、1,1-二氯乙烯(1,1-Dichloroethylene)显著下调(P<0.05),经治疗后显著上升(P<0.05)。
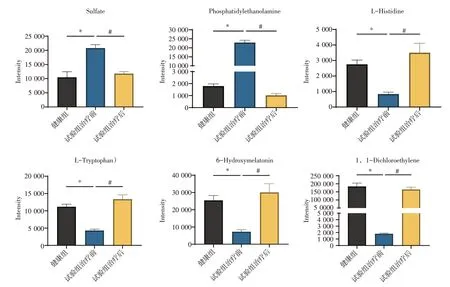
图5 加味水牛角地黄汤对过敏性紫癜血热妄行证患儿尿液生物标志物含量的影响Figure 5 Effect of modified Shuiniujiao Dihuang Decoction on urine biomarkers in Children with HSP of blood heat inducing extravasation of blood syndrome
2.4 主要代谢通路分析 将表1 中生物标志物导入MetaboAnalyst 5.0 在线数据库构建代谢通路,以代谢通路影响值(Pathway impact,PI)高于0.10 作为有影响的潜在代谢通路。结果显示,组氨酸代谢通路、硫代谢通路、戊糖和葡萄糖醛酸的相互转化代谢通路、色氨酸代谢通路、甘油磷脂代谢通路等5 条代谢通路有相关性,代谢通路影响值分别为0.221、0.213、0.143、0.141、0.104。见图6。

图6 过敏性紫癜血热妄行证患儿差异生物标志物构建的代谢通路Figure 6Constructed metabolic pathway of differential biomarker construction in children with HSP
3 讨论
过敏性紫癜(HSP)是一种全身性小血管炎,病理特征以IgA1 为主要免疫复合物沉积在病变血管壁,表现为全身性或单器官局限性血管炎[10-12]。HSP 属中医“血证”“紫癜”“肌衄”“葡萄疫”等范畴[13-14]。犀角地黄汤是中医经典方剂,方药由犀角(现以水牛角代替)、生地黄、赤芍、牡丹皮组成。水牛角地黄汤通常用于治疗各种出血,包括吐血、流鼻血、便血、皮疹等,在恢复免疫系统和增强免疫反应、改善炎症反应、改善氧化损伤和对抗病毒感染等方面具有广泛的作用[15]。以水牛角地黄汤为基础方加味治疗HSP 已得到医家重视[16-19],探索加味水牛角地黄汤治疗HSP 的作用机制,将为该方的临床应用提供依据。
本研究PCA 结果显示,健康组、试验组治疗前和试验组治疗后分别相对地聚集在一起,说明3 组间代谢轮廓存在差异。PLS-DA 分析结果显示,健康组、试验组治疗前和试验组治疗后呈现较好的聚类效果,3 组区分明显。分析试验组治疗前与健康组的差异代谢物发现硫酸盐(Sulfate)、L-组氨酸(LHistidine)等98 个差异代谢物,将98 个生物标志物导入MetaboAnalyst 5.0 在线数据库构建代谢通路,发现参与的代谢通路5 条,涉及了氨基酸、糖类及脂质代谢。HSP 患儿经加味水牛角地黄汤治疗后与治疗前比较,98 个差异代谢物中有6 个出现显著性治疗效应,治疗前硫酸盐、磷脂酰乙醇胺等显著上调(P<0.05),经加味水牛角地黄汤治疗后下降(P<0.05);治疗前L-组氨酸、L-色氨酸等显著下调(P<0.05),经加味水牛角地黄汤治疗后升高(P<0.05)。
L-组氨酸参与了组氨酸代谢通路,组氨酸作为半必需氨基酸,存在于香蕉、肉类、牛奶以及奶制品中,组氨酸的重要代谢产物是组胺,在组氨酸脱羧酶的作用下,组氨酸脱羧基形成组氨。组胺是一种活性生物胺,其在外周组织中主要由肥大细胞和附近结缔组织中的嗜碱性粒细胞产生,参与过敏和炎症反应[20]。硫酸盐参与了硫代谢通路,它存在于工业加工食品中,也存在于蔬菜和一些饮料中[21],硫酸盐具有维持细胞渗透性的作用,是细胞内环境稳定的重要调节因子[22-23]。HSP 患儿尿液硫酸盐浓度升高,治疗后下降,说明加味水牛角地黄汤有调节HSP 患儿代谢硫酸盐的能力。有研究发现硫酸盐与HSP 向HSPN 的发展有关[24]。
L-色氨酸和6-羟基褪黑激素参与了色氨酸代谢通路,色氨酸在肉类、鱼类、鸡蛋、奶酪、豆类和坚果等富含蛋白质的食物中含量很高,是膳食蛋白质的一部分。一项初步研究报告食物过敏患者的色氨酸分解较低[25]。在另一项代谢组研究中,与花生耐受者相比,花生过敏者血浆中的色氨酸和酪氨酸水平升高[26]。
磷脂酰乙醇胺参与了甘油磷脂代谢,脂质组学为代谢组学的一个分支学科,脂质作为生物膜的重要组成部分、信号分子、第二信使和能量的主要来源之一,在人类健康中发挥着重要作用[27]。在一项HSPN 发病机制研究中,差异表达蛋白富含脂质代谢,磷脂酰胆碱减少,而磷脂酰乙醇胺增加[28],这与本次代谢组学研究结果一致。
综上所述,本研究通过非靶向代谢组学方法分析血热妄行证HSP 患儿尿液标本,鉴定出了98 个差异生物标志物,涉及5 条代谢通路,经加味水牛角地黄汤治疗后98 个差异生物标志物中有6 个出现显著的变化。本研究为深入了解加味水牛角地黄汤的作用机制奠定了基础,从代谢组学层面揭示了加味水牛角地黄汤发挥疗效的可能作用机制。
