基于神经递质和5-HT1A/Gαi/o/cAMP 信号通路研究黄连温胆汤对失眠大鼠的治疗作用及机制
2023-07-11李亮王珠强胡莹戴卫波郭文贤陈巧玲王家赐中山市中医院老年病睡眠专科广东中山5840中山市中医院中药药理实验室广东中山5840
李亮,王珠强,胡莹,戴卫波,郭文贤,陈巧玲,王家赐(. 中山市中医院老年病睡眠专科,广东 中山 5840;. 中山市中医院中药药理实验室,广东 中山 5840)
失眠又称入睡或维持睡眠障碍,表现为各种原因引起入睡困难、睡眠深度或频度过短、早醒及睡眠时间不足或质量差等[1]。长期失眠会导致日间功能障碍(工作能力、认知功能、精力下降),还可增加各种疾病的发病风险[2]。随着社会发展,失眠人群呈逐年上升的趋势,全球约有27%的人遭受睡眠病症困扰[3]。许多化学合成的镇静催眠药物如苯二氮䓬类受体激动剂、褪黑素受体激动剂等已被用于治疗失眠,但其治标不治本且副作用较大,尤其是长效的镇静安眠药,用后常有宿醉效应,此外,化学合成药物多具有耐受性和依赖性,突然停药时可能会导致更严重的失眠[3-4]。
失眠在中医称之为“不寐”,中医药治疗失眠标本兼顾,疗效佳,不良反应小,无耐受性和依赖性,故而近年来受到国人的青睐。中医认为失眠多因思虑忧郁、劳倦过度、心脾血虚、心肾不交或病邪干胃而胃不和等引发[5-6]。黄连温胆汤出自清代的《六因条辨》,由黄连、法半夏、竹茹、枳实、陈皮、甘草、茯苓组成,功效清热除烦,燥湿化痰,主治痰热内扰证,症见失眠,眩晕虚烦,欲呕,口苦,舌苔黄腻[7]。现代研究[8-12]发现黄连温胆汤还可用于辅助治疗慢性乙型肝炎、肝纤维化以及儿童多发性抽动症等。
有研究[13]表明5-HT1A/Gαi/o/cAMP 信号通路参与睡眠的调控,且该通路与改善中枢5-羟色胺(5-hydroxytryptamine,5-HT)障碍的机制有一定的相关性。本研究通过5-HT 合成抑制剂对氯苯丙氨酸(DL-4-Chlorophenylalanine,PCPA)诱导建立大鼠失眠模型,探讨黄连温胆汤治疗失眠的作用及机制,为临床推广应用奠定基础。
1 材料与方法
1.1 动物 SPF 级SD 雄性大鼠60 只,8 周龄,体质量(200±10)g,购于珠海百试通生物科技有限公司,实验动物生产许可证号:SCXK(粤)2020-0051,实验动物质量合格证号:44822700001718。检疫合格后饲养于中山市中医院中药药理实验室动物房(屏障环境),使用许可证号:SYXK(粤)2020-0109,饲养环境配备聚丙烯鼠笼,每笼饲养6 只,控制饲养温度范围22~24 ℃,湿度范围45%~60%,12 h 明暗交替光照,换气次数不少于每小时15 次全新风,适应性饲养3 d。本实验经中山市中医院实验动物伦理委员会批准,批准文号:AEWC-2021020。
1.2 药物及试剂 黄连温胆汤由黄连10 g,法半夏10 g,竹茹10 g,枳实10 g,陈皮10 g,甘草5 g,茯苓10 g 组成,所有中药饮片均由中山市中医院中药房提供,并由何鉴洪副主任中药师鉴定为质量合格的正品,以上中药饮片用10 倍速量水煎2 遍,过滤合并2 次煎液,再浓缩成含生药量1.17 g·mL-1的水煎剂,于4 ℃冷藏备用。PCPA,美国Sigma 公司,批号:SHBL0057,用时取适量羧甲基纤维素钠(Sodium carboxymethyl cellulose,CMC-Na)与少量无水乙醇研磨至乙醇挥发干,再加适量PCPA 共研磨,最后加一定体积pH=7~8 的弱碱性生理盐水(生理盐水中滴入5%碳酸氢钠水溶液,直至pH=7~8)研磨均匀,得到含0.1% CMC-Na 的35 mg·mL-1的PCPA 混悬液;地西泮片,天津力生制药股份有限公司,批号:1810003,规格:2.5 mg/片,用时用超纯水配成0.2 mg·mL-1的地西泮混悬液[14];BCA 蛋白定量试剂盒,上海碧云天生物技术有限公司,批号:122120210323;大鼠脑源性神经营养因子(Brain-derived neurotrophic factor,BDNF)、神经胶质纤维酸性蛋白(Glial fibrillary acidic protein,GFAP)、去甲肾上腺素(Norepinephrine,NE)、多巴胺(Dopamine,DA)、γ 氨基丁酸(Gamma aminobutyric acid,GABA)、谷氨酸(Glutamate,Glu)、5-羟色胺(5-hydroxytryptamine,5-HT)、5-羟基吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)、环一磷酸腺苷(cyclic adenosine monophosphate,cAMP)酶联免疫试剂盒,上海抚生实业有限公司,批号分别为:20210801、20210802、20210803、 20210804、 20210805、 20210806、20210807、20210808、20210809;Gα(i)多克隆抗体,CST(上海)生物试剂有限公司,货号:5290S,批号:3;Anti-5-HT1AReceptor 多克隆抗体,Abcam(上海)贸易有限公司,货号:ab85615,批号:GR3396561;辣根过氧化物酶(HRP)二抗Anti-rabbit IgG,CST(上海)生物试剂有限公司,货号:7074P2,批号:1;甘油醛-3-磷酸脱氢酶(GAPDH)抗体,Affinity 抗体公司,货号:AF7021,批号:857357W;异氟烷,友诚生物科技有限公司,批号:445727。
1.3 仪器 YLS-1C 小动物活动记录仪,济南益延科技发展有限公司;JA-1203 电子天平,上海天平仪器厂; LUKYM-1 样品冷冻研磨仪,广州露卡测序仪器有限公司;台式H1850R 高速冷冻离心机,湖南湘仪实验室仪器开发有限公司; MULTISKAN FC 酶标仪,美国Thermo 公司; HGPN-50 隔水式电热恒温培养箱,上海跃进医疗器械有限公司;2-16R 医用离心机,湖南恒诺仪器设备有限公司; Mini-Protean Tetra 小型垂直蛋白电泳系统、ChemiDocMP化学发光成像系统,美国伯乐公司; TU-100 恒温金属浴,上海一恒科技有限公司; TS-1 脱色摇床,上海达姆实业有限公司; HYC-650 医用冷藏箱、DW-40L508 电冰箱,海尔生物医疗股份有限公司;MDF-382E(N)医用电冰箱,日本SANYO 公司。
1.4 分组、给药及模型复制 大鼠适应性饲养3 d后,第4 天将60 只大鼠随机均分成5 组,即正常组、模型组、地西泮组及黄连温胆汤低、高剂量组,每组各12 只。自第4 天开始记录各组大鼠体质量变化情况。
黄连温胆汤低、高剂量组大鼠第4 天至第19 天,连续16 d,于每日9∶00~10∶00 分别开始灌胃给予5.85 g·kg-1、11.70 g·kg-1的黄连温胆汤;正常组和模型组大鼠同步灌胃给予相应体积蒸馏水;地西泮组大鼠第4 天至第19 天中前8 d 每日9∶00~10∶00 同步灌胃给予相应体积蒸馏水,后8 d 则同步灌胃给予2 mg·kg-1的地西泮混悬液。上述黄连温胆汤及地西泮的给药剂量均参照《药理实验方法学》中60 kg成人常用临床剂量与动物等效剂量的换算方法而确定[15]。
第11 天至第13 天,除正常组外,各组大鼠连续3 d 于每天14∶30~15∶30 腹腔注射碱性生理盐水配制的PCPA 混悬液(350 mg·kg-1)进行模型复制,正常组则腹腔注射对应体积含0.1% CMC-Na 的碱性生理盐水[16-17]。第1 天模型复制24 h 后开始观察各组大鼠行为及状态,并通过小动物活动记录仪监测各组大鼠活动时间及总睡眠量。与正常组大鼠比较,其余组大鼠出现行为及状态异常(即出现异常兴奋、焦躁易怒、跳动不安、来回疾走、攻击性增强、彼此互相撕咬、体质量减轻等异常行为及状态),且出现昼夜节律消失,相比于模型复制前的白天活动量增加、总睡眠量减少,提示模型复制成功[18-19]。
1.5 行为学评价(旷场实验) 第18 天,各组灌胃给药后,采用旷场实验对各组大鼠进行行为学监测,考察大鼠在陌生空旷环境中的焦虑度以及探索行为。将大鼠依次由同一角度置于50 cm×50 cm×50 cm的敞口空间中央区域(敞口空间被均分为4×4 的16 个方格,中央4 格为中央区域),敞口空间中央区域正上方为监控拍摄设备,拍摄记录每只大鼠5 min的活动总时间、总距离以及在中心区活动的总时长,并用系统自带软件绘制相应的热感图及轨迹图[19]。整个监测过程须保持实验环境安静,不可人为干预大鼠活动。每完成1 只大鼠的监测须清洁旷场区域,避免留下排泄物和气味从而干扰下1 只大鼠的监测结果。
1.6 检测指标
1.6.1 取材 第19 天记录各组大鼠体质量,末次给药1 h 后,吸入异氟烷5 min 麻醉大鼠;再用5 mL采血管(非抗凝管)进行腹主动脉取血;将含有血液的采血管置于冰上,静置1 h 后,4 ℃、离心半径8 cm、3 500 r·min-1低温离心15 min,分离出血清,-80 ℃冰箱冷冻保存待测。大鼠脊椎脱臼法处死,取下全脑,称质量,并迅速剥离大鼠脑干和下丘脑,冰PBS冲洗,滤纸吸干后暂存于液氮中,最后转移至-80 ℃冰箱冷冻保存待测。计算大鼠全脑系数(即全脑质量与取材当天大鼠体质量的比值)。
1.6.2 ELISA 法检测血清BDNF 和GFAP 水平 取出冰箱中的血清冰上解冻,用酶联免疫试剂盒按照说明书严格操作,检测血清中BDNF 和GFAP 的含量。
1.6.3 ELISA 法检测脑干NE、DA、GABA 及Glu 水平 取出冰箱中的脑干冰上解冻,脑干按1 g∶10 mL加入PBS,加入钢珠后于样品冷冻研磨仪中。设置60 Hz、4 ℃、研磨60 s,将得到的匀浆液置于低温离心机进行离心。设置参数为4 ℃、离心半径8 cm、4 000 r·min-1离心10 min,离心后收集上清液。严格按照BCA 蛋白定量试剂盒说明书对各个样品上清液进行蛋白定量。取适量蛋白定量后的样品,通过ELISA 试剂盒检测GABA 及Glu 水平,将蛋白定量得到的样品总蛋白浓度值代入ELISA 试剂盒检测出的指标浓度结果,计算出样品单位质量总蛋白中GABA 及Glu 的水平,最后计算Glu/GABA 的值。再取适量蛋白定量后的样品用PBS 将各个样品浓度调整到统一浓度,通过ELISA 试剂盒检测NE 及DA 水平。
1.6.4 ELISA 法检测下丘脑5-HT、5-HIAA 及cAMP水平 取出冰箱中的下丘脑冰上解冻,切取一半,再参照“1.6.3”项下方法获取样品上清液进行蛋白定量,再取适量蛋白定量后的样品用PBS 将各个样品浓度调整到统一浓度。通过ELISA 试剂盒检测下丘脑中5-HT、5-HIAA 及cAMP 的水平。
1.6.5 Western Blot 法检测下丘脑中5-HT1A受体蛋白和Gα(i)蛋白表达水平 取另一半下丘脑按1 g∶10 mL加入裂解液(裂解液由蛋白酶及磷酸酶混合抑制剂与RIPA 裂解液1∶50 配制),加入钢珠后参照“1.6.3”项下的方法进行匀浆、离心和BCA 蛋白定量操作;再用裂解液将各个蛋白样品浓度调整到统一浓度。将得到的统一浓度的蛋白提取液按100 μL∶25 μL 加入蛋白上样缓冲液,恒温金属浴98 ℃变性10 min;冰上冷却,电泳,转膜,PBST 漂洗后快速封闭液中室温封闭15 min,PBST 漂洗,一抗(用抗体稀释液稀释1 000 倍)4 ℃孵育过夜;PBST 漂洗后用辣根过氧化物酶(HRP)二抗(用抗体稀释液稀释10 000 倍)室温孵育2 h,PBST 洗膜3 次,每次10 min;滴加ECL 超敏发光液,化学发光成像系统显影拍照,运用ImageJ 软件计算蛋白条带灰度值,以GAPDH 为内参,对目的蛋白进行半定量分析。
1.7 统计学处理方法 选择SPSS 23.0 软件进行统计学分析,计量资料数据以均数± 标准差(±s)表示。由于各组数据均服从正态分布,故而可用单因素方差分析进行组间差异分析。若方差齐,组间两两比较采用LSD 检验;方差不齐则采用Dunnett’s T3 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 黄连温胆汤对失眠大鼠旷场活动的影响 见图1、表1。与正常组比较,模型组大鼠活动总距离、总时间均明显增加(P<0.01),而中心区域持续时间明显减少(P<0.01);与模型组比较,黄连温胆汤各剂量组及地西泮组大鼠活动总距离、总时间均明显减少(P<0.01),黄连温胆汤高剂量组大鼠中心区域持续时间明显增加(P<0.01)。
表1 黄连温胆汤对失眠大鼠旷场活动的影响(±s,n=12)Table 1 Effects of Huanglian Wendan Decoction on open field activity in insomnia rats(±s,n=12)

表1 黄连温胆汤对失眠大鼠旷场活动的影响(±s,n=12)Table 1 Effects of Huanglian Wendan Decoction on open field activity in insomnia rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01
组别正常组模型组黄连温胆汤低剂量组黄连温胆汤高剂量组地西泮组剂量/(g·kg-1)--5.85 11.70 2 mg·kg-1总距离/m 9.97±0.82 17.05±1.65##6.35±0.48**3.29±0.27**5.92±0.45**总时间/s 92.73±8.96 147.14±9.45##73.38±4.66**42.53±3.21**63.38±5.35**中心区域持续时间/s 19.53±1.66 15.40±1.32##15.27±1.17 20.42±1.82**14.14±1.32

图1 各组大鼠活动热感图及轨迹图Figure 1 Activity thermal semsation map and trajectory map of rats in each group
2.2 各组大鼠体质量变化和全脑系数 见图2、表2。除正常组外,其余各组大鼠模型复制成功后均连续3 d(第12~14 天)体质量呈下降趋势,而正常组大鼠仅模型复制后第2 天(第12 天)体质量下降,其余时间体质量持续增长。与正常组比较,模型组大鼠全脑系数明显降低(P<0.01);与模型组比较,黄连温胆汤高剂量组及地西泮组大鼠全脑系数明显增高(P<0.01)。
表2 黄连温胆汤对失眠大鼠最终体质量及全脑系数的影响(±s,n=12)Table 2 Effects of Huanglian Wendan Decoction on final body mass and whole brain coefficient of insomnia rats(±s,n=12)

表2 黄连温胆汤对失眠大鼠最终体质量及全脑系数的影响(±s,n=12)Table 2 Effects of Huanglian Wendan Decoction on final body mass and whole brain coefficient of insomnia rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01
组别正常组模型组黄连温胆汤低剂量组黄连温胆汤高剂量组地西泮组剂量/(g·kg-1)--5.85 11.70 2×10-3体质量/g 292.00±6.54 270.00±14.90##269.90±17.58##270.00±10.40##262.00±13.95##全脑系数/(mg·g-1)6.47±0.16 6.04±0.36##6.10±0.43 6.46±0.36**6.61±0.36**
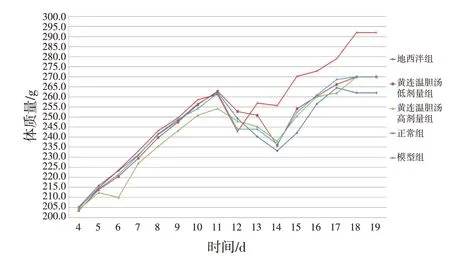
图2 各组大鼠给药干预期间体质量变化情况Figure 2 Changes in body mass of rats in each group during drug intervention
2.3 黄连温胆汤对失眠大鼠血清BDNF 和GFAP 水平的影响 见表3。与正常组比较,模型组大鼠血清BDNF 含量明显下降(P<0.01),而血清GFAP 含量明显升高(P<0.01);与模型组比较,黄连温胆汤低、高剂量组大鼠血清BDNF 含量明显升高(P<0.01),黄连温胆汤低、高剂量组及地西泮组大鼠血清GFAP 含量明显降低(P<0.01)。
表3 黄连温胆汤对失眠大鼠血清BDNF 和GFAP 水平的影响(±s,n=12)Table 3 Effects of Huanglian Wendan Decoction on serum BDNF and GFAP levels in insomnia rats(±s,n=12)

表3 黄连温胆汤对失眠大鼠血清BDNF 和GFAP 水平的影响(±s,n=12)Table 3 Effects of Huanglian Wendan Decoction on serum BDNF and GFAP levels in insomnia rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01
组别正常组模型组黄连温胆汤低剂量组黄连温胆汤高剂量组地西泮组剂量/(g·kg-1)--5.85 11.70 2×10-3 BDNF/(ng·L-1)193.50±12.66 155.62±7.86##170.31±6.16**205.49±5.98**162.27±5.74 GFAP/(ng·L-1)948.64±41.36 1 288.89±43.39##1 158.91±32.86**1 049.48±67.92**946.24±39.36**
2.4 黄连温胆汤对失眠大鼠脑干NE、DA、GABA、Glu 及Glu/GABA 水平的影响 见表4。与正常组比较,模型组大鼠脑干NE、DA、Glu 及Glu/GABA 水平均明显升高(P<0.01),而GABA 水平明显降低(P<0.01)。与模型组比较,黄连温胆汤高剂量组及地西泮组大鼠脑干NE、DA、Glu 及Glu/GABA 水平均明显降低(P<0.01),而GABA 水平均明显升高(P<0.01);黄连温胆汤低剂量组DA 及Glu/GABA水平降低(P<0.05,P<0.01)。
表4 黄连温胆汤对失眠大鼠脑干NE、DA、GABA、Glu 及Glu/GABA 水平的影响(±s,n=12)Table 4 Effects of Huanglian Wendan Decoction on the levels of NE,DA,GABA,Glu and Glu/GABA in the brain stem of insomnia rats(±s,n=12)

表4 黄连温胆汤对失眠大鼠脑干NE、DA、GABA、Glu 及Glu/GABA 水平的影响(±s,n=12)Table 4 Effects of Huanglian Wendan Decoction on the levels of NE,DA,GABA,Glu and Glu/GABA in the brain stem of insomnia rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
组别正常组模型组黄连温胆汤低剂量组黄连温胆汤高剂量组地西泮组剂量/(g·kg-1)--5.85 11.70 2×10-3 NE/(ng·L-1)192.44±6.33 230.42±8.05##223.83±8.08 198.05±6.86**206.79±6.87**DA/(ng·L-1)88.30±4.30 110.60±2.83##102.45±3.00**96.37±4.28**91.26±3.22**GABA/(nmol·mg total protein-1)71.57±5.44 55.31±3.77##59.16±3.85 69.22±5.35**72.62±4.91**Glu/(nmol·mg total protein-1)21.83±1.28 30.24±2.08##29.20±1.63 25.52±2.23**25.80±2.42**Glu/GABA 0.31±0.03 0.55±0.05##0.49±0.03*0.37±0.03**0.36±0.04**
2.5 黄连温胆汤对失眠大鼠下丘脑5-HT、5-HIAA及cAMP 水平的影响 见表5。与正常组比较,模型组大鼠下丘脑5-HT、5-HIAA 及cAMP 水平均明显降低(P<0.01);与模型组比较,黄连温胆汤低、高剂量组及地西泮组大鼠下丘脑5-HT、5-HIAA 及cAMP 水平均明显升高(P<0.01)。
表5 黄连温胆汤对失眠大鼠下丘脑5-HT、5-HIAA 及cAMP 水平的影响(±s,n=12)Table 5 Effects of Huanglian Wendan Decoction on the levels of 5-HT,5-HIAA and cAMP in the hypothalamus of insomnia rats(±s,n=12)

表5 黄连温胆汤对失眠大鼠下丘脑5-HT、5-HIAA 及cAMP 水平的影响(±s,n=12)Table 5 Effects of Huanglian Wendan Decoction on the levels of 5-HT,5-HIAA and cAMP in the hypothalamus of insomnia rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01
组别正常组模型组黄连温胆汤低剂量组黄连温胆汤高剂量组地西泮组剂量/(g·kg-1)--5.85 11.70 2×10-3 5-HT/(ng·L-1)281.86±8.83 175.52±7.51##207.03±6.72**239.88±10.41**240.17±9.84**5-HIAA/(ng·L-1)14.65±0.51 8.79±0.36##9.74±0.54**12.55±0.74**12.60±0.64**cAMP/(ng·L-1)84.12±2.28 53.78±3.29##59.18±1.97**67.84±2.57**67.83±3.94**
2.6 黄连温胆汤对失眠大鼠下丘脑5-HT1A受体蛋白和Gα(i)蛋白表达的影响 见图3、表6。与正常组比较,模型组大鼠下丘脑5-HT1A受体蛋白表达水平明显下调(P<0.01),Gα(i)蛋白表达水平明显上调(P<0.01)。与模型组比较,黄连温胆汤低、高剂量组大鼠下丘脑5-HT1A受体蛋白表达水平升高(P<0.05),Gα(i)蛋白表达水平降低(P<0.05,P<0.01);地西泮组大鼠下丘脑Gα(i)蛋白表达水平明显降低(P<0.01)。
表6 黄连温胆汤对失眠大鼠下丘脑5-HT1A 受体蛋白和Gα(i)蛋白表达的影响(±s,n=3)Table 6 Effects of Huanglian Wendan Decoction on the expressions of 5-HT1A receptor protein and Gα(i)protein in the hypothalamu of insomnia rats(±s,n=3)

表6 黄连温胆汤对失眠大鼠下丘脑5-HT1A 受体蛋白和Gα(i)蛋白表达的影响(±s,n=3)Table 6 Effects of Huanglian Wendan Decoction on the expressions of 5-HT1A receptor protein and Gα(i)protein in the hypothalamu of insomnia rats(±s,n=3)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
组别正常组模型组黄连温胆汤低剂量组黄连温胆汤高剂量组地西泮组剂量/(g·kg-1)--5.85 11.70 2×10-3 5-HT1A/GAPDH 2.41±0.46 1.13±0.28##1.81±0.33*1.95±0.27*1.61±0.43 Gα(i)/GAPDH 1.02±0.28 1.94±0.17##1.24±0.47*0.74±0.41**0.89±0.08**
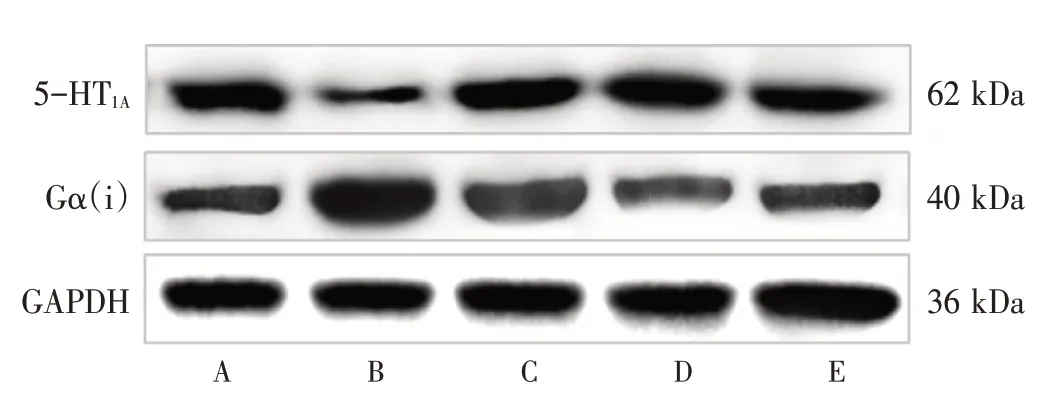
图3 各组5-HT1A受体蛋白和Gα(i)蛋白的表达Figure 3 Expressions of 5-HT1A receptor protein and Gα(i)protein in each group
3 讨论
目前国内外针对黄连温胆汤治疗失眠的相关研究以临床观察为主,显示其对痰热内扰型失眠患者疗效明显[20],尚未见有体内作用相关机制研究。雷励飞等[21]采用网络药理学的研究方法,探讨黄连温胆汤治疗失眠的作用机制,其研究显示,黄连温胆汤主要作用于神经递质结合通路、NF-κB 信号通路等生物过程。
本研究采用腹腔注射对氯苯丙氨酸(PCPA)的经典模型复制方法来制备失眠大鼠模型,以研究黄连温胆汤对失眠大鼠的作用及作用机制。PCPA 是一种5-HT 合成抑制剂,可选择性作用于色氨酸羟化酶,通过抑制酶活性,阻碍5-HT 合成,导致睡眠昼夜节律消失几乎接近完全失眠;而5-HT 含量的减少,常伴有下丘脑-垂体-肾上腺轴(HPA)功能障碍,故而可通过研究相关神经递质水平的变化探讨其相关作用机制[22]。本研究中模型复制所用试剂PCPA 用含0.1% CMC-Na 的碱性生理盐水配制,因其可增加PCPA 的分散度,从而保证模型复制成功以及模型的均一性。
从本研究的行为学旷场实验结果可知,在黄连温胆汤的干预下,失眠大鼠在旷场中活动总距离和总时间均减少,说明黄连温胆汤可以减轻失眠大鼠在旷场中的焦虑感;中心区域持续时间增加,表明黄连温胆汤可在模型大鼠自发活动和空间探索能力方面有促进作用,增强了其对空间探索的兴趣[23]。大鼠模型复制后体质量的变化情况反映出模型复制较为成功。此外,PCPA 复制模型可引起全脑系数降低,而大鼠全脑系数的降低在一定程度上表明模型复制后的大鼠可能出现神经元排列松散,细胞边界模糊,并产生大量萎缩神经元,继而造成病理性损伤[22],而黄连温胆汤高剂量和地西泮均可减轻相应损伤。由于缺少样本及实验周期较长等因素,本研究未进行病理组织切片观察及免疫组化实验验证上述结论,后期将进一步考察验证。
BDNF 是神经营养因子家族的重要成员,广泛存在于中枢神经系统中,具有促进神经细胞生长发育,防止神经细胞损伤的功能,还可参与调节睡眠-觉醒稳态;GFAP 为星形胶质细胞活化的标志物,其含量增高代表星形胶质细胞活化增加,神经元处于应激损伤状态。由本研究结果可知,黄连温胆汤可提高失眠大鼠血清中BDNF 含量,降低GFAP 含量,表明黄连温胆汤可通过调节血清中BDNF 与GFAP 含量来减轻神经细胞损伤,进而改善睡眠。
脑干中线部位的中缝核主要投射至前脑,用于调节睡眠-觉醒状态[24-25]。NE、DA、Glu 与GABA 是参与睡眠-觉醒机制的重要神经递质,基中NE、DA 及Glu 为兴奋性神经递质,在维持觉醒中起着重要作用;GABA 为抑制性神经递质,发挥镇静催眠的作用;Glu/GABA 比值调控神经兴奋与抑制平衡,故而常被用于研究和评估中枢神经系统的兴奋和抑制状态[26-27]。本研究结果表明黄连温胆汤可通过降低失眠大鼠兴奋性神经递质NE、DA 及Glu 含量以及Glu/GABA 比值,升高抑制性神经递质GABA 含量,从而调节失衡的神经调制而促进睡眠。
由于PCPA 是一种5-HT 合成抑制剂,故而本研究重点研究药物干预对5-HT 及其相关通路的影响。5-HT 神经元通过上行投射影响下丘脑高级中枢,下丘脑中5-HT 是参与睡眠-觉醒调节的重要组成部分;5-HIAA 是能反映5-HT 能神经系统的活跃程度的代谢产物,下丘脑中5-HT 及5-HIAA 含量增加一定程度可降低中枢神经系统兴奋程度,而5-HT 含量降低是诱发大鼠失眠的重要因素之一[25,28]。目前已报道[29-30]的5-HT 受体有5-HT1-7R 七大类,其中5-HT1AR 与睡眠的关系最为密切,主要分布在动物下丘脑、海马、大脑皮层及杏仁核。5-HT1A受体蛋白属于G 蛋白偶联受体,5-HT1AR 偶联Gα(i)(G 蛋白αi/o亚基),双重调节腺苷酸环化酶(Adenylate cyclase,AC)活性,进而调节环一磷酸腺苷(cAMP)量,影响大脑调节情绪、唤醒等功能[13,31]。故而可基于5-HT1A/Gαi/o/cAMP 信号通路,研究黄连温胆汤对5-HT1A后信号通路的作用。从本研究结果看,实验中PCPA 失眠大鼠cAMP 含量明显下降,且5-HT1A受体蛋白与cAMP 之间受损呈正相关性关系,而黄连温胆汤可明显升高5-HT1A受体蛋白和cAMP 的含量,降低Gα(i)含量,且这种改善作用具有统计学意义。由此可见,黄连温胆汤可能通过升高大鼠下丘脑5-HT 及5-HIAA 递质含量,上调5-HT1A受体蛋白表达,下调Gα(i)表达来发挥调节睡眠的作用。
综上所述,黄连温胆汤可能通过调控血清BDNF和GFAP 水平,脑干及下丘脑中各种神经递质以及5-HT1A/Gαi/o/cAMP 信号通路来改善大鼠失眠症状,减轻大鼠焦虑及躁狂的状态,激发大鼠自发活动和空间探索能力。
