益气养阴祛瘀方对干燥综合征NOD 小鼠颌下腺AQP5、M3R表达的影响
2023-07-11任雅婷刘丹周东海王新昌浙江中医药大学第二临床医学院浙江杭州005浙江时迈药业有限公司浙江杭州005浙江中医药大学附属第二医院浙江杭州0005
任雅婷,刘丹,周东海,王新昌 (.浙江中医药大学第二临床医学院,浙江 杭州 005;.浙江时迈药业有限公司,浙江 杭州 005;.浙江中医药大学附属第二医院,浙江 杭州 0005)
干燥综合征(Sjogren syndrome,SS)是一种由外分泌腺进行性损伤导致其功能障碍,引起口、眼、鼻、咽、喉和阴道等主要黏膜表面干燥的慢性自身免疫性疾病[1]。目前干燥综合征的病因和发病机制尚不明确,西医治疗缺乏特异性靶向药物[2-3]。本课题组王新昌教授认为,干燥综合征的中医病因病机总属气虚、阴亏、血瘀为本,燥热为标,在治疗上以益气养阴祛瘀为总则,故选取生地黄、玄参、麦冬、石斛、白芍、黄芪、丹参、益母草8 味中药组成益气养阴祛瘀方。经多年临床观察[4-9]显示,其治疗干燥综合征的疗效确切,能明显改善患者口干、眼干等临床症状,降低疾病活动指数,减少糖皮质激素使用量,调节性激素水平,改善患者唾液腺免疫微环境和分泌功能。但益气养阴祛瘀方治疗干燥综合征的具体作用机制尚未得到明确阐释,故本研究拟选取经典的自发型干燥综合征模型NOD 小鼠作为疾病模型来探讨其作用机制,以期为其临床应用提供实验依据。
1 材料与方法
1.1 动物 8 周龄雌性NOD 小鼠30 只,SPF 级,体质量(20±2)g,北京华阜康生物科技股份有限公司提供,动物质量合格证号:110322220101356542,实验动物生产许可证号:SCXK(京)2019-0008。动物饲养于浙江中医药大学动物实验研究中心,实验动物使用许可证号:SYXK(浙)2021-0012。本实验已通过浙江中医药大学实验动物管理与伦理委员会审查,批准号:20201109-07。
1.2 药物及试剂 黄芪24 g(批号:210602)、石斛12 g(批号:190301)、生地黄24 g(批号:210601)、白芍12 g(批号:210601)、玄参15 g(批号:210601)、麦冬15 g(批号:200501)、丹参30 g(批号:200801)、益母草15 g(批号:201201),均由浙江中医药大学附属第二医院药剂科提供,经浙江中医药大学王新昌教授鉴定均为正品。将上述药材冷水浸泡1 h,常规煎煮2 次,每次1 h;2 次水煎液混合并过滤,经水浴蒸发浓缩至生药浓度1.11、2.22、4.44 g·mL-1。硫酸羟氯喹(阳性对照药,批号:H19990263),上海上药中西制药有限公司,用单蒸水溶解为6 mg·mL-1。上述药液均置于4 ℃冰箱保存。
PAGE 凝胶快速制备试剂盒(12.5%),上海雅酶生物医药科技有限公司,货号:PG113 升级版;BCA 蛋白浓度测定试剂盒,上海碧云天生物技术研究所,货号:P0010;强效RIPA 裂解液、5×蛋白上样缓冲液、 ECL 发光液,杭州弗德生物科技有限公司,批号分别为:FD009、FD002、FD8000;水通道蛋白5(AQP5)、毒蕈碱样胆碱能受体3(M3R)、β-actin 上下游引物,由上海生工生物工程有限公司合成;Trizol 试剂,美国Thermo Fisher 公司,批号:15596018;cDNA 合成试剂盒、PCR 扩增试剂盒,中国诺唯赞公司,批号分别为:FSQ-101、Q321-02;AQP5 兔多克隆抗体、β-actin 兔单克隆抗体、HRP 标记山羊抗兔IgG 二抗,美国CST 公司,批号分别为:59558S、4970S、7074S;M3R 兔多克隆抗体,美国NOVUS 公司,批号:NBP2-19444;白细胞介素10(IL-10)检测试剂盒、苏木素、伊红染液,杭州浩克生物科技有限公司,批号分别为:KE10008、HK2053、HK2051;干扰素γ(IFN-γ)检测试剂盒,杭州联科生物技术有限公司,批号:70-EK280HS-96。
1.3 主要仪器 NX50 型冷冻切片机,美国Thermo Fisher 公司;紫外分光光度仪,美国PE 公司;低温离心机,德国Eppendorf 公司;Odssey 扫膜仪,美国LI-COR 公司;LightCycler 480 型实时定量PCR 仪,瑞士Roche 公司;Mini-PROTEAN Tetra 电泳槽、转膜槽,美国Bio-Rad 公司;DYY-6C 型电泳仪电源,北京六一生物科技有限公司;数字病理切片扫描系统,日本滨松公司。
1.4 分组、给药及取材 将30 只NOD 小鼠随机分为5 组:模型组、西药组(硫酸羟氯喹60 mg·kg-1)及益气养阴祛瘀方低、中、高剂量组(11.147、22.295、44.590 g·kg-1),每组6 只。采用人与动物体表面积折算法计算给药剂量,益气养阴祛瘀方低、中、高剂量相当于临床等效剂量的1/2、1、2 倍。各组小鼠每日灌胃给药1 次,每次0.2 mL,连续给药8 周;模型组给予同等体积单蒸水灌胃。末次给药后,小鼠禁食24 h,眼球取血后,室温下静置30 min,以3 000 r·min-1(离心半径为8 cm)离心10 min,分离血清,于-80 ℃保存备用;小鼠脱颈处死,取双侧颌下腺,称定质量并记录;将每只小鼠的一侧颌下腺用4%多聚甲醛溶液固定,供HE 染色及免疫组化实验使用;另一侧颌下腺装入冻存管,于-80 ℃保存,用于Western Blot 及实时荧光定量PCR 检测。
1.5 小鼠饮水量测定 分别于给药后第0、4、8 周连续测量小鼠每日饮水量,以评价小鼠口干情况。计算:小鼠每日饮水量=(前1 日水瓶质量-当日水瓶质量)/小鼠只数,连续测量7 d。
1.6 颌下腺器官指数测定 处死前称定小鼠体质量,分离小鼠双侧颌下腺并称定其总质量,计算:小鼠颌下腺指数=小鼠双侧颌下腺质量(mg)/小鼠体质量(g)。
1.7 颌下腺组织病理学观察 取石蜡包埋的小鼠颌下腺组织,切片,行苏木素-伊红(HE)染色后脱水、封片。使用数字病理切片扫描系统阅片和采集图像,观察颌下腺组织病理学变化并进行灶性指数评分。计算每4 mm2的病灶数量即为灶性指数评分(FS)。
1.8 RT-qPCR 法检测小鼠颌下腺组织AQP5、M3R mRNA 表达水平 使用Trizol 法提取小鼠颌下腺组织样本总RNA;测定RNA 纯度(OD260/OD280在1.8~2.0 之间),获得RNA 浓度后使用试剂盒进行逆转录;得到样本cDNA 后上机进行PCR 扩增,反应程序:预变性95 ℃、3 s,变性95 ℃、10 s,退火60 ℃、30 s,共循环40 次。实验得到每个基因的Ct值,以β-actin 为内参基因,采用2-ΔΔCt法计算目的基因的相对表达量。引物序列见表1。

表1 RT-qPCR 引物序列Table 1 Primer sequences for RT-qPCR
1.9 Western Blot 法检测小鼠颌下腺组织AQP5、M3R 蛋白表达水平 取小鼠颌下腺组织,称定质量,加入含有1% PMSF 的RIPA 裂解液;剪碎,置于冰上充分裂解30 min,以12 000 r·min-1(离心半径8 cm)离心10 min;收集上清后用BCA 试剂盒定量蛋白浓度。通过SDS-PAGE 分离提取蛋白并用PVDF膜转膜;采用5%脱脂奶粉室温下封闭2 h;加入一抗AQP5(1∶1 000)、M3R(1∶1 000)后4 ℃下孵育过夜;洗膜后加入二抗(1∶5 000),室温下孵育2 h;采用ECL 法显色,扫描;使用Image Lab 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白的相对表达水平。
1.10 免疫组化法检测颌下腺组织AQP5 蛋白表达水平 取颌下腺组织石蜡切片,依次经过二甲苯脱蜡,乙醇水化,0.1 mol·L-1柠檬酸钠溶液(pH=6)修复,3%过氧化氢室温下孵育10 min;以山羊血清封闭30 min,加入一抗AQP5(1∶100)后4 ℃下孵育过夜;室温下二抗孵育10 min 后,DAB 显色,苏木素复染;封片,采用数字病理切片扫描系统阅片和采集图像;根据说明书判读阳性结果,使用Image Scope 软件进行图像分析,计算:阳性面积比值(%)=(阳性面积+强阳性面积)/(阴性面积+弱阳性面积+阳性面积+强阳性面积)×100%。
1.11 ELISA 法检测血清IFN-γ、IL-10 含量 采用双抗夹心ELISA 法检测小鼠血清IFN-γ、IL-10 含量,检测步骤按照试剂盒说明书进行。将50 μL 不同梯度浓度的标准品及稀释5 倍后的血清样本分别加入预先包被IFN-γ、IL-10 抗体的酶标板上;再向每孔中加入100 μL 经辣根过氧化物酶标记的检测抗体,37 ℃下育温1 h 后洗板5 次;向每孔中分别加入50 μL 显色底物A、B,并在37 ℃下避光显色;待标准品孔出现较明显的蓝色梯度时即加入终止液,立即在450 nm 波长下测定光密度(OD)值;IFN-γ、IL-10 含量与OD 值呈正相关,通过绘制标准曲线方程及稀释倍数计算样本中IFN-γ、IL-10 的含量。
1.12 统计学处理方法 采用SPSS 25.0 及GraphPad Prism 9.0 统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 益气养阴祛瘀方对NOD 小鼠饮水量的影响 结果见表2。给药前,与模型组比较,益气养阴祛瘀方低、中、高剂量组及西药组NOD 小鼠的日饮水量无明显变化,差异无统计学意义(P>0.05);给药第4、8 周,与模型组比较,益气养阴祛瘀方低、中、高剂量组及西药组NOD 小鼠的日饮水量均显著减少,差异有统计学意义(P<0.01)。结果表明,益气养阴祛瘀方能够改善NOD 小鼠的口干症状。
表2 益气养阴祛瘀方(YP)对NOD 小鼠饮水量的影响(±s,n=6)Table 2 Effect of Yiqi Yangyin Quyu Prescription(YP)on the water intake in NOD mice(±s,n=6)
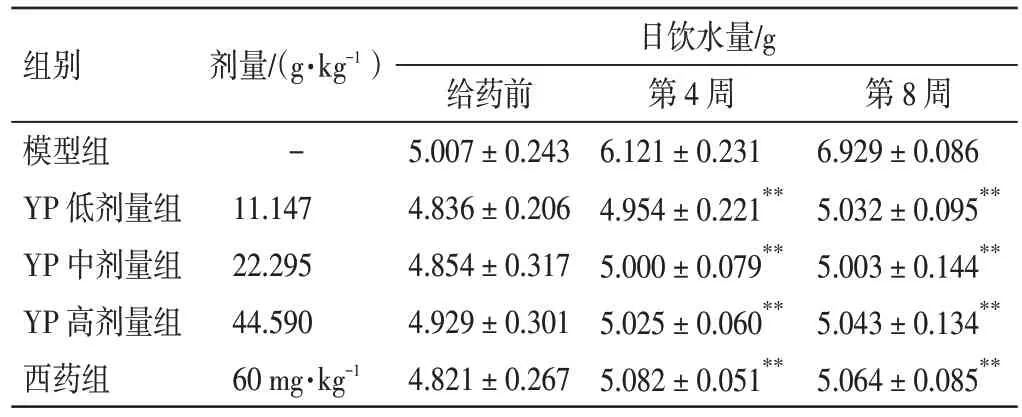
表2 益气养阴祛瘀方(YP)对NOD 小鼠饮水量的影响(±s,n=6)Table 2 Effect of Yiqi Yangyin Quyu Prescription(YP)on the water intake in NOD mice(±s,n=6)
注:与模型组比较,**P<0.01
组别模型组YP 低剂量组YP 中剂量组YP 高剂量组西药组剂量/(g·kg-1)-11.147 22.295 44.590 60 mg·kg-1日饮水量/g给药前5.007±0.243 4.836±0.206 4.854±0.317 4.929±0.301 4.821±0.267第4 周6.121±0.231 4.954±0.221**5.000±0.079**5.025±0.060**5.082±0.051**第8 周6.929±0.086 5.032±0.095**5.003±0.144**5.043±0.134**5.064±0.085**
2.2 益气养阴祛瘀方对NOD 小鼠颌下腺指数的影响 结果见表3。与模型组比较,益气养阴祛瘀方高剂量组和西药组NOD 小鼠的颌下腺指数明显升高,差异有统计学意义(P<0.05)。
表3 益气养阴祛瘀方(YP)对NOD 小鼠颌下腺指数及灶性指数评分的影响(±s,n=6)Table 3 Effects of Yiqi Yangyin Quyu Prescription(YP)on the salivary gland index and focal index score in NOD mice(±s,n=6)
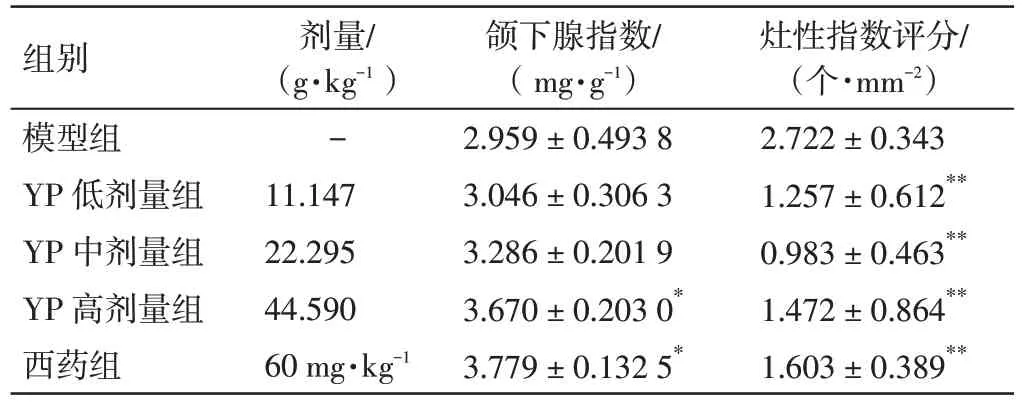
表3 益气养阴祛瘀方(YP)对NOD 小鼠颌下腺指数及灶性指数评分的影响(±s,n=6)Table 3 Effects of Yiqi Yangyin Quyu Prescription(YP)on the salivary gland index and focal index score in NOD mice(±s,n=6)
注:与模型组比较,*P<0.05,**P<0.01
组别模型组YP 低剂量组YP 中剂量组YP 高剂量组西药组剂量/(g·kg-1)-11.147 22.295 44.590 60 mg·kg-1颌下腺指数/(mg·g-1)2.959±0.493 8 3.046±0.306 3 3.286±0.201 9 3.670±0.203 0*3.779±0.132 5*灶性指数评分/(个·mm-2)2.722±0.343 1.257±0.612**0.983±0.463**1.472±0.864**1.603±0.389**
2.3 益气养阴祛瘀方对NOD 小鼠颌下腺组织病理变化的影响 结果见表3、图1。模型组小鼠颌下腺淋巴细胞浸润明显并形成较多浸润灶,腺管排列紊乱、周围出现纤维化,腺泡萎缩、大小不一。与模型组比较,益气养阴祛瘀方低、中、高剂量组及西药组NOD 小鼠的颌下腺淋巴细胞浸润情况得到明显改善,浸润灶数量明显减少,灶性指数评分显著降低,差异具有统计学意义(P<0.01)。结果表明,益气养阴祛瘀方能够有效改善NOD 小鼠颌下腺的病理损伤。
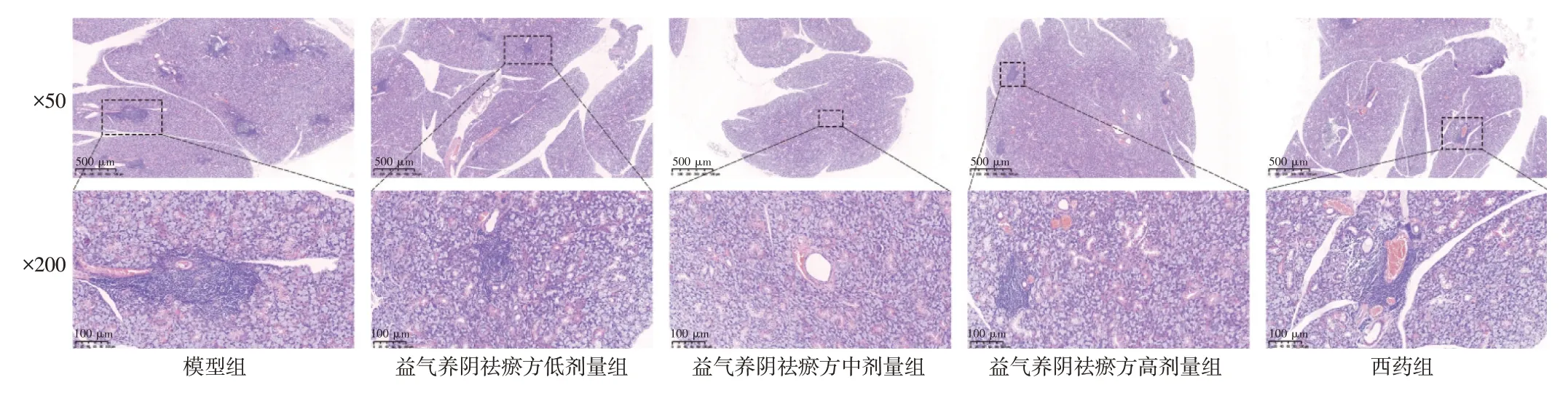
图1 益气养阴祛瘀方对NOD 小鼠颌下腺组织病理变化的影响(HE 染色)Figure 1 Effects of Yiqi Yangyin Quyu Prescription on histopathological changes of salivary gland in NOD mice(HE staining)
2.4 益气养阴祛瘀方对NOD 小鼠颌下腺组织AQP5、M3R mRNA 表达水平的影响 结果见表4。与模型组比较,益气养阴祛瘀方中、高剂量组和西药组NOD 小鼠颌下腺组织AQP5、M3R mRNA 表达明显上调,差异有统计学意义(P<0.05,P<0.01)。
表4 益气养阴祛瘀方(YP)对NOD 小鼠颌下腺组织AQP5、M3R mRNA 表达水平的影响(±s,n=6)Table 4 Effects of Yiqi Yangyin Quyu Prescription(YP)on the mRNA expressions of AQP5 and M3R in salivary gland of NOD mice(±s,n=6)
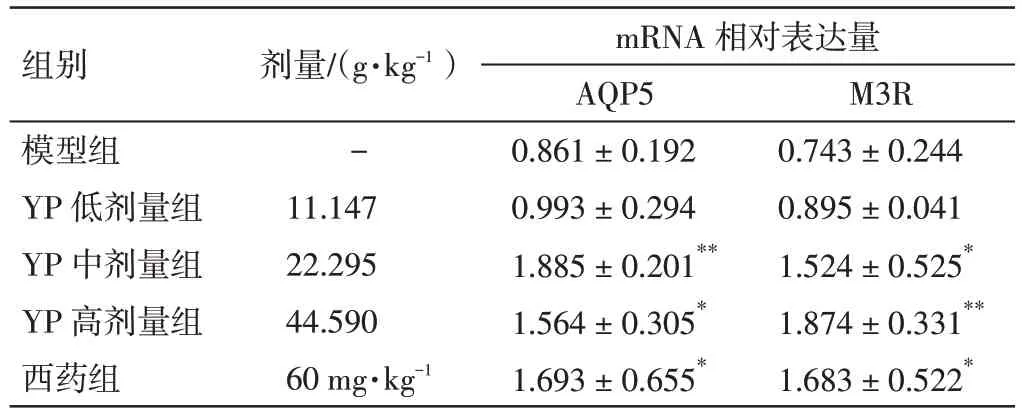
表4 益气养阴祛瘀方(YP)对NOD 小鼠颌下腺组织AQP5、M3R mRNA 表达水平的影响(±s,n=6)Table 4 Effects of Yiqi Yangyin Quyu Prescription(YP)on the mRNA expressions of AQP5 and M3R in salivary gland of NOD mice(±s,n=6)
注:与模型组比较,*P<0.05,**P<0.01
组别模型组YP 低剂量组YP 中剂量组YP 高剂量组西药组剂量/(g·kg-1)-11.147 22.295 44.590 60 mg·kg-1 mRNA 相对表达量AQP5 0.861±0.192 0.993±0.294 1.885±0.201**1.564±0.305*1.693±0.655*M3R 0.743±0.244 0.895±0.041 1.524±0.525*1.874±0.331**1.683±0.522*
2.5 益气养阴祛瘀方对NOD 小鼠颌下腺组织AQP5、M3R 蛋白表达的影响 结果见图2。与模型组比较,益气养阴祛瘀方低、中、高剂量组及西药组NOD 小鼠颌下腺组织AQP5、M3R 蛋白表达水平明显升高,差异有统计学意义(P<0.05,P<0.01)。结果表明,益气养阴祛瘀方能够有效上调NOD 小鼠颌下腺组织AQP5、M3R 蛋白表达水平。
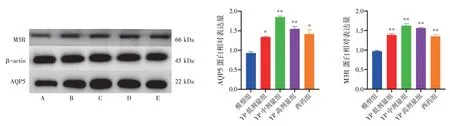
图2 益气养阴祛瘀方(YP)对NOD 小鼠颌下腺组织AQP5、M3R 蛋白表达水平的影响(±s,n=6)Figure 2 Effects of Yiqi Yangyin Quyu Prescription(YP)on the protein expressions of AQP5 and M3R in salivary gland of NOD mice(±s,n=6)
2.6 益气养阴祛瘀方对NOD 小鼠颌下腺组织中AQP5 蛋白表达的影响 结果见图3、表5。与模型组比较,益气养阴祛瘀方低、中、高剂量组及西药组NOD 小鼠颌下腺组织AQP5 蛋白表达量明显升高,差异有统计学意义(P<0.05,P<0.01)。
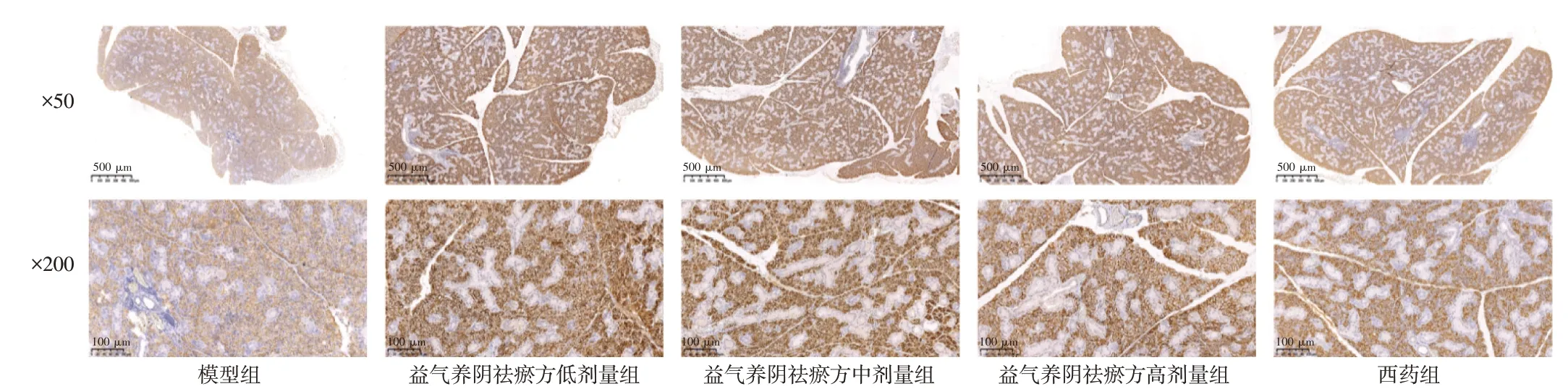
图3 益气养阴祛瘀方对NOD 小鼠颌下腺组织AQP5 蛋白表达水平的影响(免疫组化)Figure 3 Effect of Yiqi Yangyin Quyu Prescription on the protein expression of AQP5 in salivary gland of NOD mice(IHC)
表5 益气养阴祛瘀方(YP)对NOD 小鼠颌下腺组织AQP5蛋白表达水平的影响(±s,n=6)Table 5 Effect of Yiqi Yangyin Quyu Prescription(YP)on the protein expression of AQP5 in salivary gland of NOD mice(±s,n=6)
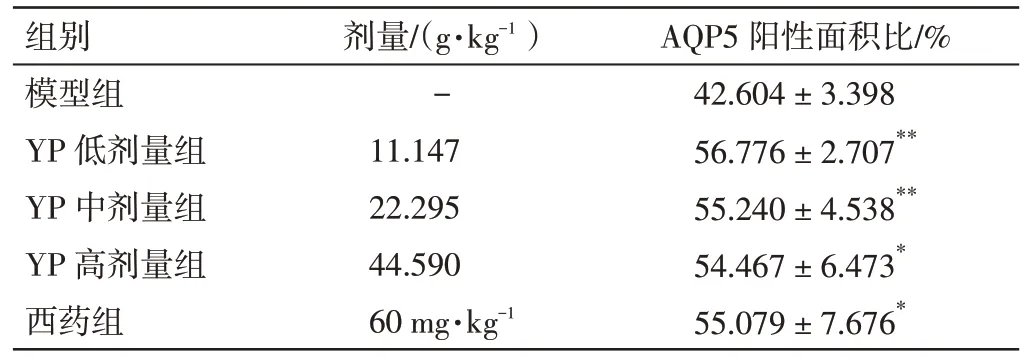
表5 益气养阴祛瘀方(YP)对NOD 小鼠颌下腺组织AQP5蛋白表达水平的影响(±s,n=6)Table 5 Effect of Yiqi Yangyin Quyu Prescription(YP)on the protein expression of AQP5 in salivary gland of NOD mice(±s,n=6)
注:与模型组比较,*P<0.05,**P<0.01
组别模型组YP 低剂量组YP 中剂量组YP 高剂量组西药组剂量/(g·kg-1)-11.147 22.295 44.590 60 mg·kg-1 AQP5 阳性面积比/%42.604±3.398 56.776±2.707**55.240±4.538**54.467±6.473*55.079±7.676*
2.7 益气养阴祛瘀方对NOD 小鼠血清IFN-γ、IL-10水平的影响 结果见表6。与模型组比较,益气养阴祛瘀方中、高剂量组和西药组NOD 小鼠的血清IFN-γ含量显著降低(P<0.01),益气养阴祛瘀方低、中、高剂量组和西药组NOD 小鼠的血清IL-10 水平明显升高,差异有统计学意义(P<0.05,P<0.01)。结果表明,益气养阴祛瘀方能够提高NOD 小鼠的免疫水平。
表6 益气养阴祛瘀方(YP)对NOD 小鼠血清IFN-γ、IL-10水平的影响(±s,n=6)Figure 6 Effects of Yiqi Yangyin Quyu Prescription(YP)on the levels of IFN-γ and IL-10 in serum of NOD mice(±s,n=6)
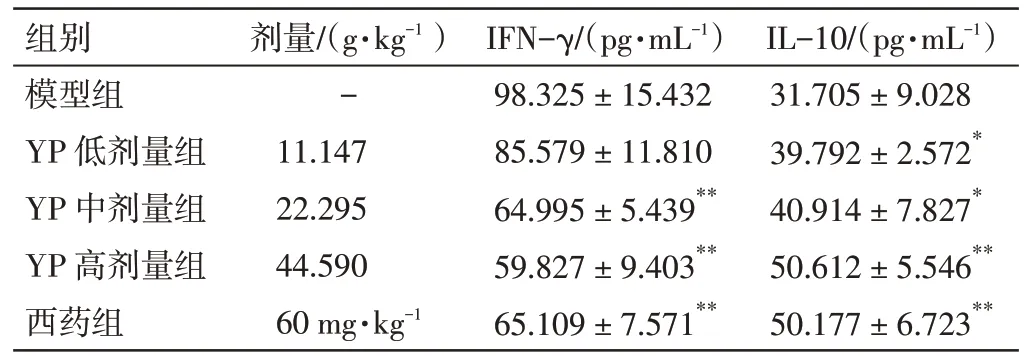
表6 益气养阴祛瘀方(YP)对NOD 小鼠血清IFN-γ、IL-10水平的影响(±s,n=6)Figure 6 Effects of Yiqi Yangyin Quyu Prescription(YP)on the levels of IFN-γ and IL-10 in serum of NOD mice(±s,n=6)
注:与模型组比较,*P<0.05,**P<0.01
组别模型组YP 低剂量组YP 中剂量组YP 高剂量组西药组剂量/(g·kg-1)-11.147 22.295 44.590 60 mg·kg-1 IFN-γ/(pg·mL-1)98.325±15.432 85.579±11.810 64.995±5.439**59.827±9.403**65.109±7.571**IL-10/(pg·mL-1)31.705±9.028 39.792±2.572*40.914±7.827*50.612±5.546**50.177±6.723**
3 讨论
根据干燥综合征的临床表现,中医将其归于“燥痹”范畴。《素问·至真要大论》曰:“燥胜则干”,先天禀赋不足者伤于内外燥邪,致使气血津液受损,出现口干、眼干、低热、乏力等症状;气虚津亏者血行不畅,发为血瘀,故肌肤枯涩,肢节疼痛,血瘀又致气津的生成与输布异常,“气虚”“阴亏”“血瘀”三者相互胶着,导致疾病更甚,缠绵难愈,久病则脏腑受损[10]。益气养阴祛瘀方是本课题组基于中医对干燥综合征的认识而拟定的经验方,方中黄芪补气升阳、生津养血,丹参、益母草、白芍活血养血、祛瘀通经。“气为血之帅,血为气之母”,气能生血、行血、摄血,血能养气、载气,方中益气祛瘀双法并用,益气则营血调达,祛瘀则血行气行;且“水化于气”,气能生津、行津、摄津,益气则精微得以化生,津液输布全身;再配养阴之品生地黄、玄参、麦冬、石斛润燥生津,诸药合用,共奏益气养阴祛瘀之功,则燥证自愈。
干燥综合征的唾液腺免疫微环境异常是导致其分泌功能下降而造成口干的最主要原因,调节唾液腺局部免疫、炎症反应可以改善其分泌功能[10]。研究[11-13]发现,AQP5、M3R 与唾液腺分泌功能密切相关。AQP5 是分布于唾液腺腺泡细胞的水通道蛋白,参与唾液的分泌、吸收及渗透[12]。M3R 是一种G 蛋白耦联的乙酰胆碱受体,在乙酰胆碱刺激下,能增加唾液腺腺泡细胞内的钙离子转运,激活氯离子通道,介导AQP5 从细胞内转移到细胞顶端质膜,从而增加唾液的分泌[13-14]。唾液腺损伤导致的分泌功能减退是干燥综合征疾病过程中的重要病理特征。研究[15-16]表明,IFN-γ 和IL-10 是导致干燥综合征唾液腺组织炎症损伤的重要因素。IFN-γ 主要由Th1 细胞产生,与IFN-γ 受体结合后IFN-γ 信号基因被诱导激活,促进炎症和组织损伤[17],间接影响AQP5、M3R 蛋白的表达。Zhou J 等[18]通过对实验小鼠颌下腺局部施以外源性IFN-γ 干预,导致唾液分泌功能受损,并伴随AQP5 表达下调和抗M3R 自身抗体增加,而IFN-γ 中和则可显著调节AQP5 表达,改善小鼠的唾液分泌功能。IL-10 是一种多效性细胞因子,由Treg 细胞产生,通过抑制Th1 细胞的极化、下调促炎细胞因子的产生等方式发挥抗炎作用[19]。Jing J 等[20]研究发现,与健康人群相比,原发性干燥综合征患者的IL-10 和CD4+IL-10+T 细胞水平明显降低。本课题组前期临床研究[4-9]表明,益气养阴祛瘀方对干燥综合征患者的干燥症状治疗效果显著,能够下调IgG、IgA 水平,降低TLR9、IFN-α 等炎症因子表达,有效改善唾液腺血流动力学指标。本研究在前期基础上,以NOD 小鼠为研究对象,进一步探究了益气养阴祛瘀方改善干燥综合征唾液腺分泌功能与纠正整体免疫炎症失调的相关机制。结果表明,益气养阴祛瘀方能有效减少NOD 小鼠颌下腺淋巴细胞浸润,降低灶性指数评分,改善颌下腺组织病理损伤,上调小鼠颌下腺AQP5 和M3R 的表达水平,同时降低血清中炎症因子IFN-γ 水平,升高抗炎因子IL-10 水平,调整机体免疫炎症平衡。
综上所述,益气养阴祛瘀方对干燥综合征唾液腺损伤具有较好的治疗作用,可以显著减少颌下腺淋巴细胞浸润,上调AQP5 和M3R 表达,增加水分子转运来恢复唾液分泌功能,进而改善口干症状,同时降低血清炎症因子水平,并提升抗炎因子表达,纠正整体免疫炎症失调状态。但由于干燥综合征免疫机制复杂,益气养阴祛瘀方发挥作用的明确上下游机制仍有待进一步研究。
