葛根芩连汤含药血清对缺氧诱导HepG2 肝癌细胞糖代谢的影响及机制研究
2023-07-11许清松彭程程李冰涛张启云姜丽李佳李洋曾治君徐国良江西中医药大学中医基础理论分化发展研究中心江西南昌33000江西省中医病因生物学重点实验室江西南昌33000江西省中药药理重点实验室江西南昌33000江西中医药大学药学院江西南昌33000江西中医药大学岐黄国医书院江西南昌33000
许清松,彭程程,李冰涛,2,3,张启云,2,3,姜丽,2,3,李佳,李洋,曾治君,2,3,徐国良,2,3(.江西中医药大学中医基础理论分化发展研究中心,江西 南昌 33000;2.江西省中医病因生物学重点实验室,江西 南昌 33000;3.江西省中药药理重点实验室,江西 南昌 33000;.江西中医药大学药学院,江西 南昌 33000;.江西中医药大学岐黄国医书院,江西 南昌 33000)
2 型糖尿病(T2DM)是以胰岛素分泌不足或胰岛素抵抗(IR)为病理基础的慢性代谢性疾病,属中医“脾瘅”“消渴”“肥胖”等范畴[1-2]。葛根芩连汤(GQD)源自张仲景的《伤寒论》,由葛根、黄芩、黄连、甘草4 味中药组成,具有清热燥湿功效,主治协热下利,临床上被广泛应用于T2DM 的治疗[3-4]。GQD 的降糖机制主要与其改善IR、调节糖脂代谢、抗炎、抗氧化、调节肠道菌群等有关[5-7]。研究发现,肥胖及代谢综合征患者存在慢性组织缺氧并且与IR 密切相关[8-9];间歇性缺氧可降低小鼠全身胰岛素敏感性,增加IR 的发生风险[10-11]。缺氧可能是周身IR 形成的重要因素[12]。也有研究[13]发现,缺氧现象迟于糖耐量异常和IR 的出现,缺氧可能不是IR的启动因素,但缺氧对糖代谢的影响值得深入探讨。HepG2 肝癌细胞具有类似正常肝细胞的代谢功能,被广泛用于糖尿病药物筛选及其分子机制研究[7]。故本研究拟采用缺氧诱导HepG2 细胞糖代谢紊乱,观察GQD 含药血清对其的影响,并采用代谢组学方法探讨相关作用机制[14],以期阐明缺氧与细胞糖代谢的关系及GQD 的干预机制。
1 材料与方法
1.1 细胞及动物 HepG2 肝癌细胞,由南昌大学重点实验室惠赠。4~5 周龄雄性SD 大鼠50 只,SPF 级,体质量(180±20)g,由江西中医药大学实验动物科技中心提供,实验动物生产许可证号:SCXK(赣)2018-003。动物实验经江西中医药大学实验动物伦理委员会审批,伦理批准文号:JZLLSC20220503。
1.2 药物及试剂 葛根(批号:180124)、黄芩(批号:171215)、黄连(批号:180131)、炙甘草(批号:171214),均购自江西江中中药饮片有限公司,符合《中华人民共和国药典》标准。将葛根、黄芩、黄连、甘草4 味药材按照8∶3∶3∶2 的比例称取,加入8 倍量的水浸泡30 min 后,微沸煎煮60 min,减压浓缩,得生药浓度为1.5 g·mL-1的GQD 汤剂[15]。
DMEM 高糖培养基,北京索莱宝有限公司,批号: 20201030; 0.25% 胰蛋白酶- EDTA, 美国Genview 公司,批号:09280101100;胎牛血清,上海碧艾生物科技有限公司,批号:2033119;Cell Counting Kit-8(CCK-8),北京博奥森生物技术有限公司,批号:BJ05203090;PBS 磷酸盐缓冲液(粉剂),南昌鼎国昌盛有限公司,批号:90M001140;葡萄糖测定试剂盒,南京建成生物工程研究所,批号:20201003137;盐酸二甲双胍,上海麦克林生物科技有限公司,批号:M90518060;甲醇(色谱纯),美国Dikma Pure 公司,批号:9287472;甲酸(色谱纯),上海迪马科技发展有限公司,批号:2486917;乙腈(色谱纯),德国默克公司,批号:WXBD3817V。
1.3 主要仪器 CKX41 型倒置显微镜,日本Olympus公司;Smartor118 型移动式三气培养箱,宁波华仪宁创有限公司;Max Plus384 型全波长酶标仪,美国Spectra 公司;R1001-VN 型旋转蒸发仪,郑州长城科工贸有限公司;3111 型CO2培养箱、SPD131DDAP1-230 型离心浓缩系统、SL8R 型台式高速冷冻离心机、LYNX6000 型高速冷冻离心机,美国Thermo Fisher 科技公司;Waters Acquity UPLC 液相色谱系统、Q-TOF SYNAPT G2-Si 质谱仪,美国Waters公司。
1.4 GQD 含药血清制备[16]将雄性SD 大鼠适应性饲养1 周后,随机分为GQD 含药血清组及正常组,每组各25 只;每日分别灌胃25 g·kg-1GQD 汤剂或等量生理盐水,给药体积为16.7 mL·kg-1,每日分2 次灌胃,连续7 d。末次给药前12 h 禁食不禁水,给药1 h 后麻醉大鼠,腹主动脉取血,室温下静置2 h,4 ℃下以3 500 r·min-1(离心半径为13.8 cm)离心15 min,将血清分装于2 mL 冻存管,-80 ℃保存。
1.5 HepG2 肝癌细胞缺氧模型复制 将复苏后的HepG2 细胞置于含10%胎牛血清的DMEM 完全培养基中培养,待细胞传代3 次后,选择生长状态良好的细胞进行实验。细胞设置正常组和缺氧组,每组分别设置6 个复孔。正常组细胞置于37 ℃、CO2培养箱中。缺氧组细胞置于移动式三气培养箱中培养,达到缺氧条件(94% N2、5% CO2、1% O2)则开始计时。(1)分别选取5 个缺氧时间点(6、12、18、24、48 h),吸取10 μL 细胞上清液与葡萄糖试剂充分混匀;37 ℃下恒温孵育10 min 后再次混匀,吸取200 μL 混合溶液,在波长505 nm 处测定光密度(OD)值;依据试剂盒说明书方法计算细胞葡萄糖消耗量。(2)在上述5 个缺氧时间点,分别于接种细胞的96 孔板中加入110 μL 的DMEM 与CCK-8 混合液(10∶1),37 ℃下孵育1 h,在波长450 nm 处测定其OD 值,比较细胞活力。通过考察不同缺氧时间对HepG2 细胞葡萄糖消耗量和细胞活力的影响,以2 组细胞葡萄糖消耗量差异有统计学意义作为模型复制成功的标准,并确定最佳缺氧时间。
1.6 分组及GQD 含药血清干预[16]将HepG2 细胞按50×104个·mL-1的密度接种于6 孔板中,每孔2 mL;设置正常组、模型组、二甲双胍组及葛根芩连汤含药血清低、中、高剂量组,在含2% FBS 的DMEM完全培养基中培养。正常组置于常氧环境,模型组及各给药组置于1% O2缺氧环境,且每组分别设置6 个复孔。干预条件如下,正常组:15%空白血清;模型组:15%空白血清;二甲双胍组:15%空白血清+2 mmol·L-1二甲双胍;葛根芩连汤含药血清低剂量组:5% GQD 含药血清+10%空白血清;葛根芩连汤含药血清中剂量组:10% GQD 含药血清+5%空白血清;葛根芩连汤含药血清高剂量组:15% GQD 含药血清。按照“1.5”项下方法检测缺氧18 h 后各组细胞的葡萄糖消耗量及细胞活力。
1.7 细胞样品制备[7]给药干预18 h 后,各组细胞用胰蛋白酶消化后离心;收集细胞,在液氮中反复冻融破裂细胞2 次;加入-80 ℃的80%甲醇-水溶液0.5 mL,涡旋5 min;4 ℃下静置2 h,以4 ℃、15 000 r·min-1(离心半径为8.5 cm)离心10 min,取上清液真空浓缩;加入200 μL 15%甲醇-水溶液复溶,震荡5 min,以4 ℃、15 000 r·min-1(离心半径为8.5 cm)离心10 min,取上清液进行样品分析。
1.8 样品分析 色谱条件:Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);柱温:40 ℃;样品室温度:10 ℃;流速:0.3 mL·min-1;进样量:2 μL;流动相A 为0.1%甲酸水,流动相B 为乙腈;梯度洗脱条件:0~2 min,99% A;2~15 min,99%~64% A;15~18 min,64%~40% A;18~20 min,40%~20% A; 20~22 min, 20% A; 22~24 min,20%~99% A。
质谱条件:电离源温度为100 ℃;锥孔气流速为50 L·h-1;去溶剂气温度为400 ℃,流速为800 L·h-1。正离子扫描模式下毛细管电压为3.5 kV,负离子扫描模式下毛细管电压为2.5 kV,锥孔电压均为40 V;正离子模式下提取锥孔电压为80 V;负离子模式下补偿电压为80 V。采集质量数范围为50~1 000 Da。采用甲酸钠标准品建立质量轴标准曲线,并利用亮氨酸脑啡肽进行实时质量校正。串联质谱碰撞气为氩气,低碰撞能为4 eV,高碰撞能为20~40 eV。
本实验使用质控样品(QC)进行方法验证,QC 样品由每个样品各取10 μL 混合而得。同一模式下,批检测时随机进行,减少误差。在进样检测前先运行5 次QC 样品平衡仪器,在检测分析过程中使用QC 样品进行稳定性考察,以确保仪器检测过程中的稳定性,同时还需在每检测8 个样品后运行一次QC样品平衡系统。
1.9 统计学处理方法及代谢组学数据分析[17]采用GraphPad Prism 8.0 统计软件进行数据分析;计量资料以均数± 标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA);两组间比较采用t检验;以P<0.05 为差异有统计学意义。
采用超高效液相色谱-四级杆-飞行时间质谱(UPLC-Q-TOF-MS)联用技术采集样品信息,得到样品的总离子流图;通过Progenesis QI 软件对采集得到的图谱进行峰提取、峰对齐、峰匹配和峰强度校正等处理,得到包含化合物保留时间(RT)、质荷比(m/z)及峰面积(Area)等质谱信息。应用SIMCA 14.1软件进行正交偏最小二乘法判别分析(OPLS-DA),根据变量重要性投影(VIP)值>1、Fold-Change≥1.3或≤0.77 及P<0.05 筛选差异变量;通过HMDB(https://hmdb.ca) 、 KEGG (https://www.genome.jp/kegg/)在线数据库中进行代谢物鉴定,以确定GQD含药血清干预缺氧诱导HepG2 肝癌细胞的潜在生物标志物;最后,通过Metabo Analyst 5.0(https://www.metaboanalyst.ca)网站进行潜在生物标志物代谢通路分析。
2 结果
2.1 不同缺氧时间对HepG2 细胞葡萄糖消耗量及细胞活力的影响 结果见图1。与正常组比较,模型组HepG2 细胞缺氧12、18 h 的葡萄糖消耗量显著降低(P<0.01),缺氧24、48 h 的葡萄糖消耗量显著增多(P<0.01),缺氧6、12、18、24 h 的细胞活力无明显变化(P>0.05),缺氧48 h 的细胞活力显著升高(P<0.01)。故在1% O2环境下,确定缺氧18 h 作为HepG2 细胞的模型复制时间。
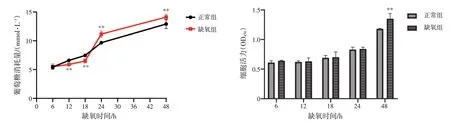
图1 不同缺氧时间对HepG2 细胞葡萄糖消耗量及细胞活力的影响(±s,n=6)Figure 1 Effects of different hypoxia time on glucose consumption and cell viability of HepG2 cells(±s,n=6)
2.2 GQD 含药血清对缺氧诱导HepG2 细胞葡萄糖消耗量及细胞活力的影响 结果见图2。与正常组比较,模型组HepG2 细胞的葡萄糖消耗量显著降低(P<0.01);与模型组比较,葛根芩连汤含药血清低、中、高剂量组HepG2 细胞的葡萄糖消耗量明显升高(P<0.05,P<0.01)。缺氧18 h,各组间的HepG2细胞活力无明显变化(P>0.05)。结果表明,GQD 含药血清能有效改善缺氧诱导HepG2 细胞的葡萄糖消耗量降低。
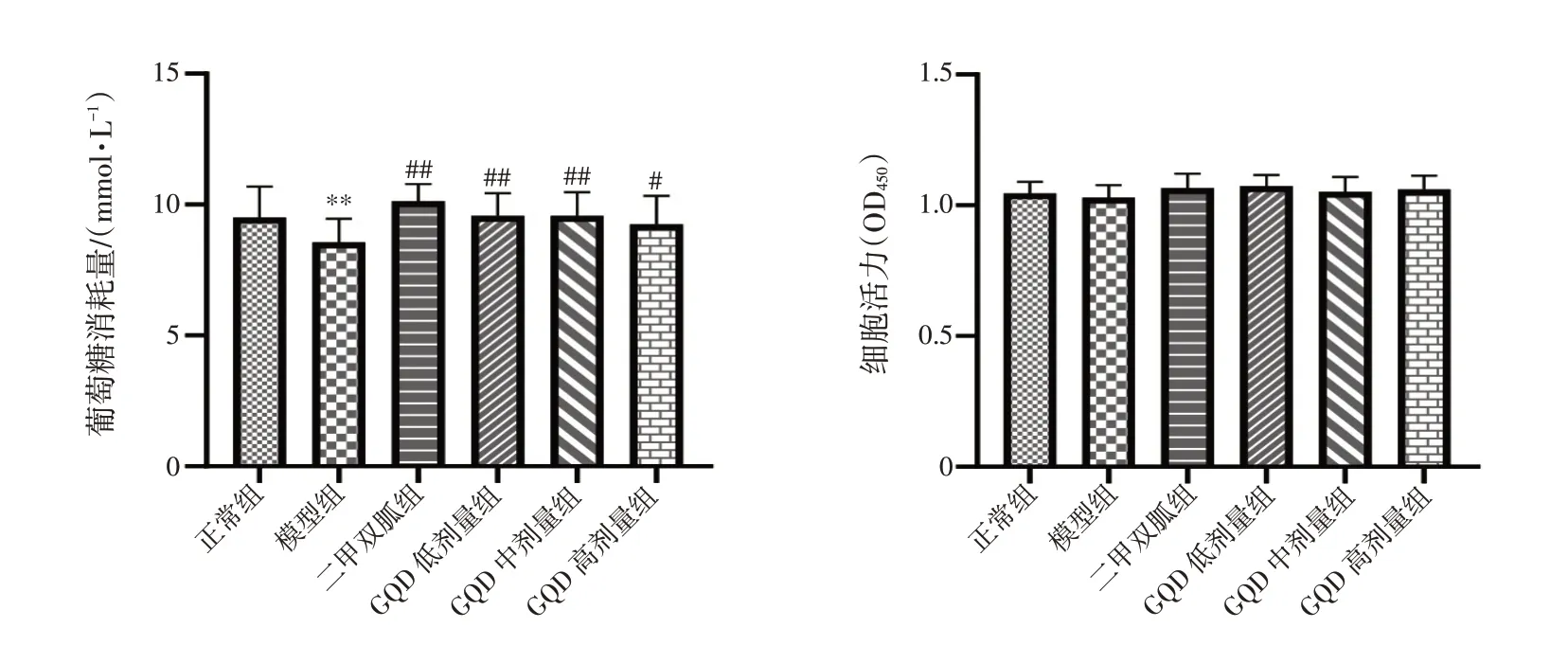
图2 葛根芩连汤(GQD)含药血清对缺氧诱导HepG2 细胞葡萄糖消耗量及细胞活力的影响(±s,n=6)Figure 2 Effects of Gegen Qinlian Decoction(GQD)-containing serum on glucose consumption and cell viability of hypoxia-induced HepG2 cells(±s,n=6)
2.3 GQD 含药血清干预缺氧诱导HepG2 细胞的代谢组学分析
2.3.1 细胞代谢轮廓分析 正、负离子模式下的总离子流图见图3。结果表明,经过峰提取、峰对齐、峰匹配和峰强度校正等处理后,各组细胞样品的UPLC-Q-TOF-MS 总离子流图轮廓基本相似,但峰响应值存在差异。
2.3.2 数据质控 基于代谢物的峰面积来计算QC 样品数据间的Pearson 相关性系数(R),范围为-1~1,QC 样品之间的相关性越高(R2越接近于1),说明在整个检测过程中稳定性越好,数据质量越高。通过3 次QC 样本数据分析得到R2在正、负离子模式下均大于0.99,结果表明仪器的稳定性较好,数据质量较高,该方法适用于检测细胞内源性物质的变化。
2.3.3 OPLS-DA 分析结果 对正常组、模型组的细胞代谢轮廓进行OPLS-DA 分析,得到正、负离子模式下的OPLS-DA 得分图(见图4-A、图4-B),结果表明正常组和模型组细胞代谢轮廓明显分离,提示缺氧诱导HepG2 细胞出现明显的代谢紊乱。对OPLS-DA模型进行验证(见图4-C、图4-D),通过重复200 次排列置换检验,Q2的回归线在纵坐标上的截距小于0,表明模型具有高度的稳健性,不存在过拟合现象。对正常组、模型组及葛根芩连汤含药血清低、中、高剂量组的细胞代谢轮廓进行OPLS-DA 分析(见图4-E、图4-F),葛根芩连汤含药血清各剂量组细胞的代谢轮廓相对远离模型组,且向正常组靠近。结果表明,葛根芩连汤含药血清可明显回调由于缺氧导致葡萄糖消耗量降低的HepG2 细胞代谢轮廓趋于正常状态。

图4 葛根芩连汤(GQD)含药血清干预缺氧诱导HepG2 细胞的OPLS-DA 分析结果Figure 4 OPLS-DA analysis of Gegen Qinlian Decoction(GQD)-containing serum intervened hypoxia-induced HepG2 cells
2.3.4 GQD 含药血清干预缺氧诱导HepG2 细胞的潜在生物标志物 结果见表1。共鉴定出缺氧诱导HepG2 肝癌细胞的潜在生物标志物12 个,其中1 个生物标志物含量显著上升,11 个生物标志物含量显著下降,而GQD 含药血清干预可使上述生物标志物明显回调。
表1 葛根芩连汤(GQD)含药血清对缺氧诱导HepG2 细胞潜在生物标志物的影响(±s,n=6)Table 1 Effects of Gegen Qinlian Decoction(GQD)-containing serum on potential biomarkers of hypoxia-induced HepG2 cells(±s,n=6)
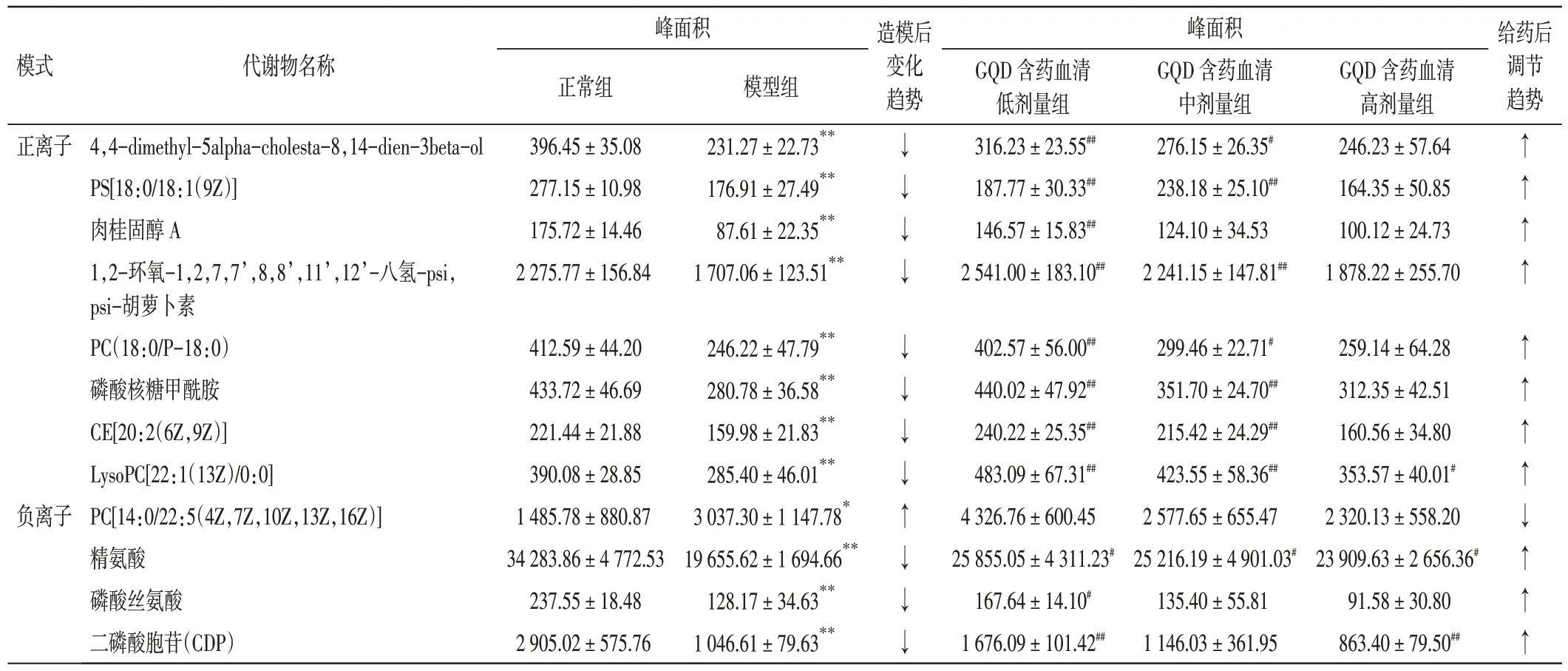
表1 葛根芩连汤(GQD)含药血清对缺氧诱导HepG2 细胞潜在生物标志物的影响(±s,n=6)Table 1 Effects of Gegen Qinlian Decoction(GQD)-containing serum on potential biomarkers of hypoxia-induced HepG2 cells(±s,n=6)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。↓:下降;↑:升高
模式正离子负离子代谢物名称4,4-dimethyl-5alpha-cholesta-8,14-dien-3beta-ol PS[18:0/18:1(9Z)]肉桂固醇A 1,2-环氧-1,2,7,7’,8,8’,11’,12’-八氢-psi,psi-胡萝卜素PC(18:0/P-18:0)磷酸核糖甲酰胺CE[20:2(6Z,9Z)]LysoPC[22:1(13Z)/0:0]PC[14:0/22:5(4Z,7Z,10Z,13Z,16Z)]精氨酸磷酸丝氨酸二磷酸胞苷(CDP)峰面积正常组396.45±35.08 277.15±10.98 175.72±14.46 2 275.77±156.84 412.59±44.20 433.72±46.69 221.44±21.88 390.08±28.85 1 485.78±880.87 34 283.86±4 772.53 237.55±18.48 2 905.02±575.76模型组231.27±22.73**176.91±27.49**87.61±22.35**1 707.06±123.51**246.22±47.79**280.78±36.58**159.98±21.83**285.40±46.01**3 037.30±1 147.78*19 655.62±1 694.66**128.17±34.63**1 046.61±79.63**造模后变化趋势↓↓↓↓↓↓↓↓↑↓↓↓峰面积GQD 含药血清低剂量组316.23±23.55##187.77±30.33##146.57±15.83##2 541.00±183.10##402.57±56.00##440.02±47.92##240.22±25.35##483.09±67.31##4 326.76±600.45 25 855.05±4 311.23#167.64±14.10#1 676.09±101.42##GQD 含药血清中剂量组276.15±26.35#238.18±25.10##124.10±34.53 2 241.15±147.81##299.46±22.71#351.70±24.70##215.42±24.29##423.55±58.36##2 577.65±655.47 25 216.19±4 901.03#135.40±55.81 1 146.03±361.95 GQD 含药血清高剂量组246.23±57.64 164.35±50.85 100.12±24.73 1 878.22±255.70 259.14±64.28 312.35±42.51 160.56±34.80 353.57±40.01#2 320.13±558.20 23 909.63±2 656.36#91.58±30.80 863.40±79.50##给药后调节趋势↑↑↑↑↑↑↑↑↓↑↑↑
2.3.5 潜在生物标志物代谢通路分析 将上述鉴定得到的12 个潜在生物标志物导入Metabo Analyst 5.0(https://www.metaboanalyst.ca)数据库中进行代谢通路分析,结果见图5。结果表明HepG2 细胞共有9 条代谢通路发生变化,分别为甘油磷脂代谢、亚油酸代谢、α-亚麻酸代谢、花生四烯酸代谢、鞘脂代谢、半胱氨酸和蛋氨酸代谢、嘧啶代谢、嘌呤代谢以及甘氨酸、丝氨酸和苏氨酸代谢。

图5 葛根芩连汤含药血清干预缺氧诱导的HepG2 细胞的代谢通路Figure 5 Metabolicpathwayof GegenQinlianDecoction-containing serum on hypoxia-induced HepG2 hepatoma cells
3 讨论
本研究通过考察HepG2 细胞在1% O2缺氧环境下不同时间点的葡萄糖消耗量变化,确定缺氧18 h为诱导HepG2 细胞缺氧的最佳时间。与正常组比较,缺氧24、48 h 出现细胞葡萄糖消耗量显著升高的现象,可能是由于HepG2 细胞具有癌细胞属性,在缺氧环境下存在Warburg 效应,增强了细胞的无氧糖酵解[18]。糖尿病随着空腹血糖的升高,其IR 指数呈线性升高,胰岛β 细胞功能指数呈线性降低,IR与糖代谢紊乱密切相关[19]。本课题组前期研究[16]发现,3T3-L1 脂肪细胞产生IR 时葡萄糖消耗量减少,而GQD 含药血清干预具有明显改善作用。组织缺氧与IR 呈正相关[8-9],间歇性缺氧可降低C57BL/6j 小鼠全身胰岛素敏感性及肌肉特异性葡萄糖利用率,引起小鼠IR 增强[10-11]。本实验证明,缺氧诱导18 h 可导致HepG2 细胞发生糖代谢紊乱,细胞葡萄糖消耗量显著降低。给予GQD 含药血清干预后,能够显著升高缺氧诱导HepG2 细胞的葡萄糖消耗量;进一步通过代谢组分析表明,缺氧诱导HepG2 肝癌细胞的潜在生物标志物共有12 个,而GQD 含药血清干预可使上述生物标志物明显回调。
研究[20]发现,缺氧对机体代谢物可产生明显影响,急、慢性高原缺氧均涉及磷脂代谢、鞘脂代谢、氨基酸代谢,慢性高原缺氧还可影响亚油酸代谢、花生四烯酸代谢通路。小鼠海马体和血清代谢组分析结果[21]显示,低氧可影响花生四烯酸、亚油酸、溶血磷脂酰胆碱,最终影响花生四烯酸代谢、亚油酸代谢、甘油磷脂代谢等代谢通路。本研究发现,12 个潜在生物标志物涉及甘油磷脂代谢、亚油酸代谢、α-亚麻酸代谢、花生四烯酸代谢、鞘脂代谢、半胱氨酸和蛋氨酸代谢、嘧啶代谢、嘌呤代谢以及甘氨酸、丝氨酸和苏氨酸代谢等9 条代谢通路,而GQD 含药血清干预可能通过调节上述相关通路,改善缺氧诱导HepG2 细胞的糖代谢。
磷脂具有促进脂质代谢和转运的作用,根据其取代基团的不同可分为甘油磷脂和鞘磷脂,甘油磷脂通过极性部分的不同又可以分为磷脂酰胆碱(PC)、磷酯酰丝氨酸(PS)、溶血磷脂酰胆碱(LysoPC)等[22],可作为糖尿病诊断的重要标志物。在本研究中,缺氧导致HepG2 细胞中PS[18:0/18:1(9Z)]、PC(18:0/P-18:0)、LysoPC[22:1(13Z)/0:0]含量显著低于正常组,而PC[14:0/22:5(4Z,7Z,10Z,13Z,16Z)]含量显著高于正常组,GQD 含药血清对上述代谢物均具有回调作用。PC 是细胞的重要组成部分,主要功能是维持细胞膜的完整性,含量不足会影响细胞膜的功能及通透性,并与糖代谢密切相关。糖尿病的发生发展中常伴随着磷脂含量和种类的变化,C18:1 溶血磷脂酰胆碱和C18:2 溶血磷脂酰胆碱水平与IR 指数呈显著的负相关[23],LysoPC 可影响糖代谢动态平衡[24],与本研究结果相符。研究发现,糖尿病性心肌病患者的PC 水平较正常组降低[23],在糖尿病肾病小鼠中也存在着PS[18:1(9Z)/18:1(9Z)]水平显著降低的现象[25]。提示缺氧引起细胞糖代谢异常的同时可能还伴随着磷脂代谢的异常。通过代谢通路富集分析显示,PC 参与亚油酸代谢、α-亚麻酸代谢、花生四烯酸代谢和甘油磷脂代谢。亚油酸、α-亚麻酸及花生四烯酸与T2DM 的糖脂代谢密切相关[26-30]。PC、PS和LysoPC 都涉及甘油磷脂代谢,而甘油磷脂代谢紊乱则会影响T2DM 的进程[31]。CE[20:2(6Z,9Z)](胆固醇二十碳二烯酸)属于胆固醇酯类物质,由脂肪酸和醇作用生成,参与鞘脂代谢。在初期诊断的T2DM患者体内CE 水平显著下降,导致脂代谢紊乱[24]。CE含量的下降也提示HepG2 细胞在缺氧条件下发生脂代谢异常。本研究结果表明,GQD 含药血清可能通过调节脂质代谢改善缺氧引起的HepG2 细胞糖代谢异常。
磷酸丝氨酸参与半胱氨酸和蛋氨酸代谢及甘氨酸、丝氨酸和苏氨酸代谢,磷酸核糖甲酰胺、CDP在体内分别参与嘌呤代谢及嘧啶代谢。研究发现,嘧啶代谢会影响肝脏脂质积累[32],CDP 主要存在于线粒体、细胞核和细胞质中,缺氧可能影响HepG2 细胞的能量代谢过程。嘌呤、嘧啶代谢循环影响糖尿病的发生发展[33],胞苷影响磷脂的合成,引起肾血流动力学发生变化,进而引发糖尿病或糖尿病肾病[34]。课题组前期研究[16]发现,GQD 含药血清可通过干预嘌呤代谢、半胱氨酸和蛋氨酸代谢调节3T3-L1 脂肪细胞的糖代谢。本研究结果表明,GQD 含药血清可能通过调节氨基酸代谢、嘌呤及嘧啶代谢改善缺氧引起的HepG2 细胞糖代谢异常。
综上所述,GQD 含药血清可能通过调节脂质代谢、氨基酸代谢、嘌呤及嘧啶代谢来改善缺氧引起的HepG2 细胞糖代谢异常,提高葡萄糖消耗量。本研究可为从缺氧角度探讨GQD 对T2DM 的作用机制提供参考。
