miR-20a通过ATG16L1影响细胞自噬并参与调节雷公藤甲素肝毒性
2023-07-06张彩霞王伟艳李会芳杜晨晖魏砚明
张彩霞,王伟艳,李会芳,杜晨晖,刘 珊,魏砚明
miR-20a通过ATG16L1影响细胞自噬并参与调节雷公藤甲素肝毒性
张彩霞,王伟艳,李会芳,杜晨晖,刘 珊,魏砚明*[1]
山西中医药大学中药与食品工程学院,山西 晋中 030619
观察雷公藤甲素对miR-20a及自噬相关16样蛋白L1(autophagy related 16 like protein1,ATG16L1)表达的影响,探讨miR-20a对雷公藤甲素所致肝细胞毒性的调控作用。利用雷公藤甲素处理人正常肝细胞株HL7702和C57BL/6J小鼠,通过qRT-PCR和Western blotting检测、ATG16L1及自噬标记物微管相关蛋白1轻链3II(microtubule-associated protein 1 light 3II,LC3II)的表达。利用雷公藤甲素和miR-20a模拟物或抑制物共同处理HL7702细胞,通过qRT-PCR和Western blotting检测ATG16L1及LC3II的表达;CCK-8法检测细胞存活率;试剂盒检测乳酸脱氢酶(lactate dehydrogenase,LDH)释放量;ELISA检测半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)和Caspase-9的活性。雷公藤甲素显著下调人正常肝细胞或小鼠肝组织中表达(<0.05),上调ATG16L1和LC3II的表达(<0.05)。miR-20a模拟物可抑制雷公藤甲素引起的ATG16L1、LC3II表达升高(<0.05),进一步降低细胞存活率(<0.05),提高LDH释放量(<0.05),上调Caspase-3和Caspase-9活性(<0.05),而miR-20a抑制物具有相反作用。miR-20a通过ATG16L1影响自噬过程,参与调节雷公藤甲素肝细胞毒性。
雷公藤甲素;肝细胞毒性;细胞自噬;miR-20a;ATG16L1;细胞凋亡
中药引起的肝损伤是临床上药物肝损伤的重要病因之一。雷公藤甲素既是传统中药雷公藤Hook. f.的主要活性成分,具有免疫调节、神经保护、抗血管生成、抑制细胞增殖及促细胞凋亡等药理活性,也是引起肝脏毒性不良反应的主要物质基础[1-2]。研究表明有多种机制参与雷公藤甲素所致肝毒性,如药物代谢与转运紊乱、氧化应激、细胞凋亡、免疫损伤、肠道菌群失调等[3]。此外,细胞自噬也被认为是雷公藤甲素引起肝毒性的关键机制[4]。细胞自噬是一种进化高度保守并受严格调控的将底物运送至溶酶体中降解的过程。雷公藤甲素可剂量相关性激活肝癌细胞自噬活性,促进肝癌细胞死亡[5-6]。在正常肝细胞系中,雷公藤甲素通过促进自噬关键蛋白Beclin1的表达上调细胞自噬活性[7]。另外,雷公藤甲素处理可导致斑马鱼肝组织中自噬相关基因和自噬相关基因5(autophagy-related gene 5,)表达明显升高[8],引起小鼠肝组织中自噬标记物微管相关蛋白1轻链3(microtubule-associated protein 1 light 3,LC3)堆积[9]。因此,调节细胞自噬水平可能为抑制或减轻其肝毒性的潜在途径。然而,目前对于雷公藤甲素调节肝细胞自噬的作用途径及细胞自噬在雷公藤甲素肝毒性中的功能仍有待阐明。
小RNAs(miRNAs/miRs)是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子。通过与特定mRNA的3’-UTR结合,引起mRNA降解或抑制蛋白质翻译。miRNAs参与调控细胞分化、器官发育、细胞代谢、细胞凋亡等多种生理过程,其表达异常与多种疾病的发生密切相关,是潜在的疾病诊断生物标志物和药物的治疗靶点[10]。雷公藤甲素可以上调或下调多种miRNAs的表达,影响多条信号通路,实现其抗肿瘤、抗炎、免疫调节及抗血管生成等多种药理活性[11]。另外,miRNAs通过调控细胞自噬相关基因或调节因子的表达,在细胞自噬过程中发挥关键作用[12]。
本课题组利用转录组测序观察到雷公藤甲素能明显下调正常肝细胞中miR-20a表达,并且Targetscan(http://www.targetscan.org/vert.72/)、miRDB(http://mirdb.org)网站预测ATG16L1为其下游靶点。由于ATG16L1是自噬小体形成所必需的关键蛋白质[13],推测miR-20a可能作为雷公藤甲素的作用靶点,参与调控细胞自噬,并在雷公藤甲素肝毒性中发挥作用。本实验拟观察雷公藤甲素对正常肝细胞中miR-20a及其下游潜在靶点ATG16L1表达的影响,探讨miR-20a对雷公藤甲素所致肝细胞毒性的调控作用,旨在为增进对雷公藤甲素肝毒性作用机制的了解,寻找雷公藤甲素肝毒性的生物标志物提供线索。
1 材料
1.1 细胞及动物
人正常肝细胞株HL-7702购自北纳创联生物技术有限公司。
SPF级雄性C57BL/6J小鼠,体质量16~18 g,6周龄,购自斯贝福(北京)生物技术有限公司,动物许可证号SCXK(京)2019-0010。动物实验经山西中医药大学动物伦理委员会批准(伦理批准号2021DW207)。
1.2 药品与试剂
雷公藤甲素(质量分数>98%,批号210607)购自上海融禾医药科技发展有限公司;氯喹(批号C6628)购自美国Sigma公司;Lipofectamine 2000转染试剂(批号2307486)购自美国Thermo公司;BCA蛋白浓度试剂盒(批号20211101)购自北京索莱宝科技有限公司;蛋白酶抑制剂(P1006)、RIPA蛋白裂解液(批号011921210824)、β-肌动蛋白(β-actin)抗体(批号AA128)购自上海碧云天生物技术有限公司;RPMI 1640完全培养基、Opti-MEM培养基、胎牛血清购自美国Gibco公司;超敏ECL化学发光试剂盒(批号MA0186-1-Nov-16G)购自大连美伦生物技术有限公司;CCK-8试剂盒(批号JH620)购自日本同仁化学科技(上海)有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(批号20220319)、谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)试剂盒(批号C010-2-1),谷丙转氨酶(glutamic-pyruvic transaminase,GPT)试剂盒(批号C009-2-1)购自南京建成生物工程研究所;半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、Caspase-9试剂盒(批号20211215)购自上海瓦兰生物科技有限公司;ATG16L1 3’-UTR野生型(Wt)和突变型(Mut)荧光质粒,由分别向pmirGLO荧光素酶载体XhoI/XbaI位点插入含有miR-20a预测靶序列(GCACTTT)及突变靶序列(TTGACCC)3’-UTR片段得到,由上海吉玛基因有限公司提供;pCMV-FLAG-ATG16L1质粒,向pCMV-Flag载体EcoRI/XhoI位点插入ATG16L1 cDNA序列得到,由PPL生物有限公司提供;pEGFP-N1-LC3质粒受赠于山西中医药大学任晋宏博士;LC3II抗体(批号GR3338049-2)购自英国Abcam公司;ATG16L1抗体(批号H226AA0020)、Trizol试剂(批号G921KA7073)、双荧光素酶报告基因检测试剂盒、miRNA第一链cDNA合成试剂盒(批号HCT4KA2901)、miRNA荧光定量PCR试剂盒(批号H712KA0769)、MightyScript第一链cDNA合成Master Mix(批号H525KA0190)、SGExcel FastSYBR qPCR预混液(批号I112KA3257)、miR-20a模拟物(mimics)、miR-20模拟物阴性对照(mimics NC)、miR-20a抑制物(inhibitor)、miR-20抑制物阴性对照(inhibitor NC)均由上海生工生物工程有限公司提供;实验中所用引物均由上海生工生物工程有限公司合成,序列见表1。

表1 引物序列
1.3 仪器
Galaxy 170s CO2培养箱(德国Eppendorf公司);Allegra X-30R型台式冷冻离心机(美国Beckman Coulter公司);EasyWeLL系列JY98-IIIN型细胞破碎仪(宁波新芝生物科技股份有限公司);倒置激光共聚焦显微镜(日本Olympus公司);微量紫外分光光度计(美国Thermo公司);Power Wave全波长酶标仪(美国Bio-Tek公司);Powercycler普通PCR仪(英国Analylik Jena公司);FQD-96A型多功能实时荧光定量PCR扩增仪(杭州博日公司);ImageQuant LAS 500化学发光成像系统(美国GE公司)。
2 方法
2.1 细胞培养
HL7702细胞用含10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素的RPMI 1640完全培养基中,置于5% CO2、95%空气的37 ℃恒温培养箱中培养。
2.2 细胞及动物分组和给药
取对数生长期的HL7702细胞,加入25、50、100 nmol/L雷公藤甲素处理24 h或用50 nmol/L雷公藤甲素处理12、24、48 h后,检测细胞存活率,并检测和ATG16L1表达;根据Lipofectamine 2000转染试剂说明,将HL7702细胞转染pEGFP-N1-LC3质粒24 h后,加入25、50、100 nmol/L雷公藤甲素处理24 h,检测LC3点状物的形成;设置对照组(仅加入培养基)、miR-20a mimics组、miR-20a mimics NC组,转染24 h后,检测miR-20a和ATG16L1表达;将miR-20a mimics、miR-20a mimics NC与ATG16L1 3’-UTR Wt、ATG16L1 3’-UTR Mut荧光质粒分别共转染到HL7702细胞内,检测荧光强度;设置对照组(仅加入培养基)、雷公藤甲素组、雷公藤甲素+miR-20a mimics组、雷公藤甲素+miR-20a mimics NC组、雷公藤甲素+miR-20a inhibitor组、雷公藤甲素+miR-20a inhibitor NC组、雷公藤甲素+miR-20a mimics+ATG16L1组、雷公藤甲素+氯喹(20 μmol/L)组,转染miR-20a mimics、miR-20a inhibitor和50 nmol/L雷公藤甲素共同处理48 h,或转染miR-20a mimics和50 nmol/L雷公藤甲素共同处理24 h后,转染pCMV-FLAG-ATG16L1,继续培养24 h后,检测细胞存活率、LDH释放量,并检测Caspase-3、Caspase-9活性和ATG16L1、LC3II蛋白表达。
将C57BL/6J小鼠随机分为对照组、雷公藤甲素组,每组6只,对照组ip 0.9%生理盐水,雷公藤甲素ip 0.8 mg/kg雷公藤甲素,每2天注射1次,注射3次,末次给药24 h后,分离血清,取肝组织,备用。
2.3 CCK-8法检测细胞存活率
将HL7702细胞接种到96孔板中,经不同处理后,按照CCK8试剂盒说明书测得各孔吸光度()值并计算细胞存活率。
2.4 RNA提取及qRT-PCR检测
按照Trizol试剂说明书提取不同处理细胞和小鼠肝组织中的总RNA,分别使用miRNA第一链cDNA试剂盒和MightyScript第一链cDNA合成Master Mix进行反转录,随后以反转录产物为模板,以为内参,以为内参,通过miRNA荧光定量PCR试剂盒和SGExcel FastSYBR qPCR预混液分别对和进行定量分析。
2.5 蛋白提取及Western blotting检测
细胞经PBS漂洗后,加入含蛋白酶抑制剂的RIPA裂解液,冰上裂解15 min后,23号针头反复吹打破碎细胞,或取适量小鼠肝组织,加入含蛋白酶抑制剂的RIPA裂解液,组织匀浆仪破碎后,4 ℃、3500 r/min离心10 min,取上清液,BCA法测定蛋白浓度。将上清液与5×SDS上样缓冲液混匀,95 ℃加热5 min使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入含5%脱脂奶粉的TBST,室温封闭1 h,加入ATG16L1、LC3II一抗(1∶1000),4 ℃孵育过夜后,加入二抗(1∶5000),室温孵育1 h。采用ECL化学发光试剂盒在化学发光成像系统下进行曝光,Image J软件定量目的条带。
2.6 激光共聚焦显微镜观察LC3点状物
将转染pEGFP-N1-LC3质粒的HL7702细胞经4%多聚甲醛固定后,DAPI溶液染细胞核,封片,激光共聚焦显微镜下观察LC3点状物的形成。随机选取5个视野不少于150个细胞,对其中含有≥5个LC3点状物的细胞进行计数。
2.7 双荧光素酶报告基因实验
将miR-20a mimics、miR-20a mimics NC分别和ATG16L1 3’-UTR Wt和Mut荧光质粒共转染至HL7702细胞48 h后,按照双荧光素酶报告基因检测试剂盒说明书测定荧光强度。
2.8 LDH释放量检测
HL7702细胞经不同处理后,收集细胞培养液,2500 r/min离心10 min,取上清液,根据LDH检测试剂盒说明书测定LDH释放量。
2.9 Caspase-3和Caspase-9活性检测
细胞经胰酶消化后,2500 r/min离心5 min,收集细胞,加入预冷PBS,利用细胞破碎仪进行破碎,4 ℃、3000 r/min离心5 min,按照ELISA试剂盒说明书测定Caspase-3和Caspase-9活性。
2.10 GOT和GPT活性检测
按照GOT和GPT试剂盒说明书检测小鼠血清中GOT和GPT活性。
2.11 统计学分析
3 结果
3.1 雷公藤甲素降低HL7702细胞存活率
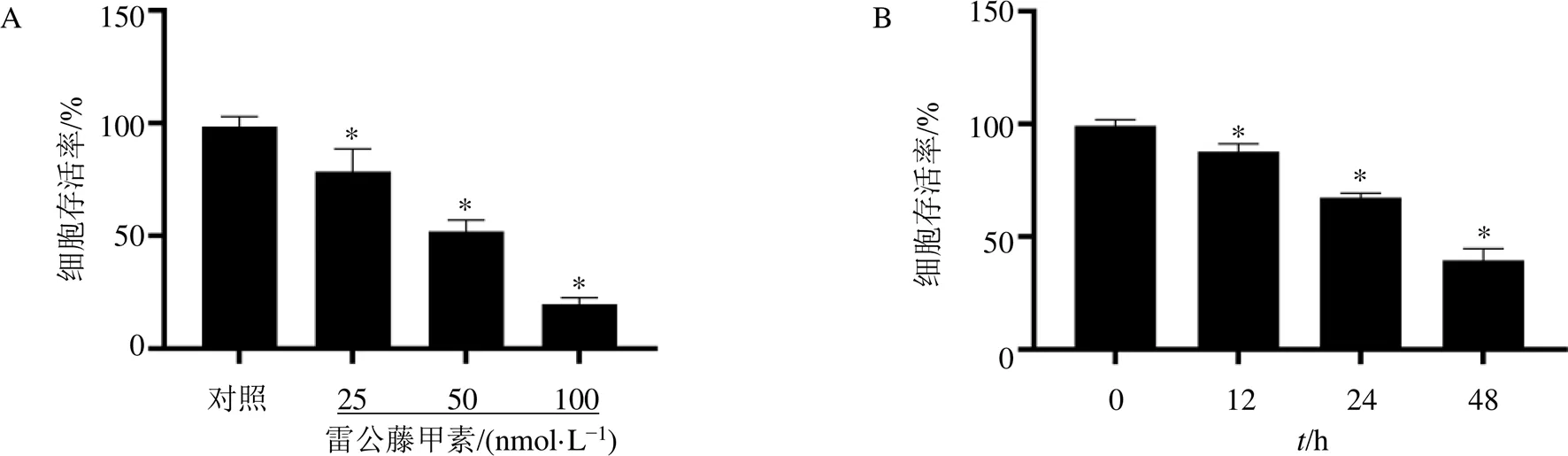
HL7702细胞经不同浓度的雷公藤甲素处理24 h后,CCK-8法检测细胞存活率,结果显示雷公藤甲素可以显著抑制细胞活力(<0.05),且呈剂量相关性(图1-A)。为了比较雷公藤甲素不同处理时间对细胞存活率的影响,HL7702细胞经50 nmol/L雷公藤甲素处理12、24、48 h后,检测HL7702细胞存活率,结果显示随着处理时间延长,细胞存活率逐渐降低(<0.05,图1-B)。
3.2 雷公藤甲素对HL7702细胞miR-20a和ATG16L1表达的影响
HL7702细胞经不同浓度的雷公藤甲素处理24 h后,利用qRT-PCR和Western blotting检测和ATG16L1的表达,结果显示25 nmol/L雷公藤甲素处理的HL7702细胞中未观察到和ATG16L1的表达有明显变化(图2-A),但随着雷公藤甲素浓度的提高,的表达显著降低(<0.05),ATG16L1的表达显著提高(<0.05)。为了比较雷公藤甲素不同处理时间对和ATG16L1的表达,将HL7702细胞经50 nmol/L雷公藤甲素处理12、24、48 h后,检测和ATG16L1的表达,结果显示不同处理时间均引起表达显著降低(<0.05,图2-B);而在经雷公藤甲素处理12 h的HL7702细胞中未观察到mRNA和蛋白的表达有明显变化,但雷公藤甲素处理24、48 h显著提高mRNA和蛋白的表达(<0.05)。
与对照组或0 h比较:*P<0.05,图2、4、5同
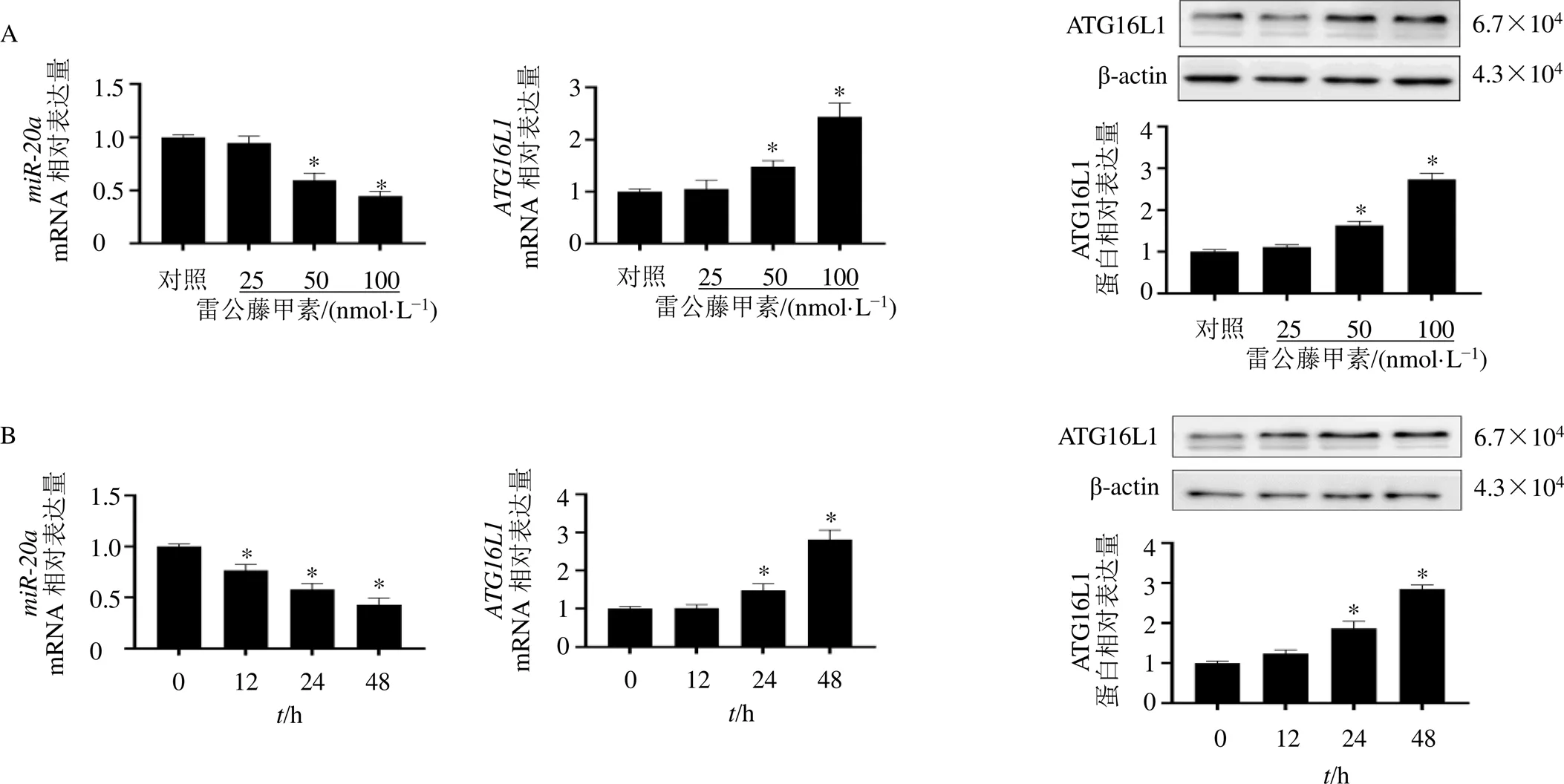
图2 不同浓度 (A)或处理时间(B) 的雷公藤甲素对HL7702细胞miR-20a和ATG16L1表达的影响(, n = 3)
3.3 miR-20a靶向调节ATG16L1的表达
双荧光素酶报告基因检测(图3-A)结果显示,ATG16L1 3’-UTR Wt荧光质粒与miR-20a mimics共转染组相对荧光强度显著低于miR-20a mimics NC(<0.05),而Mut荧光质粒共转染组无明显变化。HL7702细胞转染miR-20a mimics后,ATG16L1的mRNA和蛋白表达均显著降低(<0.05),而miR-20a mimics NC对ATG16L1表达量则无明显影响(图3-B)。以上结果说明,miR-20a能够靶向结合于ATG16L1的3’-UTR,进而抑制mRNA转录后水平。

与ATG16L1 Wt+mimics NC组比较:*P<0.05;与对照组比较:#P<0.05
3.4 雷公藤甲素对HL7702细胞自噬的影响
LC3II作为细胞自噬的底物,特异定位于自噬小体膜上,其表达量与自噬小体数量正相关。因此,LC3II常作为检测自噬水平的标志物[14-15]。HL7702细胞经不同浓度的雷公藤甲素处理24 h后,Western blotting检测LC3II的表达,结果显示50、100 nmol/L的雷公藤甲素显著提高LC3II表达(<0.05,图4-A)。利用不同浓度的雷公藤甲素处理转染pEGFP-N1-LC3质粒的HL7702细胞24 h,观察到雷公藤甲素可剂量相关性增加自噬小体点状物的形成(<0.05,图4-B)。
自噬流是由吞噬泡组装位点的形成、自噬小体的形成、自噬小体与溶酶体的融合及底物的降解等多个连续步骤组成的动态过程。自噬流活化引起的自噬小体形成增多或受阻引起的自噬小体降解抑制均能导致LC3II表达升高[16]。当使用自噬抑制剂氯喹阻断自噬小体与溶酶体的融合时,如果雷公藤甲素能够激活细胞自噬流,氯喹处理则进一步增加LC3II表达,反之,氯喹处理对LC3II表达无明显影响[17]。为了观察雷公藤甲素对肝细胞中自噬流的影响,HL7702细胞经50 nmol/L雷公藤甲素单独处理或和20 μmol/L氯喹共同处理24 h后,Western blotting检测LC3II的表达,结果显示,雷公藤甲素与氯喹共处理较雷公藤甲素单独处理LC3II表达进一步提高(<0.05,图4-C),表明雷公藤甲素可促进细胞自噬流。
与雷公藤甲素组比较:#<0.05
#< 0.05triptolide group
3.5 雷公藤甲素对小鼠血清中GOT、GPT活性及肝组织中miR-20a、ATG16L1与LC3II表达的影响
利用试剂盒检测小鼠血清中GOT和GPT的活性,结果显示与对照组比较,雷公藤甲素组小鼠血清中GOT和GPT活性显著升高(<0.05,图5-A),表明肝毒性模型构建成功。通过qRT-PCR和Western blotting检测小鼠肝组织中、ATG16L1和LC3II的表达水平,结果显示雷公藤甲素组显著下调,mRNA和蛋白表达显著上调(<0.05),LC3II蛋白表达升高(<0.05,图5-B、C)。
3.6 miR-20a对雷公藤甲素引起HL7702细胞自噬活化的影响
HL7702细胞经50 nmol/L雷公藤甲素单独处理或转染miR-20a mimics、miR-20a inhibitor共同处理24 h后,qRT-PCR和Western blotting检测mRNA和LC3II的表达,结果显示,miR-20a mimics显著抑制雷公藤甲素引起的mRNA和LC3II表达升高(<0.05),miR-20a inhibitor可进一步促进mRNA和LC3II表达上调(<0.05),而miR-20a mimics NC或inhibitor NC则无明显影响(图6)。

图5 雷公藤甲素对C57BL/6J小鼠肝功能指标(A)、肝组织miR-20a及ATG16L1 mRNA表达(B) 和ATG16L1及LC3II蛋白表达(C) 的影响(, n = 3)
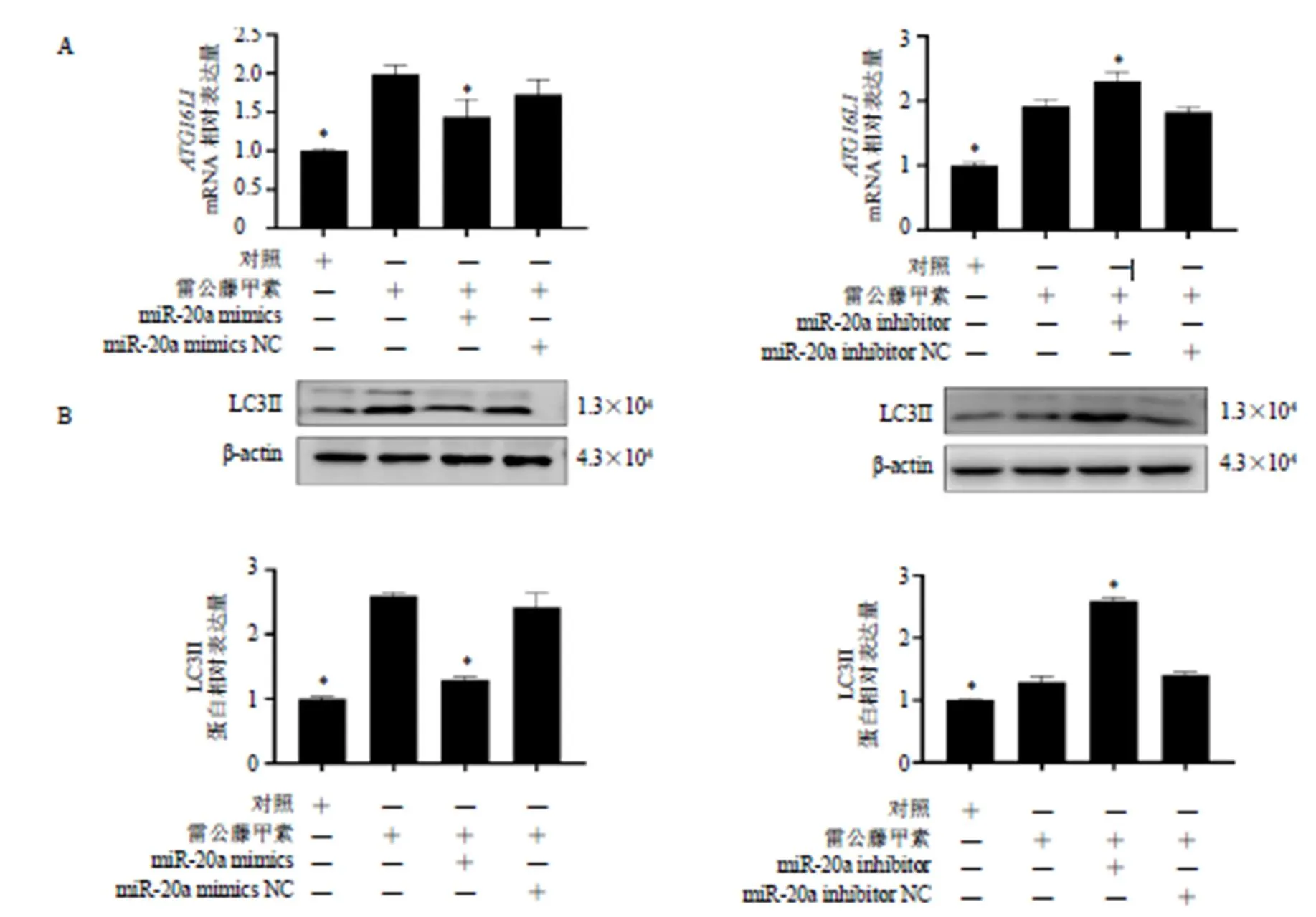
与雷公藤甲素组比较:*P<0.05
3.7 miR-20a对雷公藤甲素引起HL7702细胞毒性的影响
LDH是细胞内糖酵解途径中的氧化还原酶,其释放量反映细胞膜的完整性,是细胞毒性的重要指标[18];细胞凋亡是雷公藤甲素引起肝毒性的重要机制,其中Caspase-3和Caspase-9级联活化反应是凋亡过程中的关键信号通路[8]。HL7702细胞经50 nmol/L雷公藤甲素单独处理或与转染miR-20a mimics、miR-20a inhibitor、FLAG-ATG16L1及20 μmol/L氯喹共同处理后,检测细胞存活率、LDH释放量、Caspase-3和Caspase-9活性。如图7所示,与对照组比较,雷公藤甲素显著降低细胞存活率(<0.05),提高LDH释放量(<0.05),上调Caspase-3和Caspase-9活性(<0.05)。转染miR-20a mimics和雷公藤甲素共处理较雷公藤甲素单独处理细胞存活率进一步下降(<0.05),LDH释放量进一步增多(<0.05),Caspase-3和Caspase-9活性显著提高(<0.05),阴性对照miR-20a mimics NC则无明显影响;与转染miR-20a mimics比较,转染miR-20a inhibitor对细胞存活率、LDH释放量、Caspase-3和Caspase-9活性具有相反效应(<0.05)。利用氯喹抑制自噬小体和溶酶体的融合[19],干预细胞自噬过程可进一步加剧雷公藤甲素肝细胞毒性(<0.05)。而共转染FLAG-ATG16L1则逆转miR-20a mimics对雷公藤甲素对HL7702细胞存活率、LDH释放量、以及Caspase-3和Caspase-9活性的影响(<0.05)。
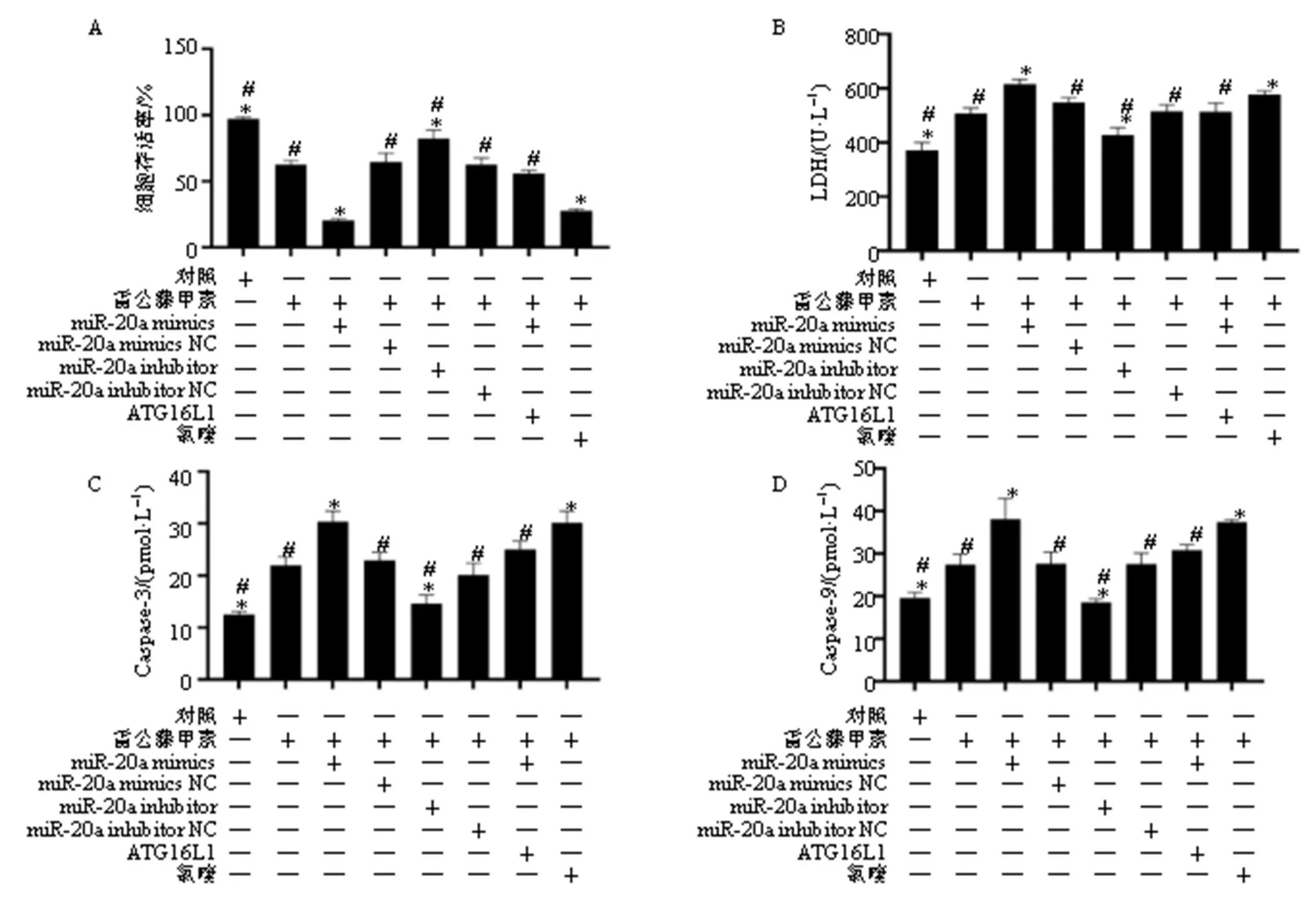
与雷公藤甲素组比较:*P<0.05;与雷公藤甲素+miR-20a mimics组比较:#P<0.05
4 讨论
多种miRNAs在雷公藤甲素的药理作用中发挥关键作用[11]。雷公藤甲素通过下调miR-155表达,引起SHIP1表达升高,从而抑制α-突触核蛋白引起的炎症因子释放和小胶质细胞活化[20]。雷公藤甲素可抑制高糖诱导的人肾小管上皮细胞中miR-188表达上调,阻断PTEN信号通路,逆转糖尿病肾病上皮间质细胞转化[21]。另外,miRNAs与细胞自噬的起始、延伸及成熟等多个阶段密切相关[22]。miR-376b可下调自噬关键基因和的表达,抑制自噬起始[23]。miR-181a和miR-630分别调节、表达,影响细胞自噬囊泡伸展阶段[24]。miR-130则可通过靶向自噬小体-溶酶体融合关键基因人溶酶体关联膜蛋白1(lysosomal associated membrane protein 1,),参与调节融合过程[25]。作为miR-17-92簇的一员,miR-20a通过阻断自噬相关基因和的表达,抑制缺氧引起的结肠癌细胞自噬活化[26]。miR-20a也可负调控ATG7表达,阻断细胞自噬,从而抑制神经母细胞瘤细胞增殖[27]。另外,mRNA也被证明为miR-20a的下游靶点。ATG16L1能够与自噬起始过程中泛素样结合系统中的ATG12-ATG5复合体非共价结合,在隔离膜的延伸及自噬小体双层膜的形成过程中发挥关键作用[28]。miR-20a通过下调ATG16L1的表达抑制细胞自噬,从而促进巨噬细胞中分枝杆菌的存活[29]。缺氧引起的miR-20a表达抑制能够上调ATG16L1表达并诱导自噬活化,引起破骨细胞分化[30]。本研究中,雷公藤甲素在引起肝细胞毒性、诱导肝细胞自噬活化的同时,能够明显降低正常肝细胞和肝组织中miR-20a的表达,上调ATG16L1的表达。双荧光素酶报告实验证实miR-20a结合于ATG16L1的3’-UTR,并且miR-20a mimics或inhibitor能够阻断或进一步促进雷公藤甲素引起的肝细胞中ATG16L1及自噬标记物LC3II表达升高。因此,雷公藤甲素通过靶向调节miR-20a的表达,上调ATG16L1,从而引起细胞自噬活化。此外,Targetscan、miRDB网站预测自噬相关基因、UNC-51样激酶1(UNC-51 like kinase 1,)、、等均为miR-20a下游潜在靶点,然而qRT-PCR和Western blotting检测结果显示雷公藤甲素对肝细胞中这些潜在靶点的表达无明显影响,提示上述自噬相关基因可能在雷公藤甲素引起的肝细胞自噬活化过程中未发挥关键作用。研究表明,多种机制参与雷公藤甲素调节miRNA表达。雷公藤甲素通过干预转录因子Smad2/3的磷酸化,阻断其于Smad4的结合及入核运输,从而抑制转化生长因子-β(transforming growth factor-β,TGF-β)引起的miR-30表达下调[31]。雷公藤甲素还能够抑制c-myc转录活性,阻断miR-7-92和miR-106b-25的转录[32]。今后的工作将探讨雷公藤甲素调节miR-20a表达的分子机制或信号通路。
细胞自噬对于细胞生存具有两面性。正常条件下,细胞自噬活性维持在较低水平。外界刺激可以增强细胞自噬活性,发挥降解蛋白质或细胞器、维持代谢平衡和促细胞生存的功能。另一方面,过度活化的细胞自噬则导致细胞功能受损,引起自噬性死亡[33]。本实验在体外条件下证明了利用miR-20a mimics或自噬抑制剂氯喹处理较雷公藤甲素单独处理可进一步降低正常肝细胞的存活率,促进LDH释放及细胞凋亡,加剧雷公藤甲素引起的肝细胞毒性,而miR-20a inhibitor则具有缓解雷公藤甲素肝毒性的效应,说明细胞自噬是肝细胞受到雷公藤甲素处理时激发的一种保护性机制,而阻断细胞自噬途径则可能影响体内活性氧或受损伤的细胞器清除能力,拮抗其对雷公藤甲素引起肝细胞凋亡的缓解作用,从而进一步加剧肝细胞毒性[34]。今后将尝试在体内条件下验证miR-20a是否通过自噬途径对雷公藤甲素肝毒性发挥调控效应。过表达ATG16L1能够部分逆转过表达miR-20a mimics对雷公藤甲素肝毒性的影响,一方面验证了ATG16L1在miR-20a调节雷公藤甲素肝毒性中发挥重要作用,另一方面说明miR-20a的其他潜在靶点可能参与了其对雷公藤甲素肝毒性的调节作用[26-27]。未来有必要探讨miR-20a的其他下游靶基因是否在雷公藤甲素肝毒性中发挥作用。
综上,本研究观察了雷公藤甲素对正常肝细胞及小鼠肝组织中miR-20a及其下游靶基因表达的影响,结果验证了在体外条件下miR-20a通过ATG16L1影响自噬过程,并参与调节雷公藤甲素肝细胞毒性,为阐明雷公藤甲素肝毒性的作用机制及miR-20a作为雷公藤甲素肝毒性的新型生物标记物提供了参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Xi C, Peng S J, Wu Z P,. Toxicity of triptolide and the molecular mechanisms involved [J]., 2017, 90: 531-541.
[2] Li Y J, Lia S, Xuea X Y,. Integrating systematic pharmacology-based strategy and experimental validation to explore mechanism ofglycoside on cholangiocyte-related liver injury [J]., 2022, 14(4): 563-575.
[3] Hu Y Q, Wu Q G, Wang Y L,. The molecular pathogenesis of triptolide-induced hepatotoxicity [J]., 2022, 13: 979307.
[4] Wei Y M, Wang Y H, Xue H Q,. Triptolide, A potential autophagy modulator [J]., 2019, 25(3): 233-240.
[5] 李彦, 付滨, 梁丙楠. 雷公藤肝毒性作用机制研究进展[J]. 天津中医药, 2017, 34(5): 358-360.
[6] Zhang L L, Li C Q, Fu L,. Protection of catalpol against triptolide-induced hepatotoxicity by inhibiting excessive autophagy via the PERK-ATF4-CHOP pathway [J]., 2022, 10: e12759.
[7] Wei Y M, Luan Z H, Liu B W,. Autophagy in triptolide-mediated cytotoxicity in hepatic cells [J]., 2019, 38(5): 436-444.
[8] Huo J T, Yu Q W, Zhang Y,. Triptolide-induced hepatotoxicity via apoptosis and autophagy in zebrafish [J]., 2019, 39(11): 1532-1540.
[9] 许可嘉, 张天娇, 韩森, 等. 细胞自噬参与雷公藤甲素诱导的肝细胞损伤 [J]. 现代生物医学进展, 2016, 16(26): 5012-5014.
[10] Menon A, Abd-Aziz N, Khalid K,. miRNA: A promising therapeutic target in cancer [J]., 2022, 23(19): 11502.
[11] Zhou K, Chang Y X, Han B,. MicroRNAs as crucial mediators in the pharmacological activities of triptolide (Review) [J]., 2021, 21(5): 499.
[12] 曾征鹏, 蔡金文, 廖毓梅, 等. MicroRNA-21通过自噬影响疾病的研究进展 [J]. 中南大学学报: 医学版, 2022, 47(7): 936-941.
[13] Li Y, Zhou D M, Ren Y H,. Mir223 restrains autophagy and promotes CNS inflammation by targeting ATG16L1 [J]., 2019, 15(3): 478-492.
[14] 魏砚明, 任晋宏, 栾智华, 等. 多种细胞自噬调节剂对自噬标记物LC3II及p62表达的影响 [J]. 中国药科大学学报, 2018, 49(3): 341-347.
[15] Mizushima N, Yoshimori T. How to interpret LC3 immunoblotting [J]., 2007, 3(6): 542-545.
[16] 吕晓希, 胡卓伟. 自噬流的检测方法 [J]. 药学学报, 2016, 51(1): 45-51.
[17] Wang Z, Wu Q, Li C Y,. Quantitative determination of autophagy flux by probes [J]., 2021, 164: 157-165.
[18] 吴若霞, 李正阳, 任婷, 等. 加味丹参饮结合微小核糖核酸21对大鼠心肌细胞的保护机制 [J]. 中国临床药理学杂志, 2020, 36(1): 61-64.
[19] Kimura T, Takabatake Y, Takahashi A,. Chloroquine in cancer therapy: A double-edged sword of autophagy [J]., 2013, 73(1): 3-7.
[20] Feng Y, Zheng C Y, Zhang Y J,. Triptolide inhibits preformed fibril-induced microglial activation by targeting the microRNA155-5p/SHIP1pathway [J]., 2019, 2019: 6527638.
[21] Xue M, Cheng Y, Han F,. Triptolide attenuates renal tubular epithelial-mesenchymal transition via the miR-188-5p-mediated PI3K/AKT pathway in diabetic kidney disease [J]., 2018, 14(11): 1545-1557.
[22] Zhang H, Liang J L, Chen N. The potential role of miRNA-regulated autophagy in Alzheimer’s disease [J]., 2022, 23(14): 7789.
[23] Korkmaz G, le Sage C, Tekirdag K A,. MiR-376b controls starvation and mTOR inhibition-related autophagy by targeting ATG4C and BECN1 [J]., 2012, 8(2): 165-176.
[24] Zhang J, Wang P Y, Wan L,. The emergence of noncoding RNAs as Heracles in autophagy [J]., 2017, 13(6): 1004-1024.
[25] D'Adamo S, Cetrullo S, Minguzzi M,. MicroRNAs and autophagy: Fine players in the control of chondrocyte homeostatic activities in osteoarthritis [J]., 2017, 2017: 3720128.
[26] Che J, Wang W S, Huang Y,. MiR-20a inhibits hypoxia-induced autophagy by targeting ATG5/FIP200 in colorectal cancer [J]., 2019, 58(7): 1234-1247.
[27] Yu Y B, Zhang J, Jin Y Q,. MiR-20a-5p suppresses tumor proliferation by targeting autophagy-related gene 7 in neuroblastoma [J]., 2018, 18: 5.
[28] Hamaoui D, Subtil A. ATG16L1 functions in cell homeostasis beyond autophagy [J]., 2022, 289(7): 1779-1800.
[29] Guo L, Zhao J, Qu Y L,. MicroRNA-20a inhibits autophagic process by targeting ATG7 and ATG16L1 and favors mycobacterial survival in macrophage cells [J]., 2016, 6: 134.
[30] Sun K T, Chen M Y, Tu M G,. MicroRNA-20a regulates autophagy related protein-ATG16L1 in hypoxia-induced osteoclast differentiation [J]., 2015, 73: 145-153.
[31] Yang Q Q, Sun M J, Chen Y,. Triptolide protects podocytes from TGF-β-induced injury by preventing miR-30 downregulation [J]., 2017, 9(11): 5150-5159.
[32] Li S G, Shi Q W, Yuan L Y,. C-Myc-dependent repression of two oncogenic miRNA clusters contributes to triptolide-induced cell death in hepatocellular carcinoma cells [J]., 2018, 37(1): 51.
[33] Napoletano F, Baron O, Vandenabeele P,. Intersections between regulated cell death and autophagy [J]., 2019, 29(4): 323-338.
[34] Gao Q. Oxidative stress and autophagy [J]., 2019, 12(6): 179-198.
miR-20a regulates autophagy by targeting ATG16L1 and involved in triptolide-induced hepatotoxicity
ZHANG Cai-xia, WANG Wei-yan, LI Hui-fang, DU Chen-hui, LIU Shan, WEI Yan-ming
College of Chinese Medicine and Food Engineering, Shanxi University of Chinese Medicine, Jinzhong 030619, China
To validate the effect of triptolide on miR-20a and autophagy related 16 like protein1 (ATG16L1) expressions and evaluate the regulatory role of miR-20a in triptolide-induced hepatotoxicity.HL7702 cells and C57BL/6J mice were treated with triptolide, and thenand ATG16L1 levels were detected by qRT-PCR and Western blotting. After HL7702 cells exposure to triptolide and simultaneous transfection with miR-20a mimics or inhibitor, ATG16L1 and microtubule-associated protein 1 light chain 3 (LC3Ⅱ) expressions were detected by qRT-PCR and Western blotting; Cell survival rate was detected by CCK-8 method; The release of lactate dehydrogenase (LDH) was detected by kit; The activities of cystein-asparate protease-3 (Caspase-3) and Caspase-9 were detected by ELISA.Triptolide significantly down-regulatedexpression in normal liver cells or mouse liver tissues (< 0.05), as well as upregulated ATG16L1 and LC3Ⅱ expressions (< 0.05). miR-20a mimics significantly reversed the elevated ATG16L1 and LC3Ⅱ expressions induced by triptolide (< 0.05), further exacerbated triptolide-elicited decrease in cell viability (< 0.05), increase in lactate dehydrogenase leakage and activation of apoptosis proteases Caspase-3 and Caspase-9 (< 0.05), whereas miR-20a inhibitor exhibited opposite effects.miR-20a plays a regulatory role on triptolide-mediated hepatotoxicity by targeting ATG16L1 to affect autophagy.
triptolide; hepatotoxicity; autophagy; miR-20a; ATG16L1; apoptosis
R285.5
A
0253 - 2670(2023)13 - 4214 - 10
10.7501/j.issn.0253-2670.2023.13.014
2023-02-09
山西省科技厅基础研究课题资助项目(202103021224295);山西中医药大学毒效关系研究创新团队(2022TD1016);山西中医药大学科技创新能力培养计划“基础研究专项”课题资助项目(2020PY-JC-17)
张彩霞,硕士研究生,研究方向为中药新产品开发与应用。E-mail: 2303537480@qq.com
通信作者:魏砚明,副教授,硕士生导师,从事中药药理与毒理研究。Tel: (0351)3179717 E-mail: weiyanming2005@aliyun.com
[责任编辑 李亚楠]
