中药多糖对肿瘤微环境中免疫细胞调节作用研究进展
2023-07-06侯兵乔牛俊博汲晨锋
王 迪,李 钧,侯兵乔,牛俊博,汲晨锋, 2*
中药多糖对肿瘤微环境中免疫细胞调节作用研究进展
王 迪1,李 钧1,侯兵乔1,牛俊博1,汲晨锋1, 2*
1. 哈尔滨商业大学药学院,药物工程技术研究中心,黑龙江 哈尔滨 150076 2. 哈尔滨商业大学 抗肿瘤天然药物教育部工程研究中心,黑龙江 哈尔滨 150076
肿瘤微环境(tumor microenvironment,TME)在肿瘤的发生、发展、转移等环节起到至关重要的作用。中药多糖抗肿瘤作用显著,具有多角度、多机制协同作用的特点,可避免产生耐药性,是具有极大研究价值和开发潜力的抗肿瘤天然药物新领域。通过对TME中的免疫细胞(肿瘤相关巨噬细胞、树突状细胞、髓源性抑制细胞、肿瘤浸润性淋巴细胞、肿瘤相关中性粒细胞)进行综述,系统地阐述了各免疫细胞的生物学特性及中药多糖对其调控作用的研究进展,为抗肿瘤中药的研发提供参考。
肿瘤微环境;免疫细胞;中药多糖;调节作用;抗肿瘤
肿瘤是一种基因突变导致的细胞不可逆的细胞无限增长的疾病,具有高发病率和高死亡率,且一直受到研究领域的广泛关注。手术和化疗是肿瘤的主要治疗方法,但易产生耐药性且不良反应较大[1]。在过去的几十年里,研究者致力于开发和探索更有效的肿瘤治疗方法,由于肿瘤的异质性和复杂性,肿瘤治疗的重点从单一靶点转向多靶点[2],其中肿瘤微环境(tumor microenvironment,TME)备受关注。TME是肿瘤的发生、生长及转移与肿瘤细胞所处的内外环境存在的密切关系,包括肿瘤细胞、免疫细胞、肿瘤相关成纤维细胞、细胞外基质(extracellular matrix,ECM)等,在肿瘤恶性进展、免疫逃逸和治疗抵抗中发挥重要作用[3-4]。因此根据TME特点开发安全有效的免疫疗法是目前抗肿瘤技术研究的重要方向,其中肿瘤相关免疫细胞在肿瘤免疫中起着关键作用。
中药多糖来源广泛,是具有多样性结构、生物活性、生物安全性和生物可降解性的生物大分子,以其多途径、多靶点、不良反应小等优点用于肿瘤研究和临床治疗。越来越多的中药多糖已被证实其对肿瘤免疫的调节作用,如海藻多糖[5]、灵芝多糖[6]、人参多糖[7]等。然而,中药多糖对不同免疫细胞发挥抗肿瘤作用的影响及其机制是复杂多样的。因此,本文对TME中免疫细胞各组分的功能及在TME中发挥的作用,以及中药多糖对其调控作用进行综述,为多糖在抗肿瘤中药的研发和临床应用中提供参考。
TME中的免疫细胞在肿瘤发生发展过程中具有重要作用,主要包括肿瘤相关巨噬细胞(tumor- associated macrophages,TAMs)、树突状细胞(dendritic cells,DCs)、髓源性抑制细胞(myeloid- derived suppressor cells,MDSCs)、肿瘤浸润性淋巴细胞(tumor infiltrating lymphocytes,TILs)、肿瘤相关中性粒细胞(tumor-associated neutrophils,TANs)等。这些肿瘤相关免疫细胞受不同细胞因子或趋化因子调控,具有抗肿瘤或促肿瘤功能,一方面产生细胞毒性,降低免疫抑制能力,识别并杀伤肿瘤细胞发挥抗肿瘤作用;另一方面引发微环境炎症、免疫耐受,促进肿瘤血管生成等发挥促肿瘤作用。
图1展示了TME中肿瘤细胞和免疫细胞及细胞间复杂的相互作用网络,主要表现为TAMs能降解并重塑ECM,招募与激活调节性T细胞(regulatory T cell,Treg),促进血管生成,同时促进肿瘤细胞生长与侵袭。Treg抑制B细胞、阻断自然杀伤细胞(natural killer cell,NK)毒性作用,抑制T细胞增殖、活化及免疫功能,抑制DCs细胞成熟。MDSCs抑制DCs分化,阻断NK细胞毒性及细胞因子释放,诱导TAMs极化,招募并增殖Treg,抑制T细胞增殖与激活,促进血管生成,促进肿瘤细胞侵袭与转移。DCs可促进Treg增殖,进而促进血管生成和肿瘤细胞存活。肿瘤细胞招募DCs、MDSCs及TAMs,通过分泌相关细胞因子实现DCs的重编程、MDSCs增殖及TAMs极化。该通讯网络可提高并维持免疫抑制性微环境,促进免疫逃逸,最终导致肿瘤恶性发展。
1 TAMs及中药多糖的靶向调控作用
TAMs是肿瘤组织中浸润的巨噬细胞,主要由被募集到TME中的单核细胞分化而来。TAMs受相关细胞因子调控,极化为不同表型,发挥不同功能[8-9]。
1.1 TAMs的生物学特性
TAMs具有可塑性和异质性的特点,可根据其功能和细胞因子的种类分为M1和M2表型。M1型巨噬细胞是由辅助性T细胞1(T helper cell 1,Th1)分泌的细胞因子如γ-干扰素、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1(interleukin-1,IL-1)和IL-2等刺激极化[10],M1-TAMs与抗肿瘤活性相关,并通过Toll样受体4(Toll-like receptor 4,TLR4)/核因子-κB(nuclear factor-κB,NF-κB)通路发挥促炎、抗病毒、抗菌、抗肿瘤等作用。M2型巨噬细胞是由Th2细胞分泌的IL-4、IL-13等刺激极化,M2-TAMs与促进肿瘤活性相关[11],参与机体稳态过程,具有抗炎、组织重塑、血管生成及清除凋亡细胞和碎片等功能,促进肿瘤发生和发展[8]。
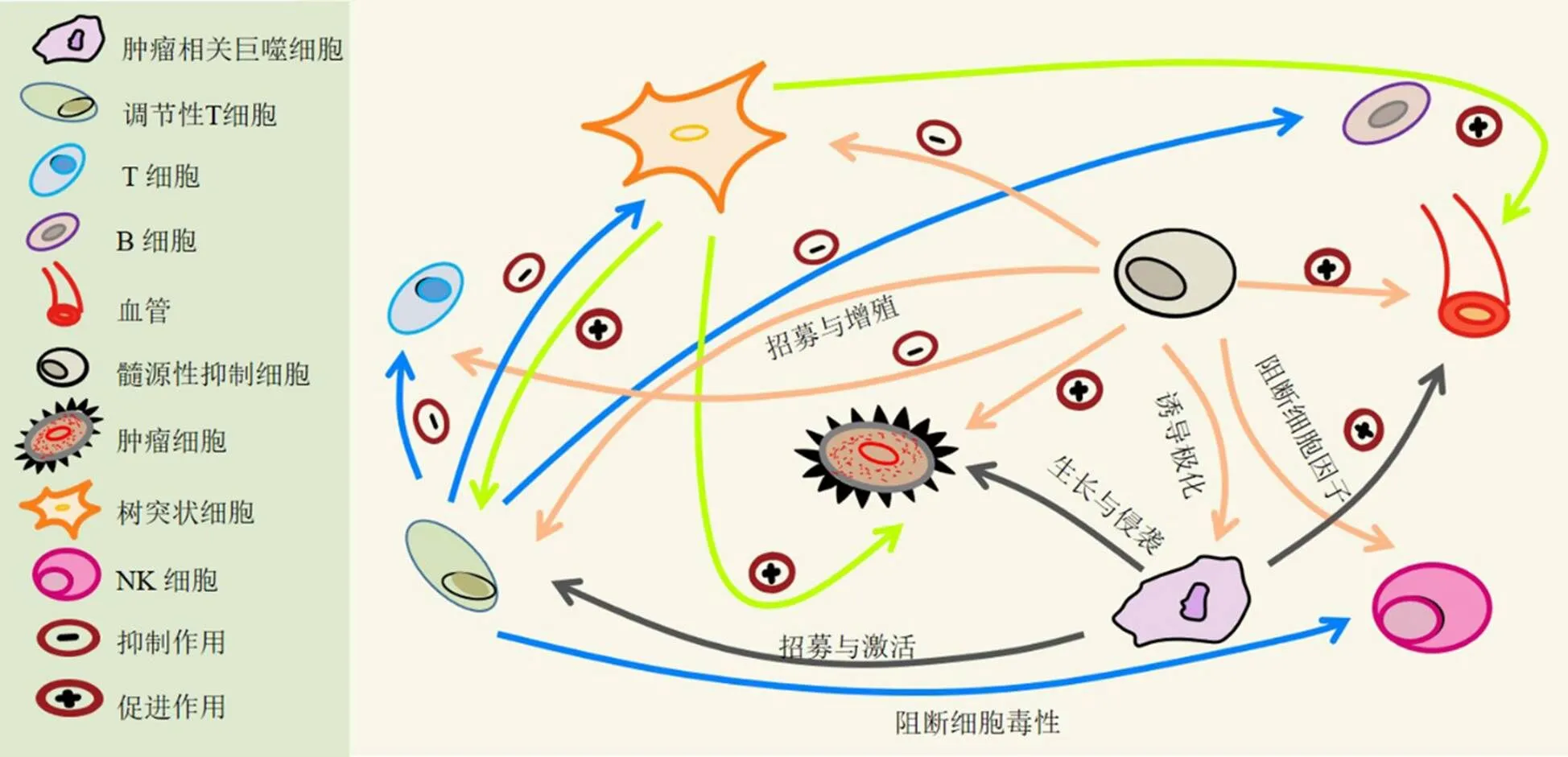
图1 肿瘤相关免疫细胞相互作用网络
1.2 TAMs对肿瘤的双重作用
M1-TAMs能够识别并杀伤肿瘤细胞发挥抗肿瘤作用,主要具有2种不同机制:(1)直接介导杀伤肿瘤细胞的细胞毒作用。此作用过程涉及多种机制,相对缓慢。如通过巨噬细胞释放的活性氧和一氧化氮等对肿瘤细胞产生细胞毒作用,并且分泌IL-6、TNF-α等细胞因子进一步激活巨噬细胞,增强其吞噬功能,形成促进免疫和杀伤肿瘤的免疫循环[12-13];(2)抗体依赖性细胞介导细胞毒性,此过程所需时间较短,需要抗肿瘤抗体参与,抗体的Fab段结合肿瘤细胞的抗原表位,Fc段与杀伤细胞(NK细胞、巨噬细胞等)表面的Fc受体结合,介导杀伤细胞直接杀伤肿瘤细胞[12,14]。
M2-TAMs可促进肿瘤细胞增殖、转移和血管生成。M2-TAMs可以表达多种细胞因子,如上皮生长因子(epithelial growth factor,EGF)、血小板源性生长因子(platelet derived growth factor,PDGF)和上皮生长因子受体配体(epidermal growth factor receptor,EGFR)家族等[15],促进肿瘤增殖。M2-TAMs通过过量分泌基质金属蛋白酶(matrix metalloproteinases,MMPs)、丝氨酸蛋白酶、组织蛋白酶、趋化因子等破坏内皮细胞的基质膜,分解细胞外基质的各种胶原蛋白等成分,从而帮助肿瘤细胞和肿瘤基质细胞迁移[16-17]。M2-TAMs在TME中的缺氧缺血区域聚集,释放促血管生成作用的相关因子,如碱性成纤维细胞生长因子(basic fibroblast growth factor,BFGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、IL-1、IL-8、TNF-α、MMP9、MMP2和一氧化氮,这些分子发挥协同作用促进肿瘤血管内皮细胞增殖、基质重塑和血管生成[17-18],此外M2-TAMs可直接接触新血管及其周围基质,促进肿瘤中新生血管的萌发、融合和组织重塑[19](图2)。

图2 不同表型TAMs对肿瘤的调节作用
1.3 中药多糖对TAMs的调节作用
靶向TAMs已成为一种潜在的肿瘤治疗策略,如促进TAMs衰竭、激活TAMs极化为M1型,抑制M2型极化,重新编程使其从M2型变为M1型[20]。中药多糖通过靶向调节TAMs可对肿瘤生长和转移产生抑制作用。
Zhan等[21]发现从白及提取的白及多糖与MMPs具有高亲和力,可以有效促进S180荷瘤小鼠TAMs衰竭,增强免疫功能,并显著抑制血管生成,从而抑制肿瘤的发展。刘春萍[22]发现从猪苓提取的猪苓多糖可显著提高-丁基--(4-羟丁基)-亚硝胺[-butyl--(4-hydroxybutyl) nitrosamine,BBN]诱导的晚期膀胱癌模型大鼠的体质量,通过分泌一氧化氮、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、IL-6、TNF-α等细胞因子使TAMs通过NF-κB信号通路发生极化,转化为具有抗肿瘤作用的M1表型。Zong等[23]报道了粒毛盘菌属多糖对S180荷瘤小鼠的肿瘤抑制率为66.31%,可将TAMs从促肿瘤M2表型转化为抗肿瘤M1表型,促进Th1极化和γ-干扰素分泌。王程成[24]发现从朝鲜淫羊藿中提取的淫羊藿多糖可有效阻止Lewis肺癌小鼠肿瘤机体免疫器官的萎缩和质量下降,通过提高细胞因子IL-2、γ-干扰素水平,改变M1/M2巨噬细胞的值,破坏肿瘤生长微环境,发挥抗肿瘤作用。Li等[25]报道冬青根多糖可显著抑制S180荷瘤小鼠的体质量并延长小鼠生存期,增加IL-12分泌水平、降低IL-10分泌水平,降低肿瘤组织中MMP9、VEGF的浓度,抗肿瘤血管生成,进一步通过NF-κB、信号转导与转录激活子1(signal transducer and activator of transcription1,STAT1)、STAT3信号通路促进M2-TAMs向M1-TAMs转化。Wang等[26]报道了从香菇中提取的香菇多糖可以增加Lewis肺癌小鼠中M1-TAMs,降低M2-TAMs,促进IL-12和γ-干扰素表达增加,降低转化生长因子-β(transforming growth factor-β,TGF-β)在血清中的产生,改善TME中免疫抑制作用。钱晶晶等[27]发现灵芝多糖可显著抑制MC38结肠癌荷瘤小鼠的肿瘤细胞增殖,抑瘤率为44.3%,延长小鼠的生存时间,生命延长率为25%,通过促进抗原分化簇86(cluster of differentiation 86,CD86)表达量升高,诱导TAMs向M1型极化,促进活性氧分泌。中药多糖对TME中TAMs的调节作用见表1。
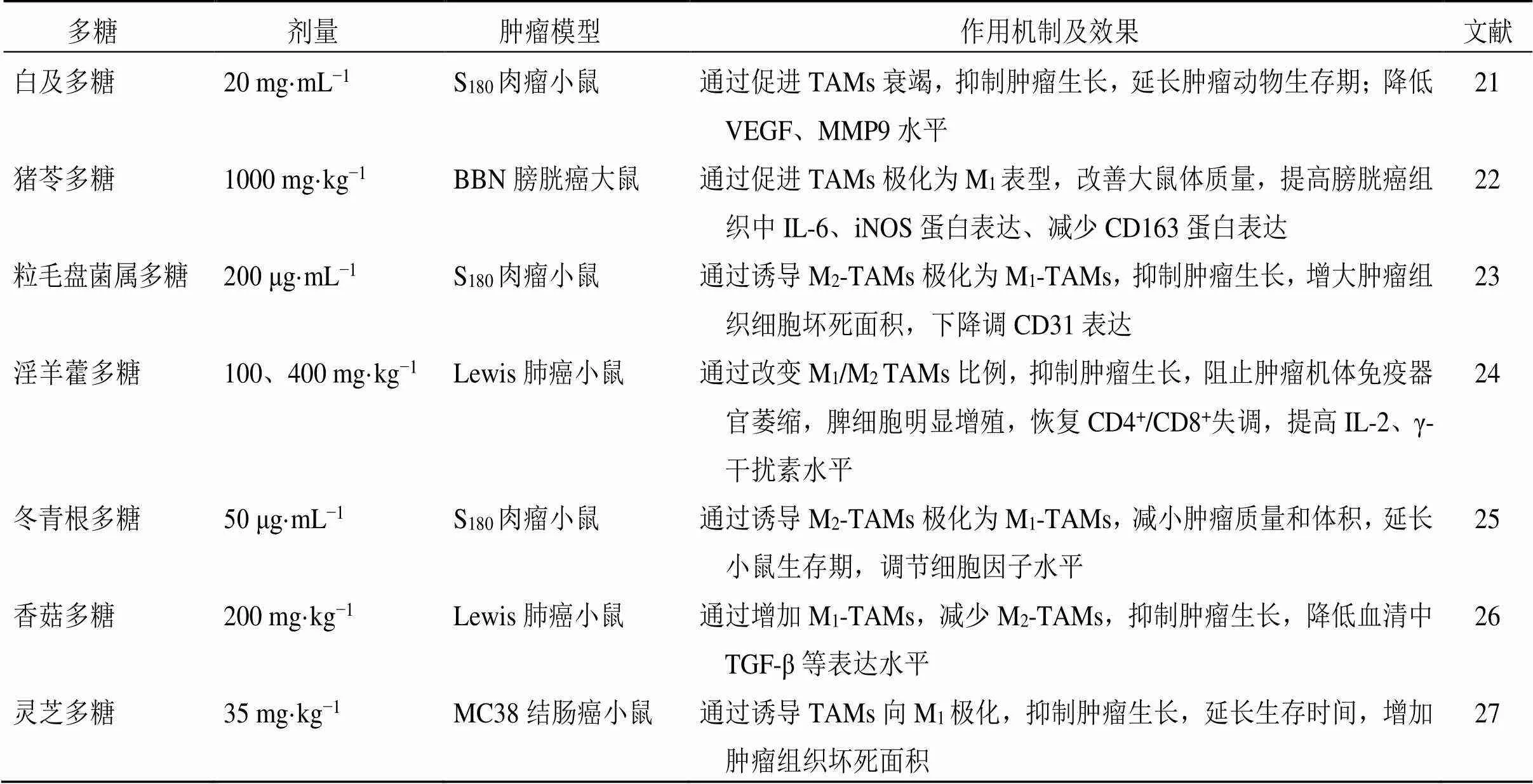
表1 中药多糖对TME中TAMs的调节作用
2 DCs及中药多糖的靶向调控作用
DCs来源于多功能造血干细胞,在免疫网络中担当机体免疫反应的“哨兵”和“初始者”,是唯一能激活初始T细胞增殖的抗原提呈细胞(antigen presenting cell,APC)。
2.1 DCs的生物学特性
DCs根据不同的前体细胞、性质与功能,分为淋巴系和髓系来源DCs。淋巴系DCs细胞与NK细胞、B细胞、T细胞源自前体淋巴干细胞;髓系DCs与粒细胞、巨噬细胞有相同的前体髓系干细胞。DCs根据发育阶段分为未成熟的DCs(immature DCs,iDCs)和成熟的DCs(mature DCs,mDCs),DCs细胞的前体经血液进入外周组织分化成iDCs,iDCs呈非活化状态,具有很强的抗原摄取能力,但激活T细胞免疫反应能力弱。而mDCs的摄取和加工抗原能力减弱,抗原提呈作用增强,可刺激T淋巴细胞并激发免疫反应。
研究发现DCs的来源并非是决定功能的唯一因素,内环境中分泌相关细胞因子调节DCs也是影响其功能的潜在因素。淋巴系DCs细胞会激起Th2反应(抗炎反应),但在TNF-α、γ-干扰素、IL-1诱导条件下会激发Th1反应(促炎反应);髓系DCs分泌的IL-12,经γ-干扰素培养会激发Th1反应,经前列腺素Z培养激发Th2反应。表明DCs在表型和功能上都呈现高度异质性,这导致它在调节机体免疫反应中具有双重作用,既能启动和调节固有免疫应答和获得性免疫应答,又能调节T细胞反应,维持和诱导机体免疫耐受[28]。
2.2 DCs与TME的相互作用
DCs通过机体的先天性和获得性免疫对肿瘤等异常细胞进行清除。然而在TME中缺氧、细胞因子分泌、基质成分变化、肿瘤血管生成等因素的条件下,影响DCs募集、分化、成熟、迁移等活动,进而抑制DCs发挥抗原提呈的功能,导致机体对肿瘤抗原无应答,造成免疫逃逸[29]。
在TME中,外周血管髓系来源的DCs前体细胞明显低于正常水平,影响DCs细胞活化数量,并且TME中浸润的DCs以未成熟型为主,免疫能力较弱;肿瘤来源的细胞因子和DCs趋化因子可招募iDC迁移至肿瘤组织中,随后限制其成熟及功能;TME还可干扰DCs的前体细胞分化,肿瘤细胞分泌的IL-6通过和粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)产生相互作用,使单核细胞更趋向于分化成巨噬细胞,导致DCs细胞数量减少,IL-6还能通过Janus激酶(Janus kinase,JAK)激活STAT3通路,从而抑制DCs的前体细胞分化为DCs,活化的STAT3可增强肿瘤的活性并抑制凋亡,从而进一步促进IL-6的分泌,形成循环回路;IL-10表达是DCs成熟的标志,IL-10水平升高,DCs前体增加,同时IL-10激活STAT3信号通路,该通路可通过抑制IL-12、TNF-α分泌,阻断T细胞活化信号,抑制mDCs激活T细胞发挥免疫作用;此外,TME对DCs免疫抑制作用还体现在诱导DCs凋亡,肿瘤细胞分泌IL-10、一氧化氮、神经苷脂、透明质酸、神经酰胺等引起DCs凋亡,具体机制见图3。
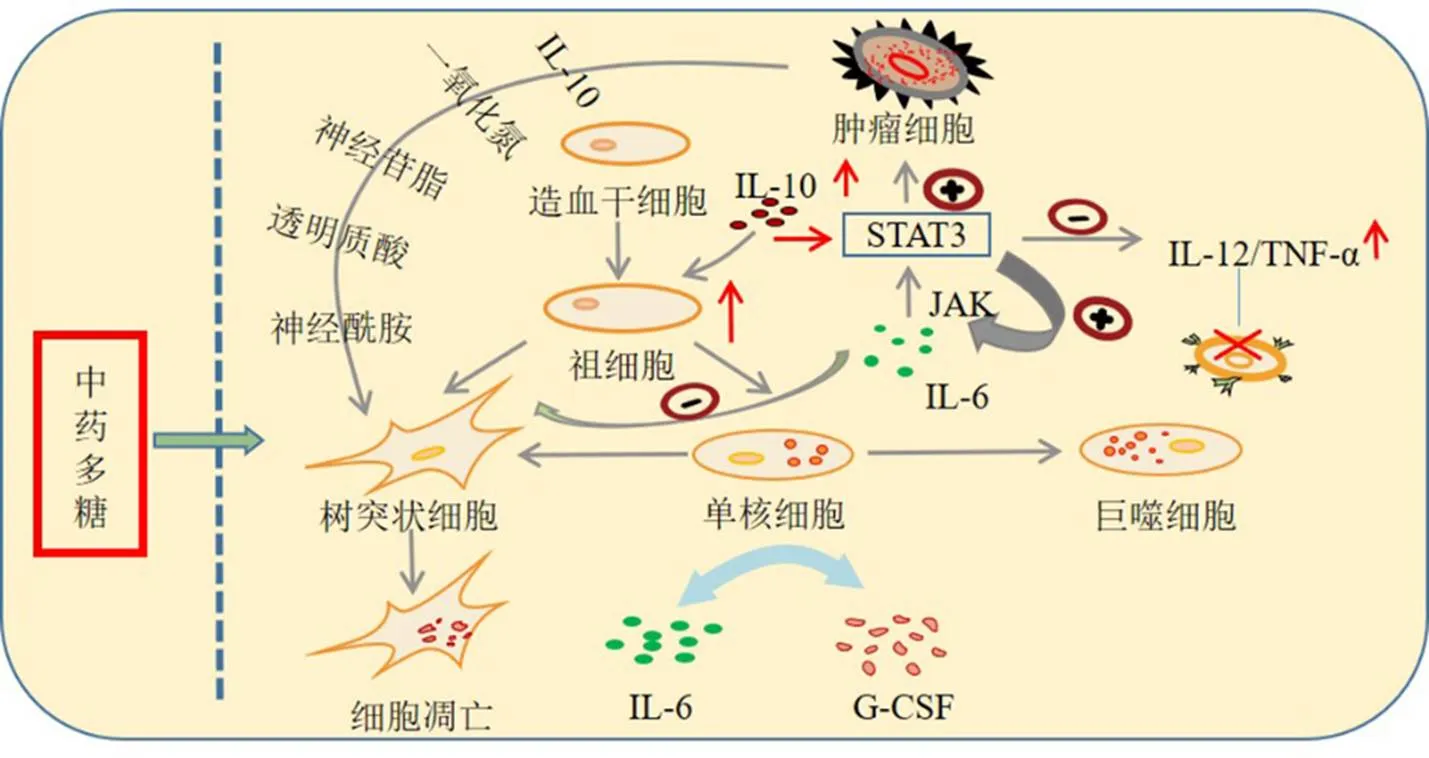
图3 DCs与TME的相互作用
2.3 中药多糖对DCs的调节作用
DCs在免疫应答中占据重要的地位,TME中因mDCs分布不均、突起短小,导致DCs细胞功能发育严重缺陷,因此促进DCs的成熟及增强抗原呈递能力是多糖逆转TME中DCs免疫抑制的一个重要机制。
李东东等[30]报道桑黄多糖体内注射可有效抑制MCA-102肉瘤小鼠的肿瘤生长,诱导DCs的表型和功能,通过TLR4、TLR2促进DCs成熟,增强DCs的抗肿瘤和自身免疫功能。王峻等[31]发现从香菇中提取的香菇多糖可通过提高γ-干扰素和IL-2分泌水平,促进DCs的成熟,增强抗原提呈能力,与DCs瘤苗联合使用后,66.7%的荷瘤小鼠黑色素瘤完全消退。Bamodu等[32]发现从黄芩中提取的黄芩多糖能显著抑制非小细胞癌(non-small cell carcinoma,NSCLC)小鼠肿瘤生长,增加CD80+、CD103+、CD86+的细胞数量,促进DCs细胞成熟,激活T细胞发挥抗肿瘤作用。张书磊[33]发现从灵芝中提取的灵芝多糖可显著抑制4T1乳腺癌小鼠肿瘤的大小,增加、、及γ-干扰素的mRNA表达,升高DCs表面抗原分子表达,促进DCs成熟,激活T细胞免疫应答,抑制肿瘤转移。张宏方等[34]发现应用调衡方多糖可以协同DCs疫苗增强S180荷瘤小鼠的免疫功能,并抑制肿瘤生长、延长小鼠生存期。通过提高CD80、CD86表达,增加小鼠血清IL-12、TNF-α分泌,促进DCs成熟,发挥肿瘤抑制作用。中药多糖对TME中DCs细胞的调节作用见表2。
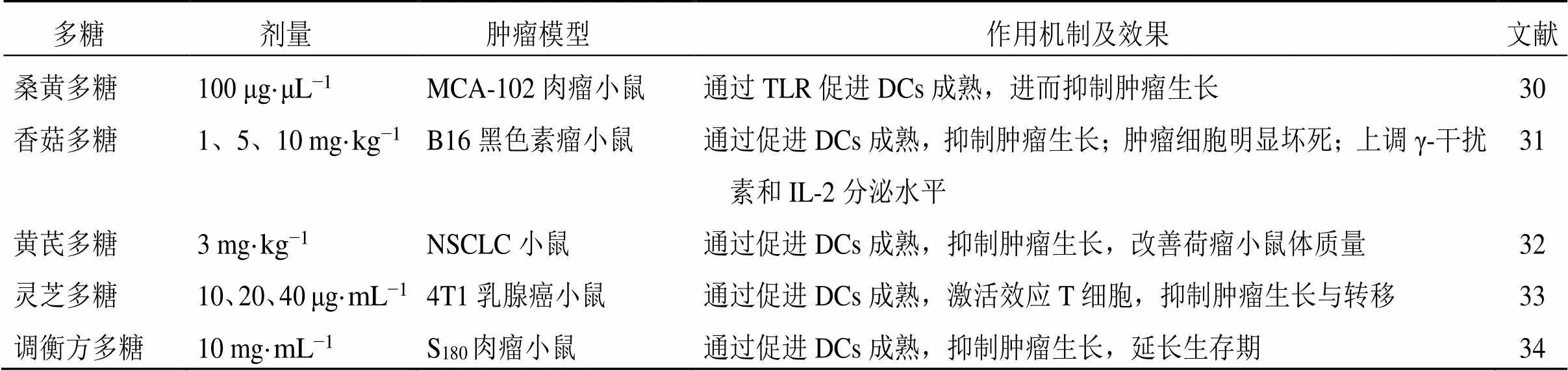
表2 中药多糖对TME中DCs的调节作用
3 MDSCs及中药多糖的靶向调控作用
MDSCs来源于共同骨髓祖细胞(common myeloid pro-genitor,CMP)和未成熟髓细胞(immature myeloid cells,IMCs),为树突状细胞、巨噬细胞或粒细胞的前体,具有显著抑制免疫应答的能力[35]。
3.1 MDSCs的生物学特性
在正常组织中,造血干细胞分化为CMP,CMP分化为IMCs,IMCs进一步分化为成熟的中性粒细胞、巨噬细胞或树突状细胞。正常组织内的MDSCs数量较少,而当机体发生肿瘤、炎症、感染、创伤等病理情况时,IMCs的正常分化可被炎性因子或肿瘤来源的细胞因子阻滞,诱导其成为MDSCs并在外周血、骨髓或病变部位募集、扩增、活化[36]。MDSCs有单核和多核,根据其来源分为粒细胞MDSCs(polymorphonuclear-MDSCs,PMN-MDSCs)和单核细胞MDSCs(monocytic-MDSCs,M-MDSCs)。不同来源MDSCs的功能特征不同,可通过不同途径进行积累、分化来发挥免疫抑制作用,其中PMN-MDSCs通过活性氧、精氨酸酶、前列腺素E2等表达介导免疫抑制;而M-MDSCs通过一氧化氮、IL-10、TGF-β等表达发挥免疫抑制。
3.2 MDSCs与TME的相互作用
MDSCs是TME中主要的“促瘤”细胞,可通过发挥免疫逃逸、促进肿瘤血管生成、促进肿瘤细胞侵袭和转移等促进肿瘤发生发展。
肿瘤细胞分泌相关趋化因子,将MDSCs募集至靶器官,而MDSCs通过产生精氨酸酶、iNOS、TGF-β、IL-10、一氧化氮、活性氧等细胞因子抑制CD4+和CD8+T细胞增殖,并分泌IL-10和TGF-β促进Treg的募集,降低先天性免疫应答能力,使肿瘤细胞逃避免疫系统的监视,最终促进肿瘤发展[37]。Notch信号通路对MDSCs的调控在肿瘤免疫逃逸中起重要作用。研究表明在黑色素瘤中,抑制Notch1可减少MDSCs和Treg的募集,促进CD8+T细胞的募集[38];MDSCs作为一种免疫抑制细胞,通过产生MMP9和VEGF促进肿瘤血管的生成、成熟并减少坏死;肿瘤细胞的迁移能力依赖于上皮间质转化(epithelial to mesenchymal transition,EMT),MDSC能够分泌TGF-β、EGF等诱导肿瘤细胞EMT,促进肿瘤转移[39],同时肿瘤血管的建立可以加强微环境内营养物质及氧气的运输从而促进肿瘤转移[40]。
3.3 中药多糖对MDSCs的调节作用
研究显示中药多糖可有效抑制MDSCs的募集、增殖及活化,调节细胞数量及功能,从而增强免疫应答,降低MDSCs应答的免疫抑制作用,为中药调节TME中MDSCs提供科学依据[41]。
柴旺等[42]发现黄芪多糖可抑制B16-F10黑色素瘤小鼠肿瘤的生长,其抑瘤率达到75.2%。同时通过抑制MDSCs产生,显著抑制IL-10及VEGF表达,促进γ-干扰素、TNF-α分泌并提高一氧化氮的生成,提高机体免疫功能,减缓肿瘤免疫逃逸现象,抑制肿瘤生长。Zhang等[43]发现芦笋多糖可显著降低MC38结肠癌小鼠MDSCs细胞增殖,抑制B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)的表达,增强Bcl-2相关X蛋白和半胱氨酸天冬氨酸蛋白酶-9的表达,通过TLR4相关信号通路诱导结肠癌小鼠模型脾脏中MDSCs的凋亡。冯子芳等[44]发现白术中提取的白术多糖对CT26结肠癌荷瘤小鼠肿瘤生长具有抑制作用,且抑瘤率呈现剂量相关性,通过增加血清TNF-α、IL-2水平,提高外周血CD4+/CD8+的值,降低MDSCs细胞增殖水平,增强小鼠的免疫功能。Wang等[45]报道灵芝多糖可显著降低Lewis肺癌小鼠的肿瘤组织的质量和体积,下调增殖细胞核抗原标记物,并且增加CD4+/CD8+T细胞的值,促进γ-干扰素、IL-12分泌,诱导MDSCs分化并抑制其增殖,显著抑制肿瘤生长。江洪等[46]报道从竹荪提取的多糖可抑制Lewis肺癌小鼠体内肿瘤细胞的生长,减小肿瘤体积,延长小鼠生存时间。通过上调基因、下调基因,促进MDSCs发生凋亡并显著下调MDSCs比例,从而发挥抗肿瘤作用。张孝钦等[47]报道从人参中提取的人参多糖可通过下调精氨酸酶、TGF-β、IL-10、VEGF,上调γ-干扰素、TNF-α水平,减少MDSCs、Treg细胞数量,发挥抗肿瘤作用,同时减轻NSCLC患者不良反应。崔伟等[48]发现黄芪多糖可减少宫颈癌患者免疫细胞MDSCs的数量,降低骨髓抑制并减轻患者不良反应。中药多糖对TME中MDSCs的调节作用见表3。

表3 中药多糖对TME中MDSCs的调节作用
4 TILs及中药多糖的靶向调控作用
TILs指从肿瘤组织中分离出的浸润淋巴细胞,包括T细胞、B细胞、NK细胞等,参与肿瘤免疫反应和调控肿瘤细胞生长过程[49]。
4.1 TILs的生物学特性
TILs是肿瘤中以T细胞为主的一类异质性淋巴细胞群体,T细胞又包括Th细胞、细胞毒性T细胞(cytotoxic T cell,CTL)和Treg细胞[50]。Th细胞表面表达CD4,被称为CD4+T细胞,该类型T细胞又根据其分泌的细胞因子不同分为Th1、Th2、Th17等细胞;CTL细胞表面表达CD8,被称为CD8+T细胞;Treg细胞表面表达叉头翼状螺旋转录因子3(forkhead box protein P3,FOXP3),被称为FOXP3+T细胞[51]。CD8+T细胞可通过识别主要组织相容性复合体-Ⅰ(major histocompatibility complex-I,MHC-Ⅰ)类分子的特异性抗原产生细胞毒作用;通过分泌穿孔素、颗粒酶、γ-干扰素、TNF-α等直接裂解病原体;CD4+T细胞主要是通过识别MHC-II类分子的特异性抗原来增强细胞及体液免疫[52];Treg可通过下调IL-2和分泌TGF-β等抑制APC,进而抑制T细胞活化。
4.2 TILs对肿瘤的双重作用
TILs在肿瘤的发生、发展过程中是一把双刃剑,既有抗肿瘤作用又有促进肿瘤作用。不同表型的T淋巴细胞及相关的分泌因子参与对肿瘤细胞的调控作用,其中CD8+CTL细胞、CD4+Th1细胞等可发挥抗肿瘤的免疫应答,抑制肿瘤的发生发展;FOXP3+Treg细胞、CD4+Th2细胞可发挥免疫抑制的作用,促进肿瘤的生长。而TME中的Treg是一种有效的免疫抑制细胞,被认为是肿瘤细胞逃避机体免疫监视的“罪魁祸首”[53],同时TME中Treg的免疫抑制作用还可能会对CTL的抗肿瘤作用产生影响[54]。CTL对肿瘤细胞具有极大的细胞毒性作用,通过裂解或诱导靶细胞凋亡实现细胞免疫。然而,随着CTL浸润到肿瘤组织中,会因增殖抑制甚至凋亡而衰竭[55]。Th1可通过诱导γ-干扰素、TNF-α、IL-2等细胞因子分泌发挥抗肿瘤作用,而Th2可通过产生IL-4、IL-5、IL-13等细胞因子发挥免疫抑制作用,因此,Th1/Th2水平是维持正常免疫状态的关键因素,Th1/Th2失衡常发生在肿瘤免疫相关疾病中[56]。Th17可通过产生γ-干扰素、IL-2等抗肿瘤细胞因子发挥抗肿瘤作用,同时还可招募免疫细胞至肿瘤细胞,被认为是肿瘤治疗的潜在靶点[57]。
4.3 中药多糖对TILs的调节作用
中药多糖可通过促进CD4+T淋巴细胞向Th1分化和减弱Th2反应发挥抗肿瘤作用,还可增加肿瘤组织中CD8+T淋巴细胞,消除Treg的免疫抑制作用。
Li等[58]通过将从灵芝中提取的多糖ip于肝癌小鼠,发现肝癌小鼠的肿瘤体积和质量均减小,通过增加IL-2的分泌消除Treg对效应T细胞(effector T cell,Teff)增殖的抑制作用,导致Teff/Treg增加,同时抑制Notch1和FOXP3+表达。Shu等[59]报道从丹参中提取的丹参多糖可以降低H22肝癌荷瘤小鼠的肿瘤质量,激发抗肿瘤免疫反应和CD4+T细胞的抗凋亡途径,促进抗凋亡基因的磷酸化,提高NK和CD8+T细胞的细胞毒活性,发挥抗肿瘤作用。王敏等[60]发现人参多糖注射液可有效缓解NSCLC患者的疾病控制率、客观缓解率,降低血清肿瘤标志物,可通过促进γ-干扰素、IL-2分泌,降低IL-4、IL-5分泌,调节Th1/Th2免疫平衡,改善NSCLC患者生存质量。Wang等[61]报道从香菇中提取的香菇多糖经肌肉注射可以增强NSCLC患者CTL细胞增殖、抑制Treg细胞增殖,降低CD4+CD25+Treg比例,恢复TME中Th1/Th2平衡,降低免疫抑制作用,进而发挥抗肿瘤作用。Yoshino等[62]发现经香菇多糖治疗后,消化系统肿瘤患者的CD4+γ-干扰素+T细胞百分比显著增加,而CD4+IL-4+T细胞和CD4+IL-6+T细胞百分比显著降低,Th1/Th2平衡得到改善。张景欣等[63]发现香菇多糖注射液可提高消化系统恶性肿瘤患者(肝癌、结肠癌、胆囊癌、胆管癌、胰腺癌)的免疫力,显著上调CD4+/CD8+T细胞表达水平,促进TNF-α生成,降低VEGF的表达而发挥抗肿瘤作用。中药多糖对TME中TILs的调节作用见表4。
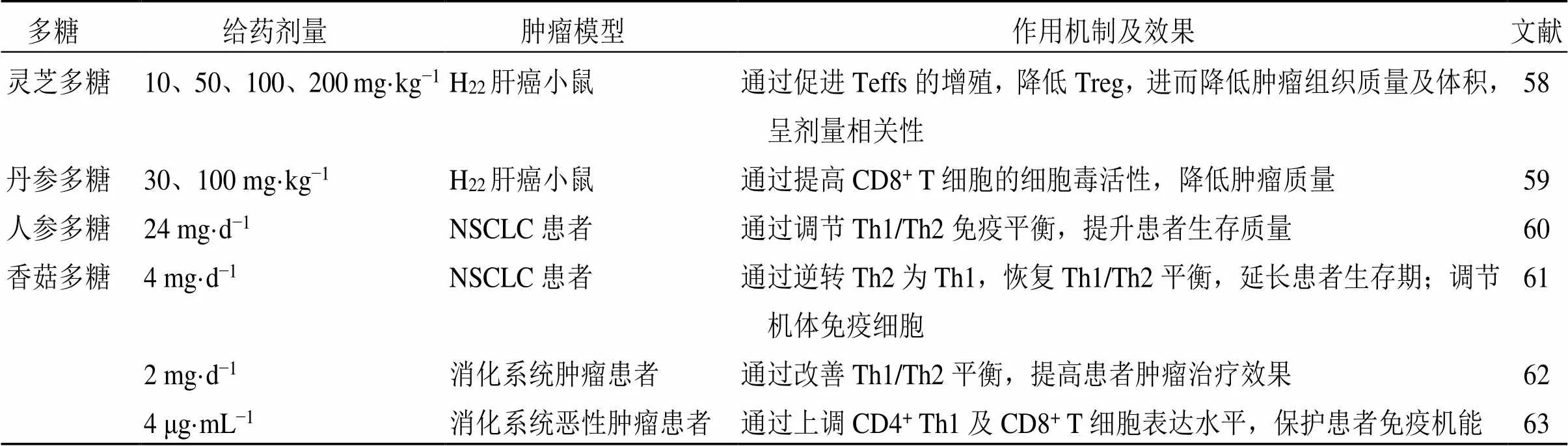
表4 中药多糖对TME中TILs的调节作用
5 TANs及中药多糖的靶向调控作用
正常的中性粒细胞来源于血液中的白细胞,具有一定的免疫调节作用,其特征是具有诱导吞噬作用、释放裂解酶和产生活性氧的能力[64-65]。浸润到肿瘤部位的中性粒细胞即TANs,其在TME中寿命短却发挥关键作用,可参与肿瘤血管的生成、肿瘤的增殖、浸润、侵袭和转移等过程[66]。
5.1 TANs的生物学特性
TANs通过细胞因子和趋化因子参与TME的调节。趋化因子具有诱导细胞定向趋化的能力,是促进肿瘤转移的关键因素之一[67]。CXC趋化因子吸引中性粒细胞,其中结合CXC趋化因子受体1(CXC chemokine receptor 1,CXCR1)、CXCR2的趋化因子介导中性粒细胞向肿瘤局部微环境迁移,在微环境中极化为不同的肿瘤相关中性粒细胞[68]。
在β-干扰素、IL-1β、IL-8等作用下,中性粒细胞可极化为抗肿瘤“N1”表型。N1-TANs具有寿命短、成熟表型、高细胞毒性、高免疫活性、促进CD8+T细胞活化等特征;而在TGF-β、IL-8、IL-6、IL-17等作用下,中性粒细胞极化促肿瘤“N2”表型[69]。N2-TANs具有寿命长、不成熟表型、低细胞毒性、促进肿瘤生长、浸润、转移、血管新生、抑制免疫等特征。
5.2 TANs对肿瘤的双重作用
中性粒细胞通过分泌趋化因子招募肿瘤细胞,并促进其向远处迁移,从而促进肿瘤细胞的转移。此外,TANs能够极化为抗肿瘤的“N1”表型或促肿瘤的“N2”表型,主要与β-干扰素和TGF-β有关[70]。研究表明,β-干扰素可诱导TANs极化为N1表型,介导中性粒细胞的抗肿瘤效应,同时促进N2型凋亡基因的表达[71]。TGF-β信号传导可影响TANs表型,肿瘤内的TGF-β诱导TANs向N2表型的极化促进肿瘤进展;而抑制TGF-β信号传导,则诱导TANs极化为N1表型。
N1-TANs可以通过分泌TNF-α、细胞间黏附分子(intercellular cell adhesion molecule,ICAM)、升高活性氧表达水平,降低精氨酸酶表达等,产生较强的细胞毒性,增强吞噬作用、表达高水平的炎症趋化因子、降低免疫抑制能力,从而发挥抗肿瘤作用[69,72]。N2-TANs可以通过细胞因子和趋化因子对肿瘤产生免疫抑制作用、促进血管生成及肿瘤细胞生长与转移。N2-TANs分泌精氨酸酶、MMP9、VEGF、TGF-β等刺激肿瘤细胞的增殖;中性粒细胞分泌的多种趋化因子单核细胞趋化蛋白2(monocyte chemoattractant protein2,CCL2)、CCL5、CXC趋化因子配体8(CXC motif chemokine ligand 8,CXCL8)、CXCL2、CXCL4、CXCL8和CXCL16与CXCR结合促进肿瘤细胞迁移[68,73]。此外,N2-TANs对T细胞具有抑制作用,对肿瘤细胞表现出较差的细胞毒性[74]。不同表型的TANs细胞对肿瘤的调节作用见图4。
5.3 中药多糖对TANs的调节作用
中药多糖可通过靶向TANs,阻断中性粒细胞向肿瘤迁移、清除中性粒细胞、抑制N2-TANs、调节TANs表型平衡等,抑制肿瘤的发展和转移,发挥抗肿瘤作用。
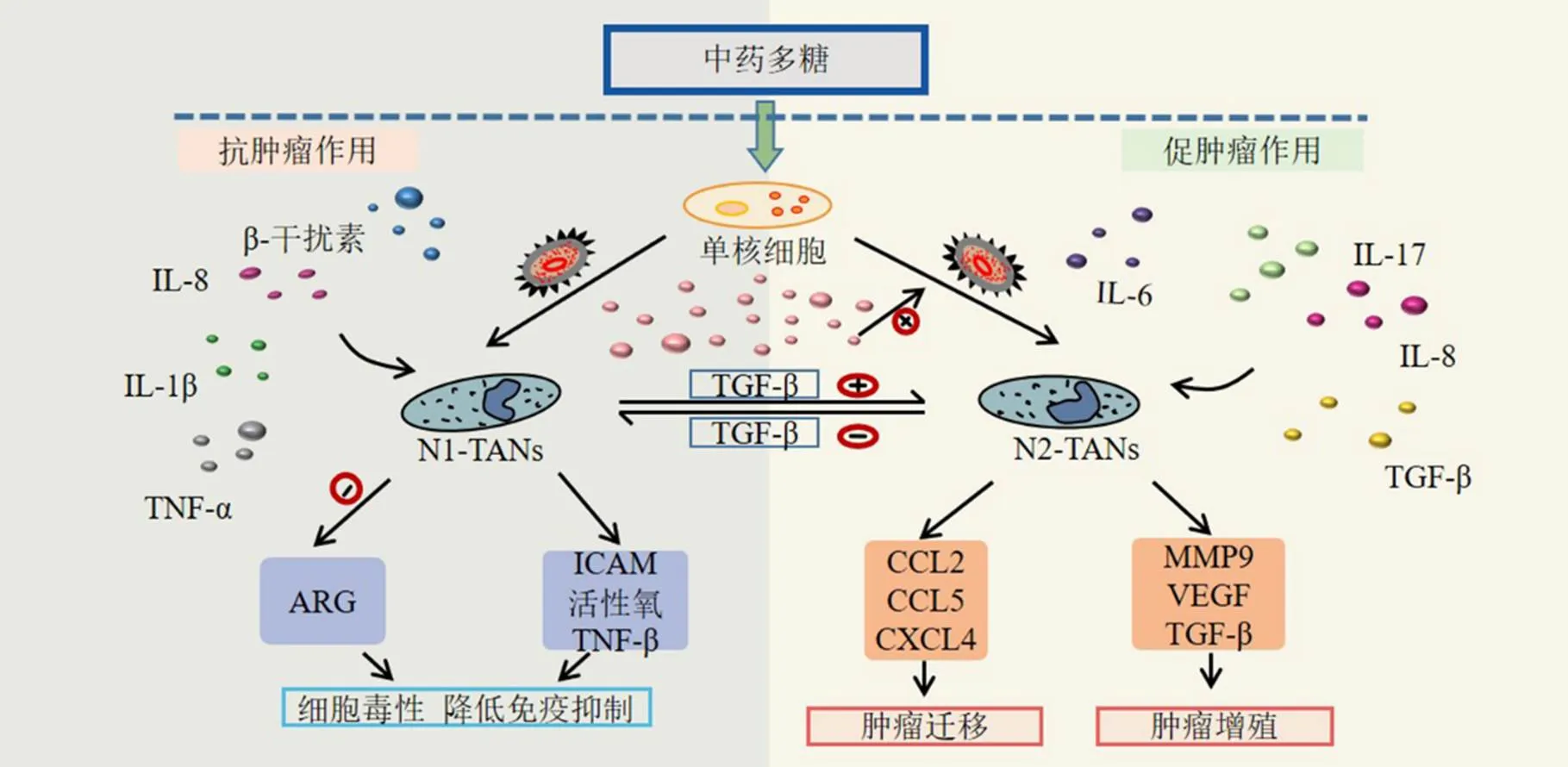
图4 不同表型TAN对肿瘤的调节作用
刘婷婷[75]研究发现草本多糖合剂(酵母胞壁多糖+鱼腥草水提液)可以改善1,2-二甲基肼(1,2- dimethylhydrazine,DMH)/葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠癌小鼠体质量,降低结肠癌的发生率,改善结肠缩短及损伤情况;通过减少中性粒细胞浸润,抑制促肿瘤相关蛋白精氨酸酶1、CXCL2、MMP9、iNOS的表达,从而抑制小鼠结肠癌的发生和发展。Xu等[76]从香菇中提取的香菇多糖可显著抑制EO771乳腺癌小鼠、LAP0297肺癌小鼠肿瘤的生长,通过促进CD8+T细胞的增殖与活化,诱导TAN极化为N1表型。Kalafati等[77]通过ip β-葡聚糖可诱导中性粒细胞表现为抗肿瘤N1表型,将β-葡聚糖诱导的小鼠中性粒细胞移植到B16-F10黑色素瘤细胞小鼠和Lewis肺癌小鼠体内,可以以活性氧依赖性的方式抑制荷瘤小鼠肿瘤的生长。Huang等[78]和Tsao等[79]发现黄芪多糖可以改善肿瘤患者的生存质量和生存时间,下调IL-1β、IL-6、IL-12、IL-17、单核细胞趋化蛋白1、VEGF、TGF-β1、γ-干扰素等细胞因子水平,并且与免疫检查点抑制剂联合治疗可以调节肺癌晚期患者的中性粒细胞与淋巴细胞比率,发挥抗肿瘤作用。中药多糖对TME中TANs的作用见表5。
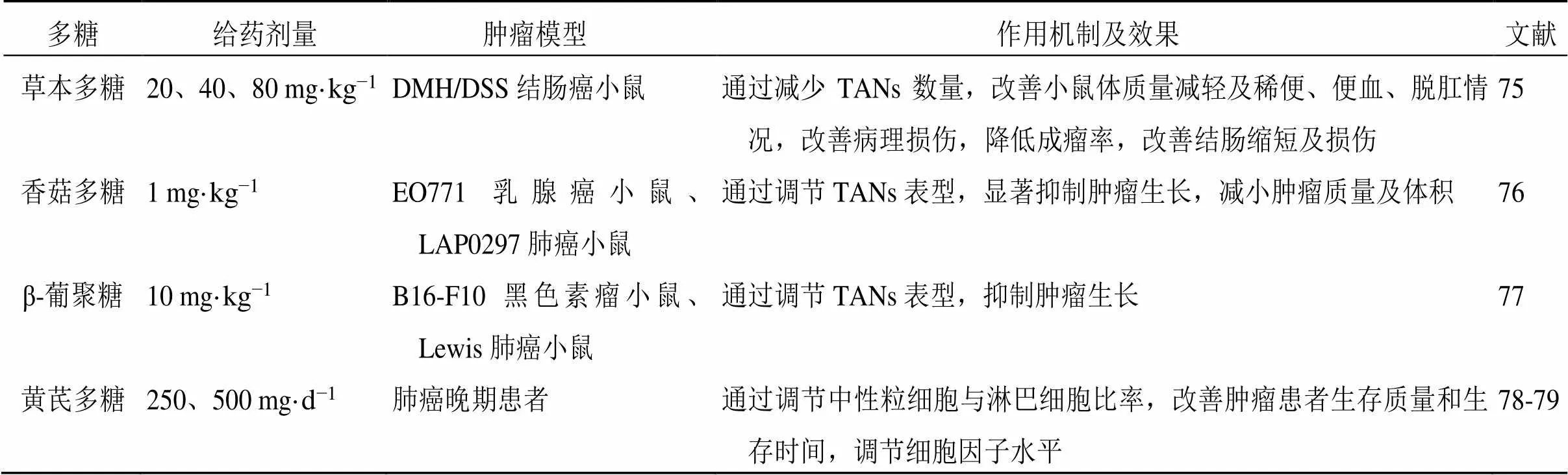
表5 中药多糖对TME中TANs的作用
6 结语与展望
近年来,免疫治疗已成为肿瘤治疗中最有前景的领域,调节免疫细胞生物学功能已被证明是发挥抗肿瘤作用的有力武器,并在临床上得到越来越多的应用。中药多糖作为来源广泛的天然活性大分子,可以通过抑制肿瘤生长、增强免疫调节能力、抑制肿瘤细胞侵袭和转移、抑制TME形成和发展等方式达到抗肿瘤效果,与传统的手术及放化疗手段相比,中药多糖展现出多通路、多靶点的作用优势和特点,同时能够提高肿瘤细胞对放化疗的敏感性,减轻不良反应,降低肿瘤耐药性和复发的风险,在肿瘤治疗中发挥积极作用[80]。本文总结了TME中肿瘤相关免疫细胞在肿瘤发生发展中的功能和作用,及中药多糖干预这些细胞组分的作用机制,为中药多糖抗肿瘤药物的未来研究提供参考。但目前中药多糖干预TME中的TAMs、DCs、MDSCs、TILs及TANs的作用机制仍不明确,系统深入性的基础研究工作还存在不足,导致临床应用上存在一定的局限性。
本文结合该领域目前的研究现状,对以下5个主要方面进行了归纳和展望:(1)目前中药多糖调节抗肿瘤免疫的研究报道大多集中在对TME中单一免疫细胞的数量、表型、活性、信号通路的影响方面,却忽略了“微环境”概念中多种细胞相互作用而协同发挥抗肿瘤的重要特点。多糖结构的复杂性、多样性使其具有多途径、多靶点的作用特点,对于肿瘤这种系统性疾病的预防和治疗,尤其对于免疫系统中免疫细胞的整体调节作用尤为重要,因此开展从微观到宏观、从单一细胞到细胞网络的研究工作是突破目前研究瓶颈的方向之一。(2)多糖作为生物活性大分子,需要与免疫细胞细胞膜上的模式识别受体结合,从而启动免疫调节与细胞免疫应答。而不同的免疫细胞具有不同的受体,不同来源的多糖可以与不同的受体结合,关于免疫细胞表面哪种受体参与多糖的识别和结合,及诱发的细胞级联反应一直是研究的热点,但目前研究还多集中于多糖作用后信号分子的改变,关于多糖受体种类和功能的进一步研究可做为揭示中药多糖特异性靶向免疫细胞调控TME作用机制的另一个研究方向。(3)肠道菌群与肿瘤的发生发展具有相关性,肠道菌群能够调节TME,影响肿瘤的发展。肠道的特征菌群与宿主TME中免疫细胞的功能有显著的相关性,多糖可作为益生元促进肠道中有益菌增殖、抑制致病菌的生长,维持肠道微生物菌多样性,促进肠道微生态平衡,从而调节TME发挥抗肿瘤作用,因此以“中药多糖-肠道菌群-TME-免疫细胞”为研究体系可较好地开拓中药多糖抗肿瘤机制的研究。(4)多糖的生物活性与其初级和高级结构密切相关,然而其构效关系的研究仍是目前该领域研究的缺陷,因此进一步突破多糖制备和表征关键技术壁垒对于中药多糖的创新改造和抗肿瘤精准用药具有重要意义。(5)此外还可着力于不同类型肿瘤的微环境中参与介导中药多糖免疫治疗作用的途径、中药多糖与化疗或免疫治疗药物的联合应用、中药多糖作为递药载体以及肿瘤靶向配体构建纳米递药系统调控TME等研究方向。
综上所述,加快开展并明确中药多糖调控TME的作用机制是亟待解决的一个关键问题,可为中药多糖在肿瘤治疗中的临床应用提供更全面的理论依据,具有重要的学术价值和实际意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 杨晨宇, 尚新悦, 姚国栋. 中药活性成分通过调控PKM2发挥抗肿瘤作用的研究进展 [J]. 中草药, 2022, 53(2): 590-598.
[2] Roma-Rodrigues C, Mendes R, Baptista P,. Targeting tumor microenvironment for cancer therapy [J]., 2019, 20(4): 840.
[3] 周雄, 杨明, 李翔, 等. 中药单体成分调节肿瘤微环境的研究进展 [J]. 中草药, 2021, 52(14): 4398-4409.
[4] Arneth B. Tumor microenvironment [J]., 2019, 56(1): 15.
[5] Liu T T, Li Q, Xu X,. Molecular mechanisms of anti-cancer bioactivities of seaweed polysaccharides [J]., 2022, 14(4): 528-534.
[6] 谢溢坤, 张静, 余茜, 等. 灵芝多糖类成分及其生物活性研究进展 [J]. 中草药, 2021, 52(17): 5414-5429.
[7] 罗林明, 石雅宁, 姜懿纳, 等. 人参抗肿瘤作用的有效成分及其机制研究进展 [J]. 中草药, 2017, 48(3): 582-596.
[8] Ngambenjawong C, Gustafson H H, Pun S H. Progress in tumor-associated macrophage (TAM)-targeted therapeutics [J]., 2017, 114: 206-221.
[9] DeNardo D G, Ruffell B. Macrophages as regulators of tumour immunity and immunotherapy [J]., 2019, 19(6): 369-382.
[10] Murray P J. Macrophage polarization [J]., 2017, 79: 541-566.
[11] Qiu Y Q, Chen T, Hu R,. Next frontier in tumor immunotherapy: Macrophage-mediated immune evasion [J]., 2021, 9(1): 1-19.
[12] Bernsmeier C, van der Merwe S, Périanin A. Innate immune cells in cirrhosis [J]., 2020, 73(1): 186-201.
[13] Li C L, Peng D, Huang W J,. Structural characterization of novel comb-like branched α--glucan fromand its immunoregulatory activitiesand[J]., 2019, 10(10): 6589-6603.
[14] Bruns H, Büttner M, Fabri M,. Vitamin D-dependent induction of cathelicidin in human macrophages results in cytotoxicity against high grade B-cell lymphoma [J]., 2014, 124(21): 4108.
[15] 李文斌. IL-17A/G-CSF axis对于免疫细胞的调控及其在结肠炎相关结直肠癌发生发展中的作用研究 [D]. 北京: 北京协和医学院, 2013.
[16] Annamalai RT, Turner P A, Carson W F 4th,. Harnessing macrophage-mediated degradation of gelatin microspheres for spatiotemporal control of BMP2 release [J]., 2018, 161: 216-227.
[17] Hao S, Meng J, Zhang Y,. Macrophage phenotypic mechanomodulation of enhancing bone regeneration by superparamagnetic scaffold upon magnetization [J]., 2017, 140: 16-25.
[18] Egawa M, Mukai K, Yoshikawa S,. Inflammatory monocytes recruited to allergic skin acquire an anti-inflammatory M2phenotype via basophil-derived interleukin-4 [J]., 2013, 38(3): 570-580.
[19] Rauff A, LaBelle S A, Strobel H A,. Imaging the dynamic interaction between sprouting microvessels and the extracellular matrix [J]., 2019, 10: 1011.
[20] Li X L, Liu R, Su X,. Harnessing tumor-associated macrophages as aids for cancer immunotherapy [J]., 2019, 18(1): 1-16.
[21] Zhan X D, Jia L X, Niu Y M,. Targeted depletion of tumour-associated macrophages by an alendronate- glucomannan conjugate for cancer immunotherapy [J]., 2014, 35(38): 10046-10057.
[22] 刘春萍. 猪苓多糖调节膀胱肿瘤微环境中巨噬细胞极化的机制及抑癌作用研究 [D]. 广州: 广州中医药大学, 2018.
[23] Zong S, Li J L, Ye Z Y,.polysaccharide suppresses S180sarcoma by boosting anti-tumor immune responses and skewing tumor-associated macrophages toward M1phenotype [J]., 2020, 144: 1022-1033.
[24] 王程成. 朝鲜淫羊藿多糖提取分离纯化及其肿瘤免疫活性研究 [D]. 南京: 南京中医药大学, 2017.
[25] Li Q, Hao Z H, Hong Y T,. Reprogramming tumor associated macrophage phenotype by a polysaccharide fromfor sarcoma immunotherapy [J]., 2018, 19(12): 3816.
[26] Wang W J, Wu Y S, Chen S,. Mushroom-glucan may immunomodulate the tumor-associated macrophages in the lewis lung carcinoma [J]., 2015, 2015: 1-15.
[27] 钱晶晶, 魏娟, 孟桂霞, 等. 灵芝多糖微乳诱导结直肠癌肿瘤相关巨噬细胞M1极化及其联合PD-1抑制剂协同抗肿瘤研究 [J]. 中国医院药学杂志, 2023, 43(3): 278-284.
[28] 施宣忍, 王莉, 崔晶. 肿瘤微环境下DC功能的抑制及作用机制 [J]. 中国免疫学杂志, 2016, 32(6): 896-899.
[29] Zhu S, Yang N, Wu J,. Tumor microenvironment- related dendritic cell deficiency: A target to enhance tumor immunotherapy [J]., 2020, 159: 104980.
[30] 李东东, 刘海燕, 宿抱玉, 等. 桑黄多糖对肿瘤微环境影响的研究 [J]. 泰山医学院学报, 2020, 41(4): 318-320.
[31] 王峻, 周智东, 夏大静. 香菇多糖增强树突状细胞瘤苗的抗肿瘤作用及其机制研究 [J]. 中国中西医结合杂志, 2007, 27(1): 60-64.
[32] Bamodu O A, Kuo K T, Wang C H,.polysaccharides (PG2) enhances the M1polarization of macrophages, functional maturation of dendritic cells, and T cell-mediated anticancer immune responses in patients with lung cancer [J]., 2019, 11(10): 2264.
[33] 张书磊. 灵芝多糖的纳米化及对树突状细胞的免疫调节和抗肿瘤研究 [D]. 上海: 上海中医药大学, 2019.
[34] 张宏方, 刘洋, 李文侠, 等. 调衡方多糖佐助的树突状细胞肿瘤疫苗增强S180荷瘤小鼠免疫功能并抑制肿瘤生长 [J]. 细胞与分子免疫学杂志, 2020, 36(10): 903-910.
[35] Hinshaw D C, Shevde L A. The tumor microenvironment innately modulates cancer progression [J]., 2019, 79(18): 4557-4566.
[36] 梁春艳, 邢海洲, 姜中兴. 髓源性抑制细胞在肿瘤免疫中的作用 [J]. 河南医学研究, 2021, 30(28): 5374-5376.
[37] Gabrilovich D I. Myeloid-derived suppressor cells [J]., 2017, 5(1): 3-8.
[38] 杨子科. RNAi干扰黑色素瘤细胞Notchl基因表达对小鼠机体抗肿瘤免疫的影响 [D]. 广州: 南方医科大学, 2015.
[39] Erin N, Grahovac J, Brozovic A,. Tumor microenvironment and epithelial mesenchymal transition as targets to overcome tumor multidrug resistance [J]., 2020, 53: 100715.
[40] Zhou J, Nefedova Y, Lei A,. Neutrophils and PMN-MDSC: Their biological role and interaction with stromal cells [J]., 2018, 35: 19-28.
[41] 胥孜杭, 张飞, 朱杨壮壮, 等. 肿瘤微环境中不同亚型的髓源抑制性细胞及中医药对其调控作用的研究进展 [J]. 中国实验方剂学杂志, 2019, 25(14): 45-54.
[42] 柴旺, 何小鹃, 朱军璇, 等. 黄芪多糖对B16-F10荷瘤鼠髓样抑制细胞免疫活性的影响 [J]. 中国中医基础医学杂志, 2012, 18(1): 63-65.
[43] Zhang W S, He W Z, Shi X D,. Anpolysaccharide fraction inhibits MDSCs by inducing apoptosis through toll-like receptor 4 [J]., 2018, 32(7): 1297-1303.
[44] 冯子芳, 杨瑞宾. 白术多糖通过TLR4信号通路对结肠癌CT26荷瘤小鼠肿瘤生长及免疫调节的影响 [J]. 中成药, 2022, 44(1): 231-235.
[45] Wang Y Y, Fan X W, Wu X W.polysaccharide (GLP) enhances antitumor immune response by regulating differentiation and inhibition of MDSCs via a CARD9-NF-κB-IDO pathway [J]., 2020, 40(6): BSR20201170.
[46] 江洪, 王小红. 以髓源抑制性细胞为靶点的竹荪多糖抗肿瘤机制研究 [J]. 中国医药科学, 2019, 9(24): 21-26.
[47] 张孝钦, 喻飒, 邬盛昌. 人参多糖对晚期肺癌化疗疗效及MDSCs、Treg细胞、免疫因子水平的影响 [J]. 中华全科医学, 2019, 17(8): 1308-1311.
[48] 崔伟, 刘爱珍, 谢琼, 等. 黄芪多糖联合新辅助化疗TP方案对宫颈癌患者免疫抑制细胞Treg和MDSC的影响 [J]. 华南国防医学杂志, 2018, 32(4): 238-241.
[49] 赵雪强, 李宁. 肿瘤浸润T淋巴细胞在非小细胞肺癌中的作用研究进展 [J]. 现代医药卫生, 2022, 38(11): 1892-1896.
[50] Linette G P, Carreno B M. Tumor-infiltrating lymphocytes in the checkpoint inhibitor era [J]., 2019, 14(4): 286-291.
[51] 梁锐, 李蕾蕾, 王志强. 肿瘤浸润性淋巴细胞在实体瘤的临床研究进展 [J]. 中国肿瘤临床, 2021, 48(22): 1168-1172.
[52] Toor S M, Murshed K, Al-Dhaheri M,. Immune checkpoints in circulating and tumor-infiltrating CD4+T cell subsets in colorectal cancer patients [J]., 2019, 10: 2936.
[53] Wang H P, Franco F, Ho P C. Metabolic regulation of tregs in cancer: Opportunities for immunotherapy [J]., 2017, 3(8): 583-592.
[54] Wolf D, Sopper S, Pircher A,. Treg(s) in cancer: Friends or foe? [J]., 2015, 230(11): 2598-2605.
[55] He Q F, Xu Y, Li J,. CD8+T-cell exhaustion in cancer: Mechanisms and new area for cancer immunotherapy [J]., 2019, 18(2): 99-106.
[56] Liu L Q, Nie S P, Xie M Y. Tumor microenvironment as a new target for tumor immunotherapy of polysaccharides [J]., 2016, 56(sup1): S85-S94.
[57] Knochelmann H M, Dwyer C J, Bailey S R,. When worlds collide: Th17 and Treg cells in cancer and autoimmunity [J]., 2018, 15(5): 458-469.
[58] Li A M, Shuai X Y, Jia Z J,.polysaccharide extract inhibits hepatocellular carcinoma growth by downregulating regulatory T cells accumulation and function by inducing[J]., 2015, 13: 100.
[59] Shu G W, Zhao W B, Yue L,. Antitumor immunostimulatory activity of polysaccharides fromBenth [J]., 2015, 168: 237-247.
[60] 王敏, 孔德军, 杨莉, 等. 人参多糖注射液联合TP方案对晚期非小细胞肺癌患者Th1/Th2免疫平衡和血清肿瘤标志物的影响 [J]. 现代生物医学进展, 2022, 22(7): 1352-1356.
[61] Wang X E, Wang Y H, Zhou Q,. Immunomodulatory effect of lentinan on aberrant T subsets and cytokines profile in non-small cell lung cancer patients [J]., 2020, 26(1): 499-505.
[62] Yoshino S, Tabata T, Hazama S,. Immunoregulatory effects of the antitumor polysaccharide lentinan on Th1/Th2 balance in patients with digestive cancers [J]., 2000, 20(6C): 4707-4711.
[63] 张景欣, 马明. 香菇多糖注射液对恶性肿瘤患者T淋巴细胞亚群及NK细胞的影响 [J]. 中医药学报, 2015, 43(4): 116-118.
[64] Borregaard N. Neutrophils, from marrow to microbes [J]., 2010, 33(5): 657-670.
[65] Carl N. Neutrophils and immunity: Challenges and opportunities [J]., 2006, 6(3): 173-182.
[66] Coffelt S B, Wellenstein M D, de Visser K E. Neutrophils in cancer: Neutral no more [J]., 2016, 16(7): 431-446.
[67] Itatani Y, Kawada K, Inamoto S,. The role of chemokines in promoting colorectal cancer invasion/ metastasis [J]., 2016, 17(5): 643.
[68] Gijsbers K, Gouwy M, Struyf S,. GCP-2/CXCL6 synergizes with other endothelial cell-derived chemokines in neutrophil mobilization and is associated with angiogenesis in gastrointestinal tumors [J]., 2005, 303(2): 331-342.
[69] Shaul M E, Fridlender Z G. Neutrophils as active regulators of the immune system in the tumor microenvironment [J]., 2017, 102(2): 343-349.
[70] Qin F X, Liu X Y, Chen J F,. Anti-TGF-β attenuates tumor growth via polarization of tumor associated neutrophils towards an anti-tumor phenotype in colorectal cancer [J]., 2020, 11(9): 2580-2592.
[71] Andzinski L, Wu C F, Lienenklaus S,. Delayed apoptosis of tumor associated neutrophils in the absence of endogenous IFN-Β [J]., 2015, 136(3): 572-583.
[72] Fridlender Z G, Sun J, Kim S,. Polarization of tumor-associated neutrophil phenotype by TGF-beta: N1 versus N2TAN [J]., 2009, 16(3): 183-194.
[73] Fridlender Z G, Albelda S M. Tumor-associated neutrophils: Friend or foe? [J]., 2012, 33(5): 949-955.
[74] Geh D, Leslie J, Rumney R,. Neutrophils as potential therapeutic targets in hepatocellular carcinoma [J]., 2022, 19(4): 257-273.
[75] 刘婷婷. 基于中性粒细胞浸润探讨草本多糖合剂防治结肠癌的作用及机制 [D]. 南昌: 江西中医药大学, 2022.
[76] Xu H Y, Qi Z W, Zhao Q,. Lentinan enhances the antitumor effects of Delta-like 1 via neutrophils [J]., 2022, 22(1): 1-11.
[77] Kalafati L, Kourtzelis I, Schulte-Schrepping J,. Innate immune training of granulopoiesis promotes anti-tumor activity [J]., 2020, 183(3): 771-785.
[78] Huang W C, Kuo K T, Bamodu O A,.polysaccharide (PG2) ameliorates cancer symptom clusters, as well as improves quality of life in patients with metastatic disease, through modulation of the inflammatory cascade [J]., 2019, 11(8): 1054.
[79] Tsao S M, Wu T C, Chen J Z,.polysaccharide injection (PG2) normalizes the neutrophil-to-lymphocyte ratio in patients with advanced lung cancer receiving immunotherapy [J]., 2021, 20: 153473542199525.
[80] 安香霖, 鲁金月, 董辉, 等. 中药多糖调控肿瘤微环境的研究进展[J]. 现代药物与临床, 2022, 37(9): 2142-2147.
Research progress on regulation of traditional Chinese medicine polysaccharides on immune cells in tumor microenvironment
WANG Di1, LI Jun1, HOU Bing-qiao1, NIU Jun-bo1, JI Chen-feng1, 2
1. Engineering Research Center for Medicine, College of Pharmacy, Harbin University of Commerce, Harbin 150076, China 2. Engineering Research Center of Natural Anticancer Drugs, Ministry of Education, Harbin University of Commerce, Harbin 150076, China
Tumor microenvironment (TME) plays an important role in the occurrence, development and metastasis of tumors. Traditional Chinese medicine (TCM) polysaccharide has obvious anti-tumor effect with multi-angle and multi-mechanism synergy, and can avoid drug resistance, which is a new field of antitumor drugs with great research value and development potential. This paper reviewed the immune cells in TME (tumor-associated macrophages, dendritic cells, myeloid-derived suppressor cells, tumor infiltrating lymphocytes, tumor-associated neutrophils), the biological properties of each immune cell and the research progress of the regulatory effects of TCM polysaccharides on them were systematically described to provide reference for the research and development of antitumor TCM.
tumor microenvironment; immune cell; traditional Chinese medicine polysaccharides; regulating effect; antitumor
R285
A
0253 - 2670(2023)13 - 4346 - 13
10.7501/j.issn.0253-2670.2023.13.028
2023-01-08
黑龙江省重点研发计划指导类项目(GZ20210088);黑龙江省中医药管理局科技计划项目(ZHY2020-175);哈尔滨商业大学产业化项目(22CZ13)
王 迪,硕士研究生,研究方向为中药多糖的化学和药理。E-mail: 2973113151@qq.com
通信作者:汲晨锋,研究员,从事中药多糖的化学和药理研究。E-mail: smilejcf001@sina.com
[责任编辑 赵慧亮]
