TPGS表面修饰岩白菜素固体脂质纳米粒的制备与口服生物利用度研究
2023-07-06杨金枝崔晓鸽郝海军
杨金枝,崔晓鸽,郝海军
TPGS表面修饰岩白菜素固体脂质纳米粒的制备与口服生物利用度研究
杨金枝1,崔晓鸽1,郝海军2, 3*
1. 郑州澍青医学高等专科学校,河南 郑州 450064 2. 上海市中药研究所,上海 201401 3. 上海雷允上药业有限公司,上海 201401
制备-α-维生素E聚乙二醇1000琥珀酸酯(TPGS)修饰岩白菜素固体脂质纳米粒(TPGS surface-modified bergenin solid lipid nanoparticles,TPGS-Ber-SLN),并考察其体外释药和口服药动学行为。采用高压均质法制备TPGS-Ber-SLN。以包封率、载药量和粒径为考察指标,通过单因素考察结合Box-Behnken设计-效应面法(Box Behnken design- response surface methodology,BBD-RSM)优化TPGS-Ber-SLN处方,并制备成冻干粉末。X射线粉末衍射法(X-ray powder diffraction,XRPD)和差式扫描量热法(differential scanning calorimetry,DSC)分析岩白菜素在TPGS-Ber-SLN冻干粉末中的存在状态,透析袋法考察TPGS-Ber-SLN在不同介质中释药情况。以岩白菜素原料药为参考,比较TPGS-Ber-SLN在体内药动学行为及口服生物利用度。TPGS-Ber-SLN最佳处方工艺:岩白菜素用量为40 mg,单硬脂酸甘油酯用量525 mg,泊洛沙姆188质量浓度为17.5 mg/mL,TPGS质量浓度为0.2 mg/mL,均质次数为9次。TPGS-Ber-SLN的平均包封率、载药量、粒径及ζ电位分别为(83.16±1.09)%、(4.97±0.13)%、(229.46±19.07)nm和(−15.67±0.23)mV,体外释药过程符合Weibull模型。口服药动学结果显示,TPGS-Ber-SLN的max延长至(2.07±0.43)h,1/2延长至(4.21±0.78)h,max和生物利用度分别提高至3.91倍和5.34倍。TPGS-Ber-SLN显著改变了岩白菜素的药动学行为,增加了口服吸收生物利用度。
岩白菜素;固体脂质纳米粒;-α-维生素E聚乙二醇1000琥珀酸酯;药动学;口服生物利用度
岩白菜素(bergenin,Ber)是一类异香豆素类化合物,主要存在于虎耳草科、豆科、紫金牛科等植物中[1],国内外研究显示,岩白菜素具有抗肿瘤、消炎、镇痛、增强免疫、抗糖尿病、肾脏保护、镇咳等活性[1-2],且毒性很小[1],具备开发成新药的潜力。岩白菜素属于生物药剂学IV类药物[3],在25 ℃下溶解度为(1.37±0.02)mg/mL[4],表观油/水分配系数lg为−1.060±0.033~−1.190±0.044[3]。据报道[4-5],岩白菜素在酸性和中性条件下可保持稳定,但在碱性条件下可发生降解现象,降解速度随着pH值增加而加快[5],且受P-糖蛋白外排作用影响[6]导致岩白菜素口服生物利用度仅为4.83%[5]。目前岩白菜素已有固体分散体[7]、磷脂复合物[3]、自微乳[8]等制剂新技术报道。但固体分散体并不能改善岩白菜素的透膜能力及P-糖蛋白外排作用等;磷脂复合物在胃肠道中容易发生解离[9],可能会削弱促吸收作用;自微乳技术需要添加大量的表面活性剂,存在一定的安全隐患。
固体脂质纳米粒(solid lipid nanoparticles,SLN)是由可生物降解、安全性高的固态脂质作为载体制备的一种纳米给药系统,具有提高药物在胃肠道的稳定性、促进药物体内吸收、提高生物利用度、增强药效等优势[10-11],且SLN的稳定性优于脂质体[12]。-α-维生素E聚乙二醇1000琥珀酸酯(-α- tocopheryl polyethylene glycol 1000 succinate,TPGS)是一种非离子型表面活性剂,不仅有助于增加药物的溶解度、提高纳米制剂的包封率,而且可抑制P-糖蛋白活性[13-14],从而有利于增加药物口服吸收[15-17]。故本研究将岩白菜素制备成TPGS表面修饰固体脂质纳米粒(TPGS surface-modified bergenin solid lipid nanoparticles,TPGS-Ber-SLN),以包封率、载药量、粒径为指标,通过单因素试验结合Box-Behnken设计-效应面法(Box Behnken design-response surface methodology,BBD-RSM)优化TPGS-Ber-SLN处方工艺,为便于储存及给药故将TPGS-Ber-SLN制备成冻干粉,并考察TPGS- Ber-SLN冻干粉体外释药及体内药动学行为,为后续药效学评价奠定实验基础。
1 仪器与材料
1.1 仪器
BSA124S型电子天平,赛多利斯科学仪器有限公司;1100型高效液相色谱仪,美国Agilent公司;HJ-3型磁力搅拌器,常州市伟嘉仪器制造有限公司;RCY-1400T型智能溶出仪,博科控股集团有限公司;RE-200型旋转蒸发仪,华辰仪器有限公司;KL-060型超声波仪器,深圳市科力超声波洗净设备有限公司;CGJB60-70型实验室用高压均质机,郑州玉祥机械设备有限公司;XLW型超低温冰箱,江苏天日智能科技有限公司;LGJ-10N型真空冻干机,北京亚星仪科科技发展有限公司;Topsizer型激光粒度分析仪,珠海欧美克仪器有限公司;JEM-2100 透射电子显微镜(TEM),日本电子株式会社;HS-50AA型恒温恒湿箱,上海目尼实验设备有限公司;D8 Venture型X射线粉末衍射仪,德国布鲁克仪器公司;DSC-HSC-2型差示扫描量热仪,北京恒久实验设备有限公司;ZX-DC型氮吹仪,北京众信佳仪科技有限公司。
1.2 试剂
岩白菜素对照品,批号JW10533,质量分数98.6%,上海极威生物科技有限公司;岩白菜素原料药,批号191208,质量分数98.0%,湖北新星化工有限公司;对乙酰氨基酚对照品,批号100018- 210615,质量分数99.4%,中国食品药品检定研究院;磷酸(批号C12747030)、四氢呋喃(批号C10303495),上海麦克林生化科技有限公司;单硬脂酸甘油酯(批号F1821057)、聚乙二醇1000维生素E琥珀酸酯(TPGS,批号T124208),阿拉丁试剂(上海)有限公司;无水乙醇(批号20200921)、醋酸乙酯(批号20200322),国药集团化学试剂有限公司;大豆磷脂,批号200718,上海辅必成医药科技有限公司;泊洛沙姆188(批号WPEE587E,德国巴斯夫有限公司);乳糖(批号191220)、甘露醇(批号201028),郑州宇控生物科技有限公司;其他试剂均为分析纯。
1.3 动物
SD大鼠,体质量(220±20)g,雌雄兼具,购自河南动物实验中心[许可证号SCXK(豫)2020- 0001],每组实验中雌雄数量各半。饲养温度为20~25 ℃,相对湿度为50%~65%,实验室适应1周后进行药动学研究,给药前禁食12 h,自由饮水。遵循郑州澍青医学高等专科学校有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 TPGS-Ber-SLN的制备[15,17]
精密称取40 mg岩白菜素和100 mg大豆磷脂至圆底烧瓶,加入10 mL四氢呋喃并置于75 ℃水浴中磁力搅拌1 h(800 r/min)至澄清,减压旋蒸除去四氢呋喃[4],加入处方量的固态脂质和10 mL无水乙醇并置于75 ℃水浴中,磁力搅拌(800 r/min)约10 min至体系澄清即得有机相。配制含一定质量浓度的泊洛沙姆188及TPGS的水相,水相体积为50 mL,置于75 ℃水浴中磁力搅拌溶解。将有机相缓慢加至水相,继续磁力搅拌20 min(800 r/min),于一定均质压力下均质数次,置于−10 ℃冰箱中存放15 min,过0.45 μm微孔滤膜,补加蒸馏水至50 mL,即得TPGS-Ber-SLN混悬液。
2.2 TPGS-Ber-SLN中岩白菜素含量测定
2.2.1 色谱条件[6]色谱柱为Diamonsil C18柱(150 mm×4.6 mm,5 µm);检测波长为275 nm;柱温为30 ℃;流动相为甲醇-水(20∶80,稀磷酸调节pH值至2.5);体积流量为1.0 mL/min;进样体积为10 µL。理论塔板数以岩白菜素计不低于6000。
2.2.2 TPGS-Ber-SLN供试品溶液的配制 精密量取1 mL的TPGS-Ber-SLN混悬液至50 mL量瓶中,加入约30 mL甲醇超声5 min(超声功率为250 W、频率为40 kHz),加入甲醇稀释,混匀后过0.45 μm微孔滤膜。精密量取5 mL至10 mL量瓶中,加入流动相稀释,即得TPGS-Ber-SLN供试品溶液。
2.2.3 岩白菜素对照品溶液的配制 精密称取岩白菜素对照品20 mg至100 mL量瓶中,加入约80 mL甲醇超声溶解(超声功率为250 W、频率为40 kHz),加入甲醇稀释至刻度,即得岩白菜素对照品储备液(质量浓度为200 μg/mL)。
2.2.4 线性关系考察 分别精密量取质量浓度为200 μg/mL的岩白菜素对照品储备液,加入流动相配制成质量浓度为10.00、5.00、2.50、1.00、0.50、0.05 μg/mL的系列对照品溶液,按“2.2.1”项下色谱条件测定,以岩白菜素峰面积为纵坐标(),质量浓度为横坐标(),得回归方程为=17.666 2-0.045 8,=0.999 9,结果表明岩白菜素在0.05~10.00 μg/mL线性关系良好。
2.2.5 专属性考察 取空白辅料制备阴性样品,另取岩白菜素对照品溶液和TPGS-Ber-SLN供试品溶液分别进样测定,结果见图1,试验结果表明辅料未对岩白菜素色谱峰产生干扰,专属性高。
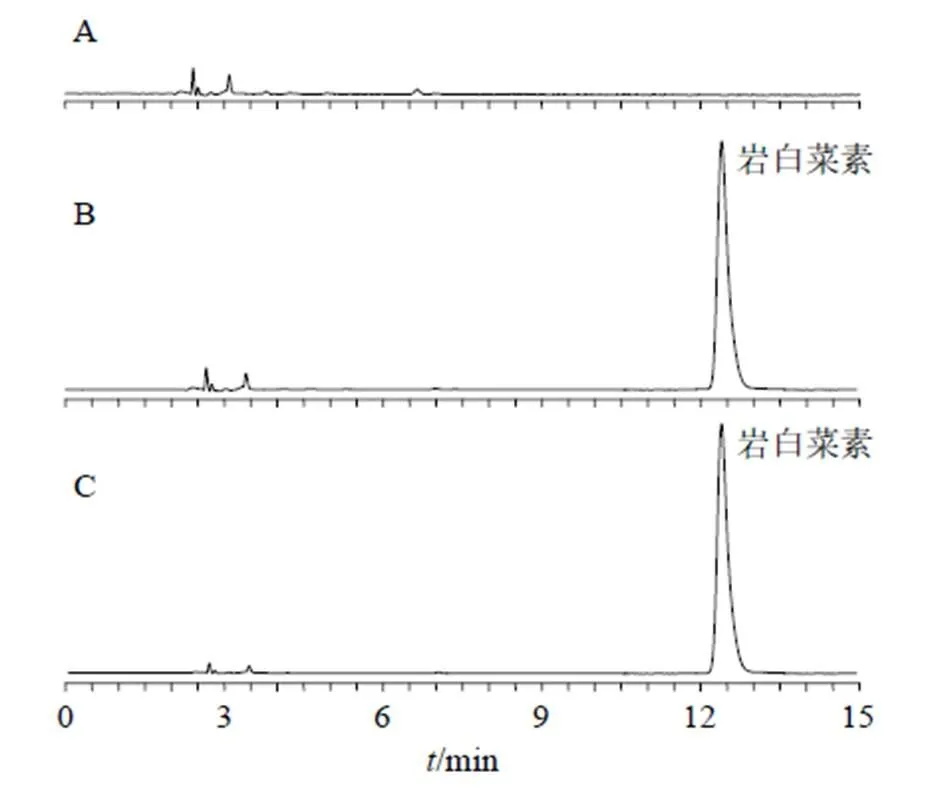
图1 空白辅料(A)、岩白菜素对照品(B)和TPGS-Ber-SLN样品(C)溶液的HPLC图
2.2.6 精密度考察 取0.05、2.50、10.00 μg/mL对照品溶液,按“2.2.1”项下色谱条件分别连续进样测定6次,计算得岩白菜素峰面积的RSD分别为0.68%、0.12%、0.16%,结果表明仪器精密度良好。
2.2.7 重复性考察 取1份TPGS-Ber-SLN混悬液,按“2.2.2”项下方法平行制备6份TPGS-Ber-SLN供试品溶液并进样测定,按“2.2.1”项下色谱条件分别进样测定,计算得岩白菜素质量浓度的RSD为0.89%,结果表明该方法的重复性良好。
2.2.8 稳定性考察 取TPGS-Ber-SLN供试品溶液,置于室温(温度25 ℃,湿度55%),分别于制备后0、2、4、8、12、24 h取样,按“2.2.1”项下色谱条件分别进样测定,计算得岩白菜素峰面积的RSD为1.45%,结果表明供试品溶液在24 h内稳定性良好。
2.2.9 加样回收率考察 精密量取0.5 mL的TPGS-Ber-SLN混悬液置于50 mL量瓶中,平行9份,分为低、中、高3组,分别加入岩白菜素对照品储备液(质量浓度为200 μg/mL)1、2、3 mL,按照“2.2.2”项下方法分别制备TPGS-Ber-SLN的供试品溶液,按“2.2.1”项下色谱条件测定岩白菜素含量,计算得岩白菜素的平均加样回收率为101.54%,RSD为1.58%。
2.3 TPGS-Ber-SLN包封率及载药量的测定
精密量取TPGS-Ber-SLN混悬液1 mL至超滤管中(平均截留相对分子质量12 000),于4 ℃下12 500 r/min离心(离心半径为6.8 cm)20 min[18],取续滤液,按“2.2.1”项下色谱条件测定游离岩白菜素的量(游离)。精密量取TPGS-Ber-SLN混悬液1 mL按“2.2.2”项下方法处理后按“2.2.1”项下色谱条件测定岩白菜素总量(总)。精密量取4 mL的TPGS-Ber-SLN混悬液于−50 ℃预冻1 d后置于低温冻干机中(−40 ℃)直接冻干,称定质量,计算1 mL的TPGS-Ber-SLN混悬液中药物与辅料总质量(总)。计算TPGS-Ber-SLN的包封率及载药量。
包封率=(总-游离)/总
载药量=(总-游离)/总
2.4 TPGS-Ber-SLN粒径及ζ电位的测定
精密量取TPGS-Ber-SLN混悬液0.1 mL,加入蒸馏水稀释40倍,摇匀。取4 mL置于四面透光型比色皿中测定TPGS-Ber-SLN粒径及多分散指数(polydispersity index,PDI)值。取稀释后的TPGS-Ber-SLN混悬液适量至ζ电位专用样品池中,测定ζ电位,平行测定3次,取平均值。
2.5 TPGS-Ber-SLN处方工艺研究
2.5.1 固态脂质种类的考察 岩白菜素投药量为40 mg,固态脂质用量为500 mg,泊洛沙姆188质量浓度为15.0 mg/mL,TPGS质量浓度为0.20 mg/mL,均质压力为80 MPa,均质次数为6次,考察固态脂质种类对TPGS-Ber-SLN的影响,结果见表1。结果显示,与双硬脂酸甘油酯和硬脂酸相比,单硬脂酸甘油酯制得的TPGS-Ber-SLN具有相对较高的包封率和载药量,平均粒径虽大于双硬脂酸甘油酯制得的TPGS-Ber-SLN,但两者之间无显著性差异(=0.152 8>0.05),因此,选择单硬脂酸甘油酯作为制备TPGS-Ber-SLN的固态脂质。
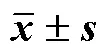
表1 固态脂质种类考察(, n = 3)
2.5.2 单硬脂酸甘油酯用量的考察 岩白菜素投药量为40 mg,单硬脂酸甘油酯为固态脂质,泊洛沙姆188质量浓度为15.0 mg/mL,TPGS质量浓度为0.20 mg/mL,均质压力为80 MPa,均质次数为6次,考察单硬脂酸甘油酯用量对TPGS-Ber-SLN的影响,结果见表2。结果显示,TPGS-Ber-SLN包封率随着单硬脂酸甘油酯用量增加而增加,可见加大载体用量利于提高包封率。但载药量随着单硬脂酸甘油酯用量的增加呈先增大后下降趋势,而粒径呈现先变小后增大趋势。为获得较高包封率和载药量、较小粒径的TPGS-Ber-SLN处方,选择单硬脂酸甘油酯用量在450~600 mg进行优化。
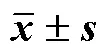
表2 单硬脂酸甘油酯用量的考察(, n = 3)
2.5.3 泊洛沙姆188质量浓度的考察 岩白菜素投药量为40 mg,单硬脂酸甘油酯用量为500 mg,TPGS质量浓度为0.20 mg/mL,均质压力为80 MPa,均质次数为6次,考察泊洛沙姆188质量浓度对TPGS-Ber-SLN的影响,结果见表3。结果显示,随着泊洛沙姆188质量浓度的增加TPGS-Ber-SLN包封率和载药量呈先增加后下降情况,所以适量增加泊洛沙姆188利于增加包封率及载药量,但泊洛沙姆188用量过大时可能由于增溶作用使药物进入水相[18],导致包封率和载药量下降。TPGS-Ber-SLN粒径随着泊洛沙姆188质量浓度增加总体呈下降趋势,可见泊洛沙姆188质量浓度对TPGS-Ber-SLN影响较大,后续可对质量浓度12.5~22.5 mg/mL进行优化。
2.5.4 TPGS质量浓度的考察 岩白菜素投药量为40 mg,单硬脂酸甘油酯用量为500 mg,泊洛沙姆188质量浓度为15.0 mg/mL,均质压力为80 MPa,均质次数为6次,考察TPGS质量浓度对TPGS- Ber-SLN的影响,结果见表4。结果显示,当处方中不含TPGS时包封率及载药相对较低,随着TPGS质量浓度的增加TPGS-Ber-SLN包封率和载药量逐渐增加后下降,而粒径呈逐渐增加趋势。可能是由于TPGS长链有助于阻止TPGS-Ber-SLN表层或浅表层药物泄露[19],从而使包封率和载药量增加;但TPGS用量过大时,TPGS长链之间的排斥作用降低了TPGS-Ber-SLN表面致密度,从而导致药物泄露。由于TPGS质量浓度为0.2 mg/mL时包封率和载药量均相对较高,粒径小于250 nm,故确定TPGS质量浓度为0.2 mg/mL。
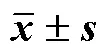
表3 泊洛沙姆188质量浓度的考察(, n = 3)
2.5.5 均质压力的考察 岩白菜素投药量为40 mg,单硬脂酸甘油酯用量为500 mg,泊洛沙姆188质量浓度为17.5 mg/mL,TPGS质量浓度为0.20 mg/mL,均质次数为6次,考察均质压力对TPGS- Ber-SLN的影响,结果见表5。结果显示,均质压力在60~80 MPa时对TPGS-Ber-SLN包封率和载药量无显著性影响,但压力达到90 MPa时包封率和载药量出现明显下降情况,可能是均质压力较高时体系温度过高,在表面活性剂作用下使岩白菜素进入水相从而降低了TPGS-Ber-SLN的包封率及载药量。较高的均质压力也使TPGS-Ber-SLN粒径出现增长趋势,为降低过高均质压力带来的影响,故固定均质压力为80 MPa。
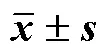
表4 TPGS质量浓度的考察(, n = 3)
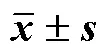
表5 均质压力的考察(, n = 3)
2.5.6 均质次数的考察 岩白菜素投药量为40 mg,单硬脂酸甘油酯用量为500 mg,泊洛沙姆188质量浓度为17.5 mg/mL,TPGS质量浓度为0.20 mg/mL,均质压力为80 MPa,考察均质次数对TPGS-Ber-SLN的影响,结果见表6。结果显示,随着均质次数的增加TPGS-Ber-SLN包封率和载药量均呈现先增加后下降,而粒径呈下降后增加情况。说明均质次数过少或过多均会对TPGS-Ber-SLN的各项指标产生影响,后续需对均质次数在6~10次进行优化。
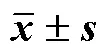
表6 均质次数的考察(, n = 3)
2.6 BBD-RSM优化TPGS-Ber-SLN处方工艺
2.6.1 试验方案 结合单因素试验发现单硬脂酸甘油酯用量、泊洛沙姆188质量浓度和均质次数对TPGS-Ber-SLN影响较大,故分别将其作为自变量1、2、3,各水平设置见表7。BBD-RSM仍采用包封率、载药量和粒径作为优化指标,即作为因变量1、2和3。为了得到具有较高包封率及载药量、同时具有较小粒径的TPGS-Ber-SLN处方工艺,将3个指标作归一化处理。
归一值(overall desirability,OD)计算过程为①包封率和载药量计算公式为max=(M-min)/ (max-min);②粒径计算公式为min=(max-M)/(max-min),其中max和min分别为该试验组中最大及最小值,M为实际值;③OD=(12…d)1/k。
分别制备TPGS-Ber-SLN,各组均进行3次平行试验,取平均值,结果见表7。
2.6.2 模型拟合、效应面图处方工艺的确定 采用Design Expert V8.0.6软件对试验数据进行拟合,得OD方程:OD=0.93+4.03×10−31-9.21×10−32+0.043+0.0812+0.0613-0.2923-0.5112-0.2822-0.2932。
方差分析结果(表8)显示,模型<0.000 1,2=0.992 6,adj2=0.983 1,失拟项=0.057 7>0.05,说明所选模型的拟合度较高。OD方程中3、12、13具有显著性差异(<0.05),23、12、22和3具有极显著性差异(<0.01),交互作用三维效应面见图2,当固定某一因素时,随着其他2因素(质量浓度、用量或次数)的增加响应值OD均呈现先增大后减小趋势,说明采用BBD-RSM优化TPGS-Ber-SLN处方工艺是非常必要的。
TPGS-Ber-SLN最佳处方工艺为单硬脂酸甘油酯524.71 mg,泊洛沙姆188质量浓度为17.2 mg/mL,均质次数为8.72次。包封率、载药量和粒径的预测值分别为83.87%、5.14%和224.37 nm。
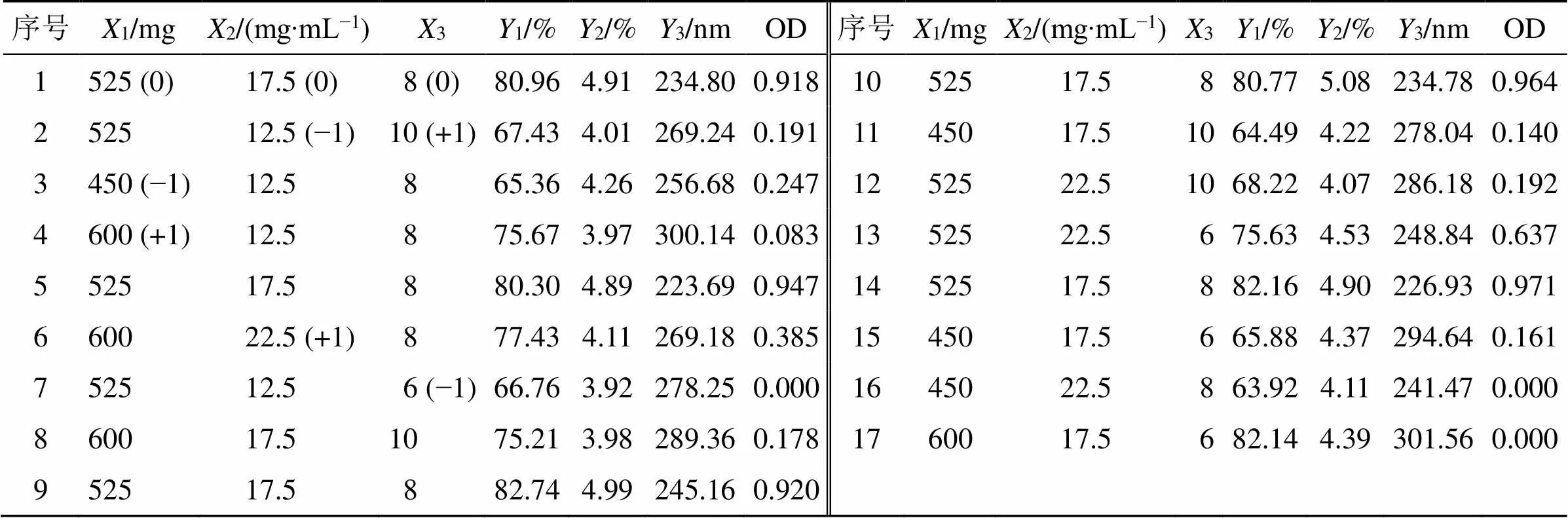
表7 BBD-RSM试验设计与结果(n = 3)
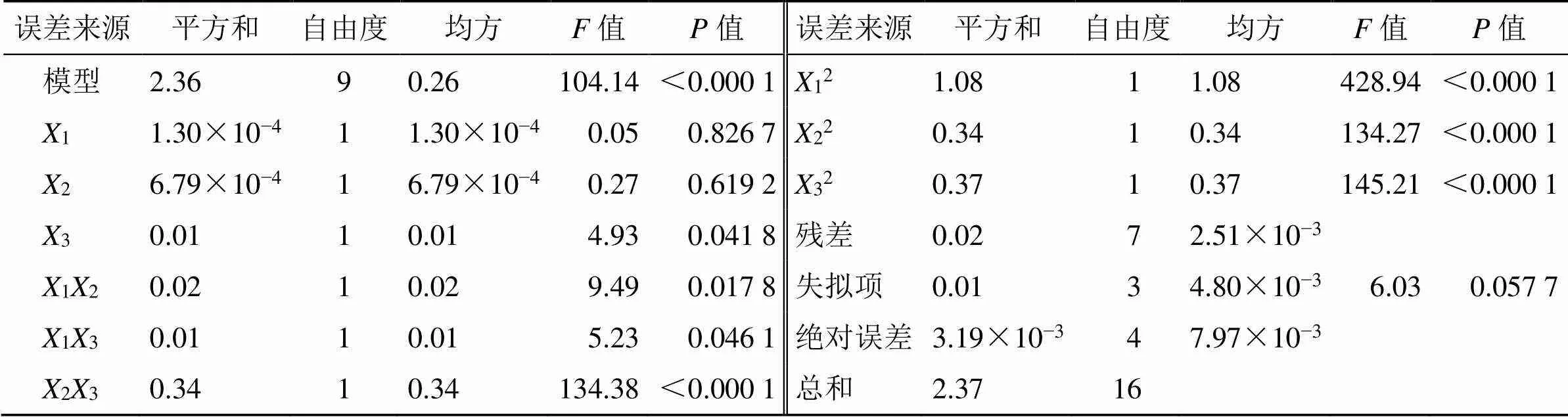
表8 方差分析
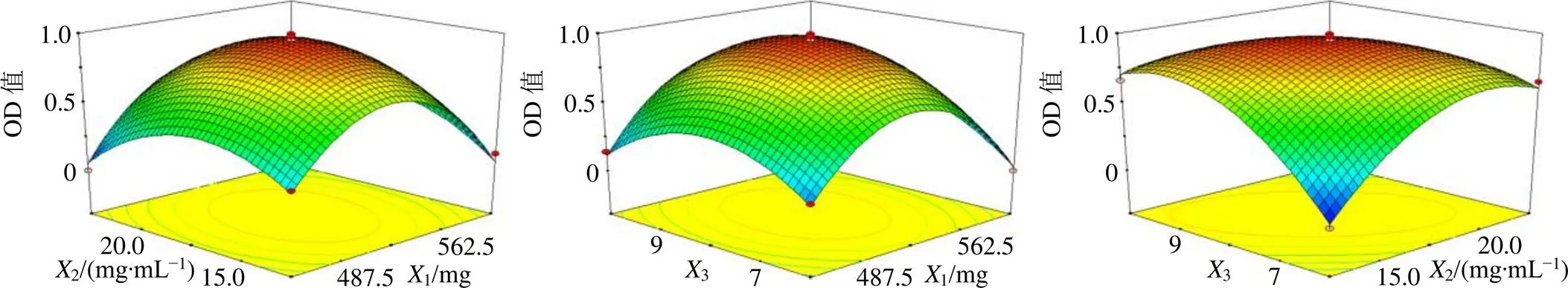
图2 不同因素对OD值的效应面
2.7 处方工艺验证
为便于实际操作,将单硬脂酸甘油酯用量调整为525 mg,泊洛沙姆188质量浓度调整为17.5 mg/mL,均质次数调整为9次,按“2.2”项方法平行制备3批TPGS-Ber-SLN,按“2.3”及“2.4”项下方法操作,分别测定TPGS-Ber-SLN包封率、载药量及粒径,并计算各自测定值与预测值的偏差,结果见表9。TPGS-Ber-SLN的包封率、载药量及粒径的偏差均小于±5%。粒径分布见图3,平均PDI为0.099±0.011,平均ζ电位为(−15.67±0.23)mV,ζ电位见图4。
偏差=(测定值-预测值)/预测值
表9 验证实验结果(, n = 3)
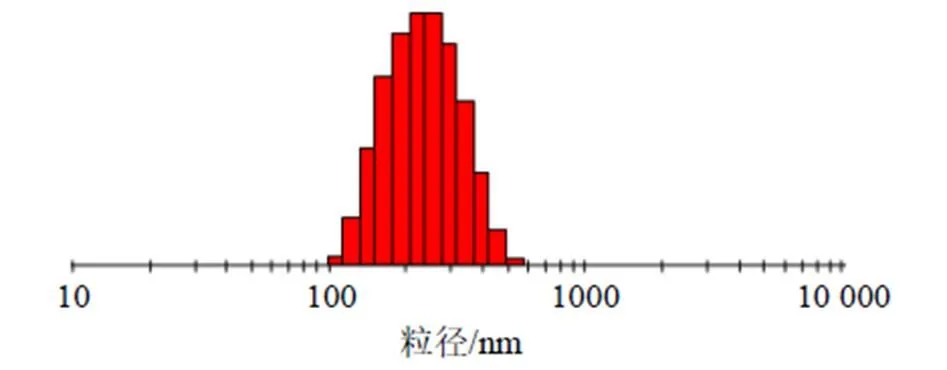
图3 TPGS-Ber-SLN粒径分布
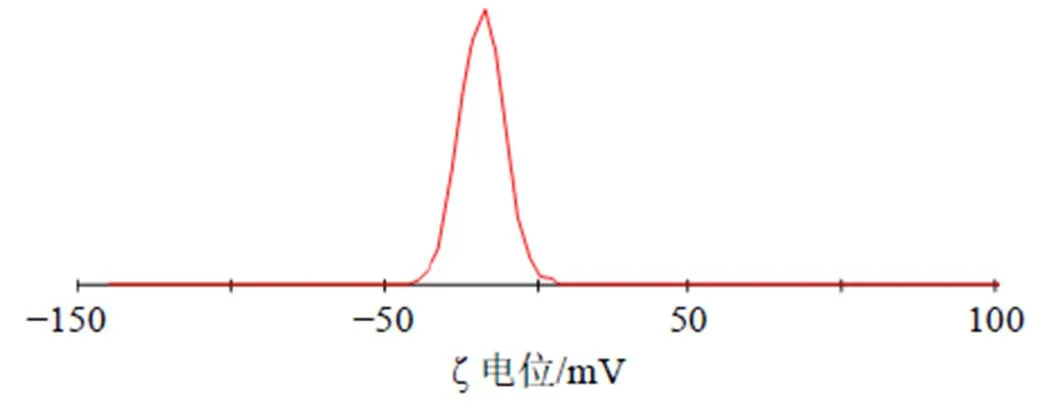
图4 TPGS-Ber-SLN的ζ电位
2.8 TEM观察TPGS-Ber-SLN微观形态
取TPGS-Ber-SLN混悬液0.1 mL,稀释50倍后滴至铜网上,用2%磷钨酸钠染色,置于室温环境晾干,于TEM下放大至12 000倍(高压为5.0 kV),即可观察到TPGS-Ber-SLN的微观形态,结果见图5。结果显示,TPGS-Ber-SLN基本形态为类球形,无粘连。
2.9 冻干粉的制备及稳定性评价
2.9.1 冻干粉种类及处方用量的考察 于TPGS- Ber-SLN混悬液中加入冻干保护剂(乳糖、甘露醇或两者混合物),震荡至澄清,−50 ℃超低温冰箱预冻1 d,取出立即置于−40 ℃冷冻干燥机中,抽真空,冷冻干燥1 d后取出冻干品。按表10进行评价,冻干粉出现塌陷、分层且色差明显、再分散时间大于90 s时表示冻干粉不理想,因而评分较低;反之则表示冻干粉较为理想,评分较高。考察结果见表11,质量浓度为0.05、0.07 g/mL的乳糖和甘露醇(质量比为1∶1)制得的冻干粉得分最高,考虑到辅料用量问题,最终选择5%的乳糖和甘露醇(质量比为1∶1)来制备TPGS-Ber-SLN冻干粉。复溶后测得包封率、粒径和PDI值分别为(81.26±1.01)%、(242.03±15.86)nm和0.116±0.021。TPGS- Ber-SLN冻干前、冻干粉和蒸馏水复溶后样品外观见图6。

图5 TPGS-Ber-SLN的TEM图
2.9.2 TPGS-Ber-SLN冻干粉稳定性考察 TPGS- Ber-SLN冻干粉密封置于恒温恒湿箱中(温度30 ℃,湿度60%),分别于0、5、10、15、30、45、60、75、90 d取样,蒸馏水复溶后测定包封率和粒径,结果见表12。TPGS-Ber-SLN混悬液稳定性较差,但制备成冻干粉后包封率和粒径波动幅度明显变小(PDI值均小于0.2),说明制备成冻干粉后增加了稳定性。
2.10 TPGS-Ber-SLN冻干粉的XRPD研究
采用XRPD对TPGS-Ber-SLN冻干粉进行晶型分析。取岩白菜素原料药、空白辅料、物理混合物(岩白菜素和辅料的比例与TPGS-Ber-SLN冻干粉一致)和TPGS-Ber-SLN冻干粉适量置于样品槽中,玻璃片将样品粉末压制平整后进行扫描。测试条件为Cu-Kα靶,速度为4°/min,扫描角度(2)为3°~45°,结果见图7。岩白菜素原料药在6.97°、8.03°、11.77°、13.45°、14.26°等处的晶型峰相对较强,在物理混合物的XRPD图谱中仍可观察到这些晶型峰,位置未发生变化但强度下降明显。TPGS-Ber- SLN冻干粉XRPD中仅可观察到空白辅料的晶型衍射峰,岩白菜素晶型峰完全消失,说明岩白菜素在TPGS-Ber-SLN冻干粉中晶型发生很大改变,转变为无定型物质。

表10 评分标准
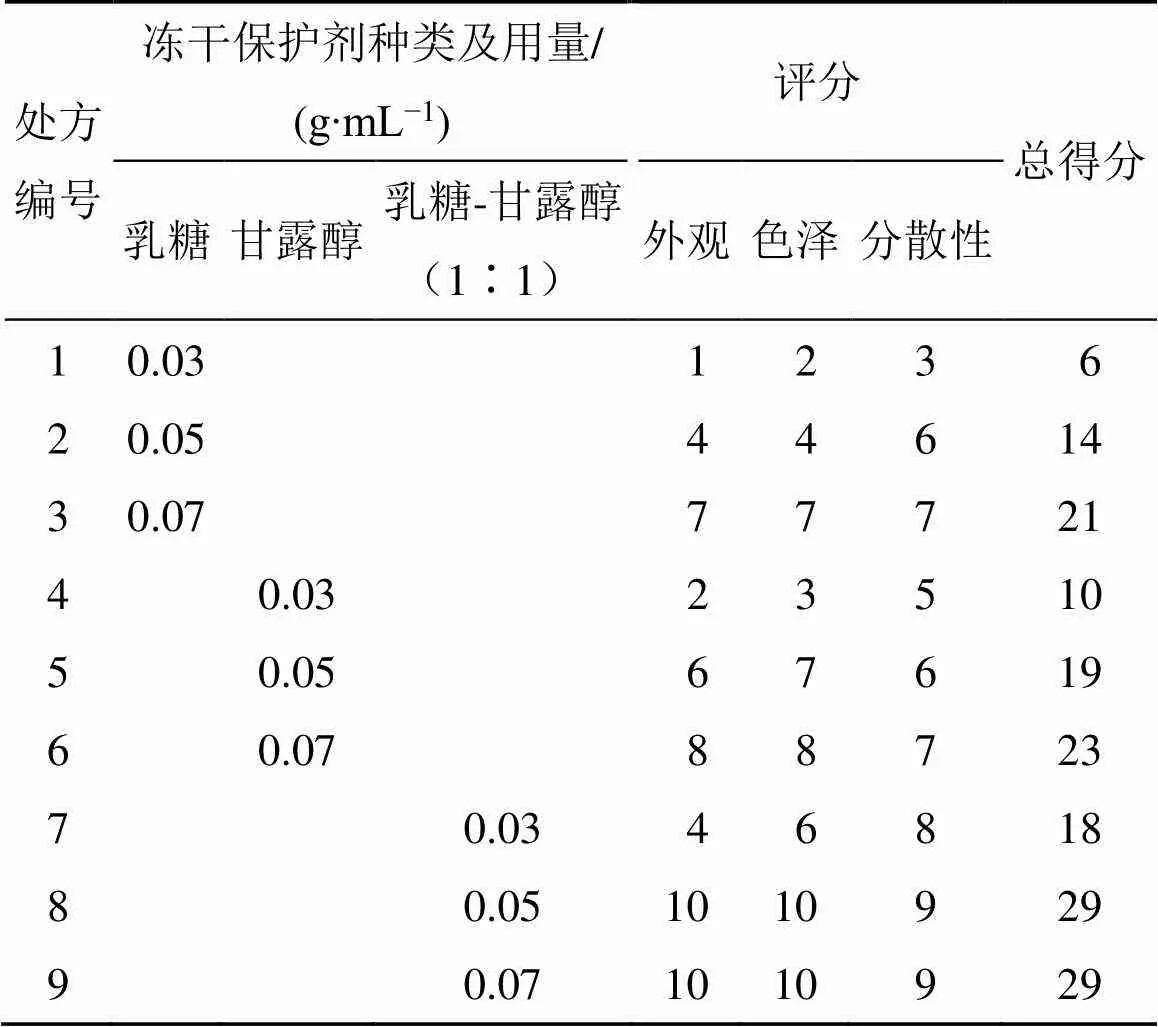
表11 冻干结果(n = 3)

A-TPGS-Ber-SLN混悬液 B-TPGS-Ber-SLN冻干粉 C-蒸馏水复溶后样品
表12 TPGS-Ber-SLN的稳定性考察结果(, n = 3)
取TPGS-Ber-SLN冻干粉密封后置于恒温恒湿箱(温度30 ℃,湿度60%),分别于0、30、60、90 d取样作XRPD分析,结果见图8。TPGS-Ber-SLN冻干粉放置90 d后XRPD图谱中仍未出现岩白菜素原料药特征晶型峰,说明岩白菜素在TPGS-Ber- SLN冻干粉中仍以无定形的形式存在,未出现析晶现象。
2.11 TPGS-Ber-SLN冻干粉的差式扫描量热法(DSC)研究
取岩白菜素原料药、空白辅料、物理混合物(岩白菜素和辅料比例与TPGS-Ber-SLN冻干粉一致)、TPGS-Ber-SLN冻干粉(0、30、60、90 d)适量置于样品槽中测试条件为氧化铝(Al2O3)为参比物,升温速度为10 ℃/min,升温范围为30~300 ℃。结果见图9,岩白菜素原料药在242.2 ℃出现熔点峰,在物理混合物中吸热峰提前至217.8 ℃。TPGS- Ber-SLN冻干粉(0 d)的DSC图谱中未出现岩白菜素原料药吸热峰,说明岩白菜素在TPGS-Ber- SLN冻干粉中以无定型形式存在,与XRPD研究结果一致。在TPGS-Ber-SLN冻干粉的30、60、90 d样品的DSC图谱中仍未出现原料药吸热峰,证明样品稳定性良好。

图7 TPGS-Ber-SLN冻干粉的XRPD结果
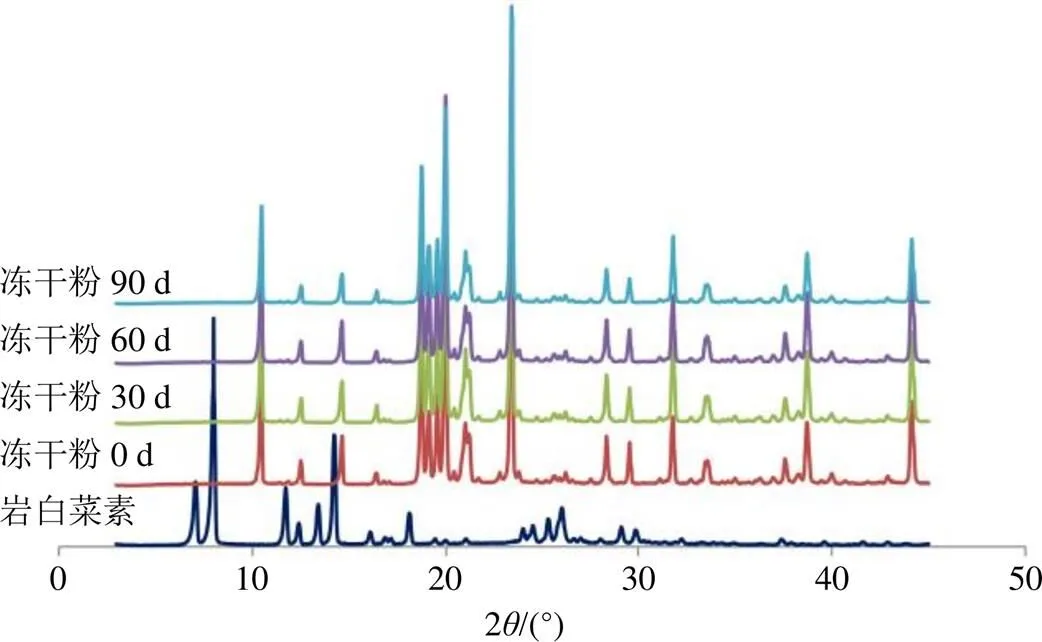
图8 TPGS-Ber-SLN冻干粉的晶型稳定性结果(XRPD)
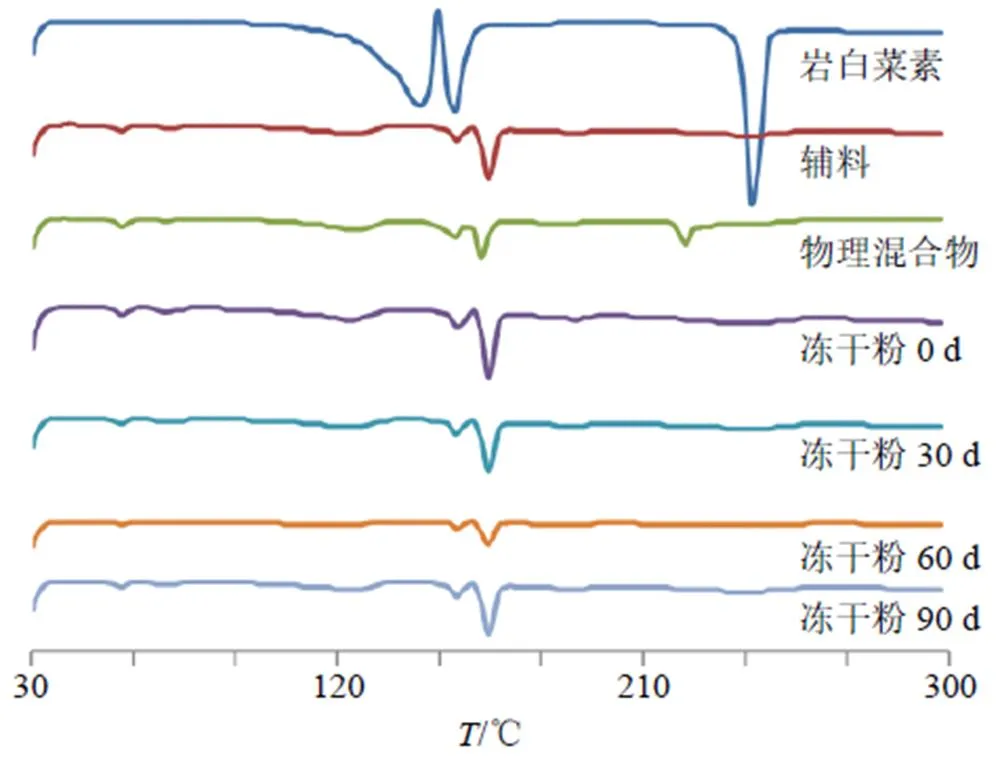
图9 TPGS-Ber-SLN冻干粉的晶型稳定性结果(DSC)
2.12 TPGS-Ber-SLN体外释药行为研究
测得岩白菜素在pH 1.2盐酸水溶液及pH 5.0和pH 6.8磷酸盐缓冲液(PBS)中溶解度分别为(1.58±0.04)、(1.60±0.03)、(0.98±0.02)mg/mL,因此50 mg岩白菜素在体积为500 mL的3种释药介质中可达漏槽条件。按照TPGS-Ber-SLN处方工艺制备Ber-SLN(不加TPGS),并按“2.9.1”项下方法制备成冻干粉末。取岩白菜素原料药、Ber-SLN和TPGS-Ber-SLN冻干粉适量,使岩白菜素含量为50 mg,加入pH 1.2盐酸水溶液5 mL,置于透析袋中(平均截留相对分子质量为12 000),扎紧。释药介质为500 mL的pH 1.2盐酸水溶液,介质温度为37 ℃,转速为75 r/min,分别于0、0.25、0.50、1.00、1.50、2.00 h取样3 mL。同法考察在pH 5.0和pH 6.8 PBS中释药情况,取样点调整为0、0.25、0.50、1.00、1.50、2.00、2.50、3.00、4.00、6.00、8.00、12.00、18.00、24.00、48.00 h。样品均过0.45 μm微孔滤膜后进样测定,结果见图10。Ber-SLN和TPGS-Ber- SLN均呈缓释特征,Ber-SLN在不同pH值的释药介质中,释药速率和累积释放度均高于TPGS-Ber- SLN。岩白菜素原料药在pH 1.2盐酸水溶液和pH 5.0 PBS中2 h内累积释放度均达90%以上,但在pH 6.8 PBS中随着时间的延长累积释放度呈现下降趋势,可能是由于岩白菜素在碱性环境中发生降解所致[4,6]。
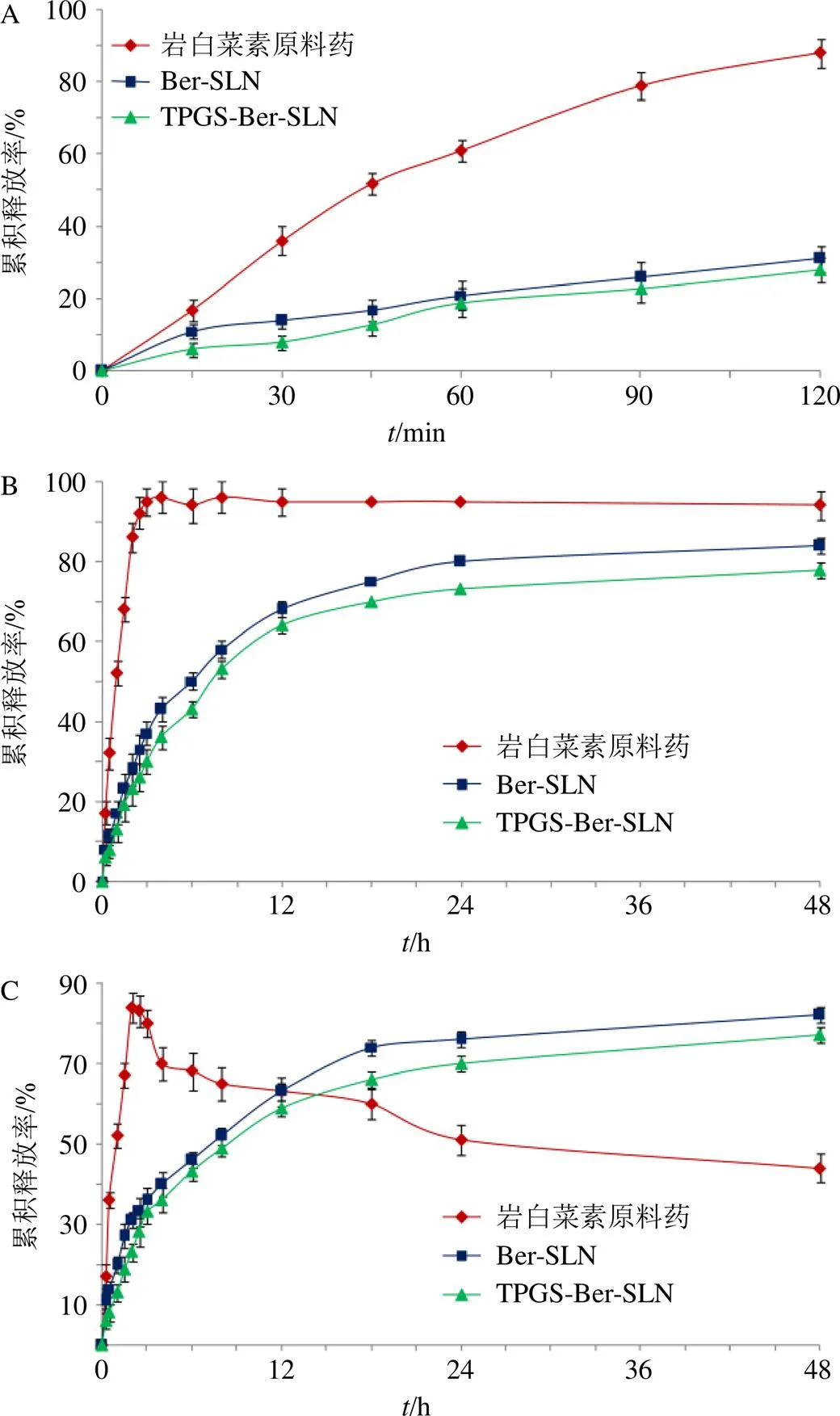
图10 岩白菜素原料药、Ber-SLN和TPGS-Ber-SLN在pH 1.2盐酸水溶液(A) 及pH 5.0 PBS (B) 和pH 6.8 PBS (C) 中的体外释放曲线(, n = 6)
Ber-SLN和TPGS-Ber-SLN在pH 5.0和pH 6.8 PBS中释药过程均符合Weibull模型(表13),说明释药过程是典型的双相动力学特征。
2.13 口服药动学比较
2.13.1 给药及取血方案 取岩白菜素原料药、Ber- SLN和TPGS-Ber-SLN冻干粉末,采用0.5%的CMC-Na溶液配制灌胃液。取18只健康SD大鼠,过夜禁食,随机分成3组,各只大鼠称定质量后按60 mg/kg ig给药(以岩白菜素含量计)。岩白菜素原料药组分别于0.25、0.50、1.00、2.00、3.00、4.00、5.00、6.00、8.00 h取血约0.3 mL,Ber-SLN和TPGS-Ber-SLN冻干粉末分别增加10 h和12 h取血点,将血样引流至肝素浸润离心管中,震荡,并以3000 r/min离心(离心半径为6.8 cm)2 min,即得血浆样品。

表13 Ber-SLN和TPGS-Ber-SLN在pH5.0、6.8PBS中的释放模型
2.13.2 血浆样品的处理[6]取100 μL血浆样品和50 μL对乙酰氨基酚内标溶液(质量浓度为800 ng/mL)至离心管中,密封涡旋15 s,加入0.5 mL醋酸乙酯后继续密封涡旋30 s,置于4 ℃离心机中5000 r/min离心(离心半径为6.8 cm)3 min,移取上层有机相。同法再次提取1次,合并有机相,于40 ℃温度下用氮气吹干得残渣,采用100 μL甲醇复溶,待测。
2.13.3 血浆对照品溶液的配制 甲醇配制50、100、250、500、1250、2500 ng/mL的岩白菜素对照品溶液,各个质量浓度分别取100 μL,氮气吹除有机溶液后加入100 μL空白血浆,涡旋30 s后超声30 s混合均匀,即得血浆对照品溶液。
2.13.4 线性关系考察 按“2.13.2”项方法配制岩白菜素血浆对照品溶液,并进样测定岩白菜素和乙酰氨基酚的峰面积。以两者峰面积比为纵坐标(),岩白菜素质量浓度为横坐标(),作线性回归得方程:=2.231 0+8.042 6,=0.996 4,结果表明岩白菜素血浆对照品溶液的线性范围为50~2500 ng/mL。
2.13.5 专属性考察 血药浓度测定时色谱条件与“2.1.1”项下色谱条件一致。取空白血浆、岩白菜素血浆对照品溶液和岩白菜素原料药ig给药8 h血浆样品,分别按“2.13.2”项下方法进行处理,按“2.1.1”项下色谱条件进样测定。色谱图见图11,试验结果表明血浆内源性物质未对岩白菜素和内标峰产生干扰,专属性较高。
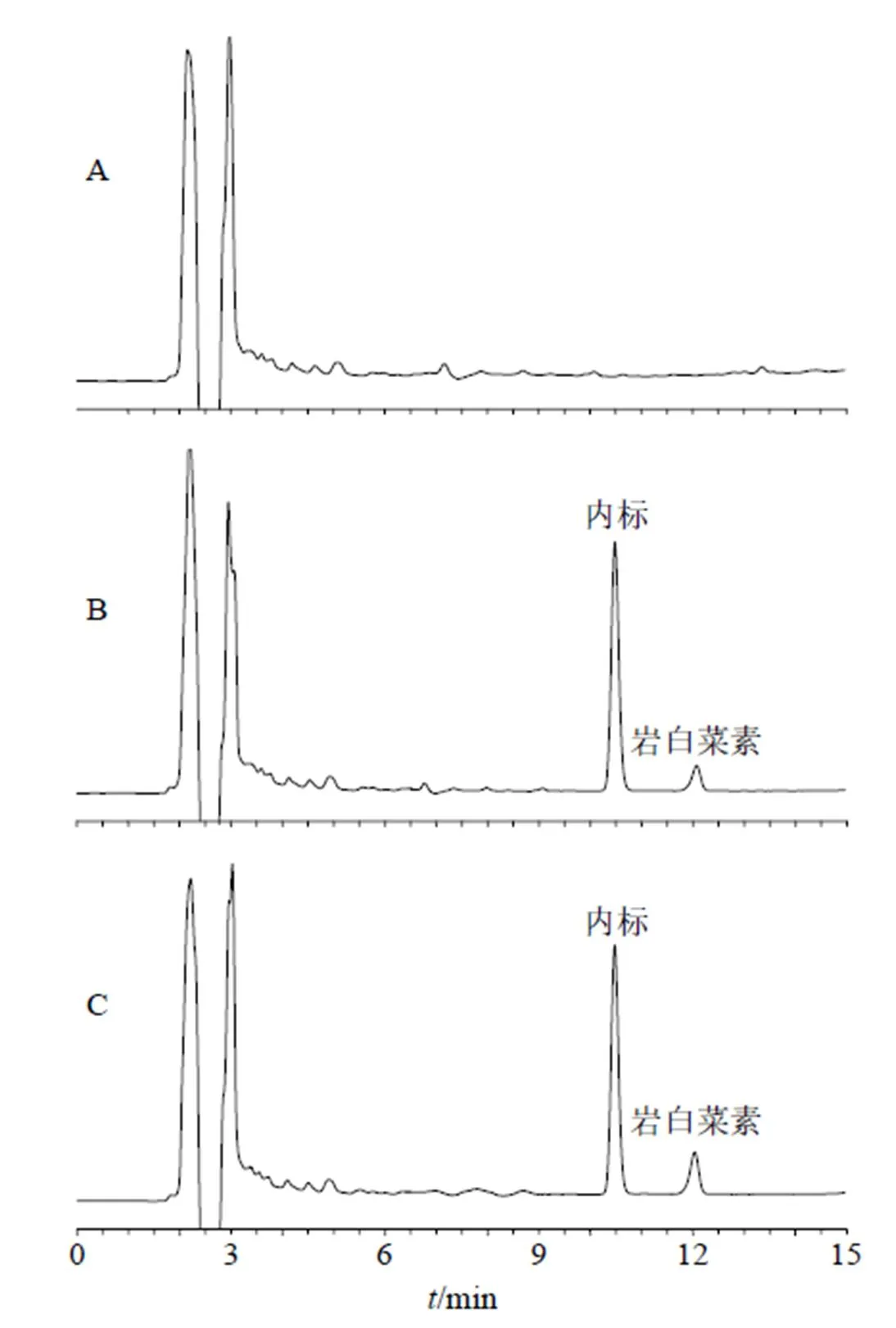
图11 空白血浆(A)、岩白菜素+空白血浆(B)和血浆样品(C)的HPLC图
2.13.6 日内精密度考察 分别取50、500、2500 ng/mL血浆对照品溶液,按“2.1.1”项下色谱条件同1 d内分别连续测定6次,计算得岩白菜素和内标峰面积比值的RSD分别为9.05%、4.17%、6.02%,试验结果表明日内精密度良好。
2.13.7 日间精密度考察 分别取50、500、2500 ng/mL血浆对照品溶液每天测试1次,按“2.1.1”项色谱条件连续测定6 d,计算得岩白菜素和内标峰面积比值RSD分别为6.79%、9.32%、5.10%,试验结果表明日间精密度良好。
2.13.8 稳定性考察 取岩白菜素原料药ig给药1 h的血浆样品,分别于0、3、6、9、12、24 h进样测定,计算得岩白菜素和内标峰面积比值RSD为6.07%,试验结果表明稳定性良好。
2.13.9 提取回收率考察[20]取岩白菜素质量浓度为50、500、2500 ng/mL对照品溶液各100 μL,氮气吹除有机溶液后加入100 μL空白血浆,涡旋30 s后超声30 s混合均匀后按“2.13.2”项下方法处理,按“2.1.1”项下色谱条件进样测定岩白菜素和内标峰面积,并计算两者峰面积比值,带入岩白菜素血浆对照品线性方程=2.231 0+8.042 6,计算测得质量浓度及提取回收率,结果显示平均提取回收率为94.98%,RSD为7.18%(=9)。
2.13.10 定量限考察 取质量浓度为50 ng/mL的岩白菜素血浆对照品溶液,加入空白血浆逐步稀释,按“2.13.2”项下方法处理后进样测定,采用信噪比为10作为定量限,试验结果表明岩白菜素在血浆中定量限为15 ng/mL。
2.13.11 药动学结果 岩白菜素原料药、Ber-SLN和TPGS-Ber-SLN药-时曲线见图12,使用DAS2.0计算主要药动学参数,结果见表14。Ber-SLN与TPGS-Ber-SLN组与原料药相比,达峰时间(max)均发生了显著性延后(<0.05);半衰期(1/2)也发生了显著性延长(<0.05),利于维持血药浓度;峰浓度(max)分别提高至2.63倍和3.91倍,差异具有极显著性水平(<0.01);药时曲线下面积(AUC0~t和AUC0~∞)均有极显著性改变(<0.01),说明Ber-SLN与TPGS-Ber-SLN极大影响了岩白菜素体内吸收过程,生物利用度分别提高至3.37倍和5.34倍。TPGS-Ber-SLN与Ber-SLN相比,max和1/2无明显改变,但max、AUC0~t和AUC0~∞发生了显著性提高(<0.05),证明TPGS-Ber-SLN更能促进岩白菜素体内吸收。

图12 药-时曲线(, n = 6)

表14 主要药动学参数(, n = 6)
与岩白菜素比较:*<0.05**<0.01;与Ber-SLN比较:#<0.01
*< 0.05**< 0.01bergenin drug substance;#< 0.05Ber-SLN
3 讨论
在制备TPGS-Ber-SLN时先将岩白菜素与磷脂在四氢呋喃中磁力搅拌至体系澄清,此时岩白菜素可与磷脂形成磷脂复合物[4],从而利于增强岩白菜素溶解度及与单硬脂酸甘油酯的亲和性[18,21],为后续制备TPGS-Ber-SLN奠定了基础。也有学者认为[19],药物-磷脂复合物本身可作为固体脂质纳米粒的脂质载体,采用2种以上的脂质载体可防止药物被排出晶格,增加纳米粒的包封率,本研究结果可为脂溶性差的药物制备SLN提供参考。TPGS是一种同时带有亲水和亲脂基团的高分子材料,具有一定的乳化能力,在水中临界胶束质量浓度为249 mg/L[22],为了防止TPGS从SLN表面逃逸出去自发形成胶束,故确定其在水相中质量浓度为0.20 mg/mL,该用量也与相关研究者采用的用量基本一致[15,17]。
测得TPGS-Ber-SLN平均ζ电位绝对值不足30 mV,稳定性不佳。可能是由于位于TPGS-Ber-SLN表面的TPGS接枝较长,起到了屏蔽作用[23-24],故将TPGS-Ber-SLN制备成冻干粉来加以改善。糖类保护剂(乳糖)在冻干失去水分时,体系可形成高黏度的玻璃态来防止纳米微观结构发生变化[25],但糖类保护剂容易出现塌陷现象。甘露醇具有优良的支撑作用,可解决糖类保护剂的不足,因此选用糖类保护剂(乳糖)和甘露醇联用来制备TPGS- Ber-SLN冻干粉。考察发现,采用质量浓度0.05 g/mL的乳糖和甘露醇(质量比为1∶1)来制备TPGS-Ber-SLN冻干粉时外观饱满、无分层、再分散性良好。
岩白菜素原料药在pH 6.8 PBS中累积释放度逐渐降低,而Ber-SLN和TPGS-Ber-SLN在pH 6.8 PBS中的累积溶出度逐渐增加,可能是由于载体的包裹作用提高了岩白菜素稳定性,为后续顺利进入血液循环奠定了基础。TPGS-Ber-SLN释药速率较慢,可能是由于TPGS-Ber-SLN表面的亲水性高于Ber-SLN,疏水性药物更倾向于分布于TPGS-Ber- SLN内部[26],因而释药更为缓慢;另外TPGS-Ber- SLN表面经TPGS修饰后对药物释放也起到一定的阻滞作用。
Ber-SLN和TPGS-Ber-SLN的max均发生显著性延后,可能与Ber-SLN和TPGS-Ber-SLN缓释作用有关,而且较小的粒径容易使Ber-SLN和TPGS-Ber-SLN滞留于肠道或绒毛间隙中[27-28],影响了入血速度,因而使max发生显著性延后。Ber-SLN和TPGS-Ber-SLN的1/2也发生显著性延长,有助于维持血药浓度,增加岩白菜素的生物利用度。Ber-SLN和TPGS-Ber-SLN的max分别极显著性提高至2.63倍和3.91倍,说明2种SLN均有效促进了药物吸收。Ber-SLN和TPGS-Ber-SLN口服吸收生物利用度的提高,可能是由于SLN对药物的包裹作用降低了岩白菜素在肠道降解,提高了岩白菜素的稳定性;纳米药物增加了与胃肠道接触面积;提高了岩白菜素累积溶出度;处方中脂质成分可打开肠壁紧密连接,增强药物渗透[12];纳米药物可经细胞间、淋巴转运等方式进入血液循环[29-30],最终显著促进了药物吸收。
另外,TPGS-Ber-SLN的max和生物利用度与Ber-SLN相比具有显著性差异(<0.05),可能是由于TPGS-Ber-SLN处方中TPGS抑制了P-糖蛋白活性,减少了岩白菜素外排作用[15],因而生物利用度提高幅度更大。
本研究制备的TPGS-Ber-SLN口服相对生物利用度提高至5.34倍,比已报道的固体分散体(提高至1.48倍)[7]、磷脂复合物(提高至439%)[4]及磷脂复合物固体分散体(202.46%)[31]改善幅度更大。后续将研究进一步对TPGS-Ber-SLN药效学、毒理学等进行评价,为TPGS-Ber-SLN提供更为全面的研究资料。另外,只采用TPGS来制备SLN是否具有更高的包封率或生物利用度有待进一步研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘斌, 谭成玉, 池晓会, 等. 岩白菜素的研究进展 [J]. 西北药学杂志, 2015, 30(5): 660-662.
[2] 裴少萌. 岩白菜素的提取、衍生化与生物活性研究 [D]. 西安: 陕西科技大学, 2009.
[3] 李凤, 周丹, 秦瑄, 等. 岩白菜素理化性质的研究 [J]. 中国药学杂志, 2009, 44(2): 92-95.
[4] Qin X, Yang Y, Fan T T,. Preparation, characterization andevaluation of bergenin- phospholipid complex [J]., 2010, 31(1): 127-136.
[5] 秦瑄. 岩白菜素的生物药剂学和药代动力学基础研究 [D]. 成都: 四川大学, 2007.
[6] 吴秀稳, 温然, 王娜, 等. 岩白菜素在MDCK-MDR1细胞模型中的跨膜转运机制 [J]. 中国药理学通报, 2022, 38(11): 1698-1704.
[7] Fang Y, Niu HD, Guo YY,. Preparation, optimization and bioavailability studies of the bergenin solid dispersion pellets [J]., 2022, 73: 103379.
[8] 陈伶俐, 晏亦林, 罗燕娜, 等. Box-Behnken实验设计法优化岩白菜素自微乳剂处方的研究 [J]. 中药新药与临床药理, 2017, 28(4): 528-533.
[9] 李君霞, 曹亚蕊, 王金涛, 等. 延胡索乙素磷脂复合物及其固体分散体、油制剂、纳米混悬剂的制备及药动学研究[J]. 中草药, 2022, 53(14): 4307-4316.
[10] 黄苏莉, 吴贻明, 包瑞, 等. 基于TPGs表面修饰的雷公藤甲素固体脂质纳米粒的制备与质量评价 [J]. 药物评价研究, 2020, 43(7): 1283-1288.
[11] 侯文书, 张丹参, 张力, 等. PEG修饰姜黄素固体脂质纳米粒的制备、表征及溶出特征 [J]. 中草药, 2019, 50(8): 1927-1934.
[12] Dattani S, Li X L, Lampa C,. A comparative study on micelles, liposomes and solid lipid nanoparticles for paclitaxel delivery [J]., 2023, 631: 122464.
[13] 苏日娜, 刘腾飞, 朱秀梅, 等. 基于TPGS的纳米递药系统在逆转P-糖蛋白介导肿瘤多药耐药中的应用 [J]. 药学学报, 2018, 53(11): 1797-1807.
[14] Guo Y Y, Luo J, Tan S W,. The applications of vitamin E TPGS in drug delivery [J]., 2013, 49(2): 175-186.
[15] Cho H J, Park J W, Yoon I S,. Surface-modified solid lipid nanoparticles for oral delivery of docetaxel: Enhanced intestinal absorption and lymphatic uptake [J]., 2014, 9: 495-504.
[16] Vieira R, Severino P, Nalone L A,. Sucupira oil-loaded nanostructured lipid carriers (NLC): Lipid screening, factorial design, release profile, and cytotoxicity [J]., 2020, 25(3): 685.
[17] Patel M, Mundada V, Sawant K. Enhanced intestinal absorption of asenapine maleate by fabricating solid lipid nanoparticles using TPGS: Elucidation of transport mechanism, permeability across Caco-2 cell line andpharmacokinetic studies [J]., 2019, 47(1): 144-153.
[18] 郜娜, 范明松, 杨庆宇, 等. 二氢杨梅素磷脂复合物纳米结构脂质载体的制备、表征及药动学研究 [J]. 中草药, 2019, 50(17): 4060-4067.
[19] 陈春燕, 徐萍, 袁弘. 口服聚乙二醇修饰固体脂质纳米粒的组织分布及抗肿瘤药效学研究 [J]. 中国现代应用药学, 2016, 33(5): 586-592.
[20] 万俊芳. 利格列汀自乳化释药系统的制备与大鼠体内药动学研究 [J]. 沈阳药科大学学报, 2022, 39(10): 1183-1188.
[21] 周开, 张佩琛, 郝海军, 等. 蒙花苷磷脂复合物固体脂质纳米粒的制备及其体内药动学研究 [J]. 中成药, 2020, 42(6): 1401-1405.
[22] 赵小义, 冯华, 朱钰叶. 洛匹那韦混合胶束的制备与大鼠口服生物利用度研究 [J]. 沈阳药科大学学报, 2022, 39(7): 773-779.
[23] 卢慧芳, 刘艳美, 王荷香, 等. 穿心莲内酯甲氧基聚乙二醇-聚乳酸-羟基乙酸纳米粒处方优化及体外释药考察 [J]. 中国医院药学杂志, 2022, 42(19): 2034-2039.
[24] 尹元元, 耿燕娜, 范明松. Box-Behnken设计-效应面法优化延胡索乙素聚乳酸-羟基乙酸共聚物纳米粒处方和体外释药行为研究 [J]. 中草药, 2021, 52(22): 6806-6815.
[25] 田烨, 吴明媛. 生物制品冻干保护方法研究进展 [J]. 中国医药生物技术, 2018, 13(1): 73-76.
[26] Khalil N M, do Nascimento T C, Casa D M,. Pharmacokinetics of curcumin-loaded PLGA and PLGA-PEG blend nanoparticles after oral administration in rats [J]., 2013, 101: 353-360.
[27] 董丹丹, 焦红军, 郝海军, 等. 吴茱萸碱纳米结构脂质载体处方优化和SD大鼠体内口服药动学研究 [J]. 中草药, 2022, 53(1): 60-70.
[28] 毛艳婷, 陶兴茹, 张胜男, 等. 漆黄素纳米混悬剂和冻干粉末的制备及体外评价 [J]. 中国医院药学杂志, 2022, 42(4): 393-398.
[29] 刘万路. Box-Behnken设计-效应面法优化白屈菜红碱mPEG-PLGA纳米粒处方制备工艺及其药动学研究 [J]. 中草药, 2022, 53(23): 7361-7371.
[30] 杨志欣, 王闻文, 卞士嘉, 等. 苦参总生物碱固体脂质纳米粒的制备工艺研究 [J]. 药物评价研究, 2021, 44(3): 517-523.
[31] Gao H, Wei Y, Xi L,. Evaluation of intestinal absorption and bioavailability of bergenin-phospholipid complex solid dispersion in rats [J]., 2018, 19(4): 1720-1729.
Formulation optimization of TPGS surface-modified bergenin solid lipid nanoparticles and oral bioavailability study
YANG Jin-zhi1, CUI Xiao-ge1, HAO Hai-jun2, 3
1. Zhengzhou Shuqing Medical College, Zhengzhou 450064, China 2. Shanghai Institute of Traditional Chinese Medicine, Shanghai 201401, China 3. Shanghai Leiyunshang Pharmaceutical Co., Ltd., Shanghai 201401, China
To prepare-α-vitamin E polyethylene glycol 1000 succinate (TPGS) surface-modified bergenin (Ber) solid lipid nanoparticles (TPGS-Ber-SLN), and investigate its drug releaseand oral pharmacokinetics behavior.High pressure homogenization method was used to prepare TPGS-Ber-SLN. Encapsulation rate, drug loading and particle size were taken as evaluation indexes, single factor investigation method combined with Box-Behnken design-response surface method was employed to optimize the prescription process of TPGS-Ber-SLN. Lyophilized powder of TPGS-Ber-SLN was also prepared. X-ray powder diffraction (XRPD) and differential scanning calorimetry (DSC) were employed to analyze the state of Ber in lyophilized powder of TPGS-Ber-SLN.drug release behavior of TPGS-Ber-SLN in different pH media were investigated by dialysis bag method. Using Ber suspension as control, pharmacokinetics behaviorof TPGS-Ber-SLNand oral bioavailability was compared.Optimal prescription process of TPGS-Ber-SLN was as follow: Ber dosage was 40 mg, glycerol monostearate dosage was 525 mg, poloxamer 188 mass concentrations was 17.5 mg/mL, TPGS mass concentrations was 0.2 mg/mL and homogenization times were nine times. Average envelopment efficiency, drug loading, particle size and ζ potential of TPGS-Ber-SLN were (83.16 ± 1.09)%, (4.97 ± 0.13)%, and (229.46 ± 19.07) nm and (−15.67 ± 0.23) mV, respectively. The drug release process of TPGS-Ber-SLNaccorded with Weibull model. Results of oral pharmacokinetics showed thatmaxof TPGS-Ber-SLN was delayed to (2.07 ± 0.43) h,1/2was extended to (4.21 ± 0.78) h,maxand oral bioavailability were increased to 3.91 fold and 5.34 fold, respectively.TPGS-Ber-SLN significantly altered the pharmacokinetic behavior of Berand increased its oral bioavailability effectively.
bergenin; solid lipid nanoparticles;-α-vitamin E polyethylene glycol 1000 succinate; pharmacokinetics; oral bioavailability
R283.6
A
0253 - 2670(2023)13 - 4144 - 13
10.7501/j.issn.0253-2670.2023.13.008
2022-11-30
上海市科委项目(21S21903400)
杨金枝(1980—),女,硕士,副教授,从事中药学研究。Tel: (0371)67673621 E-mail: yangjz2007@126.com
通信作者:郝海军(1981—),男,博士,高级工程师,从事中药新型给药系统及质量标准研究。Tel: (021)67103277 E-mail: haohj@shlys.com
[责任编辑 郑礼胜]
