金丝桃苷磷脂复合物及其介孔二氧化硅纳米粒的制备和口服药动学研究
2023-07-06李伟宏王风云隋海娟
李伟宏,郑 伟,王风云*,隋海娟
金丝桃苷磷脂复合物及其介孔二氧化硅纳米粒的制备和口服药动学研究
李伟宏1,郑 伟1,王风云1*,隋海娟2
1. 河南应用技术职业学院,河南 郑州 450042 2. 锦州医科大学,辽宁 锦州 121001
制备金丝桃苷磷脂复合物(hyperoside phospholipids complex,Hyp-PC)介孔二氧化硅纳米粒(Hyp-PC mesoporous silica nanoparticles,Hyp-PC-MSN),考察口服药动学行为。以复合率为指标,单因素实验结合Box-Behnken设计-效应面法优化Hyp-PC处方。X射线粉末衍射(X-ray powder diffraction,XRPD)对Hyp-PC进行晶型分析,并测定Hyp-PC的油水分配系数。溶剂挥发法制备Hyp-PC-MSN,扫描电子显微镜观察Hyp-PC-MSN微观形态,并与Hyp-PC比较Hyp-PC-MSN体外溶出情况。SD大鼠分为金丝桃苷组、Hyp-PC组和Hyp-PC-MSN组,测定大鼠血浆中金丝桃苷质量浓度,计算Hyp-PC和Hyp-PC-MSN主要药动学参数及相对口服吸收生物利用度。Hyp-PC最佳处方的复合率接近100%,金丝桃苷在Hyp-PC中以无定型状态存在,油水分配系数明显增大。Hyp-PC-MSN外观形态呈球形,包封率为(93.17±0.85)%,载药量为(7.54±0.33)%,粒径为(163.87±6.15)nm,PDI值为0.108±0.009,ζ电位为(−0.28±0.05)mV。Hyp-PC-MSN明显提高了释药速率和累积释放度。药动学结果显示,Hyp-PC-MSN的达峰时间(max)显著性提前,半衰期(1/2)延长至(4.56±0.82)h,达峰浓度(max)提高至(1 462.62±163.94)ng/mL,相对口服生物利用度提高至3.47倍。Hyp-PC-MSN可提高金丝桃苷体外溶出速率、累积溶出度及口服吸收生物利用度。
金丝桃苷;磷脂复合物;油水分配系数;介孔二氧化硅纳米粒;溶出速率;累积溶出度;生物利用度
金丝桃苷(hyperoside,Hyp)属于黄酮醇苷类化合物,广泛存在于金丝桃科、唇形科、蔷薇科、藤黄科、卫矛科、豆科等植物中。现代药理学表明金丝桃苷具有肾脏保护、肝脏保护、心脑血管保护、降血糖、抗炎等作用[1],在卵巢癌、宫颈癌等妇科肿瘤也有较强活性[1-2]。据文献报道[3],金丝桃苷具有较好的安全性,长期毒性显示虽对机体肝脏和肾脏具有一定损伤,但损伤是可逆的,因而金丝桃苷具有一定的开发价值。测得金丝桃苷在37 ℃下水中的平衡溶解度仅为(224.97±1.60)mg/L,容易影响其溶出速率及溶出度,油水分配系数较低(lg=−0.04)[4],导致胃肠道吸收较差[5],口服吸收生物利用度为10%左右[6],限制了该成分临床应用。李园园等[7]制备了金丝桃苷固体分散体,但固体分散体存在易吸潮、稳定性差等问题。Feng等[8]对金丝桃苷脂质体进行了研究,但工艺较复杂,普通脂质体在体内易被破坏[9],降低了促吸收作用。Shen等[10]制备了金丝桃苷纳米混悬剂,但粒径接近400 nm,较大的粒径可能会影响生物利用度改善幅度[11]。
磷脂复合物(phospholipids complex,PC)是磷脂与晶型药物在一定条件下通过氢键等作用力结合在一起,从而使药物以无定型状态存在,调节油水分配系数,促进药物口服吸收并提高药效等[12-15]。因此,本研究采用单因素结合Box-Behnken设计-效应面法优化了金丝桃苷磷脂复合物(hyperoside phospholipids complex,Hyp-PC)处方工艺,并对油水分配系数、晶型状态等进行研究。但后续研究发现Hyp-PC存在黏性较大、溶出度低等缺陷,制备成片剂、胶囊剂等口服制剂时非常困难。
近年来,介孔二氧化硅纳米粒(mesoporous silica nanoparticles,MSN)作为药物载体颇受关注,具有制备工艺简便、重复性好等优势[16]。药物通常以无定型或分子状态存在于介孔(孔径在2~50 nm)孔道内,可极大促进药物溶出,提高生物利用度[17-19]。为了改善Hyp-PC自身存在的缺陷,故对金丝桃苷磷脂复合物介孔二氧化硅纳米粒(hyperoside phospholipids complex mesoporous silica nanoparticles,Hyp-PC-MSN)进行了研究,并对Hyp-PC-MSN体外性质及体内药动学等进行比较。国内外鲜见将PC与MSN技术联合应用的报道,期望通过本研究为金丝桃苷纳米制剂及其他难溶性中药活性成分研究提供新策略。
1 仪器与材料
1.1 仪器
RE-52C型旋转蒸发仪,上海一凯仪器设备有限公司;1100型高效液相色谱仪,美国Agilent公司;XB120A型电子天平,瑞士普利赛斯公司;RG-18型磁力搅拌器,郑州邦博仕仪器设备有限;AT612型溶出仪,上海卓光仪器科技有限公司;DS360-15L超声仪,无锡鼎实电子科技有限公司;JSM-IT800型扫描电子显微镜(SEM),日本电子株式会社;Mastersizer 3000型粒度分析仪,英国马尔文仪器公司;TD-3500型X射线粉末衍射仪,丞普诺仪器苏州有限公司;TH-80型恒温恒湿箱,广东艾思荔检测仪器有限公司;LD-D12SY型氮吹仪,山东莱恩德智能科技有限公司。
1.2 材料
金丝桃苷原料药,批号20201024,质量分数94.0%,武汉市恒沃科技有限公司;乙酰苯胺,批号200518,质量分数98.9%,上海如吉生物科技有限公司;金丝桃苷对照品,批号111521-202027,质量分数94.3%,中国食品药品检定研究院;大豆磷脂,批号200422,磷脂酰胆碱质量分数88%,上海太伟药业股份有限公司;四氢呋喃,色谱级,批号20191022,瑞典欧普森色谱试剂公司;MSN,批号20210514,材料为SBA-15,博华斯纳米科技宁波有限公司;十二烷基苯磺酸钠(SDS,批号20200223)、羧甲基纤维素钠(CMC-Na,批号20200916)、乙醚(批号20201124),国药化学试剂集团有限公司;肝素钠,北京金克隆生物技术有限公司。
1.3 动物
清洁级SD大鼠,雌雄兼具,购自河南省动物实验中心,许可证号SCXK(豫)2020-0001,于实验室(温度25 ℃、湿度60%)饲养至体质量为200~240 g。动物实验遵循河南应用技术职业学院有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 Hyp-PC和Hyp-PC-MSN的制备工艺
2.1.1 Hyp-PC[12-15]取40 mg金丝桃苷(经45 ℃真空干燥12 h)和处方量磷脂置于圆底烧瓶,加入50 mL四氢呋喃(色谱级),密封后置于一定温度水浴中,磁力搅拌一定时间(速度为800 r/min),得澄清溶液。于50 ℃水浴中真空旋蒸除去有机溶剂,即得Hyp-PC,密封保存。
2.1.2 Hyp-PC-MSN[18-19]取0.1 g的Hyp-PC置于20 mL无水乙醇,室温下磁力搅拌溶解(速度为800 r/min),按照Hyp-PC与MSN质量比1∶2、1∶3、1∶4、1∶5分别加入MSN粉末,继续磁力搅拌1 d得Hyp-PC-MSN混悬液。45 ℃下减压旋转蒸发除去无水乙醇,收集粉末,置于45 ℃真空干燥箱中干燥1 d,即得Hyp-PC-MSN粉末。
2.2 HPLC法测定Hyp-PC和Hyp-PC-MSN中金丝桃苷含量
2.2.1 色谱条件 Hypersil ODS C18色谱柱(250 mm×4.6 mm,5 µm);检测波长为360 nm;柱温为30 ℃;流动相为乙腈-0.1%磷酸水溶液(20∶80);体积流量1.0 mL/min;进样量10 µL。理论塔板数以金丝桃苷峰计不低于6500。
2.2.2 线性关系考察 精密称取金丝桃苷对照品,加入甲醇配制成质量浓度为1.98 mg/mL的金丝桃苷对照品储备液,密封保存。取乙腈-0.1%磷酸水溶液(20∶80)稀释至3 960.0、1 980.0、990.0、495.0、99.0、49.5 ng/mL,进样测定。采用金丝桃苷质量浓度()对峰面积()进行线性回归,得回归方程:=548.3+228.5,=0.999 5,结果表明,金丝桃苷在49.5~3 960.0 ng/mL线性关系良好。
2.2.3 Hyp-PC和Hyp-PC-MSN供试品溶液的配制
(1)Hyp-PC:称取Hyp-PC约10 mg至100 mL量瓶中,加入60 mL甲醇超声溶解,继续用甲醇稀释至刻度,取0.5 mL置于10 mL量瓶中,加入流动相稀释至刻度,即得Hyp-PC供试品溶液。
(2)Hyp-PC-MSN:称取Hyp-PC-MSN约10 mg至100 mL量瓶中,加入60 mL甲醇超声溶解,继续用甲醇稀释至刻度,过0.45 μm微孔滤膜,取2.5 mL续滤液至10 mL量瓶中,加入流动相稀释至刻度,即得Hyp-PC-MSN供试品溶液。
2.2.4 专属性考察 取磷脂、MSN等辅料制备空白样品溶液,另取Hyp对照品溶液、Hyp-PC样品溶液和Hyp-PC-MSN样品溶液分别进样分析,色谱图见图1,结果表明辅料未对根皮素色谱峰产生干扰,专属性较高。
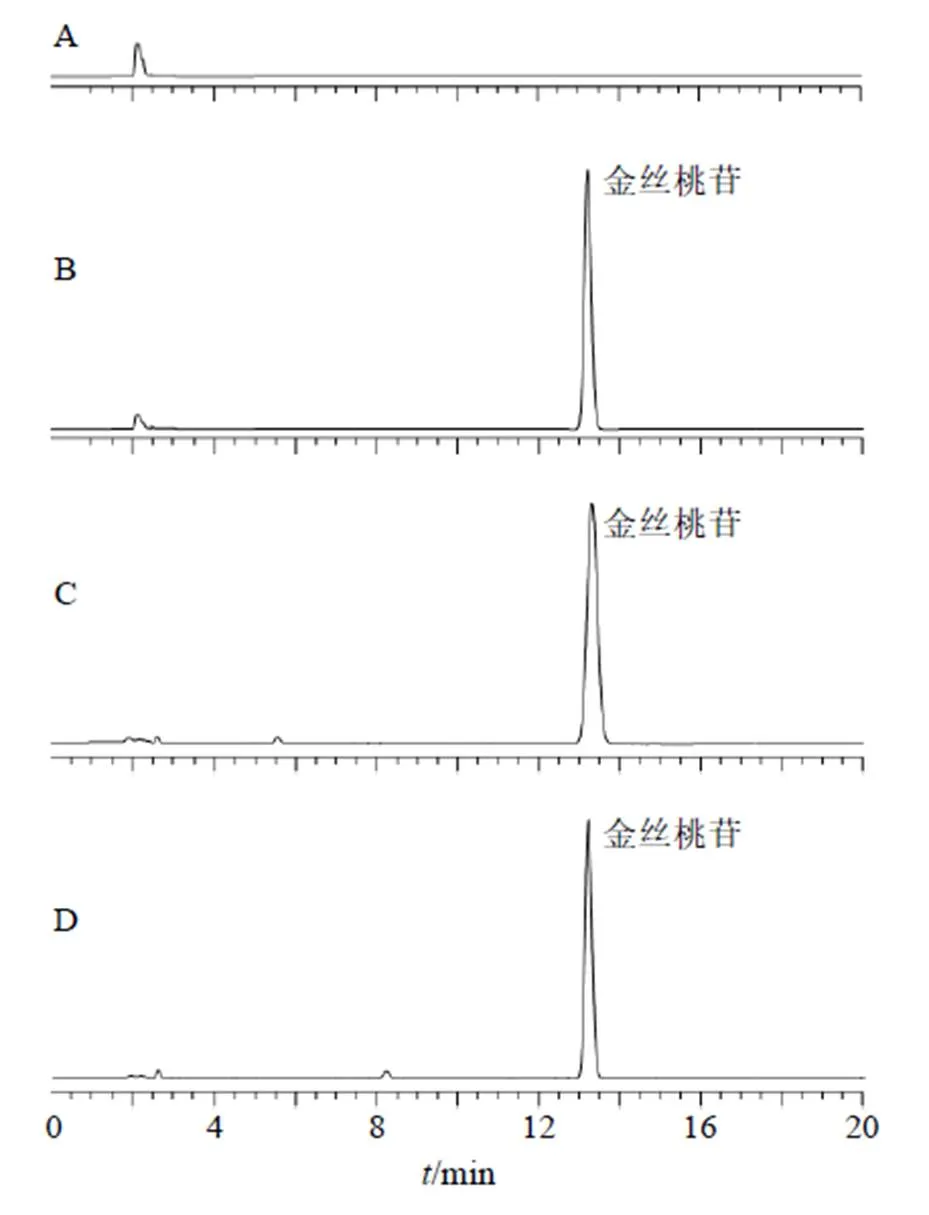
图1 空白辅料(A)、Hyp对照品(B)和Hyp-PC(C)、Hyp-PC-MSN(D)样品溶液的HPLC图
2.2.5 重复性考察 分别平行制备6份Hyp-PC和Hyp-PC-MSN供试品溶液,分别进样测定,计算得金丝桃苷质量浓度的RSD分别为1.58%和1.77%,表明该实验重复性良好。
2.2.6 稳定性考察 取Hyp-PC和Hyp-PC-MSN供试品溶液,于制备后0、4、8、12、16、24 h分别进样测定,计算得金丝桃苷峰面积的RSD分别为0.50%和0.83%,表明Hyp-PC和Hyp-PC-MSN供试品溶液在24 h内稳定性良好。
2.2.7 精密度考察 取质量浓度为3 960.0、990.0、49.5 ng/mL的金丝桃苷对照品溶液,分别连续测试6次,计算得金丝桃苷峰面积的RSD分别为0.18%、0.68%、0.60%,表明仪器精密度良好。
2.2.8 加样回收率考察 分别称取9份Hyp-PC和Hyp- PC-MSN,每份均约5 mg,分为低、中、高3组,分别加入金丝桃苷标示量的80%、100%、120%,按照“2.2.3”项下方法制备供试品溶液,按照“2.2.1”项色谱条件测定金丝桃苷含量,计算其回收率。结果计算得Hyp-PC中金丝桃苷的平均加样回收率为99.42%,RSD为1.27%;Hyp-PC-MSN中金丝桃苷的平均加样回收率为100.65%,RSD为1.87%,结果表明该实验准确度较高。
2.3 Hyp-PC的制备及表征
2.3.1 Hyp-PC复合率的测定 金丝桃苷几乎不溶于石油醚[4],但Hyp-PC在石油醚中易溶。称取金丝桃苷(0)按照“2.1.1”项下方法制备Hyp-PC,加入石油醚震荡溶解,经0.45 μm有机滤膜滤过,除去未复合的金丝桃苷,按照“2.2”项下方法操作,测定滤液中金丝桃苷的质量浓度,并计算参加复合反应的金丝桃苷的质量(1),计算Hyp-PC复合率。
复合率=1/0
2.3.2 单因素考察Hyp-PC的制备工艺
(1)制备溶剂的选择:在保持金丝桃苷40 mg、磷脂75 mg、制备温度为45 ℃,制备时间为2 h条件不变情况下,分别考察无水乙醇、醋酸乙酯、二氯甲烷、丙酮、四氢呋喃作为制备溶剂时对Hyp-PC复合率的影响,结果Hyp-PC的复合率分别为(52.64±1.03)%、(47.15±1.62)%、(68.40±1.04)%、(45.68±0.95)%、(84.73±1.56)%(=3)。可能由于无水乙醇是一种质子溶剂,而PC在非质子溶剂中往往具有较高的复合率,因而在无水乙醇中制得的Hyp-PC复合率不高。金丝桃苷在醋酸乙酯、二氯甲烷、丙酮中的溶解度较低,不利于药物与磷脂之间结合,导致制得的Hyp-PC复合率也不高。四氢呋喃作为制备溶剂时复合率最高,且沸点较低,易于除去,故最终采用四氢呋喃作为制备溶剂。
(2)磷脂用量的考察:在保持金丝桃苷40 mg、制备溶剂为四氢呋喃,制备温度为45 ℃,制备时间为2 h条件不变情况下,分别考察磷脂用量25、50、75、100、125 mg时对Hyp-PC复合率的影响,结果Hyp-PC的复合率分别为(33.14±1.26)%、(70.20±1.14)%、(88.44±1.47)%、(95.03±1.25)%、(97.17±1.76)%(=3)。随着磷脂用量的逐渐增加,Hyp-PC复合率增加后趋稳,可能是由于磷脂用量较小时部分金丝桃苷未能形成Hyp-PC,因而复合率较低。磷脂用量较大时复合率仍未达100%,可能是由于Hyp-PC复合率还受制备温度、时间等其他制备条件制约。根据考察结果,后续选择磷脂用量在50~100 mg继续进行优化。
(3)制备温度的考察:在保持金丝桃苷40 mg、磷脂用量为100 mg,制备溶剂为四氢呋喃,制备时间为2 h条件不变情况下,分别考察制备温度35、40、45、50、55、60、65 ℃对Hyp-PC复合率的影响,结果Hyp-PC的复合率分别为(60.25±1.18)%、(70.94±1.72)%、(87.92±1.80)%、(89.23±1.48)%、(90.26±1.09)%、(85.67±1.26)%、(71.46±0.99)%(=3)。随着制备温度的升高,Hyp-PC复合率先增加后减小,可能是由于制备温度较低时影响了金丝桃苷与磷脂分子的结合,导致复合率较低,但磷脂在高温时容易被氧化[13],因而制备温度过高时会导致Hyp-PC复合率出现下降情况。根据考察结果,后续可选择制备温度在40~60 ℃继续进行优化。
(4)制备时间的考察:在保持金丝桃苷40 mg、磷脂用量为100 mg,制备溶剂为四氢呋喃,制备温度为45 ℃条件不变情况下,分别考察制备时间0.5、1.0、1.5、2.0、2.5、3.0、3.5 h对Hyp-PC复合率的影响,结果Hyp-PC的复合率分别为(45.60± 1.33)%、(76.21±1.42)%、(86.83±1.07)%、(90.11± 1.72)%、(96.45±1.26)%、(88.23±1.92)%、(79.92± 1.58)%(=3)。随着制备时间的增加,Hyp-PC复合率先增加后下降,可能是由于制备时间较短时影响了金丝桃苷与磷脂分子的结合,故Hyp-PC复合率较低,但制备时间过长时同样会影响磷脂的稳定性[13],从而导致Hyp-PC复合率下降。根据考察结果,后续选择制备时间在1.0~3.0 h继续进行优化。
2.3.3 Box-Behnken设计-响应面法优化Hyp-PC处方工艺
(1)试验设计及结果:采用Box-Behnken响应面法优化Hyp-PC处方工艺,据“2.4”项下单因素考察发现,Hyp-PC复合率主要受处方工艺中磷脂用量、制备温度和制备时间影响较大,故分别作为主要影响因素1、2、3,各影响因素的水平见表1。以Hyp-PC复合率()为优化指标,测定不同处方工艺制得Hyp-PC的复合率(设置5组平行试验),结果见表1。
(2)数学模型的建立与方差分析:根据表1得到的实验数据,对Hyp-PC主要影响因素即因变量(1、2、3)和响应值即自变量()进行拟合,得到二次多元回归方程为=98.01+7.351+3.132+8.213+1.0312+3.9013-0.4823-11.8612-6.1422-12.9032,决定系数2和校正系数adj2分别为0.995 3和0.989 1,均大于0.98,所以测得的Hyp-PC复合率与拟合值吻合度较高。
方差分析结果见表2,数学模型值<0.000 1(极显著性),失拟度值=0.105 4>0.05(无显著性),因此,该数学模型可信度较高,可用于Hyp-PC处方工艺研究。二次多元回归方程中,1、2、3、13、12、22和32等均具极显著差异(<0.01),1和3系数相对较大,因此,磷脂用量和制备温度对Hyp-PC复合率的影响程度大于制备时间的影响程度。
(3)效应面结果及最佳处方工艺:两两因素交互作用的三维曲面图见图2,固定1、2、3某因素不变时(分别取中间值),其他两两因素对Hyp-PC复合率的影响均是先增加后下降趋势,因此Box-Behnken响应面法优化Hyp-PC处方工艺是必要的。设置Hyp-PC复合率最小值为50%,最大值为100%,得Hyp-PC最佳处方工艺为大豆磷脂用量1=74.85 mg,制备温度2=50.06 ℃,搅拌时间3=2.47 h,预测Hyp-PC复合率为100.1%。
2.3.4 Hyp-PC最佳处方工艺的确定及验证 为便于实际操作,将Hyp-PC最佳处方工艺略作调整,大豆磷脂用量调整为75 mg,制备温度为50 ℃,搅拌时间为2.5 h。平行制备3批Hyp-PC,按照“2.3.1”项下方法测定Hyp-PC复合率,并计算偏差[偏差=(实际值-预测值)/预测值]。结果见表3,平均复合率为(99.68±0.50)%,与预测值100.1%相比偏差仅−0.42%,证明采用Box-Behnken响应面法优化Hyp-PC处方工艺较强的指导意义。

图2 自变量与响应值的三维图
2.3.5 X射线粉末衍射(X-ray powder diffraction,XRPD)法分析Hyp-PC的晶型 采用Cu-K α靶,为不缺失必要的晶型信息将扫描速度降低至4°/min,扫描范围(2)为3°~45°。取金丝桃苷原料药、磷脂、物理混合物(金丝桃苷与磷脂比例同Hyp-PC)和Hyp-PC适量置于玻璃槽,压制平整后进行扫描,结果见图3。金丝桃苷原料药在7.3°、8.6°、11.3°、19.5°、20.2°、25.5°等处出现特征晶型峰。物理混合物中仍可见金丝桃苷特征晶型峰,但强度有所下降,说明简单混合未能使金丝桃苷晶型发生改变。Hyp-PC的XRPD图谱显示金丝桃苷特征晶型峰完全消失,证明金丝桃苷晶型发生了改变,转变为无定形物质。
表3 Hyp-PC处方验证(, n = 3)
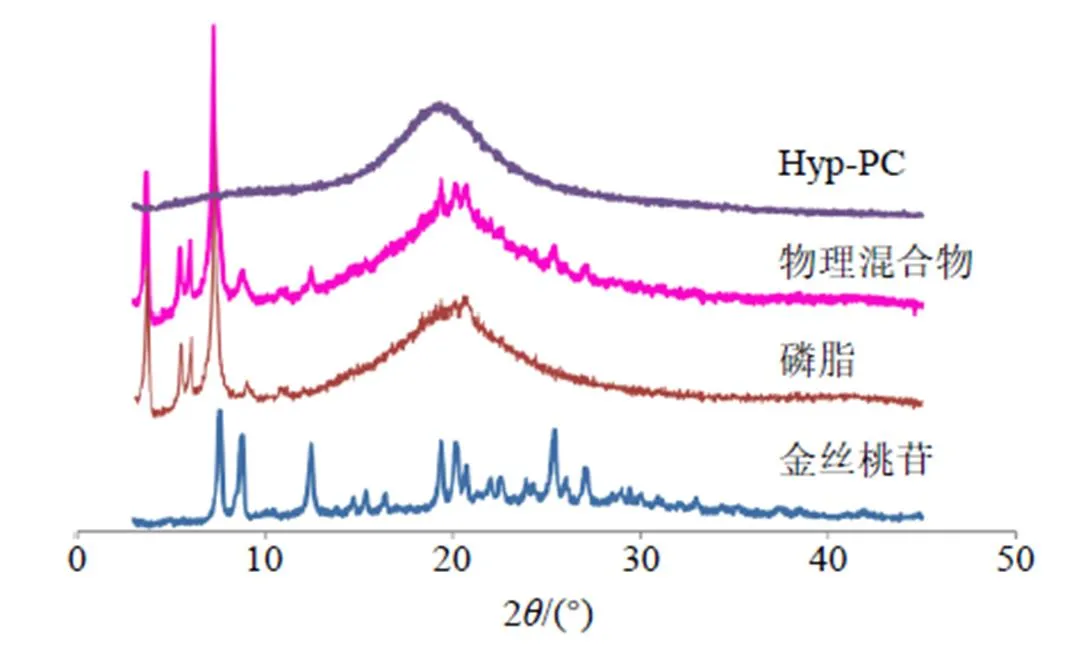
图3 Hyp-PC的XRPD结果
2.3.6 Hyp-PC油水分配系数的测定 按照《中国药典》2020年版四部配制pH值为2.0、4.5、5.0、6.8、7.4的磷酸盐缓冲液(PBS),分别取各pH值PBS 50 mL及蒸馏水50 mL分别作为水相,各水相中加入50 mL正辛醇,置于(37.0±0.5)℃的恒温振荡器中振摇2 d,分别取上层和下层即得水相饱和正辛醇及正辛醇饱和水相。取各个水相饱和正辛醇5 mL,加入过量的金丝桃苷原料药,同条件下振摇2 d,经0.45 μm滤膜滤过,测定续滤液中金丝桃苷质量浓度(o)。分别精密吸取2 mL,加入相应正辛醇饱和水相5 mL,同条件下继续振摇2 d,取水层测定质量浓度(w),计算油水分配系数(),=(o-w)/w,并计算lg值。同法测定物理混合物(金丝桃苷与磷脂用量比例与Hyp-PC一致)和Hyp-PC的lg值。结果见表4,将金丝桃苷制备成Hyp-PC后,金丝桃苷在不同pH值及水中的lg值均得到明显增加,为促进机体吸收奠定了基础。物理混合物的lg值有一定增加,但增加幅度远低于Hyp-PC。
2.4 Hyp-PC-MSN的制备及表征
2.4.1 Hyp-PC与MSN质量比考察 取金丝桃苷原料药、Hyp-PC、物理混合物(Hyp-PC与MSN质量比为1∶4)和不同处方的Hyp-PC-MSN粉末适量(金丝桃苷含量均为10 mg),加入5 mL空白释药介质,置于活化后透析袋中(截留相对分子质量为8000~12 000),两端扎紧。溶出介质为1.0% SDS溶液900 mL,溶出仪转速为75 r/min,待介质温度恒温至37 ℃后进行实验,分别于5、10、15、30、45、60、90、120、180、240 min取样5 mL,立即补加5 mL空白介质,使释药介质总体积不变。样品过0.45 μm微孔滤膜后进行HPLC测定,结果见图4。金丝桃苷原料药和Hyp-PC在240 min的累积溶出率分别为18.03%和29.88%。不同处方的Hyp-PC-MSN溶出速率和累积溶出率均明显提高,其中质量比为1∶4和1∶5时累积溶出率相对较高且无明显差别,为减少辅料用量故确定Hyp-PC和MSN的质量比为1∶4来制备Hyp-PC-MSN。
表4 油水分配系数测定结果(, n = 3)
Hyp-PC-MSN粉末及超声分散于水后混悬液外观见图5。
2.4.2 Hyp-PC-MSN包封率及载药量的测定 取Hyp-PC-MSN粉末约20 mg分散于50 mL蒸馏水中,取2 mL至离心管中,12 500 r/min高速离心45 min(离心半径4.6 cm,温度为4 ℃),取续滤液进样测定游离金丝桃苷量(游离)。取Hyp-PC-MSN混悬液按“2.2.3”项下方法进样测定总金丝桃苷的量(总药量)。取Hyp-PC-MSN混悬液50 mL,45 ℃下减压旋转蒸发除去无水乙醇,收集粉末,置于45 ℃真空干燥箱中干燥1 d,称定质量(总),计算Hyp-PC-MSN的包封率和载药量。
载药量=(总药量-游离)/总
包封率=(总药量-游离)/总药量
结果显示,3批Hyp-PC-MSN的平均包封率为(93.17±0.85)%,平均载药量为(7.54±0.33)%。
2.4.3 Hyp-PC-MSN的粒径及ζ电位测定 取“2.4.1”项下Hyp-PC-MSN混悬液,转移至比色皿中于粒度分析仪上测定粒径及多分散指数(polydispersity index,PDI)值。另取适量转移至测定ζ电位专用器皿中,测定Hyp-PC-MSN的ζ电位。结果显示,3批Hyp-PC-MSN样品平均粒径为(163.87±6.15)nm,粒径分布见图6-A,PDI值为0.108±0.009;Hyp-PC-MSN的ζ电位为(−0.28±0.05)mV,ζ电位分布见图6-B。

图5 Hyp-PC-MSN粉末(A)及混悬液(B)外观
2.4.4 Hyp-PC-MSN的溶解度测定 取过量的金丝桃苷原料药、Hyp-PC和Hyp-PC-MSN粉末,分别加入20 mL蒸馏水,置于37 ℃水浴中磁力搅拌2 d(700 r/min),12 500 r/min高速离心45 min(离心半径4.6 cm,温度为4 ℃),分别上清液进样测定金丝桃苷质量浓度。测得金丝桃苷原料药、Hyp-PC和Hyp-PC-MSN粉末的溶解度分别为(224.97±1.60)、(384.73±1.15)、(1 196.82±10.28)mg/L。可见Hyp-PC和Hyp-PC-MSN均可增加金丝桃苷溶解度,但Hyp-PC-MSN优势更大。
2.4.5 SEM观察Hyp-PC-MSN的微观外貌 取铜胶带黏贴至T型台上,用无水乙醇冲洗3次,并擦拭干净。取“2.4.1”项下的Hyp-PC-MSN混悬液,滴2滴加至铜胶带上,荡平后于室温自然晾干,喷金1 min(真空度为3.7 Pa),置于SEM观察Hyp-PC-MSN的微观外貌,放大倍数为14 000。结果见图7,可见Hyp-PC-MSN呈球形或椭圆形,外观圆整。
2.4.6 X射线衍射法分析Hyp-PC-MSN的晶型 取金丝桃苷原料药、物理混合物(金丝桃苷与辅料比例同Hyp-PC-MSN)和Hyp-PC-MSN粉末适量,置于玻璃槽,压制平整后按“2.3.5”项下条件进行扫描,结果见图8。金丝桃苷原料药在7.3°、8.6°、11.3°、19.5°、20.2°、25.5°等处出现特征晶型峰,物理混合物中仍可见原料药特征晶型峰,但在Hyp-PC-MSN的XRPD图谱中金丝桃苷特征晶型峰均完全消失,证明将Hyp-PC制备成Hyp-PC-MSN后金丝桃苷仍以无定形状态存在。

图7 Hyp-PC-MSN的SEM图
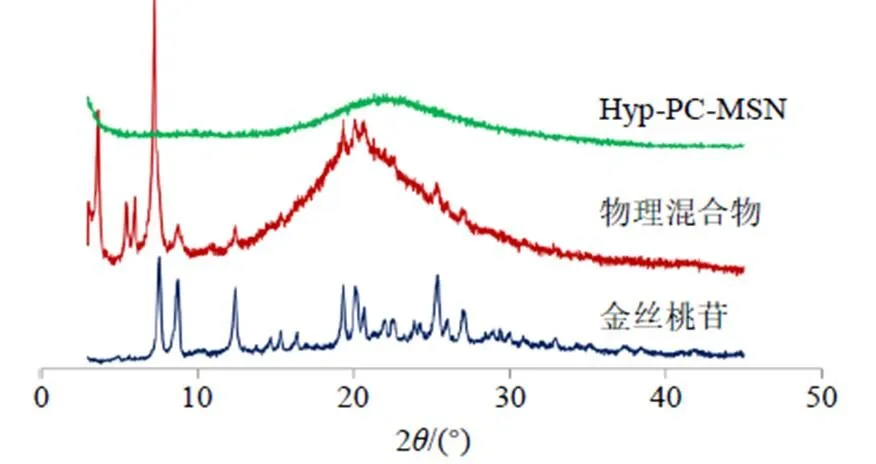
图8 Hyp-PC-MSN的XRPD结果
2.4.7 Hyp-PC-MSN的稳定性考察 取Hyp-PC- MSN粉末密封后置于温度为30 ℃、湿度为65%的恒温恒湿箱中,分别于0、1、5、10、15、30、45、60、75、90 d取样,分别测定粒径、包封率和载药量,结果见表5。Hyp-PC-MSN的粒径、包封率和载药量与0 d相比,变化幅度均小于±5%,说明Hyp-PC-MSN粉末在90 d内稳定性良好。
2.5 Hyp-PC和Hyp-PC-MSN的药动学研究
2.5.1 给药及取血方案 取质量浓度为5.0 mg/mL的CMC-Na水溶液配制金丝桃苷原料药、Hyp-PC和Hyp-PC-MSN粉末的ig液,超声10 s使之分散,临用现配。取18只SD大鼠,分为3组,按大鼠体质量进行ig给药,剂量均为20 mg/kg。ig后计时,分别于0、0.5、1、2、3、4、6、8、10、12、18 h采用乙醚麻醉后于眼眶静脉丛取血约0.25 mL,玻璃毛细管引流至肝素浸润的离心管中,涡旋震荡10 s,并3500 r/min离心(离心半径为6.8 cm)2 min,取上层浅黄色血浆至空白离心管中,密封并冷冻保存。
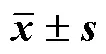
表5 稳定性研究结果(, n = 3)
2.5.2 血浆样品的制备[20]精密称取乙酰苯胺对照品适量,使用乙腈稀释至978.8 ng/mL,即得内标溶液。取100 μL血浆样品和50 μL内标溶液至离心管中,密封,涡旋混匀3 min。加入1 mL乙腈,涡旋震荡5 min,10 000 r/min离心(离心半径为6.8 cm)10 min(温度为4 ℃),收集有机相,于40 ℃氮吹仪吹干,加入100 μL流动相复溶,再次以 10 000 r/min离心10 min,即得血浆样品溶液。
2.5.3 线性关系考察 取采用乙腈稀释配制1980.0、990.0、495.0、247.5、99.0、49.5 ng/mL的金丝桃苷对照品溶液,各质量浓度分别取100 μL置于离心管中,于40 ℃氮吹仪吹干,分别加入100 μL空白血浆涡旋震荡5 min复溶,按照“2.5.2”项下方法处理,即得质量浓度为1 980.0、900.0、495.0、247.5、90.0、49.5 ng/mL的金丝桃苷血浆对照品溶液(均含乙酰苯胺内标)。按“2.2.1”项下色谱条件进样测定,以金丝桃苷质量浓度为横坐标(),金丝桃苷和乙酰苯胺峰面积比值为纵坐标(),进行线性回归,得回归方程=0.002 3-0.101 7,=0.996 4,因此,金丝桃苷血浆对照品在49.5~1 980.0 ng/mL线性关系良好。
2.5.4 专属性考察 取空白血浆、血浆样品(金丝桃苷原料药ig 18 h样品)和血浆对照品(金丝桃苷质量浓度为49.5 ng/mL),按“2.5.2”项下方法处理后进样HPLC测定,结果见图9,金丝桃苷和乙酰苯胺均不受内源性杂质干扰,专属性良好。
2.5.5 稳定性考察 取Hyp-PC给药3 h的血浆样品(处理后),分别于0、3、6、9、12、24 h进样测定,计算得金丝桃苷与乙酰苯胺峰面积比值的RSD为6.82%,因此血浆样品稳定性良好。
2.5.6 日内精密度及日间精密度考察 取金丝桃苷质量浓度为49.5 ng/mL(低)、495.0 ng/mL(中)、1 980.0 ng/mL(高)的血浆对照品溶液,1 d内连续测定6次,计算得金丝桃苷与乙酰苯胺峰面积比值的RSD分别为9.17%、5.69%、8.54%,说明日内精密度良好;连续测试6 d,每天1次,计算得金丝桃苷与乙酰苯胺峰面积比值的RSD分别为7.60%、9.43%、9.02%,说明日间精密度良好。
2.5.7 准确度考察 取质量浓度为49.5 ng/mL(低)、495.0 ng/mL(中)、1 980.0 ng/mL(高)的金丝桃苷血浆对照品溶液,分别按照“2.5.2”项下方法处理,测定金丝桃苷与乙酰苯胺的峰面积,带入血浆对照品标准曲线方程计算测得质量浓度,并与实际质量浓度对比,计算回收率,结果显示低、中、高质量浓度平均回收率为96.71%,RSD值为7.52%,可见准确度较高。

图9 空白血浆(A)、血浆对照品溶液(B)、血浆样品(C)的HPLC图
2.5.8 定量限考察 取金丝桃苷质量浓度为49.5 ng/mL血浆对照品,逐步稀释,采用信噪比为10时作为定量限,测试结果显示,金丝桃苷定量限为9.9 ng/mL。
2.5.9 药动学结果 金丝桃苷原料药、Hyp-PC和Hyp-PC-MSN组的血药浓度-时间曲线,结果见图10。使用DAS 2.0软件包拟合数据,结果见表6。Hyp-PC的达峰时间(max)与金丝桃苷原料药相比无统计学意义(>0.05),半衰期(1/2)有所延长(>0.05),达峰浓度(max)显著性提高至1.68倍,说明Hyp-PC在一定程度上可促进金丝桃苷的口服吸收,Hyp-PC的口服吸收生物利用度(Fr)提高至2.08倍。

图10 血药浓度-时间曲线(, n = 6)
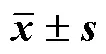
表6 主要药动学参数(, n = 6)
与Hyp原料药比较:*<0.05**<0.01;与Hyp-PC比较:#<0.05##<0.01
*< 0.05**< 0.01Hyp drug substance;#< 0.05##< 0.01Hyp-PC
将Hyp-PC制备成Hyp-PC-MSN后,max、1/2、max、AUC0~t和AUC0~¥均有极显著性提高(<0.05、0.01),与金丝桃苷原料药相比Hyp-PC-MSN的Fr提高至3.47倍。与Hyp-PC相比,Hyp-PC-MSN的max、1/2、max、AUC0~t和AUC0~¥均有极显著性改变(<0.05、0.01),可见将Hyp-PC制备成Hyp-PC-MSN后更进一步促进了金丝桃苷口服吸收,为药效提高奠定基础。
3 讨论
据文献报道[14-15],磷脂与药物分子按照物质的量比1∶1形成PC,虽然加大磷脂用量可以提高复合率,但磷脂用量过大时会对PC的存在形式产生较大影响,甚至以液态存在,因此需对磷脂用量进行精确优化。本研究采用Box-Behnken响应面法筛选出Hyp-PC最佳条件,复合率接近100%,Hyp-PC以固态形式存在,但由于较大的黏性给后续片剂、胶囊剂等制备带来了很大不便。
XRPD法结果显示,金丝桃苷在Hyp-PC中转变为无定型状态,但磷脂的晶型峰也消失不见,可能是由于金丝桃苷分子与磷脂的极性端通过氢键、范德华力等作用力结合在一起,使金丝桃苷和磷脂晶型峰均被抑制[12-13],因而导致金丝桃苷和磷脂的晶型峰均消失。磷脂具有两亲性特点,将金丝桃苷制备成Hyp-PC后,其水溶性和脂溶性均得到改善,但脂溶性的提高幅度,往往高于其水溶性的提高幅度[14-15],因而最终使金丝桃苷在不同介质中的油水分配系数均得到显著提高,利于药物经胃肠道黏膜吸收进入体循环。
PC疏水性较强,且黏性较大,因而释药速率和累积释放度均受到较大影响,最终也影响了药物的口服吸收生物利用度提高幅度[21]。国内外研究者进一步将PC制备成固体分散体、纳米结构脂质载体、固体脂质纳米粒等[21-24],但固体分散体容易吸潮,对存储条件要求较高,而磷脂复合物纳米结构脂质载体和固体脂质纳米粒均存在制备工艺复杂、辅料种类较多、载药量较低等缺陷。本研究借助MSN纳米粒技术将Hyp-PC制备成Hyp-PC-MSN粉末,不仅稳定性良好,载药量高,而且无需额外添加冻干保护剂,减少了辅料种类,具有推广意义。体外释药结果显示,Hyp-PC-MSN提高了Hyp-PC释药速率和累积释放度,使Hyp-PC本身缺陷得到明显改善。
与金丝桃苷相比,Hyp-PC生物利用度提高至2.08倍,至少与金丝桃苷转变为无定型态、溶出度及油水分配系数提高等因素有关。但Hyp-PC在240 min的累积溶出率仍不足30%,对药物溶出速率和溶出度改善作用有限,因而口服吸收提高效果受到较大限制[23]。Hyp-PC-MSN相对口服生物利用度提高至3.47倍,改善幅度高于Hyp-PC,可能是由于将Hyp-PC制备成Hyp-PC-MSN后药物的溶出速率及溶出度得到明显改善;Hyp-PC-MSN充分融合了PC和MSN技术优势,增强了药物吸收;药物比表面积剧增,增加了与胃肠道吸收部位的接触面,利于药物吸收[23-24];药物在Hyp-PC-MSN中仍以无定型态存在,而无定型态的药物更易被吸收[25-26];纳米药物在胃肠道具有较强黏附性,有益于药物吸收[27-28]。
本研究完成了Hyp-PC-MSN制备工艺、晶型、体外溶出及口服药动学等评价,为后续制剂学(片剂、胶囊剂等口服制剂)、毒理学、药效学等研究奠定了基础。此外,MSN表面含大量的羟基赋予其更好的可控性和修饰性[29-31],可通过表面功能化修饰进而实现靶向、控释药物等目的,达到提高药物疗效、降低毒副作用目的,后续也将作进一步研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 曹明明, 车琳琳, 朱路文. 金丝桃苷药理作用及机制研究进展 [J]. 辽宁中医药大学学报, 2022, 24(6): 150-155.
[2] 徐里, 赵川, 张延武. 金丝桃苷对卵巢癌细胞增殖、凋亡、迁移以及侵袭的影响[J]. 中成药, 2018, 40(3): 702-706.
[3] 王忠玲, 唐文哲, 林芳荣. 金丝桃苷对宫颈癌Hela胞凋亡及抗氧化能力的影响[J]. 中国煤炭工业医学杂志, 2019, 22(4): 402-407.
[4] 艾国, 王德文, 黄正明, 等. 金丝桃苷对Beagle犬的长期毒性研究 [J]. 中国新药杂志, 2015, 24(14): 1641-1647.
[5] 钱芳, 张芹. 黄蜀葵花总黄酮中金丝桃苷的平衡溶解度和表观油水分配系数测定 [J]. 中国药师, 2016, 19(12): 2222-2224.
[6] 张宇航, 邱智东, 邱野, 等. 金丝桃苷混合纳米胶束的制备及其肠吸收研究 [J]. 中国药房, 2022, 33(10): 1189-1197.
[7] 曹小帅, 沙美, 欧阳强, 等. 黄蜀葵花中4种黄酮类成分体内整合药动学研究 [J]. 中草药, 2010, 41(2): 255-259.
[8] 李园园, 罗明和, 石三军, 等. 金丝桃苷胶囊的制备及质量标准研究 [J]. 转化医学电子杂志, 2018, 5(9): 12-15.
[9] Feng Y F, Qin G Z, Chang S Y,. Antitumor effect of hyperoside loaded in charge reversed and mitochondria- targeted liposomes [J]., 2021, 16: 3073-3089.
[10] 禹瑞, 吕东霞, 谈秀凤. 橙皮苷脂质体的制备及其体内药动学研究 [J]. 中成药, 2022, 44(8): 2443-2449.
[11] Shen B D, Wu N, Shen C Y,. Hyperoside nanocrystals for HBV treatment: Process optimization,andevaluation [J]., 2016, 42(11): 1772-1781.
[12] 杭凌宇, 申宝德, 沈成英, 等. 不同粒径波棱甲素纳米混悬剂的制备及药动学研究 [J]. 中草药, 2021, 52(7): 1898-1905.
[13] 祝上宾, 王英飒, 敬凡尘, 等. 熊果苷磷脂复合物的制备、表征及理化性质研究 [J]. 中草药, 2020, 51(22): 5698-5704.
[14] 陈晓敏, 曹伶俐, 崔伟峰. 鼠李素磷脂复合物的处方工艺优化、表征及体外溶出度考察 [J]. 中国医院药学杂志, 2022, 42(4): 399-403.
[15] 胡悦, 孙敬蒙, 张炜煜. 羟甲香豆素磷脂复合物的制备工艺及形成机制 [J]. 中国医院药学杂志, 2021, 41(15): 1496-1501.
[16] 唐佳民, 张瑞涛. 介孔二氧化硅纳米粒的研究进展[J]. 现代药物与临床, 2015, 30(11): 1422-1426.
[17] 马记平, 刘丹花, 郝海军, 等. 根皮素磷脂复合物的制备及其体内药动学研究 [J]. 中成药, 2020, 42(6): 1577-1580.
[18] 任桂林, 柯刚, 郑琴, 等. 介孔二氧化硅350FCP固化陈皮、青皮挥发油研究 [J]. 中草药, 2021, 52(5): 1323-1334.
[19] Musallam A A, Mahdy M A, Elnahas H M,. Optimization of mirtazapine loaded into mesoporous silica nanostructures via Box-Behnken design:characterization andassessment [J]., 2022, 29(1): 1582-1594.
[20] Yang G, Li Z, Wu F H,. Improving solubility and bioavailability of breviscapine with mesoporous silica nanoparticles prepared using ultrasound-assisted solution-enhanced dispersion by supercritical fluids method [J]., 2020, 15: 1661-1675.
[21] 王晓剑, 郝旭亮, 梁泰刚, 等. HPLC测定金丝桃苷的血药浓度及其在药动学研究中的应用 [J]. 中国现代应用药学, 2009, 26(3): 231-233.
[22] 郜娜, 范明松, 杨庆宇, 等. 二氢杨梅素磷脂复合物纳米结构脂质载体的制备、表征及药动学研究 [J]. 中草药, 2019, 50(17): 4060-4067.
[23] 庞榕, 李开言, 王聪颖. 白杨素磷脂复合物固体分散体的制备及其体内药动学研究 [J]. 中成药, 2021, 43(10): 2611-2615.
[24] 刘会珍, 董丹丹, 范明松. 不同厚朴酚制剂的制备、表征及其在SD大鼠体内药动学行为比较 [J]. 中草药, 2020, 51(17): 4442-4448.
[25] 周开, 张佩琛, 郝海军, 等. 蒙花苷磷脂复合物固体脂质纳米粒的制备及其体内药动学研究 [J]. 中成药, 2020, 42(6): 1401-1405.
[26] 梁宇, 邢逞, 周启蒙, 等. 米非司酮3种晶型的制备及其在大鼠体内药动学研究 [J]. 中国新药杂志, 2020, 29(19): 2251-2259.
[27] 李君霞, 曹亚蕊, 王金涛, 等. 延胡索乙素磷脂复合物及其固体分散体、油制剂、纳米混悬剂的制备及药动学研究 [J]. 中草药, 2022, 53(14): 4307-4316.
[28] 刘万路. Box-Behnken设计-效应面法优化白屈菜红碱mPEG-PLGA纳米粒处方制备工艺及其药动学研究 [J]. 中草药, 2022, 53(23): 7361-7371.
[29] 秦芳芳, 彭有梅, 苏海波, 等. 鞣花酸纳米混悬剂的制备、表征及其体内药动学研究 [J]. 中草药, 2022, 53(13): 3980-3990.
[30] 江悦, 尚宏周, 孙晓然, 等. 介孔二氧化硅基纳米粒作为药物载体的最新研究进展 [J]. 化工新型材料, 2021, 49(9): 240-243.
[31] 盛晓丹, 刘臻, 罗砚曦, 等. 聚多巴胺修饰的载榄香烯介孔二氧化硅纳米粒的制备及其靶向抗肿瘤活性研究 [J]. 中草药, 2020, 51(10): 2745-2754.
[32] 刘盼盼, 陈文. 单分散性介孔二氧化硅的制备及靶向性评价 [J]. 中国医院药学杂志, 2020, 40(12): 1339-1344.
Preparation of hyperoside phospholipids complex and its mesoporous silica nanoparticles and oral pharmacokinetics study
LI Wei-hong1, ZHENG Wei1, WANG Feng-yun1, SUI Hai-juan2
1. Henan Vocational College of Applied Technology, Zhengzhou 450042, China 2. Jinzhou Medical University, Jinzhou 121001, China
To prepare hyperoside phospholipids complex (Hyp-PC) mesoporous silica nanoparticles (Hyp-PC-MSN), and study oral pharmacokinetics behavior.Taking the recombination rate as index, single factor experiment combined with Box-Behnken design-response surface methodology to optimize the formulation of Hyp-PC. Crystalline form of Hyp-PC was analyzed by X-ray powder diffraction (XRPD). Oil-water partition coefficient of Hyp-PC was determined. Solvent evaporation was used to prepare Hyp-PC-MSN. Microscopic appearance of Hyp-PC-MSN was observed by scanning electron microscope (SEM), and its dissolutionwas compared to Hyp-PC. SD rats were divided into hyperoside suspension group, Hyp-PC group and Hyp-PC-MSN group, hyperoside concentration in plasma was determined, and main pharmacokinetic parameters and relative oral bioavailability of Hyp-PC and Hyp-PC-MSN were calculated.Recombination rate of optimized formulations of Hyp-PC was close to 100%. Hyperoside was an amorphous substance in Hyp-PC and the oil-water partition coefficient was enhanced greatly. Microscopic appearance of Hyp-PC-MSN was spherical in shape. Average envelopment efficiency was (93.17 ± 0.85) %, drug loading was (7.54 ± 0.33)%, particle size was (163.87 ± 6.15) nm, PDI value was 0.108 ± 0.009 and ζ potential was (−0.28 ± 0.05) mV. Drug release rate and cumulative releaseratewas greatly promoted. Pharmacokinetics results showed thatmaxof Hyp-PC-MSN was advanced significantly,1/2was prolonged to (4.56 ± 0.82) h,maxwas increased to (1 462.62 ± 163.94) ng/mL and oral bioavailability was enhanced to 3.47 times.Hyp-PC-MSN could increase dissolution rate, cumulative dissolution rateand the oral bioavailability of hyperoside.
hyperoside; phospholipids complex; oil-water partition coefficient; mesoporous silica nanoparticles; dissolution rate; cumulative dissolution rate; bioavailability
R283.6
A
0253 - 2670(2023)13 - 4157 - 11
10.7501/j.issn.0253-2670.2023.13.009
2023-01-07
河南省高等学校重点科研项目计划(23B320013);妇科肿瘤科研创新团队(2021-TD-02);河南应用技术职业学院骨干教师(2020-GGJS-Y008)
李伟宏(1980—),女,硕士,副教授,从事临床药学研究。Tel: (0371)67673862 E-mail: liweihong5168@126.com
通信作者:王风云(1973—),女,硕士,教授,从事临床药学及妇科肿瘤研究。Tel: (0371)67673862 E-mail: wangfengyun1973@126.com
[责任编辑 郑礼胜]
