天然纯鲜粉葛饮料通过TLR4/MyD88/NF-κB通路抑制小鼠酒精性肝损伤研究
2023-07-05谢雪勤李志杰吴静宜邓欣洪玉冰车彦云赵毅
谢雪勤 李志杰 吴静宜 邓欣 洪玉冰 车彦云 赵毅


【摘要】目的:探討超高温瞬时灭菌全新工艺制备的无化学添加剂的天然纯鲜粉葛饮料对酒精性肝损伤小鼠的保护作用以及对TLR4/MyD88/NF-κB通路的影响。方法:采用高效液相色谱法对鲜粉葛饮料中异黄酮成分进行含量测定。采取 43% 酒精灌胃的方法建立小鼠酒精性肝损伤模型。检测血清中谷草转氨酶(AST)、谷丙转氨酶(ALT)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)及炎症因子水平;苏木素-伊红(HE)染色分析各组肝脏病理形态变化;免疫组化检测肝组织 Toll 样受体 4 (TLR4)、髓样分化分子88(MyD88)、核转录因子(NF-κB p65)的表达。结果:天然纯鲜粉葛饮料中检测到 6种异黄酮成分,其中葛根素含量最高,达到 622.6 μg/mL。天然纯鲜粉葛饮料预处理能降低小鼠体内两种血清转氨酶含量水平(P<0.01);饮料高剂量组能降低血清中 TG、TC、LDL、白细胞介素-6 (IL-6)、白细胞介素-1β (IL-1β)和肿瘤坏死因子-α (TNF-α)含量水平(P<0.001),提高HDL含量水平 (P<0.05)。病理切片结果显示天然纯鲜粉葛饮料能有效改善小鼠肝组织出现的脂肪空泡,胞质疏松,细胞核排列不规则等情况,并抑制小鼠肝组织中 TLR4、MyD88、NF-κB p65蛋白的表达(P<0.01,P<0.001)。结论:无化学添加剂的天然纯鲜粉葛饮料可减少小鼠肝脏内脂质沉积和降低炎症因子水平,对酒精性肝病具有一定的预防保护作用,其机制可能与抑制TLR4/MyD88/NF-κB通路的激活有关。
【关键词】天然纯鲜粉葛饮料;无化学添加剂;酒精性肝损伤;肝保护;炎症反应
【中图分类号】R932【文献标志码】 A【文章编号】1007-8517(2023)12-0012-08
Study on Natural Pure Fresh Pueraria Beverage Inhibited Alcoholic Liver Injury
Via TLR4/MyD88/NF-κB Pathway in MiceXIE Xueqin LI Zhijie WUJingyi DENG Xin HONG Yubing CHE Yanyun ZHAO Yi
1.College of Pharmaceutical Science, Yunnan University of Chinese Medicine, Kunming 650500, China;
2. Engineering research center for homology of medicine and food beverage of Yunnan Province, Kunming 650500, ChinaAbstract:Objective To investigate the protective effects of natural pure fresh pueraria beverage without chemical additives prepared by the brand new process of ultra-high temperature instantaneous sterilization on mice with alcoholic liver injury and its effects on TLR4/MyD88/NF-κB pathway.Methods The content of isoflavones in natural pure fresh pueraria beverage was determined by high performance liquid chromatography (HPLC). A mice model of alcoholic liver injury was established by intragastric gavage with 43% alcohol. The levels of aspartate aminotransferase (AST), alanine aminotransferase (ALT), total cholesterol (TC), triglyceride (TG), low-density lipoprotein (LDL), high-density lipoprotein (HDL), and inflammatory factors in serum were determined. And the pathological changes of the liver of each group were observed by (hematoxylin-eosin, HE) staining. In addition, the expression of Toll like receptors 4 (TLR4), myeloid differentiation factor 88 (MyD88) and nuclear factor kappa-B p65 (NF-κB p65) in the liver were measured by immunohistochemical staining.Results Six isoflavones were detected in natural fresh Pueraria beverage, and the content of puerarin was the highest, reaching 622.6 μg/mL. The experiments showed that the levels of AST and ALT in mice were reduced by the pretreatments with natural pure freshpueraria beverage (P<0.01). The serum TG, TC, LDL, the interleukin-6 (IL-6), interleukin-1beta (IL-1β) and tumor necrosis factor-alpha (TNF-α)levels were reduced in the beverage high-dose group (P<0.001), while the content of HDL was increased (P<0.05).Pathological sections showed that the fatty vacuoles, loose cytoplasm and irregular arrangement of nuclei in the liver tissue of mice were improved effectively, while the expressions of TLR4, MyD88 and NF-κB p65 proteins in those of mice were inhibited with natural pure fresh pueraria beverage (P<0.01, P<0.001).Conclusion These results suggested that natural pure fresh pueraria beverage without chemical additives could reduce the fatty deposition and levels of inflammatory factors in the liver of mice, thus had a certain preventive and protective effect on alcoholic liver injury. Its mechanism may be related with inhibition of the activation of TLR4/MyD88/NF-κB pathway.
Keywords:Natural PureFresh Pueraria Beverage;No Chemical Additives; Alcoholic Liver Injury; Liver Protection; Inflammation
酒精性肝病(alcoholic liver disease,ALD)是一种慢性肝病,早期可从酒精性脂肪肝发展为酒精性脂肪肝炎(alcoholic steatohepatitis,ASH),慢性的ASH 可导致肝纤维化,最后演变为肝硬化甚至肝细胞癌[1-2]。统计发现,亚洲ALD总患病率为4.81%,且患病率还在逐年增加[3]。ALD 的病因复杂,包括酒精及其代谢物对肝细胞的损伤、炎症因子、胆汁淤积、Kupffer 细胞和中性粒细胞的募集和激活等[4]。药理研究[5-7]表明,急性和慢性酒精肝损伤会通过TLR4激活 NF-κB通路产生各种促炎因子,同时,长期饮酒会使肠道菌群失调和肠道毒素积聚,进而增加肠道通透性,导致肝脏和其他器官发生炎性病变。此外,研究[8]发现酒精会影响肝细胞中的缺氧诱导因子1和脂肪酸代谢调节等转录因子水平,导致脂肪性病变。早期临床上的治疗手段主要包括预防、戒酒、补充营养、化学药物和肝移植等,但存在疗效一般、肝毒性和存活率低等缺陷[9-10]。药理研究表明具有抗氧化、抗炎以及调节脂肪代谢药理活性的中草药及其提取物,可用于治疗酒精性肝病[11-15]。
粉葛是豆科植物甘葛藤 Pueraria thomsonii Benth. 的干燥根,具有生津止渴,解酒毒,解肌退热等功效。《千金方》记载,将鲜葛捣烂,榨汁,饮之,可治“酒醉不醒”。现代研究[16-19]表明,葛根中具有异黄酮类、萜类、甾体类等多种活性成分。药理研究[20-22]发现,葛根提取物具有抗炎、抗凋亡和抗氧化等药理活性,可治疗酒精引起的肝脏损伤。葛根素、3′-甲氧基葛根素、大豆苷元、大豆苷等異黄酮成分肝保护作用的主要活性成分。临床研究[23]表明,葛根提取物有助于降低人对酒精饮用的需求,延长饮酒的时间间隔,有助于饮酒者降低对酒精的依赖。
目前市场上粉葛饮料开发主要集中于酶解或发酵型复配饮料,掩盖了粉葛的天然风味,且多添加化学食品添加剂,长期饮用存在安全隐患。因此,云南省药食同源饮品工程研究中心结合粉葛药食两用的特征,融合超高温瞬时灭菌等现代高新技术,研发了一款口感天然清香、无添加、质量稳定、易于携带与储存的天然纯鲜粉葛饮料,市场应用前景广阔。采用小鼠体内酒精肝损伤模型,初步探讨其对酒精诱导小鼠肝损伤的保护作用以及与TLR4/MyD88/NF-κB 通路的关联性,为天然纯鲜粉葛饮料在保护肝损伤方面的应用提供理论依据。
1材料和方法
1.1材料与试剂无添加天然纯鲜粉葛饮料主要由超纯水、鲜粉葛组成(粉葛:购自德阳远知药材经营部,由云南中医药大学中药学院赵毅正高级工程师鉴定为豆科植物甘葛藤 Pueraria thomsonii Benth. 的根,标本现存于云南省药食同源饮品工程研究中心)。
葛根素(Puerarin)、3′-甲氧基葛根素(3′-MethoxyPuerarin)、葛根素芹菜糖苷(Puerarin apioside)、大豆苷(Daidzin)、染料木苷(Genistin)、大豆苷元(Daidzein),均购于德斯特生物技术有限公司(纯度≥98.0%);水飞蓟宾(天士力制药集团股份有限公司); 43°红星蓝瓶二锅头(成都金龙酒厂);谷丙转氨酶(alanine aminotransferase,ALT,批号:20220901)、谷草转氨酶(aspartate aminotransferase,AST,批号:20220831)、总胆固醇(total cholesterol,TC,批号:20220112)、甘油三酯(triglyceride,TG,批号:202201012)、低密度脂蛋白(low-density lipoprotein,LDL,批号:20220111)、高密度脂蛋白(high-density lipoprotein,HDL,批号:20220112)试剂盒均为南京建成生物工程研究所产品;白细胞介素-6(interleukin-6,IL-6,批号:A20620845)、白细胞介素-1β(interleukin-1beta,IL-1β,批号:A201BH20445)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α,批号:A28220747)酶联免疫试剂盒均为联科生物产品;苏木素-伊红染色试剂盒(hematoxylin-eosin,HE,批号:C0105S,碧云天生物技术公司);冰乙酸(分析纯,天津市风船化学试剂科技有限公司);水(超纯水,云南省药食同源饮品工程研究中心);甲醇(色谱纯,Sigma-Aldrich)。
1.2仪器与设备BP-PB02S 破壁料理机(广州蓝宝智能科技有限公司);MLS-3751L-PC高压灭菌机(松下健康医疗器械株式会社);FT74XTS-A 超高温瞬时灭菌机(英国 Armfield 公司);DL6M 大容量冷冻离心机(湖南凯达科学仪器有限公司);SHIMADZU LC-2030 高效液相色谱仪(日本岛津公司);AR224CN型分析天平(奥豪斯仪器有限公司);22331Hamburg5452型高速冷冻离心机(德国 Eppendorf AG 公司);VE-10LH-A超纯水机(深圳市洪森环保科技有限公司);SPARK 10M 多功能酶标仪(瑞士 Tecan 公司);BCD-610W冰箱(西门子股份公司);Teksqray SQS-1000 玻片扫描影像系统(深圳市生强科技有限公司);CUT5062 石蜡切片机[莱比信(北京)仪器有限公司]。
1.3实验动物健康雄性 KM 小鼠(SPF级,18~20g),由昆明医科大学提供,合格证号:SCXK(滇)K2020-0004;动物由云南中医药大学实验动物福利与伦理委员会批准于动物实验中心饲养(批准审批号:R-06202009,许可证号:SYXK(滇)K2022-0004);饲养环境温度为 21~25 ℃,相对湿度为45%~55%,自由饮水和摄食。
1.4实验方法
1.4.1天然纯鲜粉葛饮料的制备首先挑选新鲜粉葛清洗、切小块,用破壁料理机粉碎制浆,过药典 9 号筛,滤液连续离心,两次离心后取上清液进行高压均质,再将均质后的粉葛饮料进行超高温瞬时灭菌与无菌灌装,整个过程中不使用任何防腐剂、增稠剂、稳定剂等化学添加剂,最后制得澄清透明并具有粉葛清香味的天然纯鲜粉葛饮料。天然纯鲜粉葛饮料成人推荐摄入量为 300 mL/60 kg(受试物为 10 倍浓缩液)。
1.4.2高效液相色谱条件利用 C18 色谱柱(250 mm×4.6 mm),流动相:0.2% 冰乙酸水(A)-甲醇(B);洗脱梯度:0~10 min,20% B→23% B;10~30 min,23% B→35% B;30~55 min,35% B→70% B;55~65 min,70% B→20% B,检测波长 250 nm,流速 1.0 mL/min,进样量:10 μL;柱温 30 ℃。
1.4.3动物分组和给药60只小鼠适应性饲养 1 周后随机分成 5 组(n=12):正常组、模型组、水飞蓟宾阳性药组(100 mg/kg)、天然纯鲜粉葛饮料低剂量组(4.0 mL/kg),天然纯鲜粉葛饮料高剂量组(8.0 mL/kg),正常组和模型组分别给予 0.02 mL/g 体积的蒸馏水,给药组连续按剂量给药 20 d (均灌胃给药),灌胃 1 h 后,除正常组给予同等体积蒸馏水外,其余组均灌胃红星蓝瓶二锅头(43%)(10 mL/kg)。20 d 后进行眼球取血,经低温离心得到血清;将小鼠脱颈处死,立即取出肝组织,将各肝脏用4%多聚甲醛溶液进行固定,用于后续实验。
1.4.4小鼠血清生化指標的测定取各组小鼠血清,根据试剂盒说明书,对血脂水平TG、TC、HDL、LDL四个指标、AST和 ALT 两个指标以及炎症因子IL-6、IL-1β、TNF-α的水平进行检测。
1.4.5组织病理学检查取肝左叶最大面,用 4% 多聚甲醛溶液固定后脱水,石蜡包埋制成 5 μm 切片。分别用 HE 染色后在显微镜下观察,以及进行免疫组化染色观察,免疫组化图片采用 ImageJ 软件进行平均光密度(IOD/Area)分析。
1.4.6统计学分析数据结果均用(x±s)表示,采用 IBM SPSS Statistics 26. 0软件进行数据分析处理后采用 GraphPad Prism 9.3.1 软件作图,采用单因素方差分析(ANOVA)与 LSD 检验比较评估两组间的差异,以P<0.05为差异有统计学意义。
2结果与分析
2.1鲜粉葛及其饮料中化学成分分析采用高效液相色谱法,在无添加天然纯鲜粉葛饮料中检测到葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、染料木苷、大豆苷元 6 种成分,其中各成分含量分别为622.6 μg/mL、8.3 μg/mL、63.4 μg/mL、56.6 μg/mL、7.0 μg/mL、4.4 μg/mL,跟原料相比该饮料中葛根素保留率达到75.4%,有效保留了其中有效成分。上述成分可以作为指标性成分用于无添加天然纯鲜粉葛饮料的质量控制(如图1所示)。
2.2天然纯鲜粉葛饮料对小鼠血清转氨酶、TG、TC、HDL 和LDL 的影响转氨酶是临床上肝功检查的指标,当肝脏发生严重坏死或破坏时,会引起在血清中 AST、ALT 转氨酶浓度偏高,且 AST 水平高于 ALT 的水平[24]。此外,实验对 TG、TC、HDL、LDL 水平进行了检测,此四项是反映肝脏脂肪代谢障碍的敏感指标[25]。当 TG 水平上升时,血清中 LDL 增多;当血清中 TC 水平上升时,HDL 对 TC 转运作用增强,使循环血中 HDL 含量降低[26]。检测结果表示,与正常组相比,43% 酒精灌胃,导致小鼠血清中 ALT、AST 水平升高(P<0.01,P<0.001),分别达到 15.25 U/L、32.08 U/L;而无添加天然纯鲜粉葛饮料和水飞蓟宾预给药可降低 ALT、AST 水平,天然纯鲜粉葛饮料高剂量组中 ALT、AST 下降较为显著(P<0.01,P<0.001),降低到10.33、25.88 U/L,与水飞蓟宾阳性药组效果较为接近(如图 2所示)。
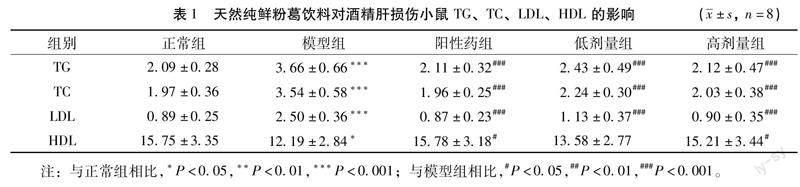
另外,结果显示,与正常组相比,模型组 TG、TC、LDL 的水平均有显著上升(P<0.001),HDL 的含量明显下降(P<0.05)。表明天然纯鲜粉葛饮料对降低血清 TG、TC、LDL 的含量有一定作用,其中天然纯鲜粉葛饮料高剂量组抑制率可达到 42.0%、42.69%、64.07%,均具有显著统计学意义(P<0.001),且该组小鼠血清中 HDL 含量也呈上升趋势(P<0.05)。实验结果表明天然纯鲜粉葛饮料能改善酒精诱导的小鼠肝组织损伤(表 1)。注:与正常组相比,*P<0.05,**P<0.01,***P<0.001;与模型组相比,#P<0.05,##P<0.01,###P<0.001。
2.3天然纯鲜粉葛饮料对小鼠 IL-6、IL-1β和 TNF-α的影响由图3可知,与正常组相比,模型组小鼠血清IL-6、IL-1β、TNF-α含量均明显上升,且差异均存在统计学意义(P<0.001);与模型组相比,鲜粉葛饮料组与水飞蓟宾阳性药组血清IL-6、IL-1β、TNF-α含量均显著下降(P<0.01,P<0.001);表明鲜粉葛饮料可通过抑制IL-6、IL-1β和 TNF-α炎症因子的释放而减轻炎症反应。
2.4天然纯鲜粉葛饮料对小鼠肝组织病理学变化的影响通过对各组肝脏 HE 染色切片观察,发现正常组中组织细胞核排列规则整齐,形态正常,染色均匀;模型组肝细胞损伤明显,可见脂肪空泡,胞质疏松,细胞核排列不规则且少量有死亡现象;与模型组比较,天然纯鲜粉葛饮料低、高剂量组小鼠肝组织损伤情况均有较明显的改善(如图4所示)。HE染色结果表明天然纯鲜粉葛饮料对酒精诱导的小鼠肝组织病理学变化有良好的治疗效果。
2.5天然純鲜粉葛饮料对小鼠肝组织 TLR4、MyD88、NF-κB p65 的免疫组化分析通过对肝脏免疫组化染色切片观察,发现TLR4、MyD88与 NF-κB p65 在模型组高表达,在正常组、天然纯鲜粉葛饮料低、高剂量组低表达或不表达。通过 ImageJ 软件进行平均光密度分析发现,在天然纯鲜粉葛饮料干预后,天然纯鲜粉葛饮料低、高剂量均可使小鼠肝组织 TLR4 的表达降低13.19%、18.17%(低剂量组:P<0.001,高剂量组:P<0.001),使小鼠肝组织 MyD88 的表达降低10.83%、11.64%(低剂量组:P<0.01,高剂量组:P<0.01),使小鼠肝组织 NF-κB p65 的表达降低23.06%、26.74%(低剂量组:P<0.01,高剂量组:P<0.001)(如图5~8所示)。
3结论与讨论
中医认为酒有毒,饮酒过量会使酒毒湿热内蕴,肝脾损伤[27]。现代研究[28-30]发现,酒精主要依靠肝脏进行代谢,长期大量饮酒会加重肝脏的负担,造成肝损伤。同时,大量饮酒会刺激体内内毒素的产生,激活肝脏巨噬细胞,引起 TLR4 的高表达。TLR4 激活后,通过 MyD88 介导信号转导,然后激活 NF-κB,启动 TLR4/NF-κB 信号通路,促进炎症因子 TNF-a、IL-1β、IL-6 的释放,引发炎症反应,调节免疫细胞和炎症细胞,参与免疫细胞的增殖、分化和凋亡,从而加重肝损伤。
古代医学对酒精性肝病的早期研究,是在唐代的《药性论》,书中明确指出葛根能“开胃下食,解酒毒”。现代药理研究[31]发现,葛根异黄酮具有抗炎活性,可降低 TNF-a、IL-1β、IL-6 等炎症因子的释放;其中,葛根素具有一定的抑制 NF-κB p65活化的作用[16];另外,葛根素、大豆苷元还能有效减少酒精的摄入[32]。本研究采用新鲜粉葛作为原料制得无添加天然纯鲜粉葛饮料,初步探究了该饮料对酒精诱导小鼠肝损伤的保护作用。
研究结果表明,无添加天然纯鲜粉葛饮料能够抑制小鼠体内血清中炎症因子水平的升高,调节脂质代谢的紊乱,并能改善肝脏组织损伤情况。进一步采用免疫组化进行机制研究,发现无添加天然纯鲜粉葛饮料可通过抑制 TLR4/MyD88/NF-κB 通路的激活,下调 TLR4、MyD88 和 NF-κB 蛋白的表达,减少炎症因子的释放,发挥抗炎作用,从而减轻小鼠酒精性肝损伤。本实验发现葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、染料木苷、大豆苷元 6 种异黄酮成分在天然纯鲜粉葛饮料中保留率较高,推测是其发挥了保肝作用。本研究为开发天然的无添加鲜粉葛护肝饮料提供基础理论指导,为粉葛资源的开发利用奠定了基础。参考文献
[1]SEITZ H K, BATALLER R, CORTEZ-PINTO H, et al. Alcoholic liver disease[J]. Nat Rev Dis Primers, 2018, 4(1):1-22.
[2]ASRANI S K, DEVARBHAVI H, EATON J, et al. Burden of liver diseases in the world[J]. J Hepatol, 2019,70(1):151-171.
[3]XU H, XIAO P, ZHANG F, et al. Epidemic characteristics of alcohol-related liver disease in Asia from 2000-2020:a systematic review and meta-analysis[J].Liver Int, 2022, 42(9):1991-1998.
[4]DUNN W,SHAH V H.Pathogenesis of Alcoholic Liver Disease[J]. Clin Liver Dis, 2016, 20(3):445-456.
[5]MANDREKAR P, SZABO G. Signalling pathways in alcohol-induced liver inflammation[J]. J Hepatol, 2009, 50(6):1258-1266.
[6]KONG X, YANG Y, REN L, et al. Activation of autophagy attenuates EtOH-LPS-induced hepatic steatosis and injury through MD2 associated TLR4 signaling[J]. Sci Rep-UK, 2017, 7(1):1-12.
[7]PUROHIT V, BODE J C, BODE C, et al. Alcohol, intestinal bacterial growth, intestinal permeability to endotoxin, and medical consequences:summary of a symposium[J]. Alcohol, 2008, 42(5):349-361.
[8]NATH B, LEVIN I, CSAK T, et al. Hepatocyte-specific hypoxia-inducible factor-1α is a determinant of lipid accumulation and liver injury in alcohol-induced steatosis in mice[J]. Hepatology, 2011, 53(5):1526-1537.
[9]STICKEL F, DATZ C, HAMPE J, et al. Pathophysiology and management of alcoholic liver disease:Update 2016[J]. Gut Liver, 2017, 11(2):173-188.
[10]MARRONI C A, FLECKl JR A M, FEMANDES S A, et al. Liver transplantation and alcoholic liver disease:History, controversies, and considerations[J]. World J Gastroentero, 2018, 24(26):2785-2805.
[11]QIU P, DONG Y, ZHU T, et al. Semen hoveniae extract ameliorates alcohol-induced chronic liver damage in rats via modulation of the abnormalities of gut-liver axis[J]. Phytomedicine, 2019(52):40-50.
[12]GUO M X, ZHANG M M, YANG H Y, et al. Lagotis brachystachya maxim attenuates chronic alcoholic liver injury combined with gouty arthritis in rats via its anti-inflammatory activity[J]. Front Pharmacol, 2022 (13):995777.
[13]王思为,夏道宗,方月娟,等.葛根复合胶囊对小鼠酒精性肝损伤的保护作用研究[J].云南中医学院学报,2015,38(1):1-4.
[14]李志满,邵紫君,李珊珊,等.人参枳椇子提取物对小鼠酒精性肝损伤的保护作用[J].食品工业科技, 2019, 40(14):302-306.
[15]许皖,李娜,柳海艳,等.基于Keap1/Nrf2/ARE信号通路探讨葛花、枳椇子及其配伍对急性酒精性肝损伤小鼠抗氧化应激的作用机制[J].中国实验方剂学杂志,2023,29(1):37-44.
[16]张汉庆,刘勇,古鹏,等.葛根素对IL-1β损伤大鼠关节软骨细胞核因子-κB的影响[J].云南中医学院学报,2013,36(5):4-6.
[17]SRIVASTAVA S, PANDEY H, SINGH S K, et al. Anti-oxidant, anti-apoptotic, anti-hypoxic and anti-inflammatory conditions induced by PTY-2 against STZ-induced stress in islets[J]. Biosci Trends, 2019,13(5):382-393.
[18]ZHAO W, PENG D, LI W, et al. Probiotic-fermented Pueraria lobata (Willd.) Ohwi alleviates alcoholic liver injury by enhancing antioxidant defense and modulating gut microbiota[J]. J Sci Food Agric, 2022,102(15):6877-6888.
[19]SATPATHY S, PATRA A, AHIRWAR B, et al. Antioxidant and anticancer activities of green synthesized silver nanoparticles using aqueous extract of tubers of Pueraria tuberosa[J]. Artif Cell Nanomed B, 2018, 46(3):S71-S85.
[20]SUN Y J, ZHANG H M, CHENG M, et al. New hepatoprotective isoflavone glucosides from Pueraria lobata (Willd.) Ohwi[J]. Nat Prod Res, 2019, 33(24):3485-3492.
[21]张林松,徐卫东,石继伟,等.葛根素与葛根多肽对小鼠酒精性肝损伤的治疗作用研究[J].江苏中医药,2018,50(2):76-78.
[22]JIANG B, YANG W, CHEN L, et al. In vitro effects of Pueraria extract on ethanol-exposed microglia and neurons[J]. Biomed Pharmacother, 2020(127):110163.
[23]PENETAR D M, TOTO L H, LEE D Y W, et al. A single dose of kudzu extract reduces alcohol consumption in a binge drinking paradigm[J]. Drug Alcohol Depen, 2015(153):194-200.
[24]SINGAL A K, BATALLER R, AHN J, et al. ACG clinical guideline:alcoholic liver disease[J]. Am J Gastroenterol, 2018, 113(2):175-194.
[25]梁燕媚,黃伟健,高飞云.脂肪肝患者血脂、血糖和肝功酶学指标变化的检测分析[J].中国当代医药,2019,26(18):155-158.
[26]王萍,唐光才,舒健,等.非酒精性脂肪肝肝/脾CT值与血脂的关系研究[J].西南医科大学学报, 2018, 41(1):67-70.
[27]季光,曹承楼.酒精性肝病的中医研究[J].辽宁中医杂志, 2001(4):198-199.
[28]RASHIDIAN A, MUHAMMADNEJAD A, DEHPOUR A R, et al. Atorvastatin attenuates TNBS-induced rat colitis:the involvement of the TLR4/NF-kB signaling pathway[J].Inflammopharmacology, 2016(24):109-118.
[29]WANG W, HU X, SHEN P, et al. Sodium houttuyfonate inhibits LPS-induced inflammatory response via suppressing TLR4/NF-κB signaling pathway in bovine mammary epithelial cells[J]. Microb Pathogensis, 2017(107):12-16.
[30]YU H X, WANG X L, ZHANG L N, et al. Involvement of the TLR4/NF-κB signaling pathway in the repair of esophageal mucosa injury in rats with gastroesophageal reflux disease[J].Cell Physiol Biochem, 2018, 51(4):1645-1657.
[31]LIM D W, EE C, KIM I H, et al. Anti-inflammatory effects of total isoflavones from Pueraria lobata on cerebral ischemia in rats[J]. Molecules, 2013, 18(9):10404-10412.
[32]SZULC M, KUJAWSKI R, BARANIAK J, et al. Differential Influence of Pueraria lobata Root Extract and Its Main Isoflavones on Ghrelin Levels in Alcohol-Treated Rats[J]. Pharmaceuticals, 2021, 15(1):25.(收稿日期:2022-11-01編辑:刘斌)
