香蕉枯萎病菌1号和4号生理小种在‘巴西蕉’植株及根际土壤中的时空分布
2023-07-01饶雪琴李华平
饶雪琴,唐 瑞,李华平
(广东省微生物信号与病害防治重点实验室/华南农业大学 植物保护学院,广东 广州 510642)
香蕉Musaspp.是我国重要的经济作物,由尖孢镰刀菌古巴专化型(Fusariumoxysporumf.sp.cubense,Foc) 引起的香蕉枯萎病不断扩散蔓延,使我国香蕉产业发展严重受阻。根据Foc 在不同香蕉品种上的致病性差异,将其分为Foc1、Foc2和Foc4 等3 个不同生理小种[1]。按照病害发生的地理区域等因素,进一步将Foc4 分为热带4 号小种(Tropical race 4,TR4) 和亚热带4 号小种(Subtropical race 4,STR4)[2];Foc1 分布于世界各地,侵染范围较广[3],而TR4 为目前世界各地香蕉中蔓延最广、危害最重的香蕉枯萎病菌[2]。我国自1996年在广东番禺大面积发现香蕉枯萎病以来,随后在海南、福建、广西和云南等地相继发现Foc4 引起的香蕉枯萎病[4]。目前为害我国香蕉的枯萎病菌主要是Foc1 和Foc4 生理小种[5-6],其中,Foc4 多数为TR4[7],该菌在热带亚热带地区均有较强致病力,严重威胁我国香蕉产业[5]。研究Foc 侵染香蕉最常用的方法是利用激光共聚焦扫描显微镜观察荧光蛋白标记的Foc[8-9]。Li 等[8]采用绿色荧光蛋白标记Foc TR4 和Foc1,然后分别接种巴西蕉,发现两者侵入方式不同,Foc TR4 从表皮细胞间或者伤口侵入,而Foc1 只能通过伤口侵染。Xiao 等[10]发现绿色荧光蛋白标记的Foc4 先侵入巴西蕉幼根表皮,随后侵入球茎和假茎,Foc 菌丝在假茎中最多、球茎中最少。Dong 等[11]发现接种Foc 后 7 d,在巴西蕉假茎和叶鞘中均能检测到标记的Foc4,但检测不到标记的Foc1;接种后15~30 d,在叶片中能检测到Foc4;在巴西蕉根和球茎中Foc4 菌量高于Foc1。刘磊等[12]通过平板菌落计数法发现,Foc 在香蕉植株内的分布因样地发病程度和植株部位不同差异显著,球茎中的Foc 明显高于其他部位。这些学者利用不同的方法研究香蕉枯萎病菌侵染过程,为香蕉枯萎病菌致病和病害流行提供了参考。香蕉枯萎病萎蔫症状主要是由于维管束堵塞造成营养和水分运输受阻[8]。Foc 侵染过程反映了香蕉体内Foc 的变化,而Foc 分布与其侵染和致病性直接相关。由于香蕉枯萎病是一种菌量依赖性病害[13],土壤中病菌含量是决定香蕉植株能否发病以及病害严重程度的影响因素。目前鲜见枯萎病菌在病株土壤中空间分布的相关报道,探究香蕉枯萎病菌在寄主体内和根际土壤中的分布是研究香蕉枯萎病菌致病机制和病害流行的重要基础。本研究对香蕉植株内及根际土壤中Foc 含量及分布进行分析,旨在为香蕉枯萎病菌的侵染和致病机理研究提供理论依据。
1 材料与方法
1.1 材料
试验材料为对Foc1 抗病、对Foc4 感病的‘巴西蕉’MusaacuminateL.AAA group,cv.Brazilian。Foc 均为华南农业大学植物病毒实验室保存,Foc4菌株为TR4 XJZ2(VCG 01216),Foc1 菌株为Foc1 FJZ3(VCG 01221)。温室试验取“五叶期”盆栽幼苗置于防虫网室中,大田种植于华南农业大学教学科研基地。
1.2 样品总DNA 抽提和引物合成
香蕉枯萎病菌总DNA、土壤总DNA 以及香蕉总DNA 提取分别采用MAGEN 生物公司的真菌DNA、土壤总DNA 以及广谱性植物DNA 抽提试剂盒,具体方法参考说明书。利用核酸蛋白分析仪测定DNA 浓度及D260 nm/D280 nm比值。
根据GenBank 中香蕉枯萎病病菌序列,利用Primer 3 分别设计Foc PCR 和实时荧光定量PCR引物,引物由上海生物工程有限公司合成,具体见表1。本研究中引用的引物以及设计的引物经试验证明,对相应Foc 生理小种都有特异性[4,14-15]。
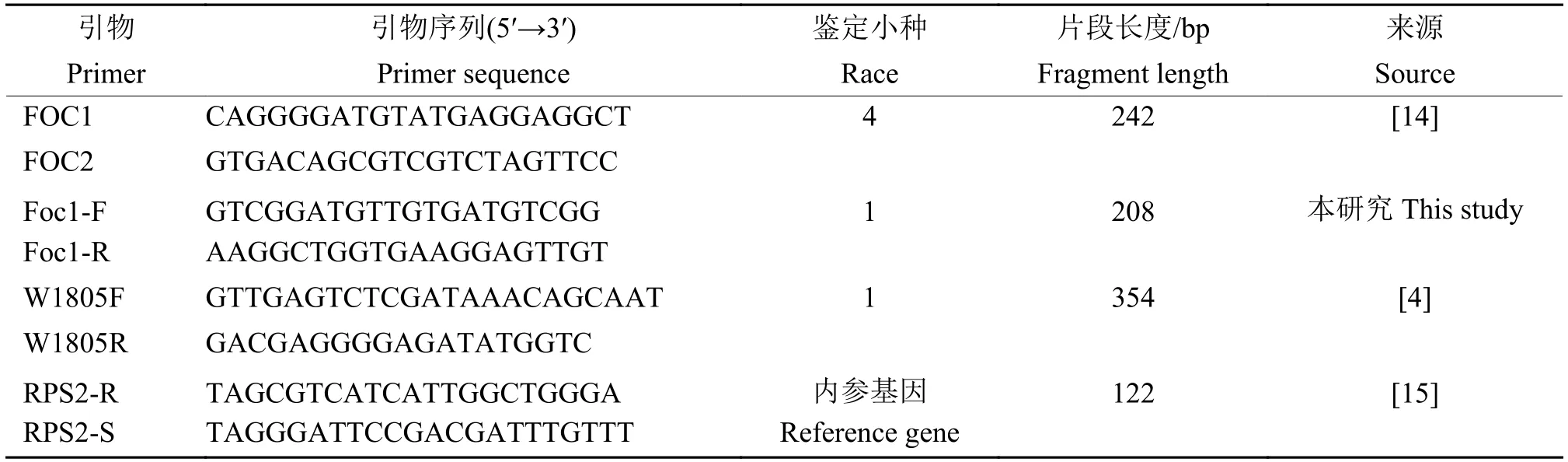
表1 本研究引物信息Table 1 The primers used in this study
1.3 实时荧光定量PCR 方法
提取Foc 侵染的‘巴西蕉’根部DNA,以其为模板进行PCR 扩增。电泳后,将目的片段切胶回收,连接至pMD18-T 载体上。经PCR 和酶切,鉴定为阳性的重组质粒送生工测序,选取相似性大于90%的作为阳性重组质粒,分析其浓度,计算拷贝数。以10 倍梯度稀释的质粒DNA 作为绝对定量标准品。标准曲线由系列稀释的量化目标 DNA 和Ct值生成。实时荧光定量PCR 进行3 次生物学和技术重复。
1.4 香蕉枯萎病菌接种液的制备和接种
将-80 ℃保存的Foc1 和Foc4 菌种接种在PDA 固体培养基上,28 ℃恒温培养箱中培养1 周。将无菌水洗脱的孢子添加至YPD 液体培养基中恒温振荡培养,Foc1 和Foc4 培养温度分别为28 和26 ℃。培养3 d 后,将培养液离心,孢子沉淀用无菌水洗2 次,调整孢子浓度备用。
香蕉枯萎病菌温室接种采用伤根接种法[11],接种后的香蕉置于25~32 ℃温室内培养。Foc 孢子浓度为1×105mL-1,无菌水作空白对照,每个处理15 株幼苗。大田种植的健康‘巴西蕉’株高1 m左右接种,在每株植株半径为0.5 m 内用取土器伤根后,浇灌1.5×106mL-1的Foc 接种液1 L。Foc1 和Foc4 各接种5 株。
1.5 香蕉枯萎病调查和样品收集
对接种后香蕉发病情况进行调查,计算病情指数,枯萎病分级标准参考Brake 等[16]。对接种Foc1 和Foc4 的盆栽幼苗分别于接种后2、4、6、8、10、14、21 d 采集根、球茎、球茎以上3~4 cm 处假茎和刚展开的第1 叶进行Foc 检测。接种后30 d,对大田种植的‘巴西蕉’植株不同部位进行PCR 检测,采集病株不同方位(东、南、西、北)、离植株不同地面半径(r分别为5、15、30 cm)处不同深度(h分别为0~5、10~15、25~30 cm)的土样进行混合,共获得9 组土壤样品,-20 ℃保存,试验重复3 次。
1.6 ‘巴西蕉’植株和根际土壤中Foc1 和Foc4菌量及统计分析
分别提取接种Foc1 和Foc4 的‘巴西蕉’植株不同部位和不同土壤DNA 作为定量模板,进行实时荧光定量PCR 扩增。通过计算确定不同样品中Foc1 和Foc4 菌量。试验数据均用平均值±标准差表示,采用SPSS 19.0 统计软件(IBM company,Armonk,America)进行方差分析,采用Duncan’s 法检验差异显著性。
2 结果与分析
2.1 实时荧光定量PCR 方法的建立
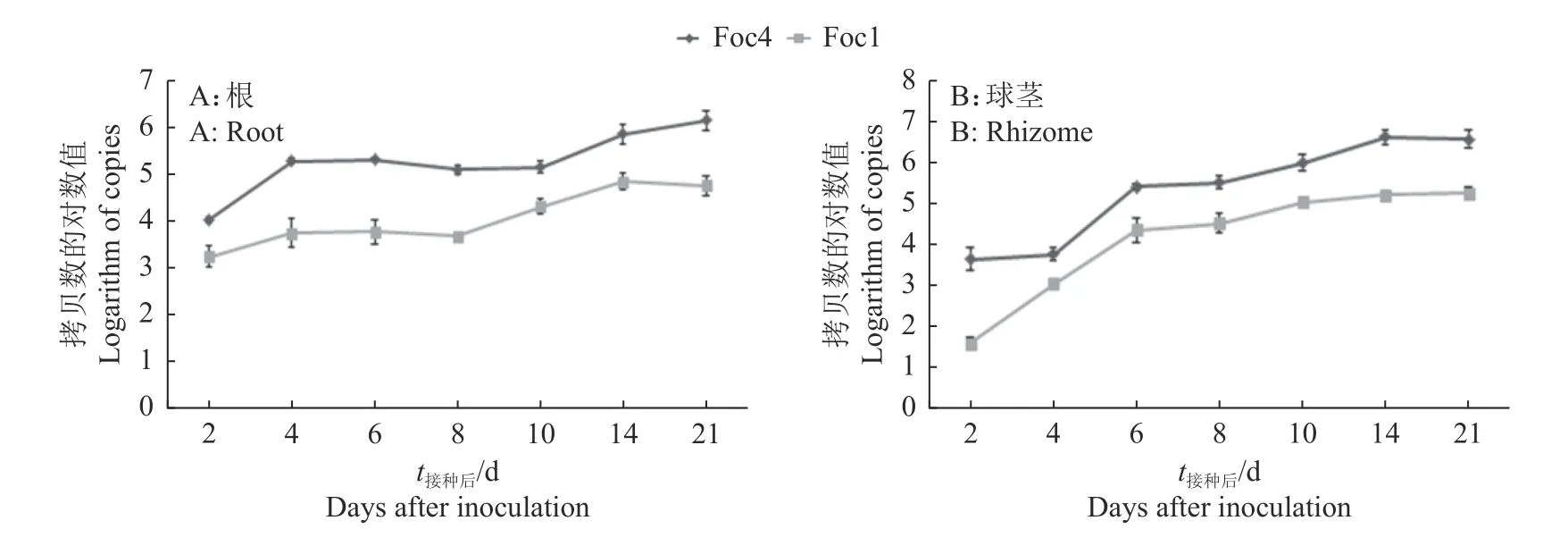
分别以制备的重组质粒标准品为模板,建立Foc1 和Foc4 实时荧光定量PCR。结果(图1) 表明,Foc1 和Foc4 质粒标准品拷贝数分别为1.05×108~1.05×102和7.09×108~7.09×102μL-1;所建立的2 种标准曲线的决定系数(R2)均为0.999,Ct值与拷贝数线性关系良好,扩增效率(E)分别为107.1%和94.1%,达到了实时荧光定量PCR 标准曲线的要求(R2> 0.98,90% 图1 Foc1 和Foc4 质粒DNA 标准品实时荧光定量PCRFig.1 Real-time quantitative PCR of Foc1 and Foc4 plasmid DNA standards Foc1 伤根接种‘巴西蕉’8 d 后,球茎开始变褐,且随时间增加褐变逐渐加重;在接种后21 d,‘巴西蕉’叶片保持绿色,说明Foc1 侵染前期只影响根部和球茎,不影响地上部。而接种Foc4 后6 d,球茎变褐,并且随着时间的增加褐变越来越严重。在接种后21 d,地上部叶片开始变黄。说明Foc4 对‘巴西蕉’致病性比Foc1 强。 分别提取Foc1 和Foc4 接种的‘巴西蕉’根、球茎、假茎、叶组织总DNA 进行PCR 检测,结果表明,接种后21 d,只在根和球茎中检测到Foc,而假茎和叶片中未检测到。接种Foc 后2 d,在‘巴西蕉’根部采用实时荧光定量PCR 可以检测到Foc1 和Foc4,拷贝数分别为(1.62×103±2.97×102)和(9.65×103±4.68×102) μL-1;接种后21 d,根部Foc1 和Foc4 拷贝数分别为(5.26×104±8.37×102) 和(1.48×107±9.78×105) μL-1(图2A),Foc 值达到最大。表明在接种后2~21 d,Foc1 和Foc4 在‘巴西蕉’根部不断增加,且Foc4 菌量明显高于Foc1。 图2 Foc1 和 Foc4 侵染‘巴西蕉’后根部和球茎的菌量变化Fig.2 The Foc quantity in roots and rhizomes of Musa acuminate cv.Brazilian seedlings infected by Foc1 and Foc4 接种后2 d,采用实时荧光定量PCR 检测‘巴西蕉’球茎中Foc,结果显示,球茎中能检测到Foc4,几乎检测不到Foc1;Foc1 的Ct值为35.01±0.15,超出了 PCR 的检测范围(15~35);Foc4 的Ct值为30.54±0.14、拷贝数为(41.10±4.00)×102μL-1。接种后6 d,Foc 在球茎中迅速增加,Foc1 和Foc4 的Ct值分别为26.27±0.08 和24.43±0.07,拷贝数分别为(211.0±6.21)×102和(234.00±1.31)×103μL-1。接种后21 d,Foc1 和Foc4 的Ct值分别为23.74±0.16 和20.38±0.20,拷贝数分别为(168.00±3.90)×103和(350.00±9.79)×103μL-1(图2B)。表明在接种Foc 后6~21 d 内,Foc 积累减缓,21 d 时积累量达到最大,且Foc4 菌量均高于Foc1。 随后,对‘巴西蕉’不同部位Foc 进行了比较,发现接种后2 和4 d,球茎中Foc 菌量低于根部Foc。接种后6 d,球茎中Foc 菌量开始高于根部。 大田中‘巴西蕉’接种Foc1 和Foc4 后30 d,球茎变褐,接种Foc4 的球茎比接种Foc1 的球茎变褐更明显。分别取接种Foc1 和Foc4 的‘巴西蕉’周围土壤抽提总DNA,并以提取的土壤DNA(D260 nm/D280 nm约1.8,DNA 约为20 ng)为模板进行PCR,结果(图3)显示,PCR 扩增目的条带清晰,与预期大小一致。 图3 接种Foc4(A)和Foc1(B)后‘巴西蕉’根际土壤DNA 的 PCR 检测Fig.3 PCR detection of DNA in rhizosphere soil of Musa acuminate cv.Brazilian after inoculation with Foc4 (A) and Foc1 (B) 为研究Foc 在根际土壤中分布,取接种Foc1 后 30 d 的‘巴西蕉’根际土壤样品进行分析,结果(图4A)显示,在距离‘巴西蕉’植株地面半径(r)5 cm、土壤深度25~30 cm 处Foc1 菌量最高,拷贝数为(2 115.91±54.47) μL-1;而r分别为15 和30 cm 时,在土壤深度10~15 cm 处Foc1 菌量最高,拷贝数分别为(604.31±174.86)和(471.23±24.31) μL-1。当r分别为5、15 和30 cm 时,在土壤深度为0~5 cm处Foc1 菌量均最低,拷贝数分别为(670.23±44.83)、(377.33±32.98)和(328.23±17.83)μL-1,表明在‘巴西蕉’根际空间分布中,与‘巴西蕉’植株距离越近,土壤中Foc1 菌量越大;相同地面距离时,以土壤深度为10~15 或25~30 cm 的土壤中Foc1 菌量最大。 图4 Foc1 和Foc4 接种‘巴西蕉’后在土壤中的分布Fig.4 Distribution of Foc1 and Foc4 in rhizosphere soil after inoculating on Musa acuminate cv.Brazilian 对接种后30 d 的‘巴西蕉’根际土壤中Foc4 分析结果(图4B)表明,在r为5 cm 且土壤深度25~30 cm 处土壤中Foc4 菌量最大,拷贝数为(12 506.79±289.58) μL-1;在r为30 cm 且土壤深度25~30 cm 处土壤中Foc4 菌量最小,拷贝数为(220.39±41.11) μL-1。Foc4 在‘巴西蕉’根际空间分布规律与Foc1 基本相同,但是在相同r和土壤深度时,除r为30 cm 且土壤深度25~30 cm 外,其他土壤中Foc4 菌量均高于Foc1。 香蕉枯萎病菌生理小种Foc1 和Foc4 对不同香蕉致病性差异是当前研究热点之一,对致病性不同的Foc1 和Foc4 开展空间分布研究,可以为香蕉枯萎病的流行、预测预报以及病害防控提供科学依据。目前,利用激光共聚焦显微镜研究香蕉枯萎病菌侵染过程大多数在室内进行,该方法不能准确计算病菌含量,且鲜见大田香蕉枯萎病菌含量的研究报道。实时荧光定量 PCR 不用标记菌株,操作相对简单,广泛应用于病毒[17]、细菌[18]等定量分析。本研究采用实时荧光定量 PCR 定量分析了香蕉植株不同部位Foc1 和Foc4 菌量,与激光共聚焦显微镜观察结果相比[3,8-9],能够准确地掌握Foc 侵染量,可以为香蕉枯萎病的预测提供科学依据。 在研究Foc 侵染过程中,不同的研究者结果不同。本研究结果表明,在接种Foc 后 2 d,‘巴西蕉’球茎中Foc 菌量远低于根部,这与Li 等[8]研究结果一致。Li 等[8]观察到Foc4 可以侵入‘巴西蕉’球茎,而Foc1 在接种后2 个月都不能侵入‘巴西蕉’球茎。本研究中,接种后6 d 的‘巴西蕉’球茎中均能检测到Foc1 和Foc4,说明接种后6 d,Foc1 和Foc4 已侵入‘巴西蕉’球茎。Xiao 等[10]发现接种后10 d 时Foc4 侵入‘巴西蕉’球茎,17 d 时已从球茎扩展到假茎,且假茎、根部和球茎Foc4 菌量依次减少。本研究接种后21 d 发现,Foc 在球茎中最多,根部次之,假茎和叶片几乎没有。这与Dong 等[11]研究结果一致,即在侵染前期,香蕉球茎Foc 菌量高于其他部位。Foc1 和Foc4 侵染‘巴西蕉’根部后,菌量不断增加,在不同时间和空间内Foc4 菌量均高于Foc1,说明在‘巴西蕉’中Foc1 和Foc4 在侵染速度、定殖后的繁殖能力以及扩展能力方面差异明显。在侵染前期,Foc4 能从‘巴西蕉’根部扩展至球茎、假茎中,而Foc1 仅能从根部扩展至球茎[11];这可能与Foc1 和Foc4 对‘巴西蕉’的致病力不同有关,或者与‘巴西蕉’对Foc1 和Foc4 的抗病性差异有关。有研究表明,由于Foc1 和Foc4 的致病力不同,导致侵染过程中与‘巴西蕉’抗病性相关的多种酶活性不同[15],并且Foc 致病相关基因的表达也不同[3],这些差异最终决定了Foc1 和Foc4 能否从球茎向上扩展至地上部从而引起香蕉系统性病害。 香蕉根系由初生根、二级和三级次生根组成,初生根可能有几米长,二级和三级次生根只有几厘米至1 m 长,且主要分布在土壤表层[19-20],土壤中的少量病原菌可能使香蕉植株发生严重病害[20]。本研究发现,在r为5 cm、土壤深度25~30 cm 时,无论是致病性强的Foc4 还是致病性弱的Foc1 菌量均比其他土壤层高。Foc 在土壤中的这种分布可能与‘巴西蕉’根系生长特性有关,即在r为5 cm 且土壤深度25~30 cm 处是‘巴西蕉’二级和三级次生根最多的地方,Foc 菌量最多,此处Foc 菌量与香蕉枯萎病发生流行密切相关。在根际土壤中,Foc1 菌量一般低于Foc4,这可能与Foc4 强致病力有关。 土壤中Foc 分布影响香蕉枯萎病的发生,在一定范围内,随土壤中菌量增加香蕉枯萎病发生加重,当超过某一范围,香蕉枯萎病发生达到饱和而不再加重[20]。本研究也发现香蕉植株根际土壤中Foc 菌量与香蕉枯萎病严重度呈正相关[21],这符合香蕉枯萎病的发生规律,说明影响香蕉枯萎病发生的病菌主要是根际土壤中的Foc。 香蕉枯萎病菌的侵染过程包括Foc 接触香蕉根部、侵入根表皮后建立寄生关系[3],并不断繁殖扩展的过程;其侵染过程不但体现了Foc 与香蕉的相互作用,而且与香蕉枯萎病的发生发展密切相关[22]。本研究表明,Foc1 比Foc4 在‘巴西蕉’植株中扩张慢、定殖量低,Foc1 和Foc4 通常在香蕉根际土壤中含量高,同一空间中的Foc4 菌量明显高于Foc1。‘巴西蕉’是我国现阶段主要栽培品种之一,对不同香蕉枯萎病菌在‘巴西蕉’植株及根际土壤中的空间分布研究为Focl 和Foc4 致病机理的研究及科学制定综合防控策略提供了理论依据。
2.2 ‘巴西蕉’接种Foc1 和Foc4 的症状
2.3 Foc1 和Foc4 在‘巴西蕉’根部及球茎中的菌量变化
2.4 大田‘巴西蕉’及根际土壤中的Foc1 和Foc4分析


3 讨论与结论
3.1 香蕉枯萎病菌侵染‘巴西蕉’过程中Foc 菌量变化
3.2 香蕉枯萎病菌在根际土壤中的分布
