基于mt-roGFP1探针研究除草化合物对拟南芥根尖细胞氧化还原电位的影响
2023-07-01朱雪珍张晓红周利娟
朱雪珍 ,张晓红,桑 杰,周利娟
(华南农业大学 植物保护学院/绿色农药全国重点实验室,广东 广州 510462)
活性氧(Reactive oxygen species,ROS)是植物有氧代谢以及逆境代谢过程中的产物。活性氧参与植物的生长发育、细胞循环、细胞的程序性死亡、激素信号等生物过程,是调控各种生物和非生物胁迫反应的重要信号分子[1-2]。活性氧的性质极为活泼,它的产生伴随着植物正常的有氧代谢,当植物受到环境胁迫时,如除草剂等外源化合物的胁迫,会诱导活性氧的产生[3-4]。活性氧含量一旦超出了植物的清除能力,就会与蛋白质、脂类和DNA 等大分子物质发生反应,引起酶活性降低、膜透性增强及突变增加,造成植物体细胞的氧化损伤甚至死亡[5]。活性氧水平的内源性变化发挥着信号功能,并在适应环境变化方面发挥积极作用[6-8]。所以测定植物体细胞内ROS 含量的动态变化对研究植物体内活性氧的具体作用机制、ROS 信号转导网络以及植物的生长发育等具有重要意义。
利用氧化还原敏感绿色荧光蛋白(roGFP)检测活体氧化还原电位,是将一个本身不含二硫键且对生物系统没有影响的蛋白,特异性地表达并定位到特定的亚细胞结构中的方法,可以无损伤地检测活细胞内的氧化还原电位。相比荧光染料[9-11],roGFP探针因具备非破坏性、局域测定、可逆、实时和动态的优势,成为评估细胞内氧化还原状态的一种手段,适用于许多生物和细胞类型[9,12-17]。当roGFP 感应系统可用于哺乳动物系统后,不同的roGFPs(roGFP1~4,roGFP-iX) 已被用作氧化还原传感器[18-25],广泛应用于各个领域,从哺乳动物到植物,尤其是在模式生物拟南芥中。且roGFP 在线粒体(Mitochondria-roGFP,mt-roGFP)中反映氧化还原电位的能力优于在细胞质(Cytoplasm-roGFP,croGFP)的[3]。
目前对拟南芥氧化还原电位影响的研究集中在干旱胁迫、高低温和盐溃等非生物逆境中,研究除草化合物对拟南芥氧化还原电位影响的相对较少。本试验测定不同作用机理的几种商品化除草化合物和具有除草活性的植物源化合物小檗碱及其类似物[26-27]对mt-roGFP1 标记的拟南芥转基因植株根尖的根冠、分生区、过渡区和伸长区在不同测定质量浓度和时间下的氧化还原电位的影响,以期填补外源除草化合物胁迫下拟南芥细胞氧化还原电位变化的研究空白,分析除草化合物处理对植物细胞氧化还电位影响的变化规律,研究其对植物细胞起作用的方式,为应用roGFP 探针技术研究除草化合物的作用机理提供新思路和理论依据。
1 材料与方法
1.1 试验材料
拟南芥ArabidopsisthalianaL.Col 生态型,mtroGFP1 标记的拟南芥转基因植株由加州大学伯克利分校 Feldman Lewis J 教授提供。
超净工作台购自苏净集团安泰空气技术有限公司;LRH-300-GⅡ光照培养箱购自广东省医疗器械厂;Zeiss Axiowert 荧光显微镜购自德国ZEISS公司。
二甲戊灵、草甘膦:浙江新安化工集团股份有限公司;氟乐灵、草铵膦:江苏辉丰农化股份有限公司;莠去津:利尔化学股份有限公司;环嗪酮:浙江欣禾化工有限公司;小檗碱:Sigma-Aldrich(上海)贸易有限公司;二氢小檗碱:四川省维克奇生物科技有限公司;次氯酸钠(分析纯)、赤霉素(分析纯)、KNO3、NH4NO3、Ca(NO3)2、FeSO4·7H2O、MgSO4·7H2O、MnSO4·4H2O、CuSO4·5H2O、ZnSO4·7H2O、KH2PO4、H3BO3、MnCl2、NaCl、H2MoO4、CaCl2·2H2O、KI、NaMoO4·2H2O、CoCl2·6H2O 和Na2-EDTA(分析纯)购自广州化学试剂厂;其他化合物均购自成都瑞芬思生物科技有限公司。
1.2 方法
1.2.1 mt-roGFP1 标记的拟南芥转基因植株的培养
采用竖直培养皿法[3]培养mt-roGFP1 标记的拟南芥转基因植株。配制1/2 MS 培养基,并用1 mmol/L 的NaOH 溶液调节pH 至5.7~5.8,最后加入10 g/L 的琼脂粉,121 ℃高温灭菌20 min,放置干净无菌环境备用。整个种植试验均在超净工作台进行,先将mt-roGFP1 标记的拟南芥转基因种子放入无菌的2 mL 离心管中,用异丙醇溶液清洗消毒5 min,然后用1.5%(φ)的次氯酸钠溶液充分浸泡10 min,再用无菌水清洗3~4 次,直至洗出液变为透明,在4 ℃冰箱放置2~3 d,使种子春化以备用。将待用仪器及培养皿、培养基等放入超净工作台紫外灭菌30 min。用移液枪吸取20 mL 加热溶化后的1/2 MS 培养基到10 cm×10 cm 方形培养皿中,待其完全冷却凝固。用无菌水将春化后的mt-roGFP1标记的拟南芥转基因种子清洗3~4 次,用移液枪均匀播种到凝固培养基上,每皿50 颗种子,待水分完全蒸发后,封口膜封口。将培养皿竖直放置在光照强度4 000 lx、(22 ± 1)℃、16 h 光∶8 h 暗的光照培养箱培养7 d。
1.2.2 拟南芥根尖透明化 待mt-roGFP1 标记的拟南芥转基因植株生长至7 d,挑选长势一致、健康的拟南芥幼苗。将拟南芥植株用细胞透明液(HGG solution)透明化[28]后,使用Zeiss Axiowert 荧光显微镜拍摄。细胞透明液的配制:准确称取80 g ddH2O 和三氯乙醛溶液,加入10 mL 甘油和30 mL ddH2O,室温下搅拌混匀并放置3~5 h。选择长势一致的mt-roGFP1 标记的拟南芥转基因植株,直接放入细胞透明液中浸泡1 min,用镊子轻轻取出,放在有1 滴10%(φ)甘油的干净载玻片上,制片,在荧光显微镜(DIC 通道)下拍摄其明场图片。
1.2.3 氧化还原电位的测量及分析 参考Jiang 等[29]的方法,待mt-roGFP1 标记的拟南芥转基因植株生长7 d 后,挑选长势一致健康的拟南芥幼苗用作试验。荧光测量采用Zeiss Axiowert 荧光显微镜,激发波长设置为410nm (DAPI 通道) 和470 nm(GFP 通道),荧光值为505~530 nm发射波长。选择长势一致的mt-roGFP1 标记的拟南芥转基因植株,放在含有1 滴10%(φ)甘油的干净载玻片上,制成玻片,在荧光显微镜(410 nm / 470 nm 通道)下拍摄荧光图片,测量荧光强度,通过减去相邻无细胞区域的荧光强度来校正每幅图像的背景荧光强度,计算410 与470 nm 荧光强度比率。将同一拟南芥用外源化合物处理一定时间,重新测定410 与470 nm荧光比率;再将同一拟南芥用100 mmol/L H2O2溶液和DTT 溶液处理15 min,重新测定410 与470 nm荧光比率,即为最大和最小氧化还原电位时比率,最大氧化条件(100 mmol/L H2O2溶液)下的最大比值设定为1.00,最大还原条件(100 mmol/L DTT 溶液)下测得的最小比值设定为0.00,将最大还原值和氧化值归一化,然后使用生成的校准曲线将这些标准化的荧光比率转换成氧化还原电位[29]。这些根尖的图像在5 min 或更短时间内被拍摄并测量保存。在根冠、分生区、过渡区及伸长区中分别测量根尖的氧化还原电位。以Schwarzländer 等[30]的方法计算氧化还原电位。
氧化还原程度(OxDroGFP)计算如下:
式中,R为410、470 nm 时的荧光强度比率;Rred为使用100 m mol/L DTT 溶液处理时完全还原的荧光强度比率;Rox:使用100 mmol/L H2O2溶液处理时完全氧化的荧光强度比率;I470ox为完全氧化形式下470 nm 时的荧光强度;I470red为完全还原形式下470 nm 时的荧光强度。
氧化还原电位(O)计算如下:
式中,E0roGFP为roGFP 的中点电位(-272 mV,25.15 ℃,pH=7);R为气体常数(8.314 J·mol-1·K-1);θ为温度(298.15 K,25.15 ℃);Z为转移电子数 (2);F为法拉第常数(96 485.34 C·mol-1)。
1.2.4 除草化合物对拟南芥根尖细胞氧化还原电位的影响 选取不同作用机理的商品化除草剂(氨基酸生物合成抑制剂草甘膦和草铵膦、微管组装抑制剂二甲戊乐灵和氟乐灵、光系统II 抑制剂莠去津和环嗪酮) 作为代表药剂,选择相同质量浓度(20 mg·L-1)的不同药剂,处理mt-roGFP1 标记的拟南芥转基因植株(15 min),研究不同作用机理除草剂对mt-roGFP1 标记的拟南芥转基因植株根尖细胞氧化还原状态的影响。测定方法同“1.2.3”。每个处理3 个重复。
1.2.5 草甘膦不同质量浓度处理对拟南芥根尖细胞氧化还原电位的影响 选择草甘膦为试验药剂,用相同质量浓度草甘膦、不同时间来处理mtroGFP1 标记的拟南芥转基因植株,研究不同作用时间对mt-roGFP1 标记的拟南芥转基因植株根尖细胞氧化还原状态的影响。用不同质量浓度草甘膦来处理mt-roGFP1 标记的拟南芥转基因植株,研究不同质量浓度草甘膦对mt-roGFP1 标记的拟南芥转基因植株氧化还原状态的影响。测定方法同“1.2.3”。每个处理3 个重复。
1.2.6 小檗碱及其类似物处理对拟南芥根尖细胞氧化还原电位的影响 选择小檗碱及其10 种类似物做测试药剂,用相同质量浓度化合物来处理mtroGFP1 标记的拟南芥转基因植株,研究小檗碱及其10 种类似物对拟南芥根尖细胞氧化还原状态的影响。测定方法同“1.2.3”。每个处理3 个重复。
1.3 数据处理
用Excel 2010 处理数据,测定的数据均以“平均数±标准误”表示,试验重复3 次,相关试验数据均用SPSS 20.0 统计,方差分析采用邓肯氏新复极差多重比较法(Duncan’s multiple ranger test,DMRT),数据处理由Office 2016 及Origin Pro 9.0 完成。
2 结果与分析
2.1 拟南芥根尖细胞氧化还原电位测定
挑选长势一致健康的mt-roGFP1 标记的拟南芥转基因植株幼苗,经透明化处理后制片观察,并按“1.2.3”中的根尖分区测量拟南芥根尖根冠、分生区、过渡区和伸长区的荧光强度变化(图1)。

图1 mt-roGFP1 标记的拟南芥转基因植株根尖透明化(A)及荧光分区(B)Fig.1 Root tip transparency (A) and fluorescence zoning(B) of mt-roGFP1 labeled transgenic Arabidopsis thaliana plants
在410 和470 nm 通道下拍摄mt-roGFP1 标记的拟南芥转基因植株根尖的荧光强度图(图2A、2B)、荧光强度—高度转化图(图2C、2D)和荧光强度—高度转化分区图(图2E、2F)。从图2可以看出,生长7 d 的拟南芥根尖分生区的荧光强度最大,根冠和分生区的最远端部分荧光强度较弱,随着近端分生组织细胞停止分裂并逐渐进入过渡区,荧光强度逐渐减弱。当从过渡区进入伸长区时,荧光强度则变得更弱。

图2 拟南芥根尖荧光强度图Fig.2 Fluorescence intensity diagram of root tip of Arabidopsis thaliana
2.2 氨基酸生物合成抑制剂草甘膦和草铵膦对拟南芥根尖细胞氧化还原电位的影响
草甘膦和草铵膦对拟南芥根尖细胞氧化还原电位的影响见图3A、3D。20 mg·L-1草甘膦处理拟南芥15 min 后,根冠、分生区、过渡区和伸长区的氧化还原电位分别为-350.88、-351.82、-340.72 和-334.48 mV,从根冠到分生区呈现被还原趋势,从分生区到伸长区呈现出逐渐被氧化的趋势(图3A)。氧化还原电位变化量分别为29.68、22.77、19.98 和11.61 mV,各分区的氧化还原电位变化量之间存在显著性差异(图3D)。

图3 不同作用机理商品化除草剂对拟南芥根尖细胞的氧化还原电位及变化量的影响Fig.3 Effects of commercial herbicides with different action mechanisms on redox potential and its changes of Arabidopsis thaliana root tip cells
20 mg·L-1草铵膦处理拟南芥15 min 后,根冠、分生区、过渡区和伸长区的氧化还原电位分别为-291.42、-308.04、-313.18 和-310.43 mV,根冠达到最大电位,从根冠到过渡区呈现出逐渐被还原的趋势,在过渡区达到最小电位值,各分区的氧化还原电位值之间存在明显差异。处理前后的氧化还原电位变化量分别为-3.80、15.32、19.67 和20.43 mV,各分区的氧化还原电位变化量之间存在显著性差异(图3D)。
2.3 微管组装抑制剂二甲戊灵和氟乐灵对拟南芥根尖细胞氧化还原电位的影响
二甲戊灵和氟乐灵对拟南芥根尖细胞氧化还原电位的影响见图3B、3E。二甲戊灵处理拟南芥15 min 后,根冠、分生区、过渡区和伸长区的氧化还原电位分别为-333.02、-342.85、-328.21 和-320.24 mV,从根冠到分生区呈现出逐渐被还原的趋势,在分生区达到最小电位后,从分生区到伸长区呈现出逐渐被氧化的趋势,在伸长区达到最大电位(图3B),各分区的氧化还原电位之间存在明显差异。处理前后的氧化还原电位变化量分别为-6.55、-1.25、-0.86 和-4.57 mV,分生区和过渡区氧化还原电位变化量之间没有显著性差异(图3E)。
20 mg·L-1氟乐灵处理拟南芥15 min 后,根冠、分生区、过渡区和伸长区的氧化还原电位分别为-352.74、-357.08、-343.61 和-339.95 mV,从根冠到分生区呈现出逐渐被还原的趋势,在分生区达到最小电位后,从分生区到伸长区呈现出逐渐被氧化的趋势,在伸长区达到最大电位,各分区的氧化还原电位之间存在明显差异(图3B)。处理前后的氧化还原电位变化量分别为2.96、14.36、11.99 和-2.64 mV,各分区的氧化还原电位变化量之间存在显著性差异(图3E)。
2.4 光系统Ⅱ抑制剂莠去津和环嗪酮对拟南芥根尖细胞氧化还原电位的影响
莠去津和环嗪酮对拟南芥根尖细胞氧化还原电位的影响见图3C 和图3F。20 mg·L-1莠去津处理拟南芥15 min 后,根冠、分生区、过渡区和伸长区的氧化还原电位分别为-345.70、-360.72、-335.48 和-329.08 mV,从根冠到分生区呈现出逐渐被还原的趋势,在分生区达到最小电位后,从分生区到伸长区呈现出逐渐被氧化的趋势,在伸长区达到最大电位,各分区的氧化还原电位之间存在明显差异(图3C)。处理前后的氧化还原电位变化量分别为13.06、10.96、10.99 和12.47 mV,分生区和过渡区氧化还原电位变化量之间没有显著性差异(图3F)。20 mg·L-1环嗪酮处理拟南芥15 min 后,根冠、分生区、过渡区和伸长区的氧化还原电位分别为-341.59、-356.23、-329.06 和-319.47 mV,从根冠到分生区呈现出逐渐被还原的趋势,在分生区达到最小电位后,从分生区到伸长区呈现出逐渐被氧化的趋势,在伸长区达到最大电位,各分区的氧化还原电位值之间存在明显差异(图3C)。处理前后的氧化还原电位变化量分别为8.92、8.43、3.61 和1.49 mV(图3F)。
从不同作用机理商品化除草剂对拟南芥根尖细胞氧化还原电位的影响可以看出,除草铵膦外的5 种化合物的氧化还原电位均在分生区达到最小值,随后从过渡区到伸长区逐渐变大。
2.5 草甘膦不同处理时间对拟南芥根尖细胞氧化还原电位的影响
20 mg·L-1草甘膦不同处理时间对拟南芥根尖细胞氧化还原电位的影响见图4A。拟南芥经20 mg·L-1的草甘膦处理24、48、72 h 后,24 和48 h时的拟南芥生长状况良好,处理72 h 时,拟南芥出现软化黄化情况。处理24 h 后,根冠、分生区、过渡区和伸长区的氧化还原电位分别为-373.88、-373.39、-371.41 和-369.17 mV,根冠与分生区的氧化还原电位之间没有显著差异。处理48 h 后,根冠、分生区、过渡区和伸长区的氧化还原电位分别为-367.95、-369.91、-366.36 和-366.33 mV,分生区与其他3 个分区的氧化还原电位之间存在显著差异。处理72 h 后,根冠、分生区、过渡区和伸长区的氧化还原电位分别为-369.52、-372.26、-371.51 和-374.43 mV,分生区与过渡区的氧化还原电位之间不存在显著差异,其他分区间存在显著差异。

图4 草甘膦不同处理时间对拟南芥根尖细胞氧化还原电位的影响Fig.4 Effect of glyphosate with different treatment time on redox potential of Arabidopsis thaliana root tip cells
从草甘膦(20 mg·L-1)处理24、48、72 h 对拟南芥氧化还原电位的影响(图4A) 中可以看出,24 和48 h 的氧化还原电位都从分生区到伸长区逐渐呈现被氧化的趋势,但72 h 的氧化还原电位从分生区到伸长区逐渐被还原,在伸长区达到最大还原状态。
拟南芥经20 mg·L-1草甘膦处理24 h 后,在过渡区达到最大氧化还原电位变化量为32.05 mV,在伸长区达到最小氧化还原电位变化量(22.14 mV),根冠与分生区的氧化还原电位变化量之间没有显著性差异,其他各分区的变化量之间都存在显著性差异(图4B)。处理48 h 后,在根冠达到最大氧化还原电位变化量(28.36 mV),在伸长区达到最小氧化还原电位变化量为18.21 mV,根冠与过渡区的氧化还原电位变化量之间没有显著性差异,其它各分区的变化量之间都存在显著差异(图4B)。处理72 h 后,在分生区到最大氧化还原电位变化量(35.93 mV),在伸长区达到最小氧化还原电位变化量(23.45 mV),各分区的氧化还原电位变化量之间都存在显著差异(图4B)。每个处理时间的氧化还原电位变化阈值之间相差约10 mV,氧化还原电位变化量与处理时间之间未呈现显著的相关性(图5)。

图5 不同质量浓度草甘膦对拟南芥根尖细胞氧化还原电位变化的影响Fig.5 Effects of different concentrations of glyphosate on redox potential of Arabidopsis thaliana root tip cells
2.6 不同质量浓度草甘膦处理对拟南芥根尖细胞氧化还原电位的影响
不同质量浓度的草甘膦处理对拟南芥根尖细胞氧化还原电位影响显著(图5A)。处理质量浓度为10 mg·L-1时,在根冠达到最小电位(-368.72 mV),在伸长区达到最大电位(-338.64 mV);处理质量浓度为20 mg·L-1时,在分生区达到最小电位(-351.82 mV),在伸长区达到最大电位(-334.48 mV);处理质量浓度为50 mg·L-1时,在伸长区达到最小电位(-367.14 mV),在根冠达到最大电位(-361.35 mV)。10 和20 mg·L-1的氧化还原电位均在分生区达到最小,在伸长区达到最大,50 mg·L-1的氧化还原电位呈现逐渐降低的趋势。
从氧化还原电位变化量(图5B) 来看,10 和20 mg·L-1草甘膦处理的变化量有显著性差异,但在过渡区和伸长区的氧化还原电位变化量未发生明显变化(图5),50 mg·L-1草甘膦处理时,氧化还原电位变化量变大。3 个质量浓度的氧化还原电位变化量在根冠及过渡区之间均呈现显著性差异。草甘膦质量浓度增大,mt-roGFP1 标记的拟南芥转基因植株的氧化还原电位变化量增大,说明氧化还原电位变化量与质量浓度大小之间存在相关性,线性回归方程为y=0.29x+21.57,R2=0.995 6。
2.7 小檗碱及其类似物处理对拟南芥根尖细胞氧化还原电位的影响
20 mg·L-1小檗碱及其类似物处理拟南芥15 min后,拟南芥根尖各分区细胞氧化还原电位和氧化还原电位变化量如图6所示。氧化还原电位的结果(图6A)表明,小檗碱及其类似物对拟南芥根尖细胞的氧化还原电位均有影响。经小檗碱、盐酸血根碱、白屈菜碱、D-四氢药根碱、罗通定处理后,拟南芥根部各分区细胞氧化还原电位多数从根冠开始呈现逐渐被氧化趋势,在伸长区达到最大氧化电位,且各分区氧化还原电位之间都存在明显差异。经巴马汀、二氢小檗碱、去亚甲基小檗碱、甲基黄连碱处理后,拟南芥根部细胞氧化还原电位从根冠到分生区呈现被还原趋势,且在分生区达到最大还原值。氧化还原电位的变化量结果(图6B)表明,小檗碱及其类似物与对照药剂草甘膦的氧化还原电位变化量之间存在明显差异,小檗碱4 个分区的变化量之间有明显差异,各化合物的变化量各不相同。
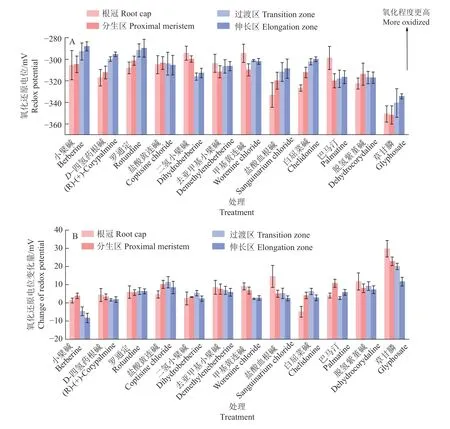
图6 小檗碱及其类似物对拟南芥根尖细胞氧化还原电位及其变化量的影响Fig.6 Effects of berberine and analogues on redox potential and its changes of Arabidopsis thaliana root tip cells
3 讨论与结论
roGFP 感应系统在检测植物细胞内氧化还原状态变化具有快速、可逆、动态和实时等优点,尤其是对拟南芥、烟草等模式植物的研究可探测从细胞到组织的氧化还原水平[31-32]。本研究在mt-roGFP1 标记的拟南芥转基因植株根尖细胞中检测到mtroGFP1 探针响应外源氧化剂(H2O2)和外源还原剂(DTT) 引起的氧化还原状态的变化,证明了mtroGFP1 探针的灵敏性和可逆性[33]。用外源氧化剂处理拟南芥时,mt-roGFP1 探针被氧化,其荧光强度比率升高,用外源还原剂处理时,mt-roGFP1 探针被还原,荧光强度比率降低,证明mt-roGFP1 探针能够响应组织中氧化还原状态的改变,试验结果与前人的研究结果[33]相一致。
基于mt-roGFP1 探针,通过测定6 种不同靶标商品化除草化合物对mt-roGFP1 标记的拟南芥转基因植株根尖的根冠、分生区、过渡区和伸长区4 个区域的氧化还原电位的影响,结果表明:氨基酸生物合成抑制剂(草甘膦和草铵膦)和微管组装抑制剂(二甲戊灵和氟乐灵)处理后的细胞氧化还原电位变化规律呈现为:在分生区达到最大还原值,并从过渡区开始呈现被氧化的趋势,在伸长区达到最大氧化值。Jiang 等[34]也曾指出在伸长区2 种形式的roGFP1(c- roGFP1 和mt- roGFP1)都显示出比分生区更氧化的静息氧化还原状态,且伸长区更氧化的状态可能与细胞壁疏松和植物细胞扩张等因素有关。光系统II 抑制剂(莠去津和环嗪酮)处理后的氧化还原电位呈现规律性变化,在分生区达到最小值,并从分生区开始,以逐渐被氧化的趋势在伸长区达到最大值,说明mt-roGFP1 荧光探针能更好地响应光系统II 抑制剂。另外,通过不同质量浓度草甘膦处理拟南芥不同时间后发现,草甘膦对拟南芥根细胞氧化还原电位和电位变化量的影响具有明显的剂量-效应关系,即草甘膦质量浓度增大,氧化还原电位值变化量也逐渐增大,呈现正相关关系(R2=0.995 6)。植物源化合物小檗碱及其类似物对拟南芥根尖的氧化还原电位影响的结果表明,经盐酸血根碱、白屈菜碱、D-四氢药根碱、罗通定和二氢小檗碱处理后,各分区氧化还原电位之间存在显著差异;且大多数化合物处理后的氧化还原电位在分生区达到最大还原值,并从分生区到伸长区逐渐被氧化,在伸长区达到最大氧化值。此外,通过6 种不同作用机理的除草化合物和小檗碱及其类似物对氧化还原电位产生的不同影响也可说明,小檗碱的作用机理不同于前述6 种商品化除草化合物,这与以往对小檗碱机理的研究[35]相符。
综上,经几种除草化合物和小檗碱及其类似物不同时间和不同质量浓度处理后,拟南芥根尖细胞氧化还原电位呈现规律性变化,即氧化还原电位均从根冠开始逐渐被还原,在分生区达到最大还原值,从分生区到伸长区逐渐被氧化,说明植物根部分生区氧化还原电位响应不同化合物的胁迫时表现出更明显的被还原趋势,因此,测定分析拟南芥根尖荧光强度和氧化还原电位的变化情况时,可选取分生区为主要观察区域。这为采用roGFP 探针技术研究除草化合物对根系细胞线粒体作用的机制提供了基础。
致谢:感谢加州大学伯克利分校Feldman Lewis J 教授和Jiang Keni 博士给予的技术指导和帮助!
