基于RNA-Seq对淫羊藿次苷Ⅱ体内抗HBV时胰岛素信号通路基因的研究
2023-06-30刘正芸廖晏蔺易世豪龚其海
刘正芸,廖晏蔺,易世豪,罗 果,秦 颖,龚其海,王 欢
(1.遵义医科大学 贵州省普通高等学校传染病与生物安全特色重点实验室,贵州 遵义 563099;2.遵义医科大学 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099)
乙型肝炎病毒(Hepatitis B virus,HBV)简称乙肝病毒,属于嗜肝DNA病毒科,它可引发急性和慢性肝炎,后者又可发展为肝硬化乃至肝癌[1]。据世界卫生组织报道,全球约2.57亿慢性HBV患者,每年约有88.7万人死于HBV感染所致的肝衰竭、肝硬化和肝细胞癌(hepatocellular carcinoma,HCC)[2]。目前临床主要使用核苷酸类似物(替诺福韦艾拉酚胺、恩替卡韦、阿德福韦和替比夫定等)或干扰素(普通、长效)进行抗HBV治疗,以上药物能控制HBV的发生发展,但对于HBV的彻底治愈或功能性治愈,目前仍无有效的办法,故寻求新的、特异的抗病毒药物依然迫在眉睫。
淫羊藿为我省道地中药材,具有“补肾阳,强筋骨,祛风湿”等功效,中医用于治疗阳痿、遗精早泄、腰膝酸软、筋骨挛急、风湿痹痛和半身不遂等。研究报道,淫羊藿对甲型流感病毒、水泡性口炎病毒、单纯疱疹病毒、鸡新城疫病毒以及HBV有抑制作用[3-4]。淫羊藿次苷Ⅱ(icariside Ⅱ,ICS Ⅱ)是淫羊藿的主要活性成分之一,ICS Ⅱ具有抗炎、抗氧化、抗疲劳、抗肿瘤、抗神经元损伤、改善心血管功能和提高性功能等作用[5-7]。本课题组前期研究发现ICS Ⅱ在体内外对HBV复制均有一定的抑制作用[8],但其机制不明。有研究表明,HBV感染会导致胰岛素抵抗(insulin resistance,IR)[9],进而影响胰岛素发挥正常功能。而淫羊藿苷能通过提高p38 MAPK和Akt T308的磷酸化水平而减轻高糖诱导的C2C12肌管细胞的IR,提示ICS Ⅱ有可能通过胰岛素通路或IR途径发挥抗HBV的作用[10]。
本项目拟利用RNA-Seq技术检测ICS Ⅱ作用于HBV复制型C57BL/6小鼠后基因水平的变化,研究ICS Ⅱ抗HBV时对胰岛素信号通路的影响,以期找到ICS Ⅱ抗HBV的相关靶标,为ICS Ⅱ抗HBV提供理论和实验依据。
1 材料与方法
1.1 动物与药品 6周龄C57 BL/6小鼠购于斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010。本研究已获遵义医科大学实验动物福利伦理委员会批准(伦理审查编号:ZMU21-2302-270)。淫羊藿次苷Ⅱ购自南京欣厚生物科技有限公司,分子式C27H30O10,分子量为514.53,纯度99.90%。
1.2 主要仪器与试剂 全波长酶标仪(1500,Thermo scientific),台式高速低温离心机(Allegra X-15R ,Beckman coulter),高通量测序仪(HiSeq 2500,Illumina),梯度PCR仪(T100,Bio-Rad),荧光定量PCR仪(CFX 96,Bio-Rad),PrimeScript RT Master Mix(TaKaRa,RR036),TB Green Premix Ex Taq Ⅱ(TaKaRa,RR820),无内毒素质粒提取试剂盒(CW2107,康为世纪),乙型肝炎病毒核酸定量检测试剂盒(DA-Z051,达安基因)等,pAAV-HBV 1.2质粒由复旦大学袁正宏教授惠赠。
1.3 实验动物建模及分组 C57BL/6小鼠,25只,适应性喂养1周后,用高压水动力法注射相当于其体重8 %的含20 μg pAAV-HBV1.2质粒(质粒提取按说明书操作)的PBS到小鼠体内,NS组注射相同体积的PBS。在第3天取5只小鼠用2 %戊巴比妥钠(4 mg/kg)麻醉后,摘眼球取血,离心取血清,检测血清样本中HBV DNA的拷贝量。按试剂盒定义,其HBV DNA拷贝量大于103copies/mL时认为模型建立成功。
确认模型建立成功后,随机进行分组:Model组(模型组,建模后灌胃生理盐水)、NS组(生理盐水对照组,建模后灌胃生理盐水)、ENT组(恩替卡韦组,建模后灌胃ENT 0.5 mg/kg)和ICS Ⅱ组(建模后灌胃ICS Ⅱ 20 mg/kg),每组5只,给药体积为10 mL/kg,1 d 1次,连续给药20 d后取材。取小鼠血清和肝脏,血清用于测定HBV DNA拷贝量,确认ICSⅡ对HBV DNA有抑制作用后,肝脏分为2份,1份用于测序分析,1份用于后期验证。
1.4 测序及测序结果分析 样本送公司测序,本次测序由生工生物工程(上海)股份有限公司完成。对测序结果进行差异可视化分析可得到散点图、火山图和MA图,将Unigene基因序列分别于GO、KEGG库进行比对,取相似度>30%,且e<1e-5的注释。并对筛选出的样品间差异基因(differential expressed gene,DEG)进行差异基因功能显著性富集分析、KEGG pathway显著性富集分析。
1.5 实时荧光定量PCR (qRT-PCR)对胰岛素信号通路相关分子进行验证 用Trizol法对留存的小鼠肝脏样本提取总RNA,用PrimeScript RT Master Mix逆转试剂盒将RNA逆转为cDNA,程序为:37 ℃15 min,85 ℃ 5 s,4 ℃∞。通过qRT-PCR检测ICS Ⅱ对胰岛素通路相关差异基因的影响。反应体系为15 μL:7.5 μL SYRB GREEN,4 μL水,0.5 μL引物(包括上下游,见表1),3 μL cDNA。反应条件为:93 ℃、3 min,93 ℃~60 ℃、45 s,共40个循环。

表1 胰岛素通路相关差异基因qRT-PCR引物序列
2 结果
2.1 ICS Ⅱ在C57 BL/6小鼠中对HBV DNA的影响 给药20 d后对Model组、NS组、ICSⅡ组和ENT组血清中HBV DNA的拷贝量进行检测。结果显示,ICS Ⅱ和ENT都能有效的降低小鼠血清中HBV DNA的拷贝量,与Model组相比,差异具有统计学意义(P<0.05,图1)。

*:与Model组比较,P<0.05。图1 ICS Ⅱ对HBV DNA的影响
2.2 差异基因分析 散点图能从宏观上展示组间差异转录本的多少与上下调转录本的个数,红色代表上调,绿色代表下调,黑色代表没有差异。结果显示,Model组和ICS Ⅱ组相比,上调的基因为982个,下调的基因为756个(图2)。
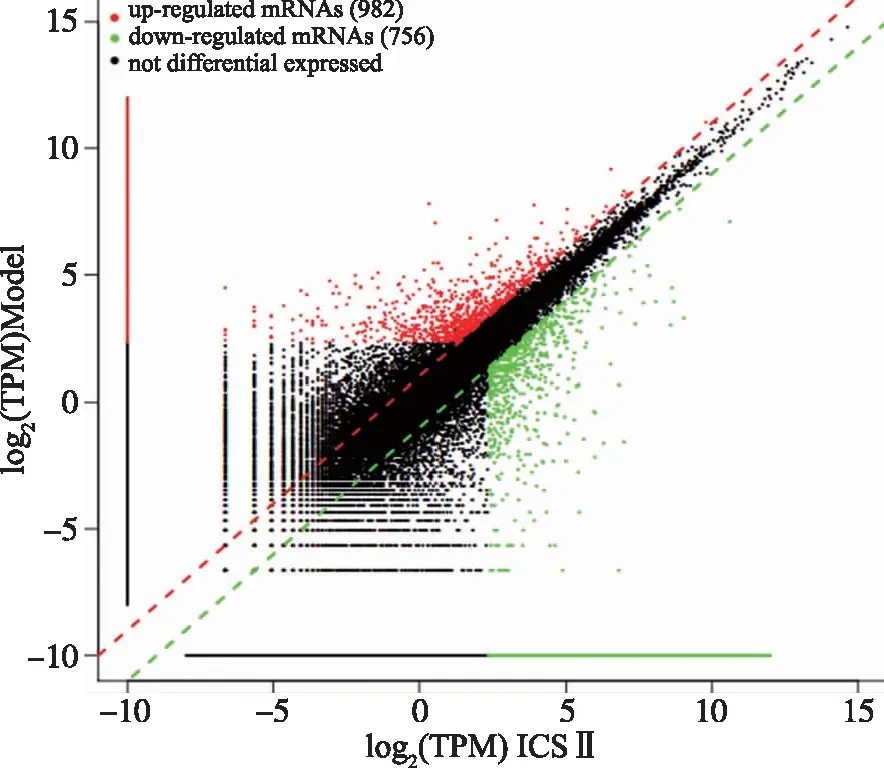
图2 Model组和ICS Ⅱ组差异基因分析
2.3 GO富集功能注释 GO总共有3个ontology,分别描述基因的分子功能 (molecular function)、所处的细胞位置 (cellular component)、参与的生物过程 (biological process)。在本次实验中,将全部的Unigenes进行GO功能分类,共注释到10 075条GO。Model组和ICS Ⅱ组相比,注释到GO 数据库中的差异基因共有 3 675个。其中,和分子功能相关的1 212个、和细胞组分有关的1 225个、参与生物学进程的1 220个。图3显示了3个ontology中差异基因最多的10个GO。

图3 Model组和ICS Ⅱ组差异基因GO数据库功能注释
2.4 KEGG通路注释及分类 功能与基因并不是简单的一对一的关系,而是复杂的多对多关系。通过关联分析,构建功能-功能和功能-基因互作网络,并利用网络分析的手段识别出关键的功能和关键的基因,并基于调控关系来阐明基因和功能的作用机理。KEGG通路注释结果显示,Model组和ICS Ⅱ组的差异基因参与多个信号通路,将Model组与ICS Ⅱ组差异基因与KEGG库进行比对,结果有493个差异基因被注释到226条通路中。这些通路主要富集于细胞内吞、PI3K-Akt及MAPK等(图4),其中参与胰岛素通路的差异基因有21个。

图4 Model组和ICS Ⅱ组差异基因KEGG通路注释分类
2.5 胰岛素通路差异基因验证结果 临床研究表明,HBsAg阳性患者的胰岛素抵抗指数和胰岛素敏感性检测指数均比HBsAg阴性患者高,显示HBV感染和IR存在着显著相关性[11]。由于胰岛素通路和HBV联系密切,故课题组选择对胰岛素通路相关差异基因进行验证。
如表2所示,通过差异基因显著富集功能-基因互作网络图选出了参与胰岛素通路互作的差异基因6个,分别是Hras原癌基因(HRA Sproto-oncogene,Hras)、葡萄糖激酶(glucokinase,Gck)、磷酸化酶激酶α2(phosphorylase kinase alpha 2,Phka2)、蛋白激酶cAMP依赖性催化亚基β(protein kinase,cAMP dependent,catalytic,beta,Prkacb)、丝/苏氨酸蛋白激酶2(serine/threonine protein kinase 2,Akt2)和生长因子受体结合蛋白2(growth factor receptor bound protein 2,Grb2)。通过荧光定量PCR对测序结果进行验证,结果显示ICS Ⅱ能有效下调Hras、Gck、Phka2、Prkacb、Akt2和Grb2基因(图5),和测序结果一致,代表测序结果具有可信度,可用于下一步ICS Ⅱ抗HBV机制的探索。
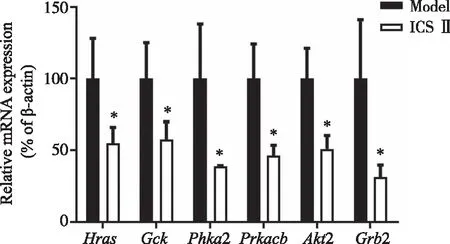
*:与Model组比较,P<0.05。图5 ICSⅡ对胰岛素信号通路相关基因mRNA水平的影响
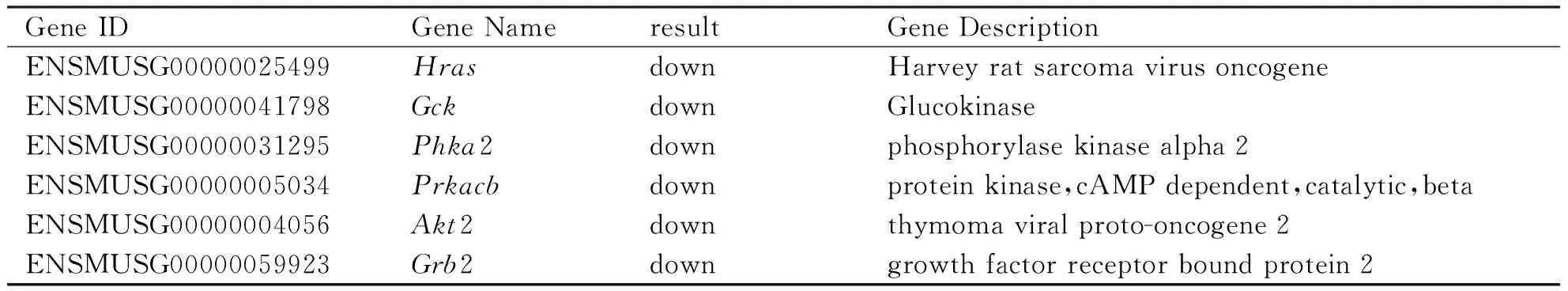
表2 胰岛素通路相关差异基因
3 讨论
本研究采用RNA-Seq对经ICS Ⅱ处理后的HBV复制型C57BL/6小鼠肝脏组织进行测序,经过数据分析得到差异基因共3 675个,主要涉及细胞组成、生物过程和结合功能。KEGG通路注释结果显示差异基因参与最多的是细胞内吞信号通路。
IR指正常剂量的胰岛素产生低于正常生物学效应的一种状态。机体尤其是肌肉、脂肪组织对胰岛素不敏感,使胰岛素促进葡萄糖摄取和利用效率下降,机体代偿性分泌过多胰岛素以维持血糖的稳定,同时产生高胰岛素血症[12-13]。研究表明,HBV感染可导致IR的产生[14-15],因为在慢性HBV感染时,肝脏在抵抗病毒清除的过程中反复受到免疫细胞的侵害,为了补偿组织损伤机体会启动肝脏再生。但肝脏再生需要胰岛素受体信号传导,而HBV感染的肝细胞对胰岛素刺激不敏感,导致肝再生延迟[16]。同时,在肝癌细胞系HepG2和Huh7细胞中,过表达HBV前S2蛋白(pre-S2) 对外周组织(肝脏周围的器官组织)胰岛素受体基因有明显下调作用,且胰岛素受体数目减少及生理作用下降也是发生IR的原因之一[17]。
HBV核心抗原结合蛋白C-12可下调胰岛素受体(NM.000208)的表达[18],而HBx蛋白能够增强SOCS3蛋白表达,降低胰岛素受体底物1(insulin receptor substrate 1,IRS1)蛋白的表达,IRS1的减少可导致胰岛素受体生成减少,最终导致IR[19-20]。
原癌基因Hras的转录水平在HBV患者中较高[21],而基于网络药理学和分子对接方法探究白芨治疗糖尿病足作用机制时发现,白芨活性成分可能通过调控Hras、AKT1和EGFR等发挥作用[22]。同时,Akt2与HBV的复制也密切相关,HBV能够在mRNA和蛋白水平上上调肝癌细胞Akt2的表达[23],而PI3K-Akt信号通路参与了IR的发生[24]。
Gck特异表达于肝细胞,是胰岛素终末通路的信号分子,负责葡萄糖转运入肝细胞及活化葡萄糖参与糖原合成过程。故Gck能调节空腹血糖水平,且Gck基因变异与第一和第二阶段胰岛素分泌相关[25]。也有文献报道,肝细胞Gck蛋白参与间歇低氧条件下肝IR的形成[26]。Phka2基因突变能导致糖原累积症Ⅸa型,导致不能激活糖原磷酸化酶,引起糖原分解障碍并在体内贮积。临床表现为空腹低血糖、肝肿大、转氨酶水平升高等[27]。通过对hsa-miR-223-3p靶基因的预测及生物信息学分析可知,在糖尿病的发病过程中,靶基因Prkacb可能通过胰岛素分泌通路发挥作用[28]。而激活的胰岛素受体底物(insulin receptor substrate,IRS)能通过结合Grb2导致下游MAPK信号通路的激活,最终激活转录因子,调节基因表达,影响胰岛β细胞生长、增殖和存活[29]。
以上文献说明Hras、Gck、Phka2、Prkacb、Akt2和Grb2作为胰岛素通路的相关基因,从不同的机制途径参与了胰岛素调控,ICS Ⅱ能够下调这些基因的转录水平,提示ICS Ⅱ可能通过胰岛素通路调节HBV的复制。
综上所述,本研究发现在HBV复制型C57BL/6小鼠中,ICS Ⅱ引起的差异基因涉及多个生物学过程,参与多个通路的调节。由于IR和HBV的关系,课题组重点关注ICS Ⅱ在抗HBV中对胰岛素通路的影响,发现ICS Ⅱ可能通过下调胰岛素信号通路相关基因(Hras、Gck、Phka2、Prkacb、Akt2和Grb2)发挥抗HBV的作用,此发现为下一步深入研究ICS Ⅱ抗HBV的机制提供了实验依据。
