慢性心力衰竭长期生存列线图预测模型的构建
2023-06-28马修远宋允轩郝恩魁
马修远 宋允轩 郝恩魁


[摘要] 目的 建立一个慢性心力衰竭长期生存率列线图预测模型。方法 纳入山东省千佛山医院共235 例慢性心力衰竭患者临床数据,采用LASSO 回归、多因素COX 回归分析后得出影响慢性心力衰竭长期生存率的独立预测因子,构建列线图模型。采用一致性指数(C-index)、校准曲线和时间依赖性受试者工作特征曲线评估列线图模型的预测能力。结果LASSO 回归筛共选出7 个与慢性心力衰竭长期生存率相关的独立预测因子,分别为年龄、左室舒张末期内径、二尖瓣反流、三尖瓣反流、红细胞分布宽度、血尿酸、血尿素氮,并构建了列线图预测模型、进行模型的内部验证。训练集、验证集C-index 分别为0.782、0.791,1 年、5 年、10 年生存率的曲线下面积分别为0.813、0.843、0.876,校准曲线表现出良好的一致性。结论 通过本次研究,建立了一个能够相对准确预测慢性心力衰竭长期生存率的列线图模型,对临床医生判断慢性心力衰竭患者预后有一定的指导意义。
[关键词] 慢性心力衰竭;长期生存率;列线图模型
[中图分类号] R514.6 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.12.016
心力衰竭(heart failure,HF)是心脏结构或功能异常导致的心脏射血能力下降,从而形成的一组临床综合征,主要表现为呼吸困难、乏力等[1],它具有死亡率高、预后差等特点,目前亚洲人群心力衰竭患病率为1.0%~1.3%[2],而据调查统计,由于人口老龄化的加剧,自2012 至2030 年,心力衰竭患病率预计将较前增加46%[3]。由于病因复杂,心力衰竭患者10 年生存率仅34.9%,重症患者甚至更低[4]。慢性心力衰竭患者的长期生存率关系到个人用药管理、家庭生活、社会经济等一系列问题。迄今为止,已有许多学者对慢性心力衰竭的预后行了预测模型的构建[5],但回顾既往研究,仍缺少对于慢性心力衰竭长期生存率的可靠预测。列线图模型是一种结合多因素回归分析,构建对临床结局能够进行可靠预测的工具,已在心血管病领域得到广泛应用[6]。本研究通过长期跟踪随访,旨在建立一个能够准确评估慢性心力衰竭长期生存率的列线图预测模型,实现可视化评估,为临床医生判断患者预后提供参考工具。
1 资料与方法
1.1 一般資料
收集山东省千佛山医院2006 至2009 年共285例首次因慢性心力衰竭急性加重住院患者临床数据。纳入标准:①具有慢性心力衰竭急性发作的症状(如胸闷、呼吸困难等)和体征(如双下肢水肿、肺部湿性啰音等);②年龄40~80 岁;③可配合完成治疗,配合血液学检查,在经治疗后疾病初步稳定的1 周内配合超声心动图检查;④诊断为缺血性心肌病或扩张性心肌病。排除标准:①合并急性心肌梗死;②合并酒精性心肌病;③合并风湿性心脏病;④合并病毒性心肌炎;⑤合并围产期心肌病;⑥合并感染性心内膜炎。因此,本研究根据纳入及排除标准,最终共纳入235 例患者。
1.2 数据采集
通过文献回顾,本研究共纳入34 个潜在的临床危险因素。包括患者的超声心动图参数:左室舒张末期内径(left ventricular end diastolicdimension , LVEDD )、左房内径( left atriumdimension,LAD)、左室射血分数(left ventricularejection fraction,LVEF)、室间隔厚度(interventricularseptum,IVS)、肺动脉收缩压(pulmonary arterysystolic pressure,PASP)、二尖瓣反流(mitralregurgitation , MR )、三尖瓣反流( tricuspidregurgitation,TR)、胸腔积液、心包积液。血液指标:血清肌酐(creatinine,Cr)、血清尿酸(uricacid,UA)、血尿素氮(blood urea nitrogen,BUN)、血红蛋白(hemoglobin,Hb)、红细胞分布宽度(red blood cell distribution width,RDW)、三酰甘油( triglyceride , TG )、总胆固醇( totalcholesterol , TC )、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、血钙、血钾、血磷浓度。心电图指标:QRS 波时限、QTc 间期;一般特征:性别、年龄、平均心率、平均收缩压、平均舒张压;既往史:糖尿病、高血压、慢性胃炎、吸烟史、饮酒史。
1.3 随访
每3 个月进行1 次电话随访,要求患者至少每年来山东省千佛山医院门诊复诊1 次。随访至2022 年11 月1 日,失访率控制在15%以下,随访终点为全因死亡,记录总生存期(overall survival,OS)。
1.4 预测模型的建立与验证
将纳入本研究的慢性心力衰竭患者按照7∶3 的比例随机拆分为训练集(n=165)与验证集(n=70)。在训练集中,采用LASSO 回归初步筛选出与慢性心力衰竭长期生存率有关的危险因素。LASSO 回归算法使用L1 范数进行收缩惩罚,对一些对于因变量贡献不大的变量系数进行罚分矫正,将一些不太重要的变量系数压缩为0,保留重要变量的系数>0[7],解决共线性问题,避免过拟合。将筛选后的危险因素纳入多因素COX 回归方法,采用后退法整合影响慢性心力衰竭总生存期的独立影响因子,建立列线图预测模型。使用Bootstrap(自展法)有放回重复抽样1000 次对模型进行内部验证,采用0.5~1.0的一致性指数(C-index)和时间依赖性受试者工作特征( time dependent receiver operatingcharacteristic,tdROC)曲线评估列线图模型对慢性心力衰竭总生存期的预测能力, 通过Kaplan-Meier 法拟合并绘制校准曲线来测试该模型1 年、5 年、10 年慢性心力衰竭预测与实际总生存期的一致性。
1.5 统计学方法
应用EpiData 3.1 软件建立数据库。根据临床界值,将所纳入连续变量全部轉换为二分类变量与等级变量(二尖瓣反流、三尖瓣反流均划分为4 组别,0 组:无反流;1 组:反流束面积/左心房面积<19%;2 组:20%≤反流束面积/左心房面积≤40%;3 组:反流束面积/左心房面积≥41%),以频数和百分比表示。所有数据的分析及模型的建立、验证均使用SPSS 26.0 及R 4.1.3 软件进行。R 4.1.3 软件应用到的程序包有“survival”“rms”“foreign”“glmnet”“Matrix”“plyr”“MASS”“survivalROC”等,以P<0.05 为差异有统计学意义。
2 结果
2.1 病例特征
本研究共纳入235 例慢性心力衰竭患者,平均年龄71 岁,42~80 岁。其中男136 例,占57.9%,女99 例,占42.1%。1 年、5 年、10 年生存率分别为77.0%、43.0%、21.3%。拆分后数据集基线图特征见表1。
2.2 危险因素的选择
将34 个潜在危险因素纳入LASSO 回归后,可见各个危险因素对于因变量的贡献度不同,系数压缩为0 时,log(λ)取值不同,见图1A。使用10倍交叉验证后,log(λ)取最优值时,lambda.1se为0.0395,此时LASSO 回归筛选变量个数最优,共筛选出7 个危险因素,见图1B。7 个危险因素在LASSO 队列中均有非零系数,分别为年龄、左室舒张末期内径、二尖瓣反流、三尖瓣反流、红细胞分布宽度、血清尿酸、血尿素氮。多因素COX 回归分析:将训练集中年龄、左室舒张末期内径、二尖瓣反流、三尖瓣反流、红细胞分布宽度、血清尿酸、血尿素氮共7 个变量纳入多因素COX 回归分析,结果见表2。可见经LASSO 回归筛选出的7个变量均为影响慢性心力衰竭OS 的独立预测因子且均为危险因素。
2.3 列线图模型的构建
将多因素COX 回归分析所得影响慢性心力衰竭总生存期的7 个独立预测因子均纳入列线图模型的构建,见图2。将每个自变量赋以不同分值,对照对应的总分坐标轴,各个分值相加后可以得出总分,根据总分对应的1 年、5 年、10 年生存率坐标轴,可得预测慢性心力衰竭1 年、5 年、10 年的生存率。
2.4 测试列线图模型的准确性
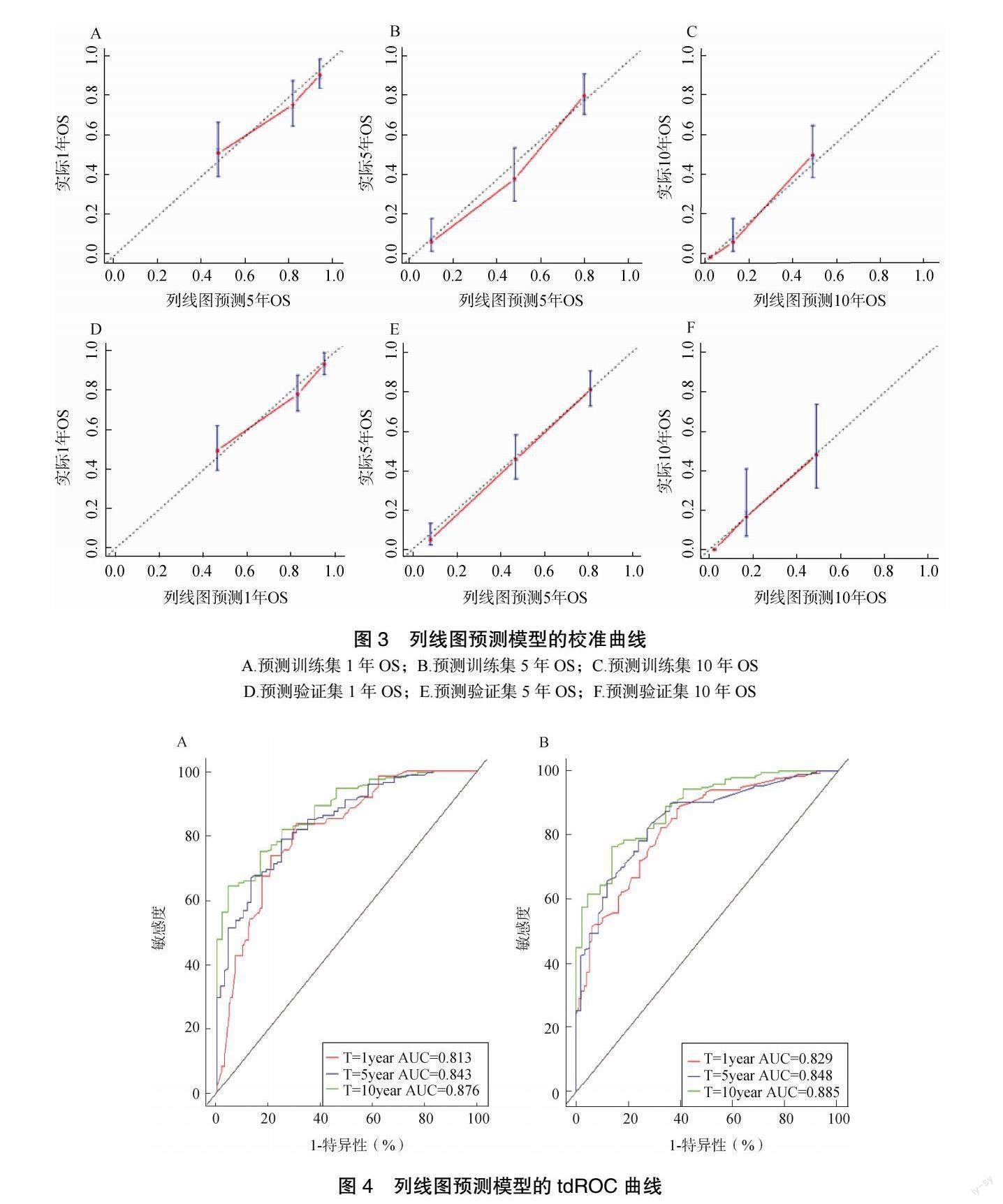
该模型训练集、验证集C-index 分别为0.782、0.791(P<0.05),表明该模型对于慢性心力衰竭总生存期有很好的预测作用,分别绘制1 年、5 年、10年校准曲线后,可见该模型预测值与实际值有较好的准确度,见图3。进一步绘制tdROC 曲线评估模型的区分度与准确性,见图4。训练集1 年、5 年、10 年ROC曲线下面积(the area under the ROC curve,AUC)分别为0.813、0.843、0.876,验证集分别为0.829、0.848、0.885,可见该模型拥有较好的区分度与准确性。
3 讨论
慢性心力衰竭病因复杂,影响慢性心力衰竭预后及长期生存率的危险因素有很多。本研究共得到7个影响慢性心力衰竭OS 的独立预测因子。研究发现年龄≥60 岁的慢性心力衰竭患者发生全因死亡的概率为<60 岁患者的2.2 倍(HR=2.20,95%CI:1.41~3.42,P<0.001)。有研究表明,心力衰竭的发病率及死亡率均随年龄增长而增加[8],而年龄不仅与心力衰竭的病情进展息息相关,更与心力衰竭合并症(如高血压、糖尿病等)的发生密切相关。据另一项研究表明,即使在有效控制这些合并症后,年龄的增长仍与心力衰竭的不良预后相关[9]。左室舒张末期内径是评估慢性心力衰竭心脏结构与功能变化的重要指标,本研究发现LVEDD≥60mm 的慢性心力衰竭患者发生不良结局的风险是LVEDD<60mm 患者的2.73 倍(HR=2.73,95%CI:1.94~3.85,P<0.001),与先前的研究结果一致,LVEDD 增大不仅预示着心脏收缩与舒张功能不全、心室重构的发生,更与心力衰竭的不良预后密切相关[10]。本研究证实二尖瓣反流、三尖瓣反流均与心力衰竭预后独立相关,且随着反流面积的增加,心力衰竭患者生存率进行性下降。与Cork 等[11]的研究结果一致。Li 等[12]在动物试验中进一步探究其机制后,发现二尖瓣反流一定程度上加剧了心肌细胞肌节的破坏与心脏偏心性重构的形成,并最终导致心力衰竭生存率下降。三尖瓣反流的定量评估不仅是慢性心力衰竭独立预测因子,其常与二尖瓣反流并存于约30%的心力衰竭患者中,并与心力衰竭全因死亡率增高有关[13-14]。
红细胞分布宽度反映了外周红细胞大小异质性,已被发现与心力衰竭预后密切相关[15]。Huang等[16]进行的一项研究显示,心力衰竭人群中,RDW每增加1%,全因死亡风险增加1.1 倍。本研究发现RDW>14.6%的慢性心力衰竭患者全因死亡率为≤14.6%慢性心力衰竭患者的1.59 倍(HR=1.59,95%CI:1.15~2.2,P=0.005)。本研究另一项结果显示血尿素氮升高(>8.3mmol/L)与心力衰竭不良预后相关(HR=2.33,95%CI:1.72~3.15,P<0.001),与Jujo 等[17]的研究结果一致,可能与血尿素氮升高后损伤内皮细胞,促进其释放组织因子有关。高尿酸血症在慢性心力衰竭人群中很常见,研究证明,血清尿酸升高为慢性心力衰竭发生不良结局的独立预测因子[18-19]。本研究也证实血清尿酸升高的慢性心力衰竭患者全因死亡风险明显高于血清尿酸正常者(HR=1.74,95%CI:1.24~2.44,P=0.001)。
超声心动图作为评估心脏结构与功能的重要检查,其通过超声短波观察心脏瓣膜功能、房室形态、室壁厚度等,可以判断心脏及各血管的血流分布。近些年來,已被广泛应用于心血管疾病的识别和诊断[20]。在本次研究构建的列线图模型中,左室舒张末期内径、二尖瓣反流、三尖瓣反流均为超声心动图参数,也证明超声检查能够更加直观地反映心脏的血流动力学及形态结构变化,及时判断心力衰竭患者的病情进展。
综上,列线图模型是一种可量化的临床评分工具,其结合了可视化、个体化、方便简易等优点,能够为临床医生提供可靠、准确的临床结局发生风险。本研究通过LASSO 回归筛选、多因素COX 回归分析进一步整合后,利用7 个危险因素建立了一个能够预测慢性心力衰竭长期生存率的列线图模型,通过内部验证证实模型具有较好的预测准确度与一致性,对临床医生评估慢性心力衰竭人群病情进展、实现个体化管理有一定指导意义。
[参考文献]
[1] HEIDENREICH P A, BOZKURT B, AGUILAR D, et al.2022 AHA/ACC/HFSA guideline for the management ofheart failure: A report of the American College ofCardiology/American Heart Association Joint Committeeon clinical practice guidelines[J]. Circulation, 2022,145(18): e895–e1032.
[2] GROENEWEGEN A, RUTTEN F H, MOSTERD A, et al.Epidemiology of heart failure[J]. Eur J Heart Fail, 2020,22(8): 1342–1356.
[3] TSAO C W, ADAY A W, ALMARZOOQ Z I, et al.Heart disease and stroke statistics-2022 update: A reportfrom the American Heart Association[J]. Circulation,2022, 145(8): e153–e639.
[4] JONES N R, ROALFE A K, ADOKI I, et al. Survival ofpatients with chronic heart failure in the community: Asystematic review and Meta-analysis[J]. Eur J HeartFail, 2019, 21(11): 1306–1325.
[5] MOZAFFARIAN D, ANKER S D, ANAND I, et al.Prediction of mode of death in heart failure: The seattleheart failure model[J]. Circulation, 2007, 116(4): 392–398.
[6] CHEN J, LI Y, LIU P, et al. A nomogram to predict thein-hospital mortality of patients with congestive heartfailure and chronic kidney disease[J]. ESC Heart Fail,2022, 9(5): 3167–3176.
[7] SIMON N, FRIEDMAN J, HASTIE T, et al. Regularizationpaths for cox's proportional hazards model viacoordinate descent[J]. J Stat Softw, 2011, 39(5): 1–13.
[8] TROMP J, PANIAGUA SMA, LAU E S, et al. Agedependent associations of risk factors with heart failure:Pooled population based cohort study[J]. BMJ, 2021,372: n461.
[9] SATTAR N, RAWSHANI A, FRANZEN S, et al. Age atdiagnosis of type 2 diabetes mellitus and associationswith cardiovascular and mortality risks[J]. Circulation,2019, 139(19): 2228–2237.
[10] GRAYBURN P A, APPLETON C P, DEMARIA AN, et al. Echocardiographic predictors of morbidity andmortality in patients with advanced heart failure: Thebeta-blocker evaluation of survival trial (BEST)[J]. J AmColl Cardiol, 2005, 45(7): 1064–1071.
[11] CORK D P, MCCULLOUGH P A, MEHTA H S, et al.Impact of mitral regurgitation on cardiovascular hospitalizationand death in newly diagnosed heart failure patients[J].ESC Heart Fail, 2020, 7(4): 1502–1509.
[12] LI S, NGUYEN N U N, XIAO F, et al. Mechanism ofeccentric cardiomyocyte hypertrophy secondary to severemitral regurgitation[J]. Circulation, 2020, 141(22): 1787–1799.
[13] BENFARI G, ANTOINE C, MILLER W L, et al. Excessmortality associated with functional tricuspid regurgitationcomplicating heart failure with reduced ejectionfraction[J]. Circulation, 2019, 140(3): 196–206.
[14] HAHN R T, ASCH F, WEISSMAN N J, et al. Impact oftricuspid regurgitation on clinical outcomes: The COAPTtrial[J]. J Am Coll Cardiol, 2020, 76(11): 1305–1314.
[15] PARIZADEH S M, JAFARZADEH-ESFEHANI R,BAHREYNI A, et al. The diagnostic and prognosticvalue of red cell distribution width in cardiovasculardisease; current status and prospective[J]. Biofactors,2019, 45(4): 507–516.
[16] HUANG Y L, HU Z D, LIU S J, et al. Prognostic valueof red blood cell distribution width for patients withheart failure: A systematic review and Meta-analysis ofcohort studies[J]. PLoS One, 2014, 9(8): e104861.
[17] JUJO K, MINAMI Y, HARUKI S, et al. Persistent highblood urea nitrogen level is associated with increasedrisk of cardiovascular events in patients with acute heartfailure[J]. ESC Heart Fail, 2017, 4(4): 545–553.
[18] HUANG H, HUANG B, LI Y, et al. Uric acid and risk ofheart failure: A systematic review and Meta-analysis[J].Eur J Heart Fail, 2014, 16(1): 15–24.
[19] MANTOVANI A, TARGHER G, TEMPORELLI P L, et al.Prognostic impact of elevated serum uric acid levels onlong-term outcomes in patients with chronic heart failure:A post-hoc analysis of the GISSI-HF (gruppo Italiano perlo studio della sopravvivenza nella insufficienza cardiacaheartfailure) trial[J]. Metabolism, 2018, 83: 205–215.
[20] NAGUEH S F. Left ventricular diastolic function:Understanding pathophysiology, diagnosis, and prognosiswith echocardiography[J]. JACC Cardiovasc Imaging, 2020,13(1 Pt 2): 228–244.
(收稿日期:2022–01–16)
(修回日期:2023–02–19)
