P504s、CK-h、p63、CK5/6 在前列腺癌患者中的表达及意义
2023-06-28陈嗣双黄志芳侯斐胡嘉瑜
陈嗣双 黄志芳 侯斐 胡嘉瑜


[摘要] 目的 研究前列腺癌患者超声引导前列腺穿刺活检组织中α 甲酰基辅酶A 消旋酶(α-methylacyl-CoA racemase,P504s)、高分子量角蛋白(high molecular weight keratin,CK-h)、p63、细胞角蛋白5/6(CK5/6)表达及意义。方法 选取金华市人民医院2018 年6 月至2022 年1 月171 例前列腺癌患者超声引导前列腺穿刺活检组织作为研究对象并进行回顾性分析,免疫组化法进行检测癌组织及癌旁组织标本中P504s、CK-h、p63、CK5/6 阳性表达率,分析P504s、CK-h、p63、CK5/6 与临床特征的相关性。结果 癌组织中P504s 阳性率高于癌旁组织,CK-h、p63、CK5/6 阳性率低于癌旁组织(P<0.05)。P504s、CK-h、p63、CK5/6 表达与病理分级、分化程度、Gleason 评分具有一定相关性(P<0.05)。结论 P504s 在前列腺癌组织中表达升高,CK-h、p63、CK5/6 在前列腺癌组织中表达降低,且P504s 表达水平随着病理分级、分化程度、Gleason 评分逐渐增强,表明P504s、CK-h、p63、CK5/6 联合检测在前列腺癌的诊断中具有较高价值。
[关键词] α 甲酰基辅酶A 消旋酶;高分子量角蛋白;p63;细胞角蛋白5/6;前列腺癌
[中图分类号] R737 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.12.010
前列腺癌在男性恶性肿瘤中发病较高,超声引导前列腺穿刺活检技术临床上应用较为广泛,使前列腺癌的检出率明显提高[1-3]。病理学诊断是对腺泡结构及形态观察,是否出现紊乱、异形及浸润的生长方式[4]。光镜下前列腺癌组织形态、良性病变较为相似,鉴别较为困难,误诊、漏诊的发生率较高,而免疫组化技术有利于提高诊断准确率[5]。P504s 在支链脂肪酸β 氧化过程中发挥较为重要的作用[6]。
p63 属于特异性标记组织的基底细胞。CK-h 属于高分子量角蛋白,存在于前列腺基底细胞中,有助于前列腺癌的诊断[7]。CK5/6 属于另一种基底细胞的标志物,在前列腺病变组织中表达较低[8]。既往虽有研究显示P504s、CK-h、p63、CK5/6 在前列腺癌中的表达,但关于上述各指标对生存情况的影响报道较少。本研究回顾性分析P504s、CK-h、p63、CK5/6在前列腺癌组织中的表达,现报道如下。
1 对象与方法
1.1 研究对象
选取金华市人民医院2018 年6 月至2022 年1月171 例前列腺癌患者超声引导前列腺穿刺活检组织作为研究对象,均为男性,年龄52~78 岁,平均(69.67±8.34)岁;纳入标准:符合《歐洲泌尿外科会议前列腺癌诊断治疗指南》[9]中相关标准;①均行超声引导前列腺穿刺活检;②前列腺特异性抗原正常者;③首次发现;④临床病例资料完整。排除标准:①其他肿瘤性疾病;②心、肝、肺等出现病变者;③精神障碍者;④严重出血倾向;⑤直肠、肛周病变;⑥痔疮者;⑦严重免疫系统疾病;⑧全身严重感染患者。
1.2 方法
1.2.1 标本保存及制备 实验所取的组织标本均为患者肿瘤组织和癌旁组织中的基底细胞,标本保存于–70℃环境中。10%甲醛固定标本,石蜡包埋,连续切片,厚度约3μm,完成后对标本进行HE 染色及免疫组化,显微镜进行观察。
1.2.2 P504s、CK-h、p63、CK5/6 检测 应用免疫组化法进行检测癌组织及癌旁组织中P504s、CK-h、p63、CK5/6,将制备好的石蜡切片进行脱蜡、水化,自来水进行冲洗,依照各指标试剂盒进行抗原修复,去除缓冲液(phosphate buffer solution,PBS),滴加过氧化物酶阻断试剂,孵育10min,PBS 冲洗3 次;滴加动物非免疫血清,孵育10min;滴加第一抗体,孵育60min,PBS 冲洗3 次;滴加第二抗体,孵育10min,PBS 冲洗3 次;进行链霉菌抗生素蛋白-过氧化物酶试剂滴加,孵育10min,PBS 冲洗3 次,滴加DAB 显色试剂显色;冲洗,苏木精复染,PBS 返蓝。梯度乙醇脱水,二甲苯透明,中性树胶封固,孵育均在室温下进行。
1.2.3 结果判定 P504s、CK-h、p63、CK5/6 免疫组化切片均由2 名以上病理科医生进行独立评估。细胞质、细胞核发生黄至棕褐色为阳性。观察整个视野,然后在肿瘤细胞及间质进行5 个高倍视野(×200)随机选取,染色强度:0 分:无着色,1 分:淡黄色,2 分:棕黄色,3 分:棕褐色;阳性细胞:1 分:阳性细胞≤10%,2 分:10%~50%,3 分:>50%。两项分值相乘,≥3 分为阳性。
1.3 统计学方法
采用SPSS 22.0 统计学软件对数据进行分析处理。计量资料经Levene 法检测具备方差齐性,Shapirowilk检验符合正态分布,计量资料以均数±标准差(x s )表示,组间比较进行独立样本t 检验;计数资料以例数(百分率)[n(%)]表示,组间比较进行χ2 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 癌组织、癌旁组织P504s、CK-h、p63、CK5/6阳性表达率比较
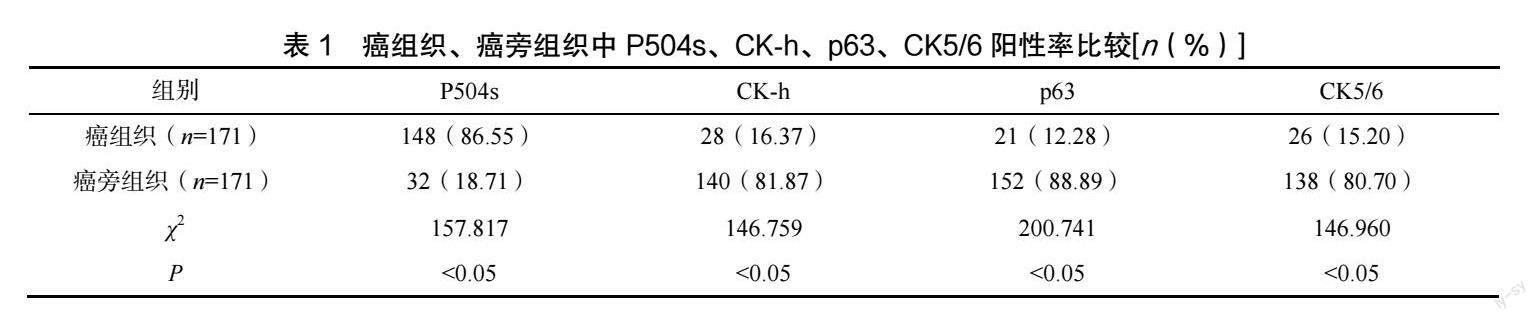
癌组织中P504s 阳性率高于癌旁组织,CK-h、p63、CK5/6 阳性率低于癌旁组织(P<0.05),见表1。
2.2 P504s、CK-h、p63、CK5/6 与前列腺癌临床特征的相关性
P504s、CK-h、p63、CK5/6 表达水平与病理分级、分化程度、Gleason 评分具有一定相关性(P<0.05),见表2~5。
3 讨论
前列腺癌发病较为隐匿、发展慢,早期可能无明显症状,难以与前列腺增生等疾病进行准确鉴别,确诊时可能已发展为中晚期,因此,深入研究前列腺癌的发生发展中关键的分子标志,对于寻找新的诊断治疗靶点,改善患者预后具有重要意义[10-12]。对于前列腺癌的诊断多采用病理诊断进行,以腺体结构异常、细胞核间变以及侵袭生长为原则,但由于前列腺组织较为复杂,部分良、恶性病变组织之间差异较微小,光镜下难以辨别[13]。穿刺活检已成为临床诊断前列腺病变的重要手段,由于穿刺活检所取组织较小,前列腺癌组织结构较为复杂,临床相关诊断依据较少,因此,前列腺穿刺活检标本在前列腺的诊断中较为困难,需与前列腺上皮瘤细胞病变、前列腺基底细胞增生等病变进行鉴别。因此,需借助于免疫组化染色来帮助诊断准确性提高[14]。
P504s 基因参与脂肪酸及相关衍生物的β 氧化。有研究指出[15],P504s 表达与前列腺癌关系密切。另有研究指出[16],P504s 属于前列腺癌阳性标志物,敏感度较高,在泌尿、生殖等系统相关肿瘤中均具有阳性表达,在临床病理诊断中发挥作用。本研究结果显示,与癌旁组织比较,前列腺癌组织中P504s阳性率较高,P504s 与病理分级、Gleason 评分、分化程度呈正相关关系,考虑可能是由于前列腺癌的发病与患者细胞质中支链脂肪酸长期处于高水平具有一定的关系。植烷酸属于常见支链脂肪酸,降植烷酸的植烷酸经氧化后分解的主要产物,可激活过氧化物酶体增殖,而P504s 的主要作用底物为植烷酸,因此,免疫组化P504s 与前列腺癌诊断具有较深的联系[17]。CK-h 作为基底细胞的重要标志物,若基底细胞未被侵犯,其表达较高,对于前列腺癌的诊断、分期起到辅助作用。多数前列腺癌组织的特点为基底细胞缺失,因此,CK-h 在前列腺癌组织中表达较少,甚至不表达。CK-h 也可特异性识别前列腺组织中的基底细胞,通过不同前列腺组织中的基底细胞是否发生阳性着色及特点进行显示癌组织及非癌组织中基底细胞的存在情况,在疾病的诊断、鉴别中有着重要作用[18]。
p63 属于p53 抑癌基因家族成员,主要在基底细胞核中进行表达,有学者研究指出,p63 在癌细胞核中均呈阴性表达,前列腺增生表达为阳性,本研究中,前列腺癌组织中p63 阳性率低于癌旁组织,其结果与上述学者研究结果一致[19]。p63 主要是出发胚胎上皮组织层化、激活靶基因,进行转录,进而调控细胞周期,同时诱导细胞凋亡。本研究中,p63 在癌旁组织中也可少量表达为阴性,说明在少数癌旁组织或前列腺良性疾病中也可能会出现上皮基底细胞不连续的情况,因此,p63 阴性不可单独作为诊断前列腺癌的指标。细胞角蛋白CK5/6 属于目前免疫组化染色进行检测中较为常用的基底细胞标志物,正常组织中多为阳性表达,肿瘤组织中多表达为阴性[20]。本研究中,前列腺癌组织中CK5/6 阳性率低于癌旁组织,其结果与本研究结果一致。本研究证实,癌旁组织中,P504s 多为阳性表达,CK-h、p63、CK5/6 多为阴性表达,提示前列腺癌组织中存在角蛋白缺失的情况,CK-h、p63、CK5/6 表达在前列腺癌组织存在缺失,基底细胞几乎全部消失,CK-h、p63、CK5/6 分别对基底细胞的不同部分进行标记,因此,联合检测P504s、CK-h、p63、CK5/6 表达对于前列腺癌的诊断准确性有助于提升,降低误诊的发生情况[21]。
综上所述,P504s 在前列腺癌中表达上调,CK-h、p63、CK5/6 在前列腺癌中表达下调,且与病理分级、分化程度显著相关,联合检测有助于临床评估病情、预测生存状况提供参考依据。
[参考文献]
[1] 李征, 杨立新, 刘磊, 等. 前列腺癌基因表達标志物1在膀胱癌组织的表达变化及其对膀胱癌细胞增殖和凋亡的影响[J]. 中华实验外科杂志, 2020, 37(7):1339–1341.
[2] 韦付坤, 阚懿, 刘继海, 等. 特异性核基质结合区结合蛋白1 与转录因子E 盒结合锌指蛋白1 在前列腺癌组织的表达及其临床意义[J]. 中华实验外科杂志,2021, 38(6): 1067–1070.
[3] SIEGEL D A, O'NEIL M E, RICHARDS T B, et al.Prostate cancer incidence and survival, by stage andrace/ethnicity-united states, 2001–2017[J]. MMWR MorbMortal Wkly Rep, 2020, 69(41): 1473–1480.
[4] FOSTER C C, WEICHSELBAUM R R, PITRODA S P.Oligometastatic prostate cancer: Reality or figment ofimagination?[J]. Cancer, 2019, 125(3): 340-352.
[5] 张伟, 施春梅, 张忠新, 等. 核磁共振联合超声融合成像引导下前列腺靶向穿刺对PI-RADS 评分≥3 分的前列腺癌患者的诊断价值[J]. 影像科学与光化学,2021, 39(1): 96–100.
[6] 杨东. 前列腺癌P504S 蛋白表达与肿瘤特征及预后的关系[J]. 实用癌症杂志, 2020, 35(9): 1419–1422.
[7] 骆杨, 班德文, 何婷玉, 等. p63、34βE12 和S100 在前列腺穿刺活检组织中的表达及其对前列腺癌的诊断价值[J]. 临床泌尿外科杂志, 2020, 35(9): 721–724.
[8] 马志方, 曾胜, 郐海洋, 等. 雄激素受体对从前列腺癌LNCaP 细胞分选出的CK5+CK8+细胞的作用及其调控机制[J]. 肿瘤研究与临床, 2021, 33(1): 42–47.
[9] 中国抗癌协会泌尿男生殖系统肿瘤专业委员会前列腺癌学组. 前列腺癌筛查专家共识[J]. 中华外科杂志,2017, 55(5): 340–342.
[10] HAFFNER M C, ZWART W, ROUDIER M P, et al.Genomic and phenotypic heterogeneity in prostatecancer[J]. Nat Rev Urol, 2021, 18(2): 79–92.
[11] 王婵, 董传江, 毛峥, 等. ERβ 真核表达质粒对前列腺癌LNCaP 细胞生物学行为的影响及p38 信号通路的作用[J]. 广东医学, 2016, 37(20): 3016–3020.
[12] 何桂芳, 黄晓娟, 郑露露, 等. 前列腺癌组织中N-Myc、p53 的表达及其临床意义[J]. 临床与实验病理学杂志,2019, 35(1): 10–13.
[13] 胡传义, 刘修恒, 葛名欢, 等. 肝细胞生长因子激活因子的抑制因子1 基因在前列腺癌组织中的表达及其意义[J]. 中华实验外科杂志, 2012, 29(4): 744–746.
[14] 王志国, 王友志, 许长宝, 等. 超声引导下前列腺穿刺联合外周血循环肿瘤细胞检测对前列腺癌预后分析[J]. 中华细胞与干细胞杂志(电子版), 2019, 9(6):327–332.
[15] LLOYD M D, YEVGLEVSKIS M, LEE G L, et al.α-Methylacyl-CoA racemase (AMACR): Metabolicenzyme, drug metabolizer and cancermarker P504S[J].Prog Lipid Res, 2013, 52(2): 220–230.
[16] LUO H H, HUO Z, XIAO Y, et al. ClinicopathologicalFeatures and Expression of P504s, E-cadherin, erythroblasttransformation-specific related gene and estrogen receptorin prostate adenocarcinoma in Tibet[J]. Zhongguo YiXue Ke Xue Yuan Xue Bao, 2021, 43(5): 761–766.
[17] EVANS A J. Alpha-methylacyl CoA racemase (P504S):overview and potential uses in diagnostic pathology asapplied to prostate needle biopsies[J]. J Clin Pathol,2003, 56(12): 892–897.
[18] WANG Y, WANG E, WU G, et al. Immunohistochemicaland ultrastructual study of so-called sclerosing hemangiomaof the lung suggests different origins of cells[J]. ZhongguoFei Ai Za Zhi, 2003, 6(2): 92–96.
[19] SHAO Y, NIR G, FAZLI L, et al. Improving prostatecancer classification in HE tissue micro arrays using Ki67and P63 histopathology[J]. Comput Biol Med, 2020,127(5): 104053.
[20] FICHTENBAUM E J, MARSH W L J R, ZYNGER D L.CK5, CK5/6, and double-stains CK7/CK5 and p53/CK5discriminate in situ vs invasive urothelial cancer in theprostate[J]. Am J Clin Pathol, 2012, 138(2): 190–197.
[21] 杨云杰, 戴波, 叶定伟, 等. 循环肿瘤细胞分型对初诊高转移负荷前列腺癌激素敏感時间的预测作用[J].中华泌尿外科杂志, 2019, 40(9): 661–667.
(收稿日期:2022–09–17)
(修回日期:2023–01–06)
