肿瘤负荷评分结合BCL-C 分期识别适合手术的BALC-b 期肝癌患者的效果评价
2023-06-28赵灵峰吴美君赵嗣钰
赵灵峰 吴美君 赵嗣钰

[摘要] 目的 使用肿瘤负荷评分(tumor burden score,TBS)结合巴塞罗那临床肝癌(barcelona clinic liver cancer,BCL-C)分期识别适合手术的BALC-b 期肝细胞性肝癌(hepatocellular carcinoma,HCC)患者。方法 回顾性分析2000 年1 月至2016年12 月台州市肿瘤医院接受肝切除术的1053 例HCC 患者的资料。TBS≥9 分为高风险(n=109),TBS≥3 分且<9 分为中风险(n=675),TBS<3 分为低风险(n=269),比较不同TBS 风险分层患者生存率的差异。结果 低危、中危和高危TBS患者的5 年总生存率分别为77.9%、61.0%和39.0%,差异有统计学意义(P<0.001)。BCL-C 分期a 期患者中,低危、中危和高危TBS 的5 年OS 分别为78.0%、61.6%和45.0%,log rankP<0.001;BCL-C-b 期患者中,中危和高危TBS 的5 年OS分别为13.0%和58.9%,log rankP<0.001。具有相同TBS 的患者术后OS 较为相近:BCL-C-a/中危TBS 与BCL-C-b/中危TBS 患者5 年OS 分别为61.6%和58.9%,P=0.930;BCL-C-a/高危TBS 与BCL-C-b/高危TBS 为45.0%和13.0%,P=0.175)。BCL-C-b 期/中危TBS 的患者比BCL-C-a 期/高危TBS 的患者具有更好的5 年OS(58.9%vs. 45.0%,P=0.005)。多因素COX回归分析结果显示,BCL-C-a 患者中,以低危TBS 为参照,中危TBS 患者HR=2.07,95%CI:1.42~3.02,P<0.001;高危TBS 患者的HR=4.05,95%CI:2.40~6.82。BCL-C-b 患者中,以中危TBS 为参照,高危TBS 患者HR=3.42,95%CI:1.84~6.36。结论 BCL-C 分期系统中结合TBS 进行亚分类,可以进一步筛选适合手术的BCL-C-b 期患者。
[关键词] 肿瘤负荷评分;肝细胞性肝癌;巴塞罗那临床肝癌分期系统;预后分析
[中图分类号] R735.7 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.12.012
肝细胞性肝癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要病理类型,约占所有类型肝癌的85%~90%[1]。巴塞罗那临床肝癌(Barcelonaclinic liver cancer,BCL-C)分期系统被认为是较好的肝癌分期系统且在大量的临床研究中得到证实。然而,该分期系统对肿瘤数量、肿瘤大小的分期标准不精确,导致同一分期的HCC 切除后的结局具有异质性。当前主流的肝癌诊疗指南推荐仅对BCL-C-0 和BCL-C-a 期HCC 患者予切除,而认为病情中晚期(BCL-C-b 和BCL-C-c)的患者术后预后较差,建议进行包括经动脉化疗栓塞和索拉非尼(sorafenib)等非手术疗法[2-3]。然而,近期有很多学者认为BCL-C 分期标准在肿瘤直径和数量方面的定义太过模糊[4-5],有研究显示同一分期肝癌切除术后的预后结局差异较大[6]。一些最近的研究主张应扩大手术切除的标准,认为BCL-C-b HCC 患者经手术治疗可能比非手术疗法获得更好的生存预后[7-8],认为需要对该系统进行细化和进一步的亚分类,以便识别哪些亚型BCL-C-b 分级的HCC 患者适合手术[9],但针对此建议,当前并没有准确的分类方法。Sasaki等[10]将肿瘤数量和肿瘤直径作为连续变量计算的肿瘤负荷评分(tumor burden score,TBS)对接受结直肠癌肝转移切除术患者的预后具有较好的预测价值。TBS 的计算方法简单,仅需要最大肿瘤的直径和肿瘤结节的数量。因此,TBS 恰好弥补了BCL-C分期标准在肿瘤的大小和数量方面的定义太过模糊的缺陷,从理论上推断,将TBS 与BCL-C 相结合,能够更为准确地筛选BCL-C-b HCC 患者中适合手术的患者。目前评估TBS 预测HCC 切除术患者结局效能的研究较少,本研究旨在评价TBS 对接受手术治疗的HCC 患者的预后意义,现报道如下。
1 资料与方法
1.1 临床资料
回顾性分析2000 年1 月至2016 年12 月臺州市肿瘤医院接受肝切除术的1053 例HCC 患者的病历资料,纳入标准:①符合《原发性肝癌诊疗规范(2017年版)》[10]的诊断标准;②年龄≥18 岁;③BCL-C分期为0 期、a 期和b 期;④接受肝癌根治性切除术;⑤病历和随访资料完整。根据随访记录、医保卡信息和电话随访的方式确实患者的生存时间,随访日期截止至2022 年6 月,排除合并其他恶性肿瘤的患者。本研究经台州市肿瘤医院伦理委员会批准(伦理审批号:2022-08-03)。
1.2 数据资料
从维护的数据库中采集患者人口学和临床数据,包括年龄、性别、美国麻醉医师协会(AmericanSociety of Anesthesiologists,ASA)、肝硬化史、乙型肝炎病毒(hepatitis B virus,HBV)和丙型肝炎病毒(hepatitis C virus,HCV)感染、甲胎蛋白水平、Child-Pugh 分级[11]、手术类型、肿瘤直径和数量、病理性淋巴血管浸润,肝包膜受累情况、BCL-C分期等[12]。
1.3 定义
从影像学资料中获取最大肿瘤直径和肿瘤数量数据,根据公式[10]计算TBS。TBS≥9 分为高风险,TBS≥3 分且<9 分为中风险,TBS<3 分为低风险[10]。
1.4 观察指标
主要结局为总生存期(overall survival,OS),为根治性切除术日期与死亡日期之间的时间间隔。次要结局为无病生存期(disease-free survival,DFS),为根治性切除术日期与癌症复发或死亡(以先发生为准)之间的时间间隔。
1.5 统计学方法
采用SAS 9.4 统计学软件进行对数据进行处理分析。不符合正态分布的连续变量采用中位数(四分位数)[M(Q1,Q3)]表示,分类变量以例数(百分率)[n(%)]表示。采用Kruskal-wallis 检验或χ2检验比较3 组患者的一般资料和TBS 得分及其分布情况组间差异。其中Kruskal-wallis 检验是比较3 个及以上非正态分布样本的非参数检验方法。采用Kaplan-Meier 曲线和Log rank 检验比较TBS 及其与BCL-C 分期相结合的亚组之间生存率的差异。其中Kaplan-Meier 曲线通过可视化曲线形象展示不同组间患者的生存率,Log-rank 检验用于比较生存曲线之间的统计学差异。采用单因素COX 风险比例模型考察影响患者术后总生存率的可能影响因素,单因素分析中P<0.05 的危险因素采用逐步后进的方法进入多因素COX 风险比例模型,考察生存率的独立影响因素。P<0.05 为差异有统计学意义。
2 結果
2.1 患者的一般情况
共有1053 例HCC 患者符合入排标准。患者中位年龄为67 岁,75.0%(790 例)患者为男性。677例(64.3%)患者的ASA 分级为2 级及以下。24.6%的患者(259 例)接受微创手术,多数患者(850 例,80.7%)肿瘤分化程度为良好或中等,最终病理结果显示,367 例患者(34.9%)有淋巴血管浸润,其他人口学和临床资料见表1。
2.2 TBS 得分及其分布情况
TBS 得分中位数为3.9(2.5,7.3)分,根据TBS将患者分为3 组:高危TBS 患者109 例(10.4%),中危TBS 患者675 例(64.1%)和低危TBS 患者269例(25.5%)。63 例BCL-C-0 期HCC 患者的TBS 均属低危。BCL-C-a 期低危TBS 患者206 例(24.9%)、中危535 例(64.8%)、高危85 例(10.3%),而BCL-C-b期仅包含TBS 中危患者140 例(85.4%)和高危24例(14.6%),见表2。
2.3 TBS 与患者的生存率的关系
中位随访时间27(12.6~2.4)个月,整个队列术后5 年OS 和DFS 分别为62.9%和36.0%。低危、中危和高危TBS 患者的5 年OS 分别为77.9%、61.0%和39.0%,差异有统计学意义(log rankP<0.001)(图1A),DFS 分别为40.7%、35.4%和28.5%)(图1B),差异均有统计学意义(log rankP<0.001)。
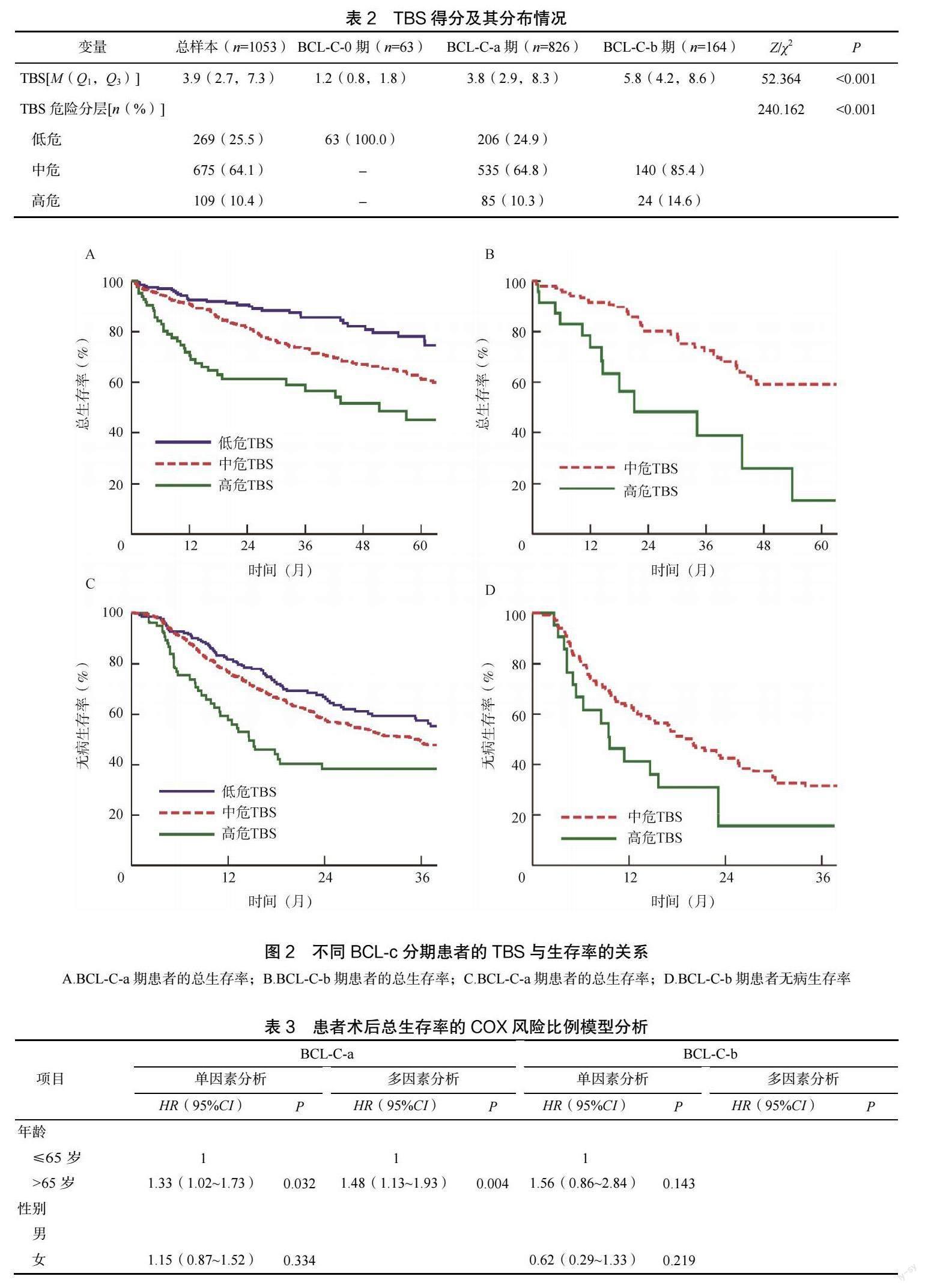
2.4 不同BCL-C 分期患者的TBS 与生存率的关系
BCL-C-a 期患者中,低危、中危和高危TBS 的5 年OS 分别为78.0%、61.6%和45.0%,log rankP<0.001(图2A);BCL-C-b 期患者中,中危和高危TBS 的5 年OS 分别为13.0%和58.9%,log rankP<0.001(图2B)。
BCL-C-a 期患者中,低危、中危和高危TBS 的3 年DFS 分别为57.4%、49.4%和38.0%,log rankP=0.008(图2C),BCL-C-b 期患者中,中危和高危TBS 的3 年DFS 分别为31.4%和15.0%,log rankP=0.043(图2D)。
2.5 不同TBS 分层和BCL-C 分期组合的OS 分析
为了鉴别BCL-C-b 期患者经手术治疗可能产生良好结局的亚组,对不同BCL-C 分期和TBS 危险分层的患者进行重新组合,结果显示,具有相同TBS的患者术后OS 较为相近:BCL-C-a/中危TBS 与BCL-C-b/中危TBS 患者5 年OS 分别为61.6%和58.9%,P=0.930;BCL-C-a/高危TBS 与BCL-C-b/高危 TBS 为45.0%和13.0%,P=0.175。BCL-C-b 期/中危TBS 的患者比BCL-C-a 期/高危TBS 的患者具有更好的5 年OS(58.9%vs. 45.0%,P=0.005)。相反,BCL-C-a 期/低危TBS 患者的5 年OS 优于BCL-C-b 期/中危TBS 患者(78.0%vs. 58.9%,P=0.007)和BCL-C-b 期/高危TBS(78.0%vs. 13.0%,P<0.001)的患者。
2.6 BCL-C-a 和BCL-C-b 患者术后总生存率的相关因素分析
BCL-C-a 患者中,在多因素分析校正竞争因素后,TBS 评分是患者OS 的独立预测因子,以低危TBS 为参照,中危TBS 患者HR=2.07,95%CI:1.42~3.02,高危TBS 患者的HR=4.05,95%CI:2.40~6.82。其他独立影响BCL-C-a 患者OS 的因素有年龄超过65 岁(HR=1.48,95%CI:1.13~1.93),肝硬化(HR=2.07,95%CI:1.56~2.75,P<0.001),AFP 水平超过400ng/ml(HR=1.65,95%CI:1.23~2.22,P=0.001),淋巴血管浸润(HR=1.86,95%CI:1.41~2.46,P<0.001)和R1 切除(HR=1.61,95%CI:1.07~2.42,P=0.020)。见表3。
BCL-C-b 患者中,在多因素分析校正竞争因素后,TBS 评分是患者OS 的独立预测因子,以中危TBS为参照,高危TBS 患者HR=3.42,95%CI:1.84~6.36,P<0.001。其他独立影响BCL-C-b 患者OS的因素有ASA分级>2 级(HR=2.05,95%CI:1.17~3.60),低/未分化肿瘤分级(HR=2.80,95%CI:1.57~5.02,P=0.001),见表3。
3 讨论
肿瘤直径和肿瘤数量作为评估肝癌患者预后的重要指标,在实体瘤形态学上具有重要的地位。二者是HCC 常规分期系统如TNM 分期和BCL-c 分期系统的重要组成部分[13]。TBS 利用勾股定理原理,综合考虑了肿瘤数量和肿瘤直径的共同影响,形成了一种新的科学的肿瘤负荷评估方式。计算TBS 的数据易于获得,方法简便,其结果可以作为一个连续变量,更能反映肿瘤累及肝脏的程度,可对结局进行更为具体的预测[14]。研究显示,与现行的米兰标准或up-to-seven标准[15]比较,TBS的对预后具有较好的鉴别能力,TBS每增加1 分,死亡风险增加6%[14]。同时,TBS 又可以按照临界值转换为等级变量,有利于对患者的预后进行预测分层。自2018 年经由Sasaki 等[10]提出以来,TBS 受到了较为广泛的关注[16]。有研究显示TBS 对经动脉化疗栓塞和肝移植的HCC 患者的预后具有较好的预测能力[10,16]。
当前肝癌诊疗指南仅推荐对BCL-C-0 和BCL-C-a 期HCC 患者给予切除,而对BCL-C-b 和BCL-C-c 的患者非手术疗法[2-3]。但是BCL-C 分期系统标准在肿瘤直径和数量方面的定义太过模糊[4-5],导致同一分期肝癌切除术后的预后存在加大的差异[6]。故有学者认为BCL-C-b HCC 患者中可能有的患者经手术治疗可能也会产生较好的预后[7-8],但如何识别这些患者仍存在困难[9]。本研究纳入经肝切除术治疗的BCL-0 期、a 期和b 期的HCC 患者,结果显示,无论BCL-C 分期如何,同一TBS 危险分层的患者具有相似的结局,即使是BCL-C-b 期的HCC 患者,其术后生存获益也是不一样的,TBS 是识别BCL-C-b 期术后生存获益的有效工具。
虽然本研究中BCL-C-0 期患者TBS 全部为低危,但BCL-C-a 期患者的TBS 评分从低危到高危均有分布。而BCL-C-a HCC 切除术后的结局在很大程度上依赖于TBS,低TBS 患者的5 年OS率高达78%,而高TBS 患者的5 年OS 率仅为45%。同样,TBS能够对BCL-C-b 期患者的预后进行分层。BCL-C-b期患者5 年OS 率为52.8%。本研究中BCL-C-b/中危TBS 的患者比BCL-C-a/高危TBS 的患者结局更好,说明BCL-C-b 期患者如果TBS 分级较好,仍可通过手术中取得较好的生存获益。即使调整了竞争因素后,TBS 仍是BCL-C-a 和BCL-C-b 期患者OS 的独立预测因素。TBS 还可以预测整个队列以及不同BCL-C 分期的DFS。本研究结果提示,TBS 可作为一种辅助工具,对HCC 切除术患者的预后进行分层,并提示BAL-C-a 和BAL-C-b 期患者均可从手术中获益,尤其是对于BCL-C-b 期患者,可结合TBS 评估手术切除可能获得生存益处,判断患者是否可以作为手术治疗的候选人群。
首先在术前患者咨询方面,不应单纯依据BCL-C分期对患者分析预后。尤其是不同TBS 危险分级的BCL-C-b 期患者术后生存结局存在着很大区别,应结合TBS 为患者提供更为精确的预后信息,以利于患者做出更为科学的治疗决策。其次,应避免患者仅依据BCL-C 分期对自己的术后结局存在过于乐观/悲观的心理。即使是BCL-C-a 期患者,假如TBS 分级为高危,其术后结局也会不如TBS 低危患者,应及早对患者表现出的不适合临床实际的乐观或悲观心理进行合理的教育和心理干预。第三,有利于术前根据TBS制定更为准确的、前瞻性的围手术期管理计划。
总之,在BCL-C 分期系統中结合TBS 进行亚分类,可以进一步筛选适合手术的BCL-C-b 期患者。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancerstatistics 2020: Globocan estimates of incidence andmortality worldwide for 36 cancers in 185 countries[J].Ca Cancer J Clin, 2021, 71(3): 209–249.
[2] EUROPEAN association for the study of the liverelectronic address: easloffice@easloffice.eu, europeanassociation for the study of the liver, easl clinicalpractice guidelines: Management of hepatocellularcarcinoma[J]. J Hepatol, 2018, 69(1): 182–236.
[3] MARRERO J A, KULIK L M, SIRLIN C B, et al.Diagnosis, staging, and management of hepatocellularcarcinoma: 2018 practice guidance by the Americanassociation for the study of liver diseases[J]. Hepatology2018, 68(21): 723–750.
[4] REIG M, FORNER A, RIMOLA J, et al. BCL-C strategyfor prognosis prediction and treatment recommendationbarcelona clinic liver cancer (BCL-C) staging system.the 2022 update[J]. J Hepatol, 2021, 21(8): 2358–2366.
[5] BEUMER B R, BUETTNER S, GALJART B, et al.Systematic review and Meta-analysis of validatedprognostic models for resected hepatocellular carcinomapatients[J]. Eur J Surg Oncol, 2021, 36(5): 420–424.
[6] GUO H, WU T, LU Q, et al. Surgical resection improveslong-term survival of patients with hepatocellularcarcinoma across different barcelona clinic liver cancerstages[J]. Cancer Manag Res, 2018, 10(6): 361–369.
[7] BHANDARE M S, PATKAR S, SHETTY N, et al. Livervesection for HCC outside the BCLC criteria[J].Langenbecks Arch Surg, 2018, 403(1): 37–44.
[8] BHANDARE M S, PATKAR S, SHETTY N, et al.Hepatic resection compared to chemoembolization inintermediate-to advanced-stage hepatocellular carcinoma:A Meta-analysis of high-quality studies[J]. Hepatology,2018, 68: 977–993.
[9] GOLFIERI R, BARGELLINI I, SPREAFICO C, et al.Patients with barcelona clinic liver cancer stages b and chepatocellular carcinoma: Time for a sub classification[J].Liver Cancer, 2019, 8(2): 78–91.
[10] SASAKI K, MORIOKA D, CONCI S, et al. The tumorburden score: A new "metro-ticket" prognostic tool forcolorectal liver metastases based on tumor size andnumber of tumors[J]. Ann Surg, 2018, 267(1): 132–141.
[11] 張长坤, 张龙辉, 王东, 等. 术前肝功能Child-Pugh评分与白蛋白–胆红素评分对肝癌患者肝切除术后肝衰竭和预后的预测价值[J]. 中华消化外科杂志, 2018,(5): 474–482.
[12] 陈闯, 龙沛雲, 陈洁, 等. 巴塞罗那临床肝癌分期与香港肝癌分期对肝细胞癌患者预后预测价值的比较[J]. 临床肝胆病杂志, 2019(3): 530–534.
[13] HUO T L. Albi grade as a new player in hepatocellularcarcinoma[J]. J Chin Med Assoc, 2019, 82(1): 1.
[14] VITALE A, LAI Q, FARINATI F, et al. Utility of tumorburden score to stratify prognosis of patients withhepatocellular cancer: Results of 4759 cases fromita.li.ca study group[J]. J Gastrointest Surg, 2018, 22(5):859–871.
[15] 董骏峰, 滕飞, 李培磊, 等. 基于up-to-seven 标准肝细胞癌肝移植术后生存预测模型的建立和验证[J]. 第二军医大学学报, 2018, 39(7): 745–752.
[16] 王言焱, 刘佳明, 王立军, 等. 肿瘤负荷评分在肝细胞癌患者预后预测中的价值[J]. 中国癌症防治杂志,2019, 11(5): 393–397.
(收稿日期:2022–09–30)
(修回日期:2023–01–18)
