神经肌肉电刺激下小腿肌肉的电学特性研究*
2023-06-20PanjiNursetiaDarma张全成姚佳烽
孙 博 Panji Nursetia Darma 张全成 姚佳烽
(1)西安理工大学机械与精密仪器工程学院,西安 710048;2)Department of Mechanical Engineering, Chiba University, Chiba263-0022,Japan;3)西安石油大学体育系,西安 710065;4)南京航空航天大学机电学院,南京 210016)
通常,测量评估NMES 对肌肉的训练效果有以 下 方 法 。 a. 表 面 肌 电 图 (surface electromyography,sEMG)作为一种“被动”测量方法,其基本原理是记录电极下方人体骨骼肌中运动单位电位产生的肌电信号。sEMG的时频特性定量地反映了肌肉的功能状态、肌肉群的协调性和肌肉的力量[6]。sEMG方法已经应用于许多领域,包括手势识别以及踩踏或步行分析[7-9]。b. 计算机断层扫描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI) 和超声成像(ultrasonic imaging,UI)。CT具有很好的肌肉形状图像分辨率,能够准确、清晰地区分人小腿成像中的肌肉、脂肪和骨骼。MRI是使用氧合[10]或收缩成像[11]提供肌肉结构和功能信息的工具。MRI 能够准确反映NMES 对肌肉的训练效果[12]。UI 用于检测肌肉厚度、肌肉纤维羽状角和肌肉束活动的变化,已经被广泛用于研究肌肉的生理特性[13]。
然而,NMES训练对肌肉效果的监测所有常规检测方法都有缺点。sEMG受到“噪音”的过度影响,无法专注于感应特定肌肉的募集[14]。长期且定期进行高强度阻力训练会增加人体骨骼肌的横截面积,肌肉会发生明显的形态学变化。因此,传统成像检测方法能够通过对肌肉形态学变化的检测来评估NMES训练对肌肉的效果,但传统成像检测方法设备体积较大无法携带,且价格高昂,无法实现在家或者床旁的长期监测。然而,NMES下人体肌肉人体骨骼肌的电特性分布会发生了变化[15],在这种情况下,我们提出了一种方法,电阻抗成像(electrical impedance tomography,EIT)技术解决了上述缺陷,成为一种通过监测在长期NMES训练下不同肌肉响应隔室电学特性来评估NMES对肌肉训练效果的新颖技术。
EIT是一种利用观察区域内物质阻抗分布进行成像的技术[16]。由于生物体不同组织在不同的生理、病理状态下具有不同的电阻抗特性,采用各种激励模式,对人体施加安全驱动电流/电压,通过生物组织在安全激发下测量响应信息,重建人体内部的电阻抗分布图像[17]。基于这一原理,生物电阻抗断层成像技术发展为一种非侵入性,安全无辐射,响应速度快、廉价的可视化方法[18]。当人体骨骼肌在NMES 训练下发生电学特性分布变化时,EIT可以检测到改变化并通过可视化的方法直观的展示。
本文采用已开发的EIT系统对使用NMES训练小腿后侧肌肉的效果进行可视化和定量化分析,旨在将EIT 作为一种长期监测方法,从而可视化NMES训练对人类小腿肌肉的训练效果。首先,将EIT 应用于对右小腿NMES 训练前和5 周每周3 次后的电导率分布进行成像,以得到EIT 重建图像。然后,通过比较EIT重建图像肌肉被刺激隔室的空间平均电导率<σ>和生物电阻抗分析(bioelectrical impedance analysis,BIA)方法所测得的右腿组织细胞外含水量比率βrl,验证EIT重构图像的电导率分布σ。最后,通过配对样本t检验评估NMES 的有效性,并且讨论在NMES训练肌肉电学特性变化的生理原因。
1 仪器与方法
1.1 实验仪器
EIT方法使用电传感器收集材料内部电特性的分布信息,电信号用作数据传输和处理的载体,适当的图像重建算法用于重建对象电特性的空间分布。EIT 系统通常分为3 个单元(图1)。a. 传感器阵列,使用了16 个电极可穿戴式传感器。物理场分布信息被转换为电信号,即根据物理场电特性的变化获得测量值。b. 数据采集和处理单元,它使用多路复用器和阻抗分析仪(IM3570,HIOKI,日本)。该单元用于收集传感器处理数据。c. 图像重建单元(安装Phython 软件的个人计算机),该单元从测量信号重建物理场参数分布。在实际测量中,正弦电流的幅值设置为1 mA[19],并且选择1kHz 频率关注于细胞外液,因为低频电流仅穿透细胞间质[20-21]。本研究采用的阻抗分析仪的阻抗测量精度为±0.08%,激励频率范围为4 Hz~5 MHz。
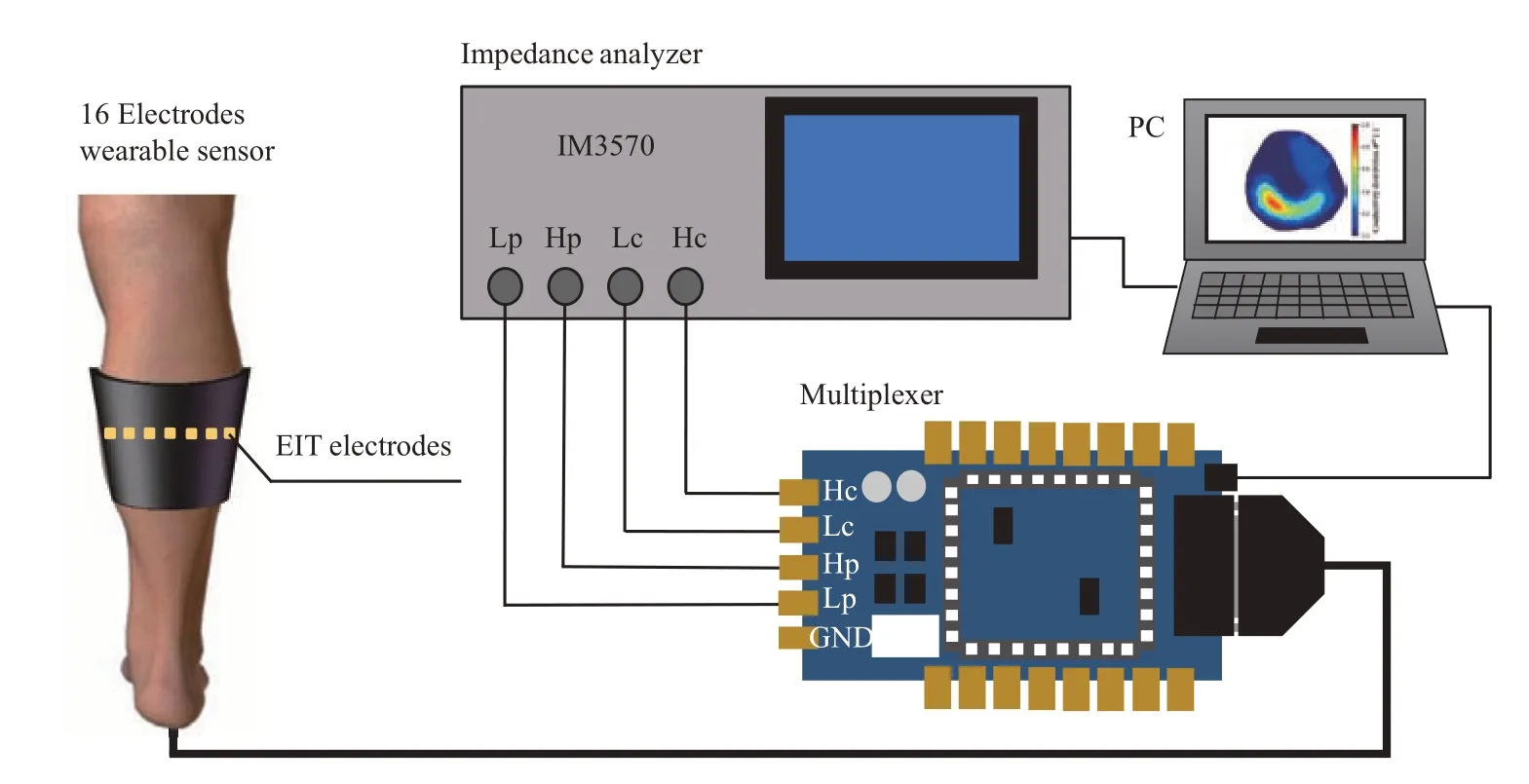
Fig. 1 Electrical impedance tomography (EIT) system

Fig. 2 Human calf long-term experiment protocol

Fig. 3 The electrode locations for NMES and structure of calf muscle compartments
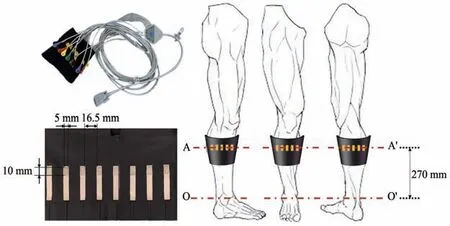
Fig. 4 EIT sensor location and electrode distribution

Fig. 5 The spatial-mean conductivity <σ>M1, ECW/TBW ratio βrl of right leg, and total body water (TBW) τ in control group (CG) during 5 experimental weeks

Fig. 6 The spatial-mean conductivity <σ>M1, ECW/TBW ratio βrl of right leg, and total body water (TBW) τ in optimal voltage intensity training group (OG) during 5 experimental weeks
1.2 实验方法
1.2.1 实验对象和道德规范
根据千叶大学(Chiba University)人体实验伦理道德规范,所有受试者在获得详细解释后,均已签署研究的书面知情同意书,已了解参与有关的目的、潜在利益和风险。所有研究程序均根据赫尔辛基宣言和千叶大学研究道德规范进行,并得到千叶大学人体实验委员会的批准。16 名健康的年轻男性自愿参加此实验,实验对象的基本信息如表1所示。所有受试者均无任何肌肉骨骼或神经系统疾病史,并在3个月内无额外的肌肉训练和体育运动。
(3)经费使用要求:项目经费、培训和会议经费支出应合理合规,区县(自治县)民政局婚姻登记处应加强对财务的监管,保证项目资金的安全和正确使用。
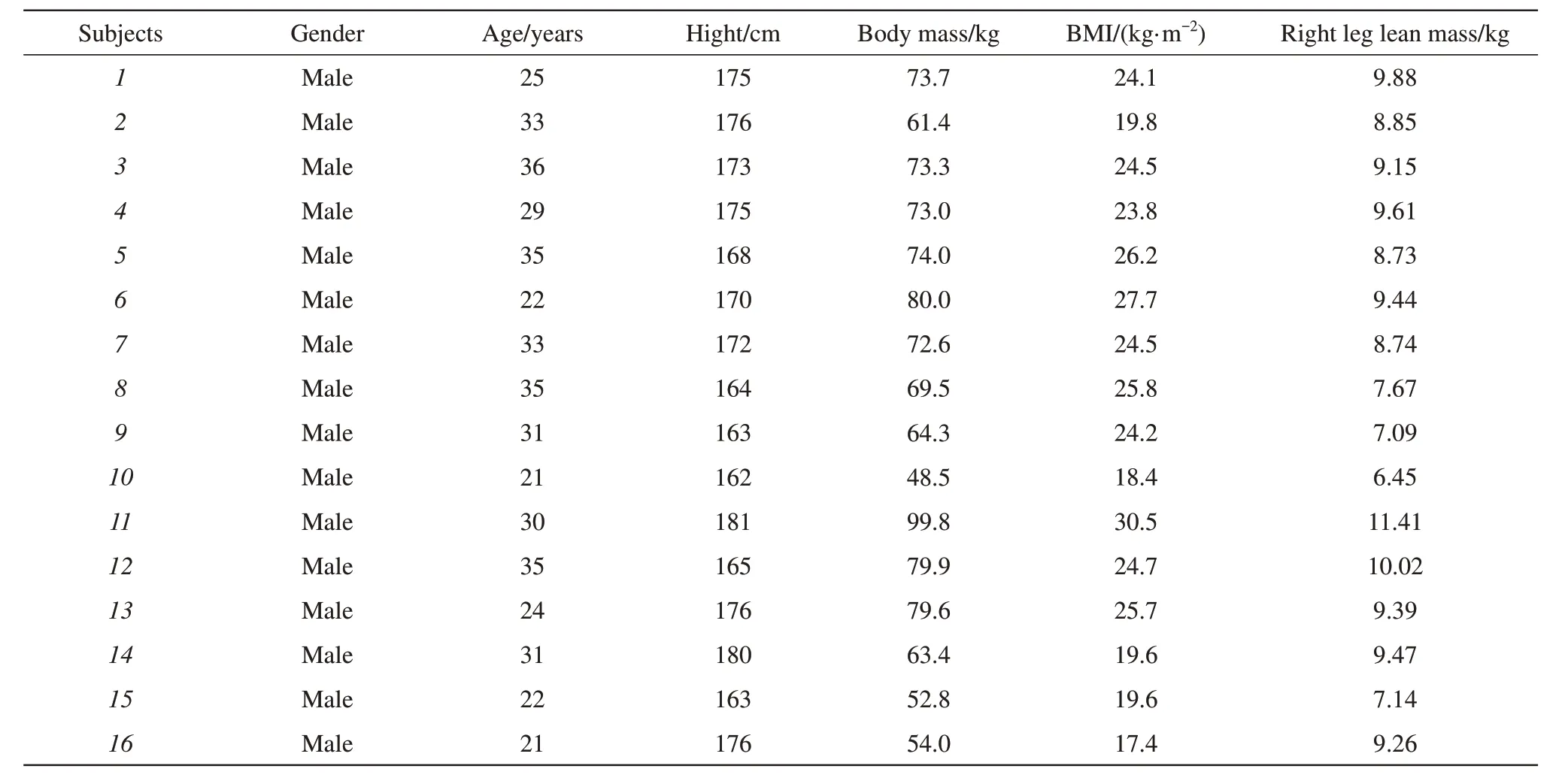
Table 1 The information of experimental subjects
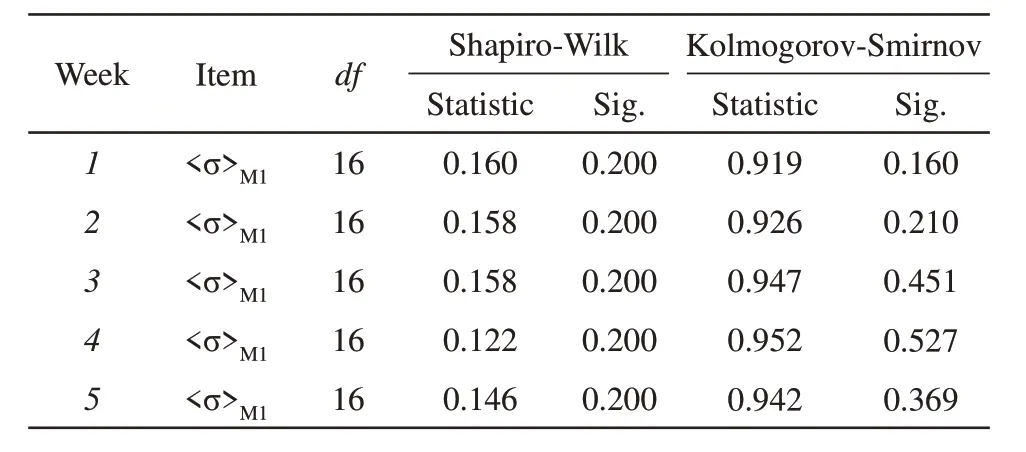
Table 2 The results of Shapiro-Wilk test and Kolmogorov-Smirnov test

Table 3 Conductivity distribution images σ in control group
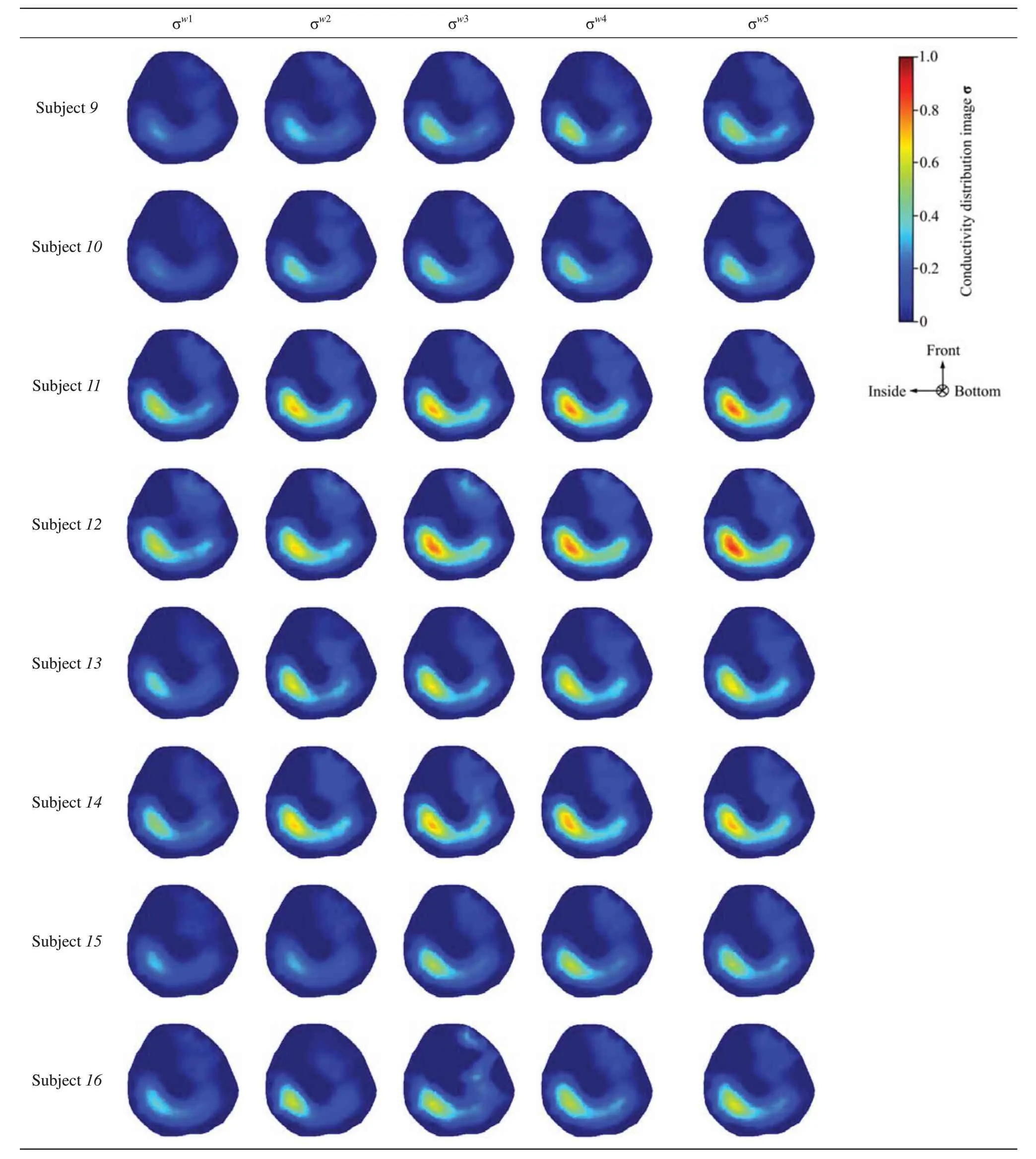
Table 4 Conductivity distribution images σ in optimal voltage intensity training group
1.2.2 实验过程
这项研究的实验方案如图2所示,每个实验周期为1周,重复5周。16名实验对象被随机分配到对照组(control group,CG,n=8)和最佳电压强度NMES 训练组(optimal voltage intensity training group,OG,n=8)。对照组保持正常生活方式并不进行NMES和其他的肌肉训练;NMES训练组中使用商业NMES 设备进行23 min 的NMES 训练,每周3 次,为期5 周。NMES 硅胶电极的位置如图3中左图所示,该电极直接与受试者的皮肤接触。该NMES设备有一个不同的电压值,但使用恒定的控制电流,即8 mA。刺激周期规则是4 s 刺激,4 s停顿,刺激频率为20 Hz。在OG 中,根据以前的研究计算的最佳电压强度被用来训练受试者的右小腿[5]。在所有的实验步骤中,受试者都以坐姿进行测量。
第1 天,首先在NMES 训练前进行EIT 测量,重建人体右小腿的电导率分布图像σ。图4 显示了可穿戴式传感器的16个电极的位置和分布。然后,用BIA 测量右腿的细胞外含水量(ECW)与身体总含水量(TBW)的比率βrl(βrl=ECW/TBW),以获取每次EIT 测量期间小腿组织水分含量的变化,该变化与小腿电导率变化有关,测量身体总含水量(TBW)τ,TBW 随着瘦体重的增加而增加,这是由于肌肉大约73%是水份。最后,用NMES 训练受试者的小腿肌肉23 min。
第2 天和第4 天,没有实验安排。要求实验对象在日常饮食中摄入适量的蛋白质。
第3 天和第5 天,只进行NMES 训练。实验对象的小腿肌肉受到NMES的刺激,持续23 min。
在CG中,除了不使用NMES训练受试者的小腿肌肉外,实验方案与OG的实验方案相同。
从阻抗Z重建电导率分布图像σ的图像重建算法使用高斯-牛顿方法[15],表示为:
其中J是雅可比矩阵,JT是雅可比矩阵的转置。μ是超参数。ΔZ =[ΔZ1,…,ΔZm,…ΔZM] ∊ℜM,是频差EIT中高频f2= 1 kHz注入电流下的一个测量阻抗Zf2和低频f1= 500 Hz注入电流下的另一个测量阻抗Zf1之间的阻抗差[22],其表示方法为:
为了定量的评估肌肉电导率分布的变化,空间平均电导率<σ>被定义为:
1.3 数据分析和处理
根据之前的研究,运动训练后小腿肌肉隔室的空间平均电导率<σ>发生了变化,因此EIT 重建图像中的肌肉层色深也发生了变化。在NMES 刺激下,有两个小腿肌肉隔室的电学响应明显,分别表示为由腓肠肌组成的M1隔室和由胫前肌、趾长伸肌,及腓骨长肌组成的M2隔室,如图3 中右图所示。NMES 主要覆盖在M1肌肉隔室,M1被认为主要参与腿部肌肉的快速募集,因为它以白肌纤维(II 型快肌)为主[23]。M1(腓肠肌)被收缩的同时,小腿前部M2肌肉隔室的肌肉被拉伸,M1与M2属于拮抗肌肉对,因此M2肌肉隔室在NMES 刺激下发生的电学响应是由于肌肉机械运动产生,由于本研究的目的是可视化NMES 训练对人类小腿肌肉的训练效果,因此下面的研究重点评估了M1区间的电导率分布。所有数据均以组内所有受试者的平均值和标准差表示。为了长期使用NMES 对人类小腿肌肉的训练效果,将配对样本t检验应用于空间平均电导率<σ>,ECW/TBW 比率值βrl,以及身体总含水量(TBW)τ,显著性水平设定为a=0.05。使用SPSS 软件(版本25.0)的描述性统计功能来检验实验数据的正态分布,表2 显示了Shapiro-wilk 检 验 和Kolmogorov-smirnow 检 验 的 结果。在α=0.05,P>0.05 的检验水平下,不拒绝无效假设。因此,可以认为实验数据服从正态分布。
2 结 果
2.1 对照组实验结果
表3显示了由公式(1)和(2)得到的对照组(CG)8 名受试者右小腿的电导率分布图像σ。在不同受试者的实验中,肌肉层在重建图像中很好地被识别。尽管使用所提出方法仍在不同的受试者中观察到一些噪音,但是观察到EIT能够清楚检测到小腿肌肉隔室的电学特性在对照组5周的测量中无明显变化。
图5a 中的实色条形图显示了在CG 组5周的监测中右小腿M1肌肉隔室的空间平均电导率<σ>M1。M1的空间平均电导率从第1周的<σw1>M1=0.155到第5 周的<σw5>M1=0.154(n=8,P>0.05)没有明显变化。图5b 中的实色条形图显示了用生物电阻抗(Inbody S10,InBody Co.,Ltd,韩国)方法测量所得右腿的细胞外含水量(ECW)与身体总含水量(TBW)的比率(ECW/TBW)βrl。ECW/TBW从第1 周的βw1rl=0.375 到βw5rl=0.375(n=8,P>0.05)没有明显变化。图5b 中的实线图显示了用BIA 方法测量所得的身体总含水量(TBW)τ。第5 周TBW 值τw5=39.62 L 与第1 周的TBW 值τw1=39.81 L相比无明显变化(n=8,P>0.05)。
2.2 NMES训练组实验结果
表4 显示了由公式(1)和(2)得到的OG 组8 名受试者右小腿的电导率分布图像σ,通过EIT检测在5 周NMES 训练中8 名受试者小腿肌肉电学特性的变化。表4显示使用EIT方法对于检测小腿骨骼肌在NMES 训练下引起的小腿肌肉电学特性变化的检测具有令人满意的结果。电导率图像显示,在使用NMES训练右小腿肌肉的第2周电导率发生显著增加,随后第3、4、5周仍有增加,但变化并不明显。
图6a中的实色条形图显示了NMES训练组5周内右小腿M1肌肉隔室的空间平均电导率<σ>M1的变化趋势。M1的空间平均电导率从第1 周的<σw1>M1=0.159 明显增加到第5 周的<σw5>M1=0.248(n=8,P<0.01)。图6b中的点状彩条图显示了用BIA方法测量所得右腿的细胞外含水量(ECW)与身体总含水量(TBW)的比率(ECW/TBW)βrl,ECW/TBW 也有增加趋势,从第1 周的βw1rl=0.365 到βw5rl=0.378(n=8,P<0.01)。图6b中的点线图显示了用BIA 方法测量所得的身体总含水量(TBW)。第5周TBW 值τw5=42.22 L 与 第 一 周 的TBW 值τw1=42.25 L相比无明显变化(n=8,P>0.05)。
3 讨 论
一般来说,有两个原因用于研究NMES训练下人类肌肉组织的生理响应,即肌肉收缩的“血液动力学”原因和肌肉收缩的“新陈代谢”原因[24]。
在肌肉收缩的“血液动力学”原因中,一般的概念是,肌肉收缩会压缩骨骼肌中的血管(尤其是静脉),而松弛会引起吸力或束缚。这种现象称为肌肉泵,它使血管以允许血流速度急剧上升的方式打开[25]。当骨骼肌有规律地收缩时发生的充血是正常哺乳动物组织中最大的灌注增加之一[26],肌肉充血通常用于确定目标训练肌肉是否得到有效训练。已经认识到在肌肉收缩期间骨骼肌的血流量急剧增加[27]。而且,运动过程中的血流量增加仅限于收缩肌肉,这直接作用于给定肌肉群内被募集的纤维[28]。Currier等[29]在NMES下进行了一项血流研究,当电刺激施加于人的小腿肌肉组织时,他们发现,在电刺激的第1分钟血流量便增加,并在随后的刺激中保持相对稳定的水平。
另一方面,是肌肉收缩的“新陈代谢”原因。肌浆肥大的主要成因是无氧代谢机制,NMES快速招募目标肌肉,会给代谢带来很大压力,而随着肌纤维增大,尤其是又不怎么做有氧训练的情况下,线粒体密度会降低,而且由于肌肉横断面面积增大,氧气扩散也会变慢一点,从而导致有氧代谢效率降低[30]。因此,肌纤维随着自身的增长,会越来越依赖于无氧代谢,产生与无氧代谢更相关的蛋白质,而这些蛋白质会将水分带入细胞,从而使得肌浆扩大。
本研究发现, CG组实验对象保持正常生活状态,在实验期间无任何体育锻炼,其右小腿肌肉电学特性及右腿细胞外液体积及身体总含水量与第1周无明显变化(图5)。然而,OG组实验对象在实验期间每周一、三、五使用NMES 训练右小腿肌肉,其右小腿肌肉M1肌肉隔室空间平均电导率<σ>M1及右腿细胞外液体积βrl与第1 周相比有相同的增长趋势,而身体总含水量与第1周无明显变化(图6)。综上所述,连续5周的EIT测量结果显示,NMES 训练引起被刺激肌肉隔室空间平均电导率<σ>M1的增加,且第2 周<σw2>M1增加最为明显,之后第3、4、5周相较于上一周均有增加但增加幅度明显小于第2 周,这意味着肌肉纤维体积在第2 周已发生明显增加,发生肌浆肥大现象,之后受试者逐渐适应NMES训练,肌肉生理响应变慢但仍在持续增长。因此,EIT能够作为一种长期监测方法有效的评估NMES 训练增加人类小腿肌肉纤维体积的效果。
4 结 论
通过EIT检测NMES下人类小腿肌肉的电学特性变化,被刺激肌肉隔室在重建图像中很好地被识别,因此EIT方法对于检测人类小腿肌肉在NMES下收缩所引起的电学特性及生理响应具有令人满意的结果。使用配对样本t检验方法对小腿M1肌肉隔室连续5 周测量的空间平均电导率<σ>M1和右腿细胞外液比例(ECW/TBW)βrl进行分析,结果表明,对照组实验对象右小腿肌肉电学特性及右腿细胞外液体积及身体总含水量与第1 周无明显变化。与对照组相比,NMES训练组实验对象连续5周的EIT测量结果显示,NMES训练引起被刺激肌肉隔室空间平均电导率<σ>M1的增加,且第2 周<σw2>M1增加最为明显,之后第3、4、5周相较于上一周均有增加但幅度明显小于第2周,这意味着肌肉纤维体积在第2 周已发生明显增加,发生肌浆肥大现象,之后受试者逐渐适应NMES 训练,肌肉生理响应变慢但仍在持续增长。本研究提出EIT能够作为一种长期监测方法有效的评估NMES 训练增加人类小腿肌肉纤维体积的效果。
