新型冠状病毒感染相关嗅觉障碍的流行现状、机制和康复*
2023-06-20马敬钞允寒琦刘青菁常潇月王宴庆
邢 晨 马敬钞 允寒琦 刘青菁 常潇月 王宴庆 周 雯
(1)中国科学院心理研究所,脑与认知科学国家重点实验室,北京 100101;2)中国科学院大学心理学系,北京 100049;3)北京脑科学与类脑研究中心,北京 102206)
新型冠状病毒感染(COVID-19),下简称“新冠”,是由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARSCoV-2)引发的全球性大流行病。临床表现多样,感染并不局限于呼吸道,也可累及心血管系统、消化系统、生殖系统及神经系统等。其中,嗅觉损伤是常见的神经系统症状,严重影响了大量民众的生活质量。本文从嗅觉系统和嗅觉障碍入手,梳理了新冠患者嗅觉障碍的流行现状、机制和毒株间的差异,并就“长新冠”患者持续性嗅觉障碍的流行现状、机制和影响及可行的嗅觉功能恢复和治疗方法展开了探讨。通过综述新冠相关嗅觉障碍的研究证据,本文可以帮助研究者更全面地认识SARSCoV-2对神经系统的损伤,并为后续神经功能的保护和康复研究提供思路。
1 嗅觉系统和嗅觉障碍
1.1 嗅觉系统
嗅上皮位于鼻孔后上方约7 cm处的鼻腔末端,覆盖了部分鼻中隔(nasal septum)、筛状板和上鼻甲[1],总面积约5 cm2(每侧鼻腔各2.5 cm2)[2],是产生人类嗅知觉的关键部位。嗅上皮中主要存在3 种细胞:嗅觉感觉神经元(olfactory sensory neurons,OSNs)、支持细胞(supporting cells or sustentacular cells)和基底细胞(basal cells)。其中,基底细胞又分为两种:水平基底细胞(horizontal basal cells)和球形基底细胞(globose basal cells)。此外还有微绒毛细胞(microvillar cells)、分泌黏液(mucus)的嗅腺细胞(Bowman gland cells)和嗅鞘细胞(又名嗅觉胶质细胞,olfactory ensheathing cells)等[1,3]。支持细胞在调节OSNs的稳态和增殖中起着至关重要的作用,当支持细胞受到破坏,OSNs 的功能就会受到损伤[4]。而嗅腺细胞不仅可以通过导管将黏液分泌至嗅上皮表面,浸润OSNs的树突末梢和嗅觉纤毛(olfactory cilia),对OSNs 起到保护作用,还含有IgA、IgM 和J 链等大量免疫球蛋白,具有重要的免疫功能[4]。
嗅质(odorant)是指能够刺激神经系统产生气味(odor)感知的外界物质[5]。就像光线射入视网膜,激活视锥和视杆细胞使人类产生了视觉一样,嗅质与OSNs 表达的嗅觉受体(olfactory receptor)结合是产生嗅觉的开始。人类嗅上皮存在1~2 千万的OSNs[6],每个成熟的OSN 只特异性表达一种嗅觉受体[7]。人类基因组包含800多种嗅觉受体基因,其中有相当比率的假基因,最终产生约400种功能性的嗅觉受体[8]。不同的个体在嗅觉受体基因及表达上有显著差别[9],这导致人类在气味感知上存在很大的个体差异[8-9]。除了嗅觉受体本身的变异性,嗅质和嗅觉受体之间的关系也非常复杂。一个受体可以对多种嗅质产生反应,一种嗅质也可以激活多个受体[10]。此外,嗅质之间也会对同一个神经元产生交互作用,即一种气味分子的存在可能会增强或抑制该神经元对另一种气味分子的反应[11]。因此,人类使用仅仅上百个受体就能识别上万种气味[10],甚至有研究估计人类可以辨别的气味多达1万亿种[12]。
嗅质伴随着每次的吸气(sniff)进入鼻腔。在嗅上皮区域,嗅质会被嗅质结合蛋白(odorantbinding protein)运输至OSNs 树突端的嗅觉纤毛上,与嗅觉受体(大多为G 蛋白偶联受体)相结合,使化学信号转化为电信号[13]。之后嗅觉信息再通过OSNs 轴突形成的嗅丝传出,穿过筛状板,进入颅内,到达嗅球(olfactory bulb)[14]。编码相同嗅觉受体基因的嗅丝会汇聚在一起,投射到位于嗅球中特定位置的嗅小球(olfactory glomerulus)之中。嗅小球的数量个体差异较大,一般在3 000到9 000 之间,平均约5 500 个[15]。嗅小球的传出神经元是僧帽细胞(mitral cells) 和丛状细胞(tufted cells),其轴突形成嗅束(olfactory tract),投射到下游的梨状皮质(piriform cortex)、杏仁核(amygdala)、嗅结节(olfactory tubercle)和内嗅皮质(entorhinal) 等脑区,合称为初级嗅皮质(primary olfactory cortex)。从初级嗅觉皮质往后,嗅觉信息被进一步的投射到眶额皮质(orbitofrontal cortex)、脑 岛(insula)、下 丘 脑(hypothalamus)和海马(hippocampus)等广泛区域(图1a)。
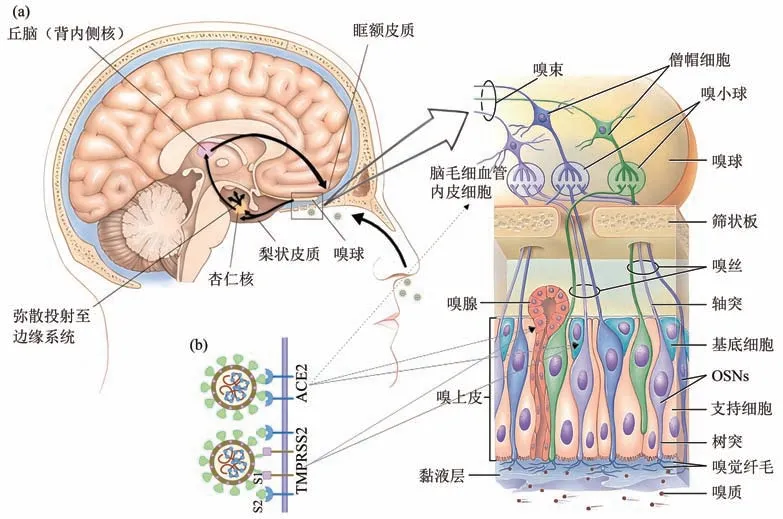
Fig. 1 The human olfactory system and infection with SARS-CoV-2图1 人类嗅觉系统与SARS-CoV-2感染
1.2 嗅觉障碍
嗅觉障碍(olfactory dysfunction)是指在吸嗅(鼻前嗅觉,orthonasal olfaction)或进食(鼻后嗅觉,retronasal olfaction)期间嗅觉功能的减退或扭曲[18]。嗅觉障碍主要包括嗅觉丧失(anosmia)、嗅觉减退(hyposmia)、嗅觉倒错(parosmia)和幻 嗅(phantosmia), 涉 及 嗅 觉 阈 限(odor threshold)、嗅觉分辨(odor discrimination)和嗅觉识别(odor identification) 3 种不同的嗅觉能力[19]。一般认为,嗅上皮属于外周嗅觉系统(peripheral olfactory system),而中央嗅觉系统(central olfactory system)则包括嗅球及其下游脑区。从嗅上皮到中枢的嗅觉系统中任何一个区域的损伤都有可能造成嗅觉障碍(图1)[20]。位于嗅上皮的OSNs是唯一与环境直接接触的神经元,容易受到外界危险因素的影响而发生损伤,比如外伤、病毒[21]、细菌和真菌感染[22]。在这里发生的嗅觉损伤会直接影响到气味敏感性,表现为嗅觉阈限的上升;而在中央嗅觉系统发生的损伤,除了影响嗅觉功能,还可能伴随认知功能(如注意、学习、记忆和决策)的障碍。
在众多危险因素中,病毒感染是造成嗅觉障碍的主要原因。比如,副流感病毒(parainfluenza virus)、 鼻 病 毒 (rhinovirus) 和 冠 状 病 毒(coronavirus)都会对嗅觉系统产生影响[23]。这些病毒引发的嗅觉障碍主要是由于嗅上皮和嗅觉神经通路的损伤[22]。嗅上皮感染病毒后,会发生OSNs的凋亡,其再生也会减少[24],最终神经上皮可能会被呼吸上皮或变性鳞状上皮所取代[25-26]。对于中枢而言,嗅上皮受损后OSNs信号输入减少,可能会导致嗅球体积减小等变化[27]。近年来,COVID-19肆虐全球,与副流感病毒、鼻病毒等相比,SARS-CoV-2 引发的嗅觉障碍似乎更为多见,这可能源自它能高效利用靶点蛋白附着在鼻上皮的活动纤毛上,进而利用纤毛跨过黏膜层而侵入胞体[28]。SARS-CoV-2导致的嗅觉损伤情况也区别于其他冠状病毒。SARS-CoV-1与该靶点蛋白的亲和力较低,对嗅觉的损伤有限,而中东呼吸综合征(MERS-CoV)并不损害嗅觉[29]。引发普通感冒的冠状病毒则会导致鼻窦炎症,可引起短暂或慢性的嗅觉丧失[22],但是SARS-CoV-2 引起弥散性鼻窦炎症的比率较低[29]。
嗅觉障碍的发生还与帕金森病、阿尔茨海默病和亨廷顿舞蹈症等神经退行性疾病有关,被视作相关疾病的前驱期和疾病进展的生物标志物(biomarker)之一[30-32]。追踪研究提示,在认知功能正常或轻度障碍的人群中嗅觉功能的减退预示未来罹患神经退行性疾病的风险,且嗅觉功能状况可以辅助鉴别帕金森病和特发性震颤等非神经退行性疾病[33]。一些自身免疫疾病,如多发性硬化症、视神经脊髓炎和系统性红斑狼疮,与嗅觉障碍间也存在关联[34]。理解嗅觉障碍的发生机制,并找到相应的治疗和应对策略非常必要。
2 新冠患者的嗅觉障碍
2.1 流行现状
在新冠患者的诸多急性期症状中,嗅觉障碍尤其受到关注,被视作提示感染的早期指标[35]。嗅觉障碍在SARS-CoV-2感染初期、其他症状尚未出现时便可发生,无症状感染者也表现出一定程度的嗅觉功能损伤[36],体内病毒载量越高,嗅觉功能受损越严重[37]。此外,新冠患者的嗅觉障碍也往往伴随味觉功能障碍和三叉神经敏感性减退[38]。
现有研究报告新冠患者在急性期出现嗅觉障碍的比率相差很大,在5%~85%之间[39-40]。差异可能与3方面因素有关:嗅觉评估工具、采样人群和流行毒株种类。嗅觉评估工具可分为客观嗅觉功能评估(使用校验过的气味材料和工具进行测量)和主观嗅觉功能评估(如自我报告)。在新冠患者中,客观嗅觉功能评估探测到的嗅觉障碍的发生率高于使用主观嗅觉功能评估所得到的发生率[41],经过校验的主观评估工具的检出比率高于未校验过的主观评估工具[42]。新冠患者嗅觉障碍的发生率也受到采样人群的人口学变量的影响。相比于男性,女性的嗅觉功能似乎更容易受到新冠的影响[43];相比于老年人,年轻人感染后发生嗅觉障碍的严重程度似乎更高[44]。由于SARS-CoV-2 的毒株一直在变异,嗅觉障碍的发生率也随之变化[45-46],研究采样时当地流行毒株的种类也会影响到研究结果。基于疫情早期研究的元分析研究提示新冠患者嗅觉障碍的发生率大概为50%[47-48]。
2.2 机制
SARS-CoV-2 作为一种冠状病毒,使用其刺突糖蛋白(spike glycoprotein)与宿主细胞的受体血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)结合,通过胞吞作用进入宿主细胞,并利用跨膜丝氨酸蛋白酶2 (transmembrane serine protease 2,TMPRSS2)将刺突糖蛋白裂解为S1(受体结合) 以及S2 (膜融合) 两个结构域(domain)来感染细胞(图1b)[49]。通过这种感染方式,SARS-CoV-2 进入宿主体内后,可能会引发嗅裂炎症以及嗅上皮、嗅球和后续嗅觉神经通路的损伤,从而导致急性期乃至持续的嗅觉障碍。
2.2.1 嗅裂炎症
嗅觉的产生需要气味分子顺着鼻腔内的气流,穿过狭窄的嗅裂(olfactory cleft)并接触到鼻腔末端的OSNs。研究发现嗅觉丧失的新冠患者表现出嗅裂炎症性阻塞[50]。嗅裂的阻塞会阻碍气味分子到达鼻腔末端与OSNs 接触,导致病人嗅觉丧失。例如, 有研究基于磁共振成像(magnetic resonance imaging,MRI)对比了20 名嗅觉丧失的新冠患者(嗅觉丧失时间范围:1~13 d;平均嗅觉丧失时间:5.3 d)和20 名年龄匹配的健康对照组神经影像数据,结果发现20 名嗅觉丧失的感染者中有19 人表现出嗅裂完全阻塞,而所有对照组的嗅裂均正常[51]。即使在23 名感染者嗅觉丧失1~4个月之后,其中仍有17 人的嗅裂呈现浑浊化[52]。值得注意的是,在临床症状中,大部分新冠患者出现的嗅觉障碍并不伴随鼻塞[53],但是在神经影像数据上表现出嗅裂炎症性阻塞[54],这可能是由于SARS-CoV-2 通过气溶胶传播,沉积主要发生在嗅裂内,很少在鼻呼吸道上皮沉积[55],且ACE2 受体在嗅上皮的表达量比在呼吸上皮的表达量更高[56]。
2.2.2 嗅上皮的损伤
a. 支持细胞的感染和死亡
支持细胞的感染和死亡可能会造成嗅上皮黏液减少、嗅觉纤毛失去能量来源和嗅觉纤毛脱落(deciliation)等后果,从而影响OSNs的功能。
(1)嗅上皮黏液减少。嗅上皮中的支持细胞和嗅腺细胞所分泌的黏液对嗅觉功能具有重要的作用。首先,嗅质结合蛋白可以通过液体环境将嗅质运送至嗅觉受体[13]。其次,黏液中还含有抗氧化剂、生长因子、免疫因子、肽、抗菌和调节蛋白等。黏液蛋白酶会迅速分解代谢嗅质和异物,其代谢效率会影响嗅觉功能[57];并且一些细胞因子水平的变化会影响OSNs的功能和再生[58]。值得注意的是,嗅上皮的支持细胞和嗅腺细胞除了分泌黏液,还是SARS-CoV-2 侵入嗅觉系统的主要靶点[56]。研究发现这两类细胞大量表达SARS-CoV-2的 进 入 蛋 白(viral entry proteins)、 ACE2 和TMPRSS2(图1b)。病毒对支持细胞和嗅腺细胞的感染和损伤导致了黏液的减少以及成分变化,阻碍了嗅质的溶解,由此改变了嗅质引发的神经信号传导和处理[59]。也有动物研究表明感染后嗅上皮的黏液量有显著的减少[60]。这可能说明黏液量和化学成分的变化会导致嗅觉功能的紊乱[21,61]。
(2)嗅觉纤毛失去能量来源。大量嗅觉纤毛生长在OSNs的顶端,它们在黏液中组织成一个重叠的网状结构,对溶解在黏液中的嗅质进行吸收和探测。由于OSNs 的树突节(knob)缺乏足够的核糖体为纤毛提供能量[62],为保证纤毛的正常功能,需要支持细胞和嗅腺细胞将葡萄糖通过基底层下面的血管输送到黏液中。支持细胞在基底层通过葡萄糖转运体1(glucose transporters 1,GLUT1)输入葡萄糖,在顶端通过GLUT3 分泌葡萄糖到黏液中[62]。由于嗅质和嗅觉受体结合的过程依赖葡萄糖提供的能量,当GLUT受损导致黏液中葡萄糖的浓度降低时嗅觉信号传导便会受到阻碍。当支持细胞感染受损,这一能量供给被阻碍时,失去能量来源的纤毛便会功能失调。有一项动物研究支持了上述机制,对感染SARS-CoV-2的仓鼠嗅上皮支持细胞进行单细胞RNA 测序分析(single-cell RNA sequencing analyses)发现,葡萄糖转运体的基因是最早表达下调(downregulated)的基因之一[63]。此外,在支持细胞中大量表达的ACE2 为肾素-血管紧张素- 醛固酮系统(renin-angiotensinaldosterone system,RAAS)的一部分,RAAS 相关的蛋白酶(peptidases)也会参与到离子/水平衡和葡萄糖代谢的调节中[64]。因此,嗅觉信号传导对支持细胞所提供能量的依赖,为SARS-CoV-2导致嗅觉障碍创造了条件[65]。
(3)嗅觉纤毛脱落。早先研究显示,支持细胞被特异性毒素破坏时,OSNs 与其失去联系,树突节会开始膨胀和退化(degeneration),并失去纤毛[66]。这说明支持细胞和OSNs 之间存在一种局部、接触介导的维持信号,两类细胞之间的接触紧密[64]。在动物模型中,SARS-CoV-2感染同样引发嗅觉纤毛的迅速脱落,这与急性感染期患者嗅觉障碍突然发生的特点吻合[61,67]。此外,SARS-CoV-2会导致纤毛生成的关键转录因子Foxj1(forkhead box J1)在OSNs 中的表达下调[63]。由于纤毛是嗅觉信号转导的必要条件[68],而支持细胞是纤毛维持的重要前提[61],支持细胞死亡和纤毛维持因素缺失导致的纤毛脱落可能是嗅觉障碍的其中一个原因。
b. 感染者的免疫反应
感染者对SARS-CoV-2的免疫反应可能导致了宿主嗅觉障碍,包括宿主嗅觉受体和其他信号分子的基因表达下调和免疫炎症反应。
(1)嗅觉受体和其他信号分子的基因表达下调。在嗅上皮中一些细胞因子水平的增加(比如干扰素(interferon,IFN))会降低OSNs 中嗅觉受体的表达[69]。在小鼠模型中,不仅仅嗅觉受体基因,其他参与嗅觉信号转导分子的基因也被下调表达[67];但是在人类群体中,嗅觉受体的基因表达正常,在感染和未感染的嗅上皮之间不存在差异[70],然而另一种和嗅觉受体相关的信号分子,腺苷酸环化酶3(adenylate cyclase 3,ADCY3)的水平降低[21]。一些研究表明这些信号分子的减少会导致嗅觉信号的转导受损[63,67]。
感染者体内细胞因子的来源以及导致嗅觉受损的相关细胞因子没有确定的研究结果[65]。大多数研究报告了发生SARS-CoV-2感染后,嗅上皮细胞中的IFNs水平增加[61,63,67]。除了IFNs,还有白介素-6(interleukin-6,IL-6)以及肿瘤坏死因子α(tumor necrosis factor α,TNF-α)也可能参与了嗅觉损伤的过程,但是它们在该过程发挥作用的机制仍存在争议[69]。
总体而言,SARS-CoV-2 感染对OSNs 内基因表达有广泛的影响。这些变化可能导致了嗅觉纤毛的脱落和OSNs的退化[65]。
(2) 免疫细胞因子炎症对嗅上皮的破坏。SARS-CoV-2 对鼻腔内细胞的感染迅速地引起了免疫细胞对嗅上皮的浸润(infiltration),从而导致嗅上皮发生脱屑(desquamation),上皮细胞被驱逐至内腔(lumen)。这些细胞,包括部分OSNs,大部分发生凋亡[71-72]。嗅上皮细胞的损伤和死亡会导致嗅觉障碍,而细胞的生长再生会带来嗅觉的恢复[65]。
2.2.3 中枢的损伤
嗅球是嗅觉神经环路中重要的枢纽,基于神经影像学的分析发现,患有嗅觉障碍的新冠患者嗅球体积显著低于正常对照组[73],且部分感染者的嗅球表现出结构异常(如:左右不对称[74]、形态发生变化[52])或者信号异常[52]。基于病毒RNA 和蛋白质的检测发现新冠患者的嗅球中存在病毒感染[75-76],且在嗅球外层检测到CD148(炎症标志物)和病毒抗原[77-78]。研究者推测感染者嗅球的结构性变化主要源自病毒对嗅上皮支持细胞和干细胞的损伤[50]。SARS-CoV-2使嗅上皮细胞被大量破坏,嗅神经纤维轴突损伤[79],进而导致嗅球中营养因子的缺失[49];而干细胞的损伤使得嗅上皮细胞无法正常再生,从而造成感染几周后嗅球的影像结构变化[80]。
SARS-CoV-2 也可能影响脑内其他与嗅觉功能有关的结构。研究者在感染者的尸检样本中发现,SARS-CoV-2除了入侵嗅球,还感染了三叉神经节和延髓等神经区域[75]。基于人脑类器官和小鼠的实验显示SARS-CoV-2 能够感染人类和小鼠脑组织[81]。神经影像研究提示新冠患者眶额皮质体积减少[82],代谢活动下降[74]。眶额皮质接受次级嗅觉投射,与嗅觉意识相关,其改变也可能是SARSCoV-2 导致嗅觉障碍的原因之一。SARS-CoV-2 影响中枢神经系统的具体途径和机制尚有争议。有研究者认为SARS-CoV-2 可直接通过与血脑屏障(blood-brain-barrier) 中脑毛细血管内皮细胞(brain capillary endothelial-like cells)表达的ACE2受体结合而进入中枢神经系统(图1b)[83]。也有研究者认为SARS-CoV-2入侵中枢神经系统的机制涉及神经纤毛蛋白1(neuropilin-1,NRP-1),神经纤毛蛋白1是一种跨膜糖蛋白,当刺突糖蛋白被furin蛋白酶或TMPRSS2 裂解时激活神经纤毛蛋白1,使病毒进入表达神经纤毛蛋白1的内皮细胞和上皮细胞[84]。
2.3 不同毒株的差异
自COVID-19 爆发以来,SARS-CoV-2 不断变异,从最初的原始毒株、Alpha、Delta到如今全球广泛流行的Omicron。不同毒株导致嗅觉障碍的发生率存在非常大的差异(不论是主观报告还是客观测量)[45-46]。Menni 等[45]于2021 年中至2022 年初通过手机软件收集近万感染者的症状,Delta 毒株感染引发的嗅觉障碍的发生率大概为52.7%,而Omicron毒株感染引发的嗅觉障碍的发生率大概为16.7%;Cardoso 等[46]根据巴西流行毒株的测序信息,基于自我报告的大样本数据,比较不同毒株感染后嗅觉障碍发生的比率,研究结果表明原始毒株感染所引发的嗅觉障碍的发生率最高,为52.6%,Delta 毒株次之,为42.1%,Gamma 毒株为27.5%,Omicron毒株引起嗅觉障碍的发生率仅为5.8%。新冠患者嗅知觉改变的发生比率也随SARS-CoV-2毒株的变异而波动,2020 年初进行的研究发现,嗅觉倒错和幻嗅的发生比率为7.6%和8.3%[38],采样集中在2020 年中的研究报告的比率分别为26.4%和13.6%[85],而这两个比率在2020 年末到2023 年初进行的研究中分别变为了45.5%和18.6%[44]。另有少数案例报告和小样本研究报道嗅觉障碍在重复感染不同毒株的个体中仍有发生[86],且发生嗅觉障碍的比率在两次感染中不存在显著差异,但第二次感染时嗅觉障碍的症状持续时间更短[87]。
总的来说,相比于原始毒株(D614),当同一批患者被Alpha 和Delta 毒株(G614)感染时,嗅觉受损症状出现的比率更大[88]。刺突糖蛋白的D614G 突变似乎加强了感染嗅上皮的支持细胞和嗅腺细胞的能力,因此不同毒株在感染支持细胞的效率方面存在差异[65]。原始的D614毒株会导致刺突过早脱落,刺突密度降低,因此进入细胞的效率较差[89]。这可能导致支持细胞的感染率较低,嗅觉障碍的发生率较低(约10%)[88]。G614 变种病毒有D614G 突变,它能稳定刺突的三聚体,防止刺突过早脱落,较高的刺突密度能使该种变体更有效地感染细胞[89],因此嗅觉障碍发生率相对较高[88]。
同样作为G614 变种毒株,Omicron 毒株导致化学感觉障碍(嗅觉和味觉)的发生率相比于同种的G614 变 异(Alpha 和Delta 毒 株) 似 乎 更低[45,90]。Omicron 毒株的疏水性更强,在黏液中的溶解度可能更低,使得接触到支持细胞的病毒更少[90]。此外,由于较低的furin 蛋白酶裂解(furin cleavage)效率会导致由TMPRSS2 介导的表面膜融合(surface membrane fusion)减少,Omicron 在表达TMPRSS2 的细胞中的进入效率较低,更倾向于对细胞采用感染效率较低的内体途径(endosomal pathway)[89,91-92]。支持细胞对这种方式的入侵具有更强的抵抗力,比如干扰素诱导的跨膜蛋白(interferon-indued transmembrane,IFITM)可以阻止病毒与细胞膜融合[63]。图2 总结了D614原始毒株、G614 Alpha/Delta 和G614 Omicron 感染嗅上皮支持细胞的方式。
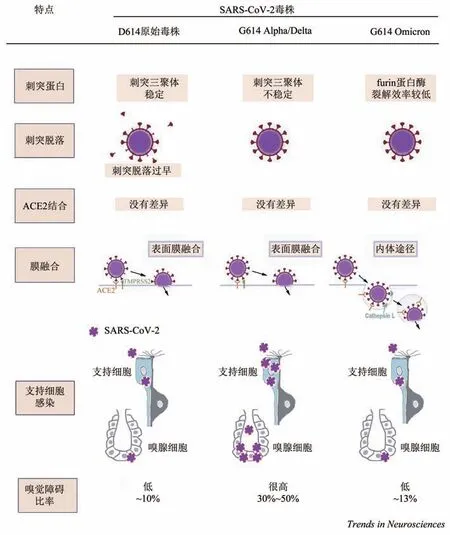
Fig. 2 Infection mechanisms and results of different SARS-CoV-2 variants图2 SARS-Cov-2不同毒株的感染机制和结果
3 “长新冠”患者的持续性嗅觉障碍
3.1 流行现状
“长新冠”一般指感染SARS-CoV-2 后的症状持续超过3 个月[76],一项基于自我报告的元分析显示90%的患者在感染SARS-CoV-2后90 d内嗅觉恢复,但仍有5%的患者在感染半年后仍存在持续嗅觉或味觉障碍[93]。影响病程的因素包括年龄、性别和遗传等[94]。嗅觉倒错和幻嗅可在COVID-19引起的嗅觉减退康复数月后作为迟发性症状发生[95]。此外,Boscolo-Rizzo等[96]发现,主观报告和客观测量结果不同,在康复6 个月后,112 名自我报告嗅觉正常的患者中,只有41%的患者在宾夕法尼亚大学嗅觉识别测验中表现出正常嗅觉。
3.2 机制
关于新冠急性感染期嗅觉障碍的机制已经有诸多研究结果,然而目前探讨“长新冠”患者持续性嗅觉障碍机制的实证研究相对较少,仍有很多假说亟待验证。总体而言,SARS-CoV-2 可能通过诱发宿主体内炎症反应(细胞非自主性机制)和直接入侵宿主细胞(细胞自主性机制)两种方式造成嗅觉系统的长期损伤。这两种方式之间也可能存在复杂的相互作用。
有研究证据支持SARS-CoV-2可以通过诱发慢性炎症反应来造成OSNs的长期损伤。SARS-CoV-2对嗅上皮的感染导致了炎症环境,在感染者尸体样本中,OSNs 轴突处的微血管出现了损伤,并产生了退化,表明微血管中存在局部炎症[79],提示髓源性巨噬细胞和中性粒细胞被募集至受感染的嗅上皮并分泌促炎症细胞因子[61]。“长新冠”患者嗅黏膜的活检样本中存在大量的IBA+(ionized calcium binding adapter molecule 1)小胶质细胞,并且出现了促炎症细胞因子IL-6 的上调表达[61]。尽管大多数OSNs在急性感染期存活[63,97],但是对感染后存在持续性嗅觉障碍个体的嗅上皮样本的分析显示,其在病毒清除后仍存在T 细胞介导的长期慢性炎症,并且成熟OSNs 的数量显著下降。由此,SARS-CoV-2 导致的慢性炎症反应可使OSNs 受到持续的免疫攻击,数量持续减少,从而带来持续性嗅觉障碍[98]。
类比慢性鼻窦炎中嗅觉障碍的机制,部分研究者提出炎性环境以及促炎症细胞因子(如TNF-α)的持续产生还可能会降低水平基底细胞的分化潜力,抑制其分化形成OSNs,致使OSNs 的再生受阻,从而导致嗅觉障碍的持续[99]。SARS-CoV-2诱发的长期炎症反应可能通过同时破坏OSNs和抑制其再生来影响“长新冠”患者的嗅觉功能。
除了诱发炎症反应,SARS-CoV-2 也可以通过ACE2 和TMPRSS2 受体直接入侵破坏宿主细胞。由于基底细胞和支持细胞都可以表达ACE2 和TMPRSS2 受体,有利于SARS-CoV-2 的直接入侵,而两种细胞又对OSNs的再生和功能维持具有至关重要的作用。有假说认为SARS-CoV-2对嗅上皮干细胞(比如水平基底细胞)的持续感染可能会引起嗅上皮再生能力的长期下降。动物实验中,SARSCoV-2的核衣壳(nucleocapsid)蛋白在水平基底细胞中被检出,这为该假说中SARS-CoV-2入侵水平基底细胞提供了证据支持[99-101]。同时另有假说认为SARS-CoV-2的持续感染也可以造成大量嗅觉相关细胞(比如支持细胞)的凋亡。正常情况下,支持细胞可从嗅上皮的干细胞中不断再生,但是持续性的感染导致其再生的速度减慢,嗅觉障碍的恢复便会推迟,从而出现持续性嗅觉障碍[65]。
也有研究者从更微观的角度提出了假说。Schirinzi 等[102]通过分析“长新冠”患者的OSNs,发现了PK2(prokineticin-2)和P物质(substance P,SP)的过度表达,且前者与残存嗅觉功能正相关。该研究者假设PK2 和SP 可能对持续性嗅觉障碍产生着不同的作用, PK2 是嗅觉再生(olfactogenesis)的因素,而SP 是嗅觉损伤的中介物[102]。PK2 对于嗅觉系统中神经元的成熟(maturation)和迁移(migration)以及嗅觉信号的转导至关重要[103-104],因此PK2 的表达有利于嗅觉能力的恢复。SP 作为一种神经源性炎症的中介分子[105-106],可能会导致大规模且有害的炎症反应[107],包括细胞因子的产生和免疫细胞的激活[108],因此SP的持续大量表达引发的炎症环境可能会导致持续的嗅觉障碍。除了炎症,SP 还可能作为一种神经递质直接影响嗅觉信号的传导[109]。此外,在仓鼠模型中,研究者发现OSNs的核染色质结构发生了大规模的重组,并且顺式和反式接触(cis- andtrans-contacts)的嗅觉受体基因之间的物理相互作用大量减少,OSNs 染色质重组会导致与嗅觉信号传导相关基因持续性的表达异常[63]。
3.3 影响
3.3.1 对认知功能的影响
嗅觉功能是大脑认知完好性的一个指标[110],嗅觉受损则与认知能力的下降和部分脑结构(例如梭状回、海马体和内嗅皮质等颞叶结构)的萎缩及神经退行性变有关[111]。从神经功能解剖的角度看,阿尔茨海默病和帕金森病早期病理性改变均发生在参与嗅觉加工的脑区,与涉及记忆和注意的脑区紧密相连[112-113]。从病理学的角度看,目前还不清楚是怎样的机制导致了嗅觉改变和神经疾病发生发展之间的关联。一个颇有影响的假说是“嗅觉媒介假说”(olfactory vector hypothesis,OVH),它认为嗅觉神经容易受到外源因素的入侵,环境中的异生素(xenobiotics),包括病毒、雾化金属和细菌毒素等,可以通过嗅黏膜进入大脑诱发神经系统的损伤。异生素可以直接渗入到OSNs 中导致病变,而OSNs又穿过筛状板投射到嗅球和其他下游大脑区域,使病变得以扩散到与疾病病理学相关的大脑区域,最终诱发神经退行性疾病[114]。根据这个假说,SARS-CoV-2 也可能通过侵入嗅觉系统进而影响“长新冠”患者的认知功能。有研究者推论,全球大范围的新冠蔓延将增加未来神经退行性疾病流行的风险[76,115]。
3.3.2 对心理健康的影响
长期嗅觉障碍患者由于抑郁、焦虑、进食相关问题和由此而来的日常生活困扰,生活质量较低,约70%出现嗅觉障碍的“长新冠”患者报告生活质量下降[116]。由于对食物的风味感知下降,87%的“长新冠”患者存在食欲不振[117];57%的患者无法检测到有害气体(如火灾、煤气泄漏和烟雾)[117],这增加了个体的安全风险。嗅觉减退的患者中报告患有抑郁症的比率高达43%[117];相比无嗅觉减退的“长新冠”患者,存在嗅觉减退的患者自杀意念和抑郁的瞬时风险高出30%[118]。综合来看,嗅觉障碍对生活质量和心理健康的影响相互交织,可形成恶性循环。
4 恢复和治疗
4.1 恢复
有些新冠患者会出现鼻塞的症状,导致气味传递受阻,嗅质无法接触到嗅上皮,暂时失去嗅觉。然而这种情况并不能代表嗅觉系统真的受到了破坏,当鼻塞导致的气味受阻解除后,嗅觉功能就会随之恢复。就像上文提到,大部分出现嗅觉障碍的新冠患者并不伴随鼻塞,而是嗅觉传导通路发生了障碍。嗅觉系统在整个生命周期中都具有可塑性,嗅上皮中的基底细胞及其固有层的嗅鞘细胞被认为是前体细胞或干细胞,能够实现OSNs和其他嗅上皮细胞的再生,促进嗅觉功能自发恢复。具体来讲,水平基底细胞可被某些转录因子激活,分化为球形基底细胞,进而分化为嗅上皮的OSNs和支持细胞等,促进嗅上皮的恢复。OSNs 的生长周期为30~90 d,而支持细胞的生长周期为4~8 d,因此新冠患者出现的嗅觉障碍大多数会在2~4周内自行康复[65,119]。但是仍有相当一部分人群无法自发恢复,需要治疗干预的手段。
4.2 治疗
4.2.1 嗅觉训练
Hummel 等[120]最 早 将 嗅 觉 训 练(olfactory training)用于改善嗅觉丧失患者的嗅觉功能,要求患者使用4 种嗅质(玫瑰、桉树、柠檬、丁香)训练,每种嗅质持续专注嗅闻10 s左右,早晚各闻一次,该法实施简单且无副作用。由于嗅上皮细胞独特的再生能力,在连续12 周的训练后,患者对嗅质的敏感性得到提升。
一般认为,基于嗅觉系统的可塑性,反复的气味暴露可使嗅质刺激嗅上皮及下游嗅觉皮质,从而增强神经元的突触连接,重塑嗅觉传导通路,并改善嗅觉功能[121-122]。Negoias等[123]发现对人类受试者偏侧化的嗅觉训练使训练侧及其对侧的嗅球体积均显著增加。Kollndorfer等[124]使用功能性磁共振成像(fMRI)分析了嗅觉丧失患者梨状皮质的功能网络,发现12 周的嗅觉训练使患者梨状皮质与大脑多个非嗅觉区之间无序的连接减弱,提示嗅觉训练诱导梨状皮质功能连接的重组。嗅觉训练也被发现能增加患者部分嗅觉相关脑区皮质的厚度或局部灰质体积[125]。
嗅觉训练的效果受患者年龄、性别、病程、治疗时间等因素影响,总体有效率为30%~50%[126]。嗅觉训练常被用于治疗与上呼吸道病毒感染、头部创伤相关的嗅觉障碍,也被用于改善老年人的嗅觉障碍。在嗅觉功能得到改善的同时,老年人的语言功能和主观幸福感也有所改善,抑郁症状有所减轻[127]。另外,嗅觉训练可能对神经退行性疾病相关的嗅觉减退也有效果[128]。影响嗅觉训练效果的因素很多,如嗅质浓度、分子质量大小、嗅质组合等,虽然相关研究结果不太一致,但可以肯定的是如果嗅觉训练持续时间越长,患者的依从性越好,嗅觉训练效果就更好。
作为一种新兴的非药物治疗方案,嗅觉训练在病毒感染后嗅觉障碍的治疗中显示出良好的前景。Lechien等[129]历时两年,对欧洲2020年3月至6月确诊COVID-19的患者进行嗅觉训练直到其完全恢复嗅觉,表明嗅觉训练在中长期恢复也具有积极影响,在感染后一年半随访时发现患者较高的客观嗅觉测试得分与坚持嗅觉训练显著相关。嗅觉训练对“长新冠”患者持续性嗅觉障碍的改善也可能是由于嗅质中具有生物活性的化学成分抑制了炎症,进而促进了嗅上皮的再生和嗅觉的恢复[98,130]。据此,研究者建议将有抗炎作用和对SARS-CoV-2有结合亲和力的化学成分作为训练材料,或许可以有效促进“长新冠”患者的嗅觉恢复[130]。
4.2.2 药物及其他治疗方法
文献报道的治疗嗅觉障碍的药物有许多,如糖皮质激素、维生素B、银杏叶提取物、维生素A滴鼻、卡罗维林、α硫辛酸、柠檬酸钠缓冲液、口服Omega-3补充剂等,但相关疗效并不十分确切,尤其对新冠相关的嗅觉障碍是否可以使用糖皮质激素治疗还存在争议[119]。嗅觉障碍的治疗首先应查明病因,如果由炎症刺激引起,患者可能需要服用抗生素,如果由鼻腔结构异常或局部病变引起,可能需要采取手术治疗。中医针灸也被用于治疗嗅觉障碍,但相关研究效果还待验证。
研究者们开发了一些新型治疗方法来促进新冠相关嗅觉障碍的恢复: 间充质干细胞(mesenchymal stem cells,MSC)可以通过分泌抗炎细胞因子和表达免疫调节表面蛋白来缓解免疫失调,嗅上皮中的支持细胞是唯一表达角蛋白K18(keratin-18)的细胞类型,在患者嗅上皮局部注射与K18结合的肽或抗体标记的间充质干细胞,可以维持间充质干细胞的保留率,减少患者嗅上皮炎症环境,加速嗅觉功能的恢复[99];富血小板血浆是自体全血经离心后得到的血小板浓缩物,含有大量生长因子及蛋白质,有研究者将其注射到新冠患者的嗅裂中,3个月后,患者的嗅觉辨别能力得到明显改善[131]。
另外,神经调控的方法正处在研究中。研究者发现成熟的OSNs 表达高水平的多巴胺D2 受体(DRD2),DRD2 作为一种抑制性G 蛋白偶联受体会抑制气味分子与受体结合的信号通路。小鼠嗅黏膜的局部多巴胺合成被药物抑制时嗅觉能力会增强,从而证实鼻腔中的多巴胺D2 受体可作为嗅觉调控的潜在外周靶点,靶向抑制鼻腔DRD2可能有助于治疗精神分裂症病人的嗅觉障碍[132]。
5 总结和展望
COVID-19 自爆发以来,以极快的速度在全球范围内流行扩散,对全人类的生活造成了巨大影响。嗅觉障碍作为其主要的神经症状,与SARSCoV-2感染情况存在密切关联,可以作为一项病毒感染早期的预测指标。目前各项研究报告的新冠患者中嗅觉障碍的发生率存在很大变异,且以主观报告方法计算的研究居多,准确发生率的确定需要更多采用客观测量的方法收集的样本数据。现阶段研究者关注更多的是嗅觉减退和嗅觉丧失,对嗅知觉异常(如嗅觉倒错和幻嗅)的研究较少,同时感染者特异性嗅觉丧失(指闻不到某种特定气味的现象)的发生率和气味种类的现象报告也并不全面。
关于SARS-CoV-2损伤嗅觉功能的机制,目前已经有大量研究从气流受阻(嗅裂炎症)、外周损伤(嗅上皮)和中枢损伤(嗅球及下游嗅觉通路)等角度进行探讨。尽管前文提及了关于SARSCoV-2可以通过嗅觉系统进入中枢的假说,但需要注意的是,这一观点仍存在争议[133],成熟OSNs不表达ACE2或TMPRSS2,SARS-CoV-2不大可能沿其轴突进入嗅球,未成熟的OSNs 虽可能被感染,但它们缺少向下游的轴突投射。在中枢存在的SARS-CoV-2 可能不是经由嗅神经,而是通过血管或脑脊液腔等途径进入中枢的。关于SARS-CoV-2入侵中枢神经系统的机制尚需更深入的研究。此外,SARS-CoV-2 的不同毒株入侵宿主的机制并不相同,由此导致嗅觉障碍的发生率和症状特点也不一样,但是目前将不同毒株纳入对比的研究较少,其发生率和机制的差异有待进一步的探索。
大部分人群在感染SARS-CoV-2后嗅觉功能都会在3个月内恢复,但仍有相当一部分患者会出现“长新冠”。目前关于“长新冠”患者持续性嗅觉障碍的机制假说,主要围绕在T细胞介导的长期炎症反应、基底细胞分化潜力受损和OSNs染色质重组等方面,亟需未来的实证研究进行支撑和验证。此外,对于“长新冠”患者持续性嗅觉障碍的机制是否涉及中枢神经系统仍存在争议[98]。在经历急性感染期的各种症状后,这些“长新冠”患者还要面对持续的嗅觉障碍、潜在的认知功能减退和心理健康问题。有研究者预计新冠患者的嗅觉障碍可能指向未来的神经退行性疾病,但这之中的因果关系尚未得到充分认识,仍需进一步的实证研究和追踪调查。
尽管目前有若干基于嗅觉训练或药物的手段对感染SARS-CoV-2 后出现嗅觉障碍的患者进行治疗,但是总体有效率还不理想,这可能和不同患者发生嗅觉障碍的机制不尽相同有关,未来治疗手段还需要更好的靶向性。此外,结合嗅觉训练和药物进行综合干预是否可进一步提升治疗效果也有待研究。
