工程化调节性T细胞调控机体免疫耐受及其生物医学应用*
2023-06-20郑思睿廖健洪黄遵楠郑明彬2蔡林涛
郑思睿 廖健洪 陈 泽 潘 宏 黄遵楠 郑明彬2,3) 蔡林涛
(1)广东医科大学药学院,东莞市计算机辅助药物设计重点实验室,东莞 523808;2)中国科学院深圳先进技术研究院,中国科学院深港生物材料联合实验室,广东省纳米医药重点实验室,深圳 518055;3)深圳市第三人民医院(南方科技大学第二附属医院),国家感染性疾病临床医学研究中心,肝病研究所,深圳 518112)
调节性T 细胞(Tregs)是一类具有显著免疫抑制功能的CD4+T 细胞亚群。Tregs 能够抑制效应T细胞、效应B细胞等免疫应答,诱导机体对抗原的免疫耐受,发挥免疫抑制功能[1]。主要机制包括:a. Tregs 通过分泌抑炎细胞因子,抑制效应细胞增殖活化[2-5];b. Tregs释放颗粒酶B诱导效应细胞凋亡,发挥细胞毒性作用[6];c. Tregs 干扰效应细胞代谢,抑制效应细胞增殖和杀伤作用[7];d. Tregs抑制树突状细胞(DC)成熟活化,阻断机体抗原呈递调节自身免疫[8-11](图1)。因此,Tregs 在介导免疫细胞增殖与代谢、维持免疫环境稳态中发挥着重要作用。
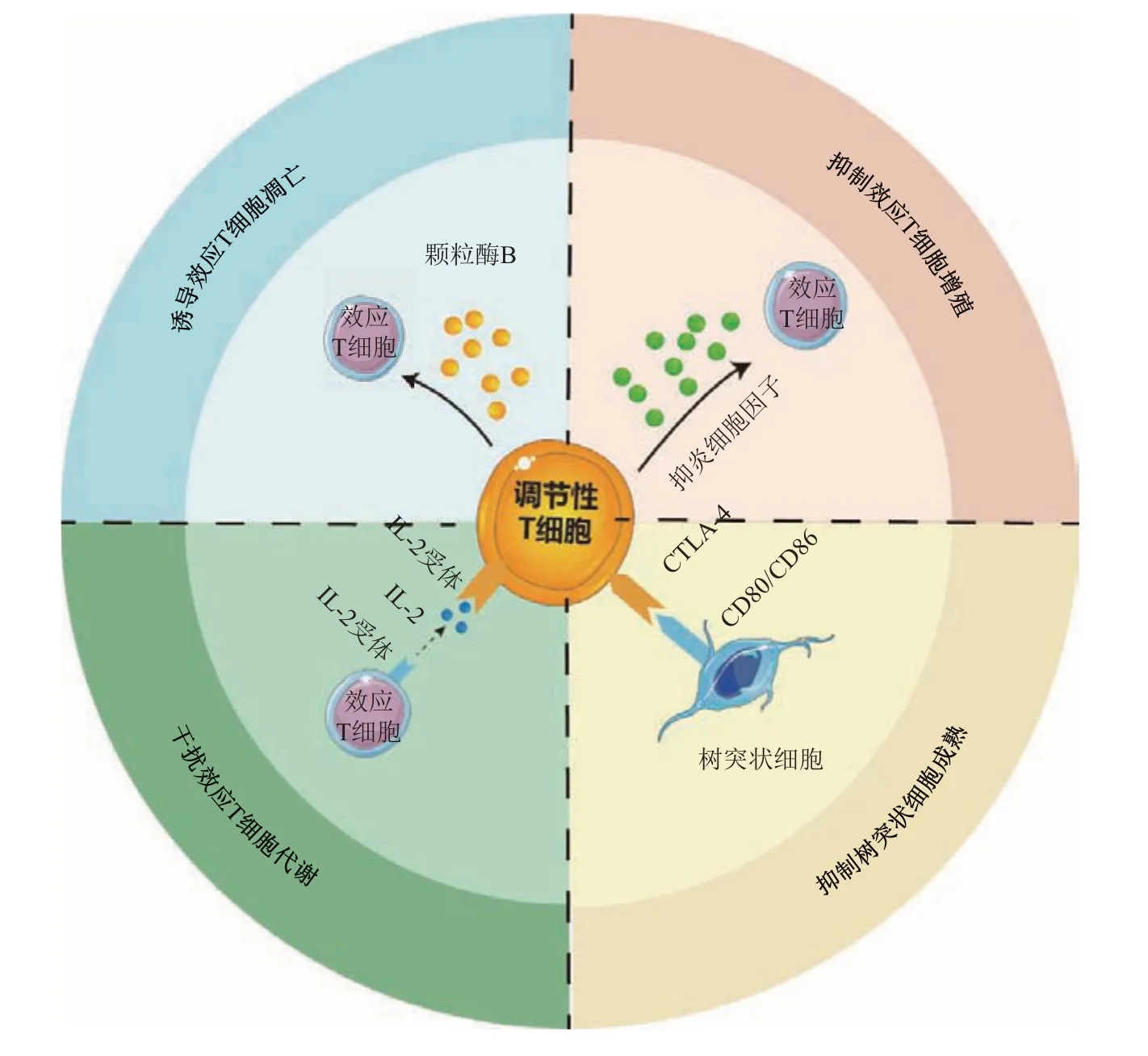
Fig. 1 Mechanism of Tregs-mediated systemic immune tolerance图1 Tregs介导机体免疫耐受的作用机制
Tregs 作为一类调节免疫细胞功能的T 细胞亚群,参与机体免疫稳态调节,目前已应用于多项临床实验研究。截至2022年,全球已有超过1 100项Tregs 临床试验,在肾脏或肝脏移植、系统性红斑狼疮、炎症性肠病、自身免疫性肝炎、过敏和哮喘、糖尿病等方面开展Tregs 治疗研究[12-13]。其中,在Tregs 疗法治疗肝移植患者研究中,输注Tregs 可在移植肝脏中富集,抑制移植肝脏中效应细胞的增殖活化,有效延长移植肝脏存活时间[14]。然而,Tregs 由于缺乏自身抗原特异性,难以识别病灶部位抗原靶点和定位至病灶部位,可导致机体免疫系统处于持续的免疫抑制状态,最终造成多器官累积毒性,增加病原体感染和恶性肿瘤发生风险[15-18]。此外,Tregs 在炎症环境中的表观遗传学特征不稳定,容易引起叉头盒蛋白p3(Foxp3)表达缺失,造成免疫调节功能丧失,最终导致临床试验失败[1,19]。因此,开发新型技术促进Treg 的增殖、局部富集以及稳定Tregs 免疫抑制功能,对于自身免疫疾病、器官移植术后排斥等炎症疾病临床治疗意义重大。
工程化改造Tregs 是实现Tregs 大量体外扩增并提高其靶向性和稳定性的关键解决策略。目前较为成熟的工程化改造技术分为生物工程化改造技术和材料工程化改造技术。生物工程化改造技术主要通过诱导Tregs 高表达组织特异性抗原受体包括T细胞受体、抗原嵌合受体以及趋化因子受体,可促进Tregs 对炎症组织表达的特定抗原(如血友病因子VIII、瓜氨酸波形蛋白)的精准识别并刺激Tregs活化,实现Tregs在靶器官的增殖和驻留,提高Tregs 病灶趋向能力,发挥精确的局部免疫调节效果[1];材料工程化改造技术主要利用生物活性材料构建药物储库,为Tregs 生长发育提供良好环境,利于Tregs 的体外扩增,同时定点缓释以稳定Tregs 在炎症环境中的免疫抑制功能。这些工程化改造技术用于增强Tregs的特异性和功能性, 使得自身免疫和移植后免疫排斥的Tregs 过继疗法得到快速的发展(图2)。
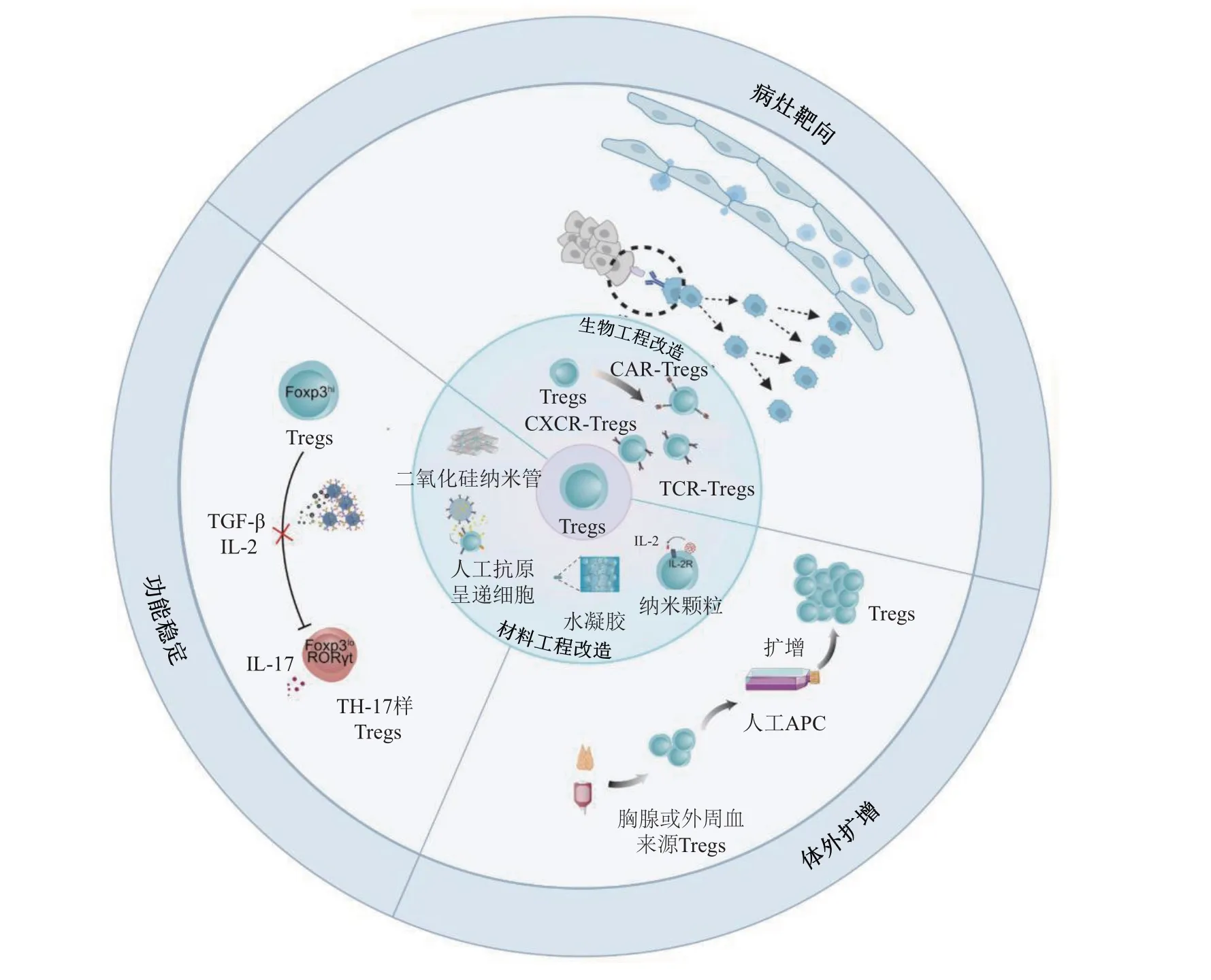
Fig. 2 Biological and material engineering strategies to empower Tregs immunotherapy图2 工程化改造赋能Tregs免疫治疗
1 工程化改造提升Tregs病灶靶向性
1.1 转导T细胞受体的Tregs(TCR-Tregs)疗法
TCR-Tregs 疗法是采用生物工程化改造技术,将抗原特异性TCR导入患者Tregs,进而提高Tregs特异性识别自体或异体抗原的能力,发挥抗原特异性抑制和非特异性旁观者抑制效应,降低炎症反应,从而形成局部免疫耐受微环境,因此被广泛用于自身免疫疾病及器官移植术后免疫排斥的治疗[19-20]。髓鞘碱性蛋白是中枢神经系统髓鞘中高表达的自身抗原,基于髓鞘碱性蛋白抗原设计的TCR-Tregs通过TCR识别髓鞘碱性蛋白抗原并靶向髓鞘,TCR 识别激活随后抑制髓鞘碱性蛋白特异性效应T 细胞的增殖和活化并分泌抑炎细胞因子,降低髓鞘炎症反应,有效保护髓鞘结构,最终延缓多发性硬化症疾病进展(临床前研究)[19]。谷氨酸脱羧酶是I 型糖尿病小鼠胰岛中效应T 细胞膜表面高表达的抗原,针对谷氨酸脱羧酶开发了一种特异性TCR-Tregs,通过识别胰岛中谷氨酸脱羧酶抗原靶向I型糖尿病小鼠胰岛,从而有效抑制胰岛中效应T细胞的增殖,保护胰岛β细胞功能,有效减少小鼠对外源胰岛素的依赖,有效延缓I型糖尿病进程(临床前研究)[20]。TCR-Tregs 利用对H-2Kd抗原特异性的TCR-Tregs治疗同种异体心脏移植术后免疫排斥,能够靶向识别异体移植心脏并诱导CD8+T细胞耗竭,减少心内膜增厚,显著延长异体移植心脏的存活时间(临床前研究)[21]。综上所述,TCR工程化的Tregs疗法利用TCR识别抗原特性,有效提高Tregs 的靶向性,从而极大缓解自身免疫疾病以及器官移植术后排斥。TCR-Tregs疗法存在亲和力低,依赖效应T 细胞分离抗原特异性TCR等挑战,进而限制其特异性和精准度。因此,需要探索更加精准的TCR-Tregs筛选方法,例如使用单克隆抗体高通量筛选、应用基因编辑技术、合成生物学等技术,提高其识别特异性和治疗精准度[1,22]。
1.2 嵌合抗原受体的Tregs(CAR-Tregs)疗法
CAR-Tregs 疗法是利用生物工程技术使Tregs细胞表达靶向炎症组织抗原的抗原嵌合受体,包括胞外结构域中抗原结合位点与胞内T细胞的共刺激分子。相较于TCR-Tregs,CAR-Tregs 的靶向识别过程不依赖传统的T细胞受体,通过绕过人类白细胞抗原(HLA)限制来提高CARs 的靶向灵活性,因此,CAR-Tregs在自身免疫疾病及器官移植术后免疫排斥中具有优良的治疗潜力(图3)[23-27]。瓜氨酸波形蛋白是一种大量存在于关节炎患者细胞外基质的抗原,针对氨酸波形蛋白开发了一种特异性的CAR-Tregs,CAR-Tregs 经静脉输注后靶向关节炎患者的关节腔,进而抑制效应T细胞引起的滑膜炎对关节软骨的破坏和骨侵蚀,达到缓解关节炎和阻断病程的目的(临床前研究)[25]。具有识别血友病因子VIII 抗原的CAR-Tregs 可有效抑制FVIII 特异性效应T细胞的增殖和促炎细胞因子产生,并发挥旁观者效应诱导机体产生免疫耐受,极大改善血友病患者的生存质量(临床前研究)[26]。靶向HLA-A2 抗原的CAR-Tregs 能够在胰岛中富集,减轻对异体移植胰岛的免疫排斥反应,延长胰岛存活时间[27]。靶向黑色素细胞表面标志物神经节苷脂D3(GD3)的CAR-Tregs 用于治疗白癜风,通过抗原响应分泌大量抑炎细胞因子白介素-10(IL-10),从而更好地抑制对黑色素细胞的效应T 细胞毒性,显著延迟黑色素脱失[28]。
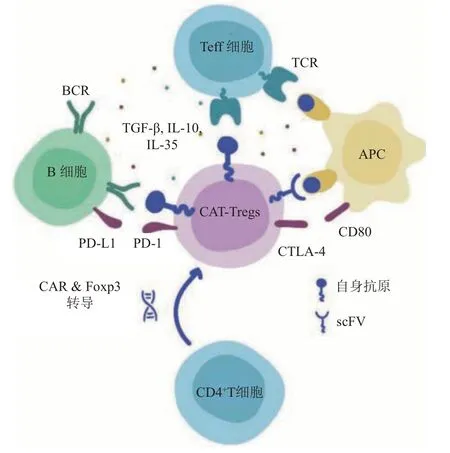
Fig. 3 The mechanism of CAR-Tregs-mediated immune tolerance图3 CAR-Tregs发挥免疫耐受的作用机制
因此,CAR-Tregs具有优异的靶向特性,有助于Tregs 靶向病灶部位形成免疫耐受微环境,降低炎症反应,在炎症疾病治疗方面具有突出优势。虽然CAR-Tregs已取得一些临床治疗成就,但该疗法可能引发细胞因子释放综合征(CRS)等严重急性毒性,且过度刺激Tregs 会导致细胞死亡,无法实现长效的免疫抑制作用。为此,需要通过优化CAR 结构,确保CAR-Tregs 在输注后的存活,并评估其安全性。
1.3 转导趋化因子受体的Tregs(CXCR-Tregs)疗法
趋化因子(chemokine) 及趋化因子受体(chemokine receptor)在介导细胞迁移、增殖过程中发挥重要作用,并与炎症的发生发展密切相关。研究表明,表达趋化因子受体3(CXCR3)的Tregs 细胞,可靶向进入多发性硬化症患者的大脑和I型糖尿病患者的胰岛,并在病灶处大量富集以发挥局部免疫耐受功能[29-32]。此外,研究表明预后良好的银屑病患者皮肤中存在大量表达趋化因子受体4 和皮肤淋巴细胞抗原(CLA)的Tregs[29]。因此,Tregs表面高表达趋化因子受体,可促进Tregs特异性靶向至炎症组织,并在炎症部位发挥抗原特异性免疫抑制和非特异性旁观者抑制效应,从而延缓炎症疾病进展,提高患者生存质量[30]。通过生物工程化改造技术过表达CX3CR 受体的CX3CR1-Tregs,可靶向特异性表达CX3CL1 的动脉粥样硬化血管,治疗4 周后大量CX3CR1-Tregs 富集在动脉粥样硬化血管内壁。CX3CR1-Tregs 选择性归巢可减缓斑块进展和减少脂质沉积,同时减少促炎巨噬细胞的浸润,增加胶原蛋白和平滑肌细胞含量,从而提高斑块稳定性,显著延缓动脉粥样硬化疾病进程(临床前研究)[31]。此外,在Tregs 体外扩增阶段,添加雷帕霉素、IL-2、IL-12、IFN-γ、rhIL-1β、rhIL-6、rhIL-23、TNF-α、维甲酸等促生长因子,可有效促进Tregs 细胞的体外扩增效率。其中,添加IL-2 可定向诱导Tregs 细胞高表达趋化因子受体7 和L 选择素,有利于Tregs 细胞借助趋化因子受体7响应趋化因子的化学浓度梯度并向外周组织迁移[32]。高表达趋化因子受体工程化的Tregs特异性靶向病灶部位,为Tregs用于炎症疾病治疗提供了新思路。尽管CXCR-Tregs 具有潜在的免疫调节效果,但其疗效受限于病灶的趋化因子表达水平及表达特异性。尽管CXCR-Tregs 具有潜在的免疫调节效果,但其疗效受限于病灶的趋化因子表达水平及表达特异性。因此,有必要进一步研究和筛选适当的趋化因子受体,以提高其治疗效果和准确性。在体外扩增过程中,可以通过向培养物中添加细胞因子、代谢物,或通过慢病毒转染等方式,诱导Tregs 高表达趋化因子受体,提高炎症组织靶向效率,并保持Tregs 的功能稳定性。将趋化因子受体与CAR 分子或TCR 分子结合,将能够进一步提高Tregs 的靶向识别能力,提升精准靶向治疗效果,规避脱靶风险[1](表1)。
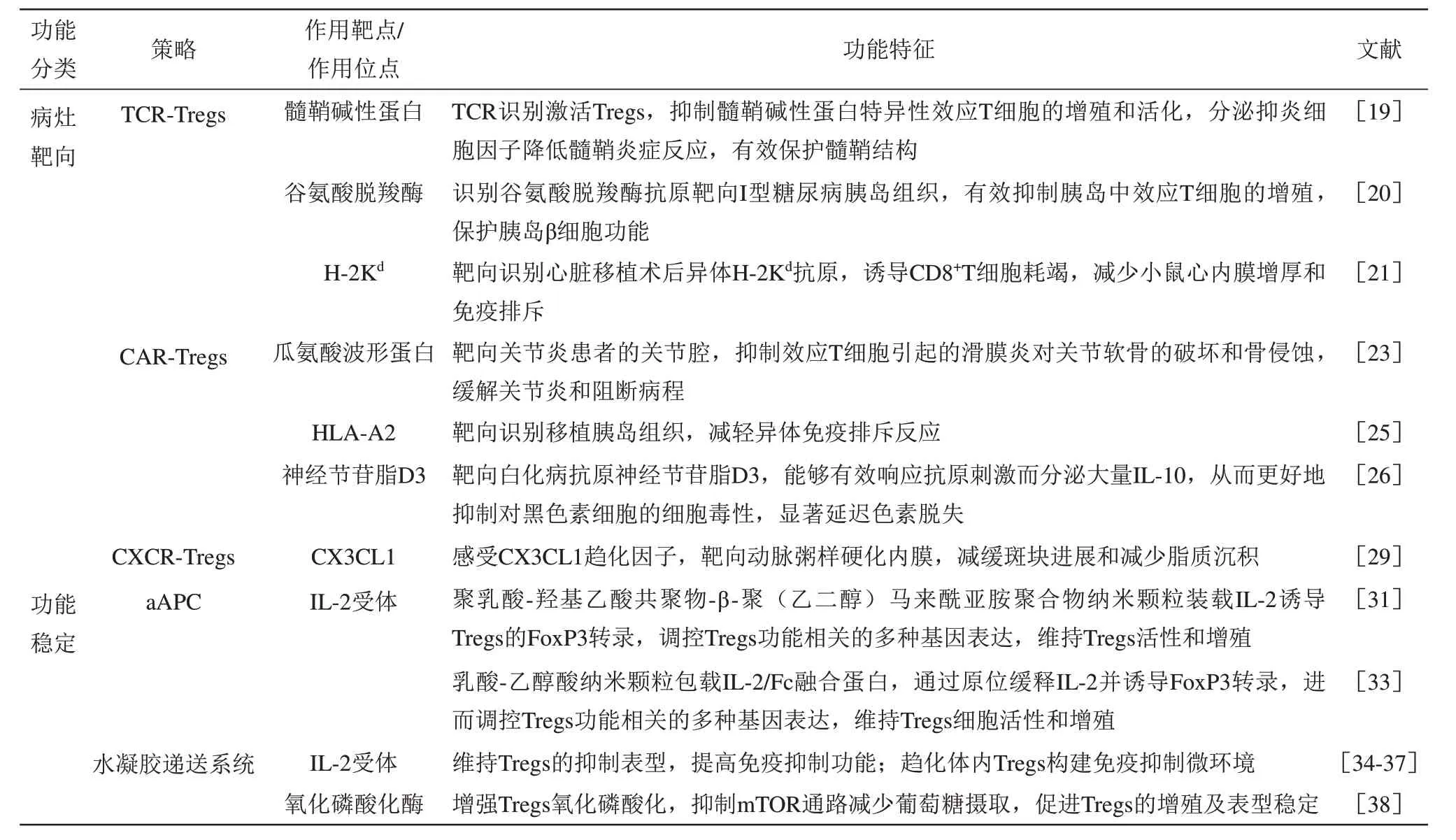
Table 1 The engineering strategies of Tregs表1 Tregs的工程改造策略
2 工程化改造增强Tregs功能稳定性
材料工程化改造技术为增强Tregs 稳定性提供了新的解决途径。目前研究热点主要集中于聚合物纳米颗粒和水凝胶,因其具有良好药物载体功能、生物降解后通过旁分泌的作用方式有效递送生物活性分子至Tregs,有助于Tregs Foxp3蛋白的稳定表达,从而稳定Tregs 细胞在炎症环境中的免疫抑制功能。
2.1 纳米材料赋能
聚合物纳米颗粒是一类以聚合物为基本骨架, 包载小分子药物、多肽、蛋白质或核酸等物质的一类纳米颗粒。聚合物负载于Tregs 表面,能够维持Tregs稳定及活化,有效发挥免疫耐受功能。在聚乳酸-羟基乙酸共聚物-b-聚(乙二醇)马来酰亚胺聚合物纳米颗粒装载Tregs 生长因子IL-2 和β细胞再生剂harmine,加入聚-L-赖氨酸(PLL)通过改变聚合物纳米颗粒表面电性,促进其与细胞的表面黏附,并且原位缓释IL-2 支持Tregs 活化,从而保持Tregs 表型稳定和生存能力(临床前研究)[33]。聚乳酸-羟基乙酸共聚物聚(β氨基酯)包封TGF-β,与Tregs 结合后持续释放细胞因子TGF-β,维持了Tregs 的去甲基化特征,有效提高Tregs 表面CD39 和CD73 表达量,从而增强了Tregs 的稳定性,抑制效应细胞成熟活化(临床前研究)[34]。聚乳酸-乙醇酸纳米颗粒包载IL-2/Fc 融合蛋白,通过原位缓释IL-2并诱导FoxP3转录,可促进Tregs 免疫调节功能相关的多种基因表达,维持Tregs 活性和增殖,最终有效抑制同种异体皮肤移植术后引起的免疫排斥反应,延长移植皮片存活时间(临床前研究)[35]。然而,随着Tregs 增殖分裂,用于激活Tregs 的纳米颗粒和细胞因子的有效浓度会逐渐降低,限制了纳米材料工程化Tregs 的活体应用。因此,如何延长纳米材料在体内的干预时间并维持Tregs 的长效性、功能稳定性,是纳米材料工程化Tregs 面临的瓶颈问题。亟需通过纳米材料的结构与性能优化,使纳米材料长效发挥作用,提高Tregs的长期治疗效果。
2.2 水凝胶包封
水凝胶在水中能够充分溶胀而不溶解,是一类具有三维网络结构的新型功能高分子材料。一方面,水凝胶与机体组织、细胞外基质非常相似,具有调节细胞生长、黏附迁移和分化等能力,极大保留细胞活性。此外,水凝胶具有良好的通透性,水及其水溶性小分子药物可以在水凝胶内部自由扩散,可维持Tregs 细胞免疫抑制功能稳定。另一方面具有良好的生物相容性。为移植细胞在体内增殖分化提供了良好的物理支持,是优良的细胞载体,在器官移植术后免疫排斥治疗等领域拥有广阔的应用前景(图4)[36]。聚乙二醇-降冰片烯(PEGNB)水凝胶搭载Tregs,可用于Tregs局部递送并在神经移植部位缓释(14 d)以延长机体免疫耐受时间,浸润在移植部位的Tregs 细胞有效抑制宿主免疫反应,最终用于修复神经节段性损伤、缓解术后免疫排斥并促进受体神经再生(临床前研究)[37]。利用海藻酸盐-明胶甲基丙烯酰水凝胶同时封装IL-2 和趋化因子配体1与Tregs,可维持Tregs 的抑制表型并提高免疫抑制功能,此外可趋化体内Tregs 进入该结构构建免疫抑制微环境,从而有效抑制胰岛移植术后免疫排斥和延长胰岛移植物存活时间(临床前研究)[38]。使用机械强度较高的聚丙烯酰胺水凝胶基质,能够增强Tregs 胞内氧化磷酸化,通过抑制雷帕霉素靶蛋白(mTOR)通路减少葡萄糖摄取促进Tregs表型稳定(临床前研究)[39]。
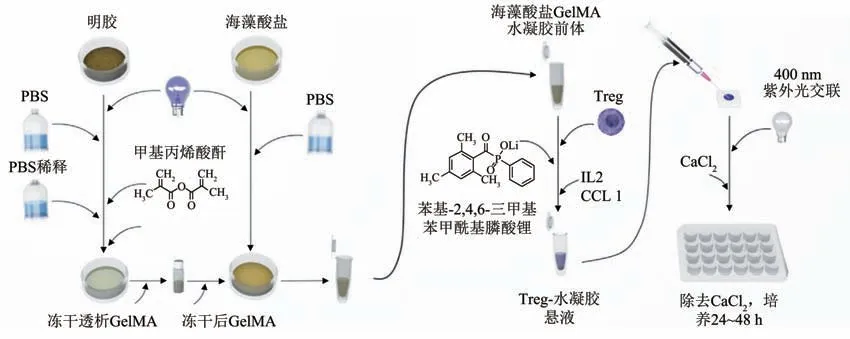
Fig. 4 Schematic showing the loading of Tregs using hydrogels图4 水凝胶负载Tregs流程示意图
因此,水凝胶作为优势活细胞药物载体,为细胞增殖和缓释提供了理想的微环境,可以长期维持Tregs 表型功能稳定,为同种异体器官移植术后免疫排斥等治疗提供新策略。然而,在复杂的体内环境中,物理交联型水凝胶会受到外部机械力和组织侵蚀的影响,丧失结构和功能完整性,同时还存在过敏和感染风险,限制了水凝胶活细胞工厂在体内环境中的应用。因此,优选体内生物相容性好、细胞负载能力强的水凝胶至关重要。基于超支化PEG基多酰肼交联剂(HB-PEG-HDZ)和醛化透明质酸(HA-CHO)开发的瞬凝型水凝胶系统,能够依靠动态键的自恢复性能,2 h 内即可将分割开的水凝胶自愈整合,为水凝胶包载药物及其Tregs 装载应用提供了生物相容性和自愈合稳定策略(临床前研究)[40]。
3 体外扩增技术提高Tregs产量
Tregs 在维持机体免疫耐受、预防自身免疫病及移植排斥中具有重要作用。但组织中分离获得的Tregs 数量无法满足临床需求,限制了其临床治疗应用[41]。因此,迫切需要开发新型体外快速扩增技术满足Tregs 回输治疗剂量,来解决临床治疗研究瓶颈。应用多种人工抗原提呈细胞(aAPC)将HLA-肽复合物及协同刺激分子、黏附分子的抗体或配体偶联在纳米材料载体表面,可有效促进Tregs扩增、分化、募集和递送,对于Tregs免疫过继疗法具有重要促进作用,并广泛用于自身免疫病及器官移植术后免疫排斥等炎症疾病的治疗[42]。
aAPC 根据所用载体不同,可分为刚性aAPC和非刚性aAPC。其中,刚性载体材料包括磁性微珠、纳米管,非刚性载体材料主要为聚合物类纳米材料。相较于非刚性载体材料,刚性载体材料形成的空间结构,利于Tregs 进入、移动和聚集,从而更利于Tregs 的体外扩增。二氧化硅纳米管通过沉降和随机堆积形成的空隙有利于T细胞进入、运动和团聚,同时表面脂质双分子层结合特定T细胞受体形成人工aAPC,进而提供激活信号促进特定T细胞增殖。聚乳酸-羟基乙酸共聚物纳米颗粒包载IL-2 和TGF-β,通过旁分泌方式作用至Tregs,促进Tregs增殖,使Tregs在5 d内体外扩增20倍,并表达归巢受体CD62L和CCR7,回输至小鼠体内最终延缓系统性红斑狼疮疾病的进展(临床前研究)[43]。相较于非刚性载体材料,刚性载体材料形成的空间结构,利于Tregs 进入、移动和聚集,从而更利于Tregs 的体外扩增。二氧化硅纳米管通过沉降和随机堆积形成的空隙有利于T细胞进入、运动和团聚,同时表面脂质双分子层结合特定T细胞受体形成人工aAPC,进而提供激活信号促进特定T 细胞增殖。单剂量APC-二氧化硅纳米管的,8 d扩增了3 200倍(临床前研究)[44]。目前,在Tregs体外扩增方面还存在特异性差、稳定性不佳、活化效率低、转染效率低等问题。为进一步优化Tregs治疗的效果,需要通过设计稳定的aAPC、调整aAPC 抗原类型和浓度、改用更高效的转染手段等方式,提高Tregs活化效率,改善Tregs的临床应用表现。使用表达CD86 抗体的K562 细胞作为骨架细胞,并将移植同种抗原(Bw6) 特异性的CAR转导到K562细胞中构建成aAPC,Tregs在aAPC刺激下能够保留FoxP3、Helios 和 CAR 的表达,数量扩增10倍[45]。
4 总 结
Tregs 是一类机体维持免疫稳态功能的T 淋巴细胞亚群,利用自身的驱动力和生物学特性穿透多重生理屏障并在病灶部位富集,从而极大程度地提升自身免疫疾病和器官移植术后患者的生活质量。本文综述了近年来多种基因和材料工程化改造细胞策略用来提高Tregs 的靶向性和稳定性,并被应用到自身免疫疾病及器官移植术后排斥等炎症疾病的临床治疗中。生物工程化改造技术通过赋予Tregs抗原特异性有效提高Tregs 的靶向性,减少免疫反应对自体或异体来源组织的损伤。材料工程化改造技术能够维持Tregs的稳定性,为Tregs生长发育提供良好环境,同时缓释药物以稳定Tregs 功能。工程化改造策略在Tregs 药物递送和个体化精准治疗等方面具有重大意义,为自身免疫疾病和器官移植术后排斥治疗提供了有效解决方案。
虽然生物与材料工程化改造策略在提高Tregs靶向性及维持其功能稳定性方面取得一定进展,但在临床应用中仍面临诸多挑战。针对类风湿关节炎、系统性红斑狼疮、移植物抗宿主病等自身免疫性疾病和器官移植术后排斥的临床治疗需求,科研人员在从事Tregs 的基础和应用基础研究中,需要从病灶靶向、功能稳定和体外扩增技术三方面协同入手:a. 优化组织特异性抗原受体结构,提升Tregs 的病灶靶向和特异识别性能;b. 优化生物活性材料的理化性质,结构性能和提高生物安全性,促进Tregs免疫调节功能的长效维持;c. 提高Tregs的分选纯度,提升Tregs扩增效率,实现Tregs体外扩增技术的标准化和一致性。
为此,可通过以下具体的技术手段优化Tregs功能:a. 未来亟需使用单克隆抗体高通量筛选、基因编辑等技术,优化组织特异性抗原受体的分子结构,延长工程化Tregs的细胞寿命并减少脱靶毒性,提高治疗效果;b. 通过物理包裹或化学改性策略,筛选优化生物活性材料体系,提高Tregs 免疫功能的稳定性和治疗安全性;c. 开展充分的临床前和临床研究,系统解析Tregs 的活体生物分布、生物安全性和治疗应用场景等,加快自身免疫性疾病和器官移植术后排斥等疾病的临床应用;d. 结合磁性细胞分选技术和活细胞分选技术,获得高纯度的Tregs,探索新型培养基与生长因子配比,提高体外扩增Tregs的纯度和扩增效率,提高Tregs细胞治疗的稳定性和安全性。综上所述,生物医学工程化改造技术的整合,使智能Tregs 活细胞药物保护机体免受炎症侵害的临床治疗目标更近一步。
