莱菔子中2 个新的含硫衍生物
2023-06-08杨佩雯张培良韩竹箴杨颖博
杨佩雯,张培良,2,韩竹箴,杨颖博,3,吴 弢*
1. 上海中医药大学中药研究所,上海 201203
2. 安徽中医药大学药学院,安徽 合肥 230012
3. 上海图锋医药科技有限公司,上海 201203
莱菔子RaphaniSemen是十字花科植物萝卜RaphanussativusL. 的干燥成熟种子,收录于《中国药典》2020 年版一部,具有消食除胀和降气化痰的功效,临床常用于治疗消化系统疾病和高血压等[1-3]。目前从莱菔子中分离纯化、鉴定的化合物主要为硫苷及其降解产物、生物碱、苯丙素及其衍生物、黄酮、萜类、甾体等[4]。现代药理研究表明,莱菔子中的水溶性生物碱能够降低自发性高血压大鼠的血压[5],芥子碱可显著调节高脂血症大鼠的血脂水平[6],莱菔苷能够促进大鼠离体回肠的运动[7],莱菔素能够抑制人乳腺癌细胞的增殖[8]和脂肪细胞的分化[9],莱菔硫烷可通过促进白色脂肪细胞的褐变而减少肥胖小鼠的脂质累积[10]。
为了从莱菔子中寻找更多具有降脂活性的化合物,本研究从莱菔子70%乙醇提取物中分离、纯化、鉴定了14 个化合物,分别为降莱菔硫代酸乙酯(ethyl norsulforaphanate,1)、莱菔酸甲酯(methyl raphanide,2)、芥子碱(sinapine,3)、(E)-2-(4-hydroxy-2-oxoindolin-3-ylidene)acetonitrile(4)、2-(4-hydroxy-2-oxoindolin-3-yl)acetonitrile(5)、6-methoxyindole-3-carboxylic acidO-β-Dglucopyranosyl ester(6)、cappariloside A(7)、3′,6-二芥子酰基蔗糖(3′,6-disinapoyl sucrose,8)、吐叶醇(vomifoliol,9)、3,4-二羟基苯甲醛(3,4-dihydroxybenzaldehyde,10)、3, 4-二羟基苯甲酸(3,4-dihydroxybenzoic acid,11)、5-羟甲基糠醛(5-hydroxy methylfurfural,12)、2-羟甲基-5-呋喃丙烯酸乙酯(2-hydroxymethyl-5-furanacrylic acid ethyl ester,13)和β-谷甾醇(β-sitosterol,14),结构见图1。其中化合物1 和2 为新化合物,4、6、10、11 和13 为首次从莱菔子中分离得到的化合物。此外,通过3T3-L1 前脂肪细胞的胰岛素抵抗模型对新化合物1和2 进行了体外调脂活性筛选。结果表明,化合物1和2 均具有潜在的调脂活性,化合物1 较化合物2 在5、10 μmol/L 下显示出更好的调脂活性。本研究为充分开发和利用莱菔子提供了一定的理论依据。
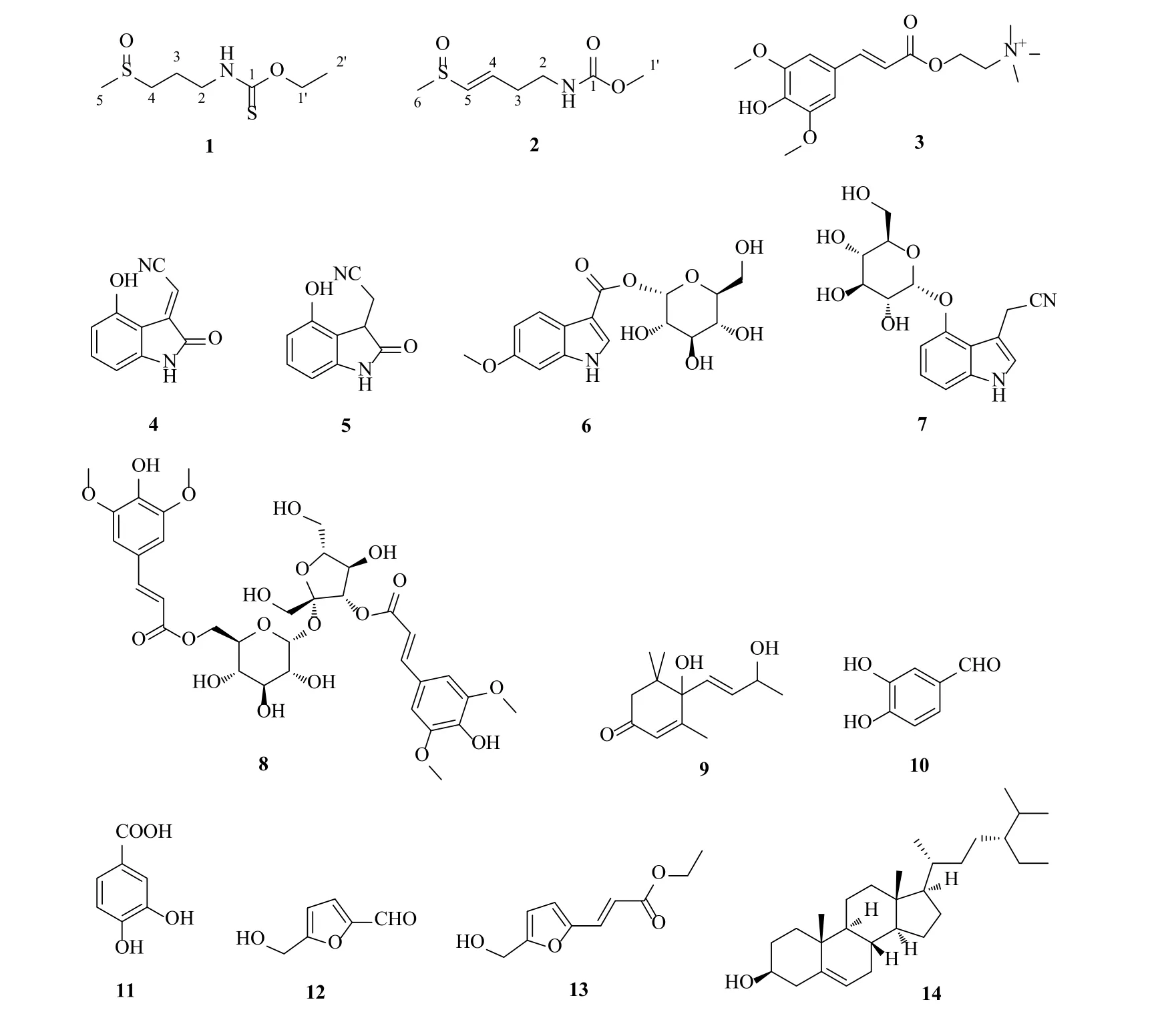
图1 化合物1~14 的结构Fig. 1 Structures of compounds 1—14
1 仪器与材料
Bruker AVANCE III 400 MHz 核磁共振波谱仪(瑞士Bruker 公司);6545 四极杆飞行时间液质联用系统(美国Agilent 公司);LC-3000 型高效液相色谱仪(北京创新通恒科技有限公司);Capcell Pak C18MG II 制备液相色谱柱(250 mm×20 mm,5 μm,日本资生堂公司);Sepacore 型中低压制备色谱仪(瑞士BUICHI 公司);BSA124S-CW 型电子天平(北京赛多利斯科学仪器有限公司);Spectrum Two 型红外光谱仪(美国PerkinElmer 公司);TU-1901 型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);MILLPORE 型Milli-Q 纯水仪(美国Bedford 公司);BB150 型CO2恒温箱(赛默飞世尔科技有限公司);SYNERGY H4 型全功能酶标仪(美国BioTek 公司);IX2 型全内反射荧光显微镜(日本OLYMPUS 公司);CKX41 型生物显微镜(日本OLYMPUS 公司);GENESPEED416 型低速离心机(基因有限公司);100~200、200~300、300~400目硅胶(青岛海洋化工厂分厂);GF254薄层色谱硅胶板(烟台江友硅胶开发有限公司);制备纯乙腈(上海泰坦科技股份有限公司);二氯甲烷、甲醇、乙醇、醋酸乙酯、EDTA、MgSO4、NaHCO3(分析纯,国药集团化学试剂有限公司);DMSO(翌圣生物科技有限公司);胎牛血清、双抗、胰蛋白酶(美国Gibco公司);PBS 缓冲液、DMEM 高糖培养基、CCK-8试剂盒(大连美仑生物技术有限公司);3-异丁基-1-甲基黄嘌呤(STBF2497V,质量分数≥99%,美国Sigma-Aldrich 公司);地塞米松(S12HS194411,质量分数≥99%)、牛胰岛素(J16HS187861,27 U/mg)、罗格列酮(W28D11H135759,质量分数≥98%)、尼罗红染料(M18HS175211,BR,质量分数≥98%)、洛伐他汀(批号A07HS190930,质量分数≥98%)均购自上海源叶生物科技有限公司。
3T3-L1 小鼠脂肪前体细胞购自中国科学院上海细胞库。
莱菔子药材(50 kg)2020 年11 月购买于安徽亳州市,由上海中药标准化研究中心吴立宏研究员鉴定为十字花科植物萝卜R.sativusL.的干燥成熟种子,标本凭证(lfz.202011)保存于上海中医药大学中药研究所标本室。
2 提取与分离
称取莱菔子药材50 kg,粉碎,用70%乙醇水溶液冷浸提取,提取料液比1∶4,共提取5 次。50 ℃减压回收试剂,得到总提取物浸膏质量约7438 g。取7398 g 总浸膏加8 L 水混悬,用8 L 醋酸乙酯分别萃取3 次,收集水部位和醋酸乙酯部位,低温减压浓缩得到水部位浸膏(7038 g)和醋酸乙酯部位浸膏(360 g)。取320 g 醋酸乙酯部位浸膏经硅胶柱色谱分离,石油醚-醋酸乙酯(20∶1、10∶1、5∶1、1∶1、0∶1)以及二氯甲烷-甲醇(100∶1、80∶1、60∶1、40∶1、20∶1、10∶1、5∶1、0∶1)梯度洗脱,收集组分Fr. A~I。Fr. B 放置过夜后,析出晶体,得到化合物14(20 mg)。Fr. E 经闪柱色谱,用二氯甲烷-甲醇(100∶0、80∶1、60∶1、50∶1和0∶100)梯度洗脱,得到组分Fr. E1~5。Fr. E1经ODS 反相色谱柱色谱,用甲醇-水(2∶8、3∶8、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1、10∶0)梯度洗脱,得到化合物12(2 mg)。Fr. F 经ODS 反相色谱柱色谱,用甲醇-水(1∶9、2∶8、3∶8、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1、10∶0)梯度洗脱,得到组分Fr. F1~4,Fr. F4 经Sephadex LH-20 凝胶柱色谱,用石油醚-二氯甲烷-甲醇(5∶5∶1)等度洗脱,得到组分Fr. F4-1~F4-4。Fr. F4-3 用半制备高效液相纯化得到化合物1(4 mg,tR=22 min,乙腈-水20∶80,8 mL/min)和9(8 mg,tR=30 min,乙腈-水20∶80,8 mL/min)。组分Fr. F3 经硅胶柱色谱,用二氯甲烷-甲醇(100∶0、100∶1、80∶1、60∶1、40∶1、20∶1、10∶1、5∶1、0∶1)梯度洗脱,得到组分Fr. F3-1~F3-2。组分Fr. F3-1 用半制备高效液相纯化得到化合物5(2 mg,tR=21 min,乙腈-水15∶85,8 mL/min)和化合物10(5 mg,tR=22 min,乙腈-水15∶85,8 mL/min)。组分Fr. F2经凝胶柱色谱,甲醇为洗脱剂,得到组分Fr. F2-1~F2-3。组分Fr. F2-3 用半制备型高效液相纯化得到化合物4(2 mg,tR=35 min,乙腈-水20∶80,8 mL/min)。Fr. G 经ODS 反相色谱柱色谱,用甲醇-水(2∶8、3∶8、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1、10∶0)梯度洗脱,得到组分Fr. G1~G10。组分Fr. G1 经硅胶柱色谱,用二氯甲烷-甲醇(100∶0、80∶1、60∶1、40∶1、30∶1)梯度洗脱,得到Fr. G1-1~G1-3。Fr. G1-2 用半制备型高效液相纯化得到化合物2(14 mg,tR=17 min,乙腈-水20∶80,8 mL/min)和11(29 mg,tR=16 min,乙腈-水13∶87,8 mL/min)。组分Fr. G4 经70%甲醇凝胶柱分离后,用半制备型高效液相纯化得到化合物13(2 mg,tR=36 min,乙腈-水27∶73,8 mL/min)。Fr. H经ODS 反相色谱柱分离,用甲醇-水(2∶8、3∶8、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1、10∶0)梯度洗脱,得到组分Fr. H1~4。组分Fr. H1 经硅胶柱色谱分离,采用醋酸乙酯-甲醇(100∶0、80∶1、60∶1、40∶1、15∶1)梯度洗脱,得到Fr. H1-1~H1-3。组分 Fr. H1-1 经凝胶柱分离,得到 Fr.H1-1-1~H1-1-4。Fr. H1-1-4 用半制备型高效液相纯化,得到化合物7(3 mg,tR=21 min,乙腈-水17∶83,8 mL/min)。组分Fr. H2 经硅胶柱分离,采用醋酸乙酯-甲醇(100∶0、80∶1、60∶1、40∶1、15∶1)体系洗脱,得到Fr. H2-1~H2-2。Fr. H2-2经制备型高效液相纯化得到化合物6(4 mg,tR=32 min,乙腈-水15∶85,8 mL/min)。Fr. H4 经薄层制备,得到化合物8(5 mg)。取50 g 水部位浸膏,经过反复硅胶柱色谱、凝胶柱色谱、制备液相色谱纯化得到化合物3(19 mg)。
3 结构鉴定
化合物1:无色油状物;HR-ESI-MSm/z232.044 4[M+Na]+(计算值为232.043 6,C7H15NNaO2S2),得到分子式为 C7H15NO2S2,不饱和度为 2。(nm): 244 (0.2);IR 光谱显示有S=O (1007 cm-1)、C=S (1193 cm-1) 等官能团的特征吸收峰。1H-NMR 谱(表1)中,在δH2.64 (3H, s, H-5) 处为1 个甲基亚磺酰基氢信号,在δH3.64 (2H, td,J= 6.8,1.6 Hz, H-2)、2.84 (2H, m, H-4)、2.04 (2H, m, H-3) 处是3 个亚甲基氢信号;由13C-NMR 谱和DEPT 谱可知,在δC192.4 (C-1) 处有1 个氨基硫代甲酸酯的季碳信号,在δC52.3 (C-4)、44.5 (C-2)、23.1 (C-3) 处有3 个亚甲基碳信号,在δC38.2 (C-5) 处有1 个甲基亚磺酰基碳信号。以上核磁共振数据与文献报道的Iberin[11]部分相似,两者可能都有1 个3-(甲基亚磺酰基)丙基,但化合物1 的相对分子质量较Iberin多46,推测化合物1 可能比Iberin 多1 个-CH2OCH3或-OCH2CH3片段。根据1H-NMR 谱中δH4.44 (2H,q,J= 7.1 Hz, H-1′) 和1.29 (3H, t,J= 7.1 Hz, H-2′)处的氢信号和13C-NMR 谱中δC66.9 (C-1′) 和δC14.7 (C-2′) 处的碳信号,可判断化合物1 较Iberin多1 个-OCH2CH3片段。为了进一步解析化合物1的结构,分析1H-1H COSY 谱(图2)可知,δH4.44(2H, q,J= 7.1 Hz, H-1′)/1.29 (3H, t,J= 7.1 Hz,H-2′) 相关,以及δH3.64 (2H, td,J= 6.8, 1.6 Hz,H-2)/2.04 (2H, m, H-3)/2.84 (2H, m, H-4) 相关,分别构成两个自旋偶合片段。结合HMBC 谱中H-4 (δH2.84) 与C-5 (δC38.2) 的远程相关,说明化合物1 存在1 个3-(甲基亚磺酰基)丙基。经查阅SciFinder 数据库,确定化合物1 为新化合物,并命名为降莱菔硫代酸乙酯。

图2 化合物1 和2 的关键1H-1H COSY () 与HMBC相关 ()Fig. 2 Key 1H-1H COSY () and HMBC ()correlations of compounds 1 and 2
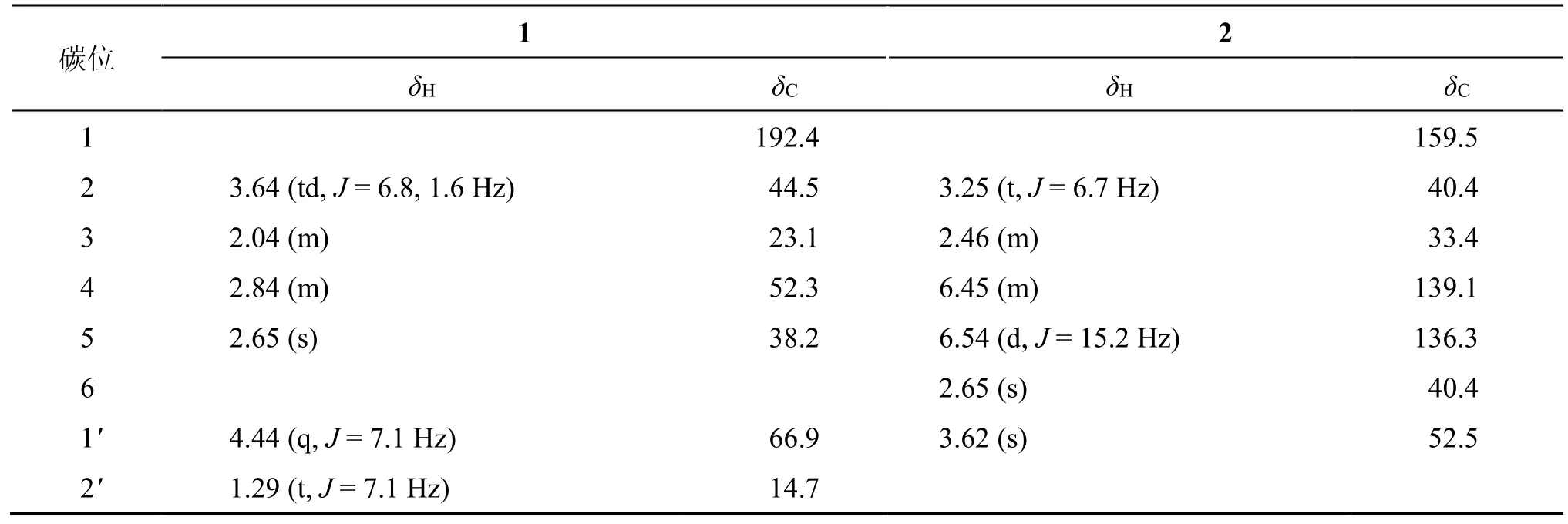
表1 化合物1 和2 的1H-NMR (400 MHz, CD3OD) 和 13C-NMR (100 MHz, CD3OD) 数据Table 1 1H-NMR (400 MHz, CD3OD) and 13C-NMR (100 MHz, CD3OD) data of 1 and 2
化合物2:无色油状物;HR-ESI-MSm/z214.051 7[M+Na]+(计算值为214.050 8,C7H13NNaO3S),得到分子式为 C7H13NO3S,不饱和度为 3。(nm): 207 (0.2);IR 光谱显示有S=O (1015 cm-1)、C=O (1699 cm-1) 等官能团的特征吸收峰。1H-NMR 谱(表1)中,在δH6.45 (1H, m, H-4) 和6.54 (1H, d,J= 15.2 Hz, H-5) 处有1 组反式双键氢信号,在δH3.25 (2H, t,J= 6.7 Hz, H-2) 和2.46 (2H,m, H-3) 处为2 组亚甲基氢信号,在δH3.62 (3H, s,-OCH3) 处有1 个氧甲基氢信号,在δH2.60 (3H, s,H-6) 处为甲基亚磺酰基团中的氢信号。由13C-NMR谱和DEPT 谱可知,在δC159.5 (C-1) 处有1 个酰胺的羰基碳信号,在δC139.0 (C-4)、 136.3 (C-5) 处为1 组双键的烯碳信号,在δC33.4 (C-3)、40.4 (C-2)处有2 个亚甲基碳信号,在δC52.5 (C-1′) 处有1 个氧甲基碳信号,在δC40.4 (C-6) 处有1 个甲基亚磺酰基碳信号。以上 NMR 数据与 methyl-(E)-5-(methylsulfinyl) pent-4-enoate[12]的非常相似,推测两者都有1 个4-(甲基亚磺酰基)-3-烯丁基团,但化合物2 的相对分子质量比上述已知化合物多15,推测化合物2 中可能有1 个-NH-片段。为了进一步解析化合物1 的结构,分析1H-1H COSY 谱(图2)可知,δH3.25 (H-2)/δH2.46 (H-3)/δH6.45 (H-4)/δH6.54(H-5) 相关,构成1 个自旋偶合系统。此外,HMBC谱中,H-6 (δH2.60) 与C-5 (δC136.3) 相关,判断化合物2 有1 个4-(甲基亚磺酰基)-3-烯丁基。比较两者碳谱中对应位置的化学位移,发现化合物2 的C-2向低场位移了7.9 个化学位移,且HMBC 谱中C-1(δC159.5) 与H-2 (δH3.25) 具有远程相关,说明C-1通过N原子与4-(甲基亚磺酰基)-3-烯丁基相连。经查阅SciFinder 数据库,确定化合物2 为新化合物,并命名为莱菔酸甲酯。
化合物1 和2 均为甲硫氨酸的衍生物,但两者的生成途径不同。莱菔子中的脂肪族硫苷Glucoiberin 在黑芥子酶的作用下,先被降解为中间产物thiohydroximate-O-sulfonate,随后通过罗森重排生成异硫氰酸酯Iberin。因为异硫氰酸酯中有一个亲电性很强的碳原子,所以异硫氰酸酯很可能与亲核试剂(乙醇)发生反应从而生成化合物1[13-14]。而化合物2 则可能是直接经过甲硫氨酸的侧链延长,生成醛肟,然后通过贝克曼重排、氧化以及GRS1酶催化脱氢而生成的[14-15](图3)。根据生成途径推测,化合物1 为异硫氰酸酯和乙醇的人工产物,而化合物2 的生成途径不涉及甲醇、乙醇等试剂,所以化合物2 不是人工产物。
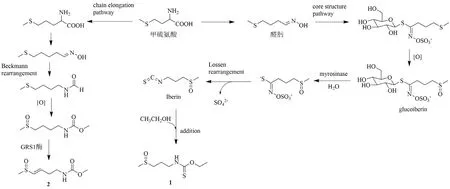
图3 化合物1 和2 可能的生成途径Fig. 3 Possible produced pathways of compounds 1 and 2
化合物3:黄色油状物;分子式C16H24NO5;ESI-MSm/z310 [M]+;碘化铋钾试液显橘红色,1H-NMR (400 MHz, CD3OD)δ: 7.68 (1H, d,J= 15.9 Hz, H-7), 6.96 (2H, s, H-2, 6), 6.48 (1H, d,J= 15.9 Hz, H-8), 4.67 (2H, m, H-10), 3.89 (6H, s, 2×-OCH3), 3.83 (2H, s, H-11), 3.30 (9H, s, 3×-NCH3),以上波谱数据与文献数据基本一致[16],并且与芥子碱对照品薄层行为一致,鉴定化合物3 为芥子碱。
化合物4:淡黄色粉末;分子式C10H6N2O3;ESI-MSm/z209 [M+Na]+;1H-NMR (400 MHz,CD3OD)δ: 7.16 (1H, m, H-6), 6.52 (1H, s, H-2), 6.47(1H, d,J= 8.4 Hz, H-5), 6.34 (1H, d,J= 7.6 Hz,H-7);13C-NMR (100 MHz, CD3OD)δ: 167.3 (C-9),158.6 (C-4), 145.2 (C-7a), 144.9 (C-3), 135.7 (C-6),117.1 (C-1), 109.2 (C-5), 102.6 (C-7), 97.1 (C-2)。以上波谱数据与文献数据基本一致[17],鉴定化合物4 为(E)-2-(4-hydroxy-2-oxoindolin-3-ylidene) acetonitrile。
化合物5:淡黄色粉末;分子式C10H8N2O2;ESI-MSm/z187 [M-H]-;1H-NMR (400 MHz,CD3OD)δ: 7.09 (1H, t,J= 8.0 Hz, H-6), 6.51 (1H, d,J= 8.3 Hz, H-7), 6.45 (1H, d,J= 7.6 Hz, H-5), 3.30(1H, m, H-3), 3.18 (2H, m, H-2);13C-NMR (100 MHz, CD3OD)δ: 179.4 (C-9), 155.7 (C-4), 145.2(C-7a), 131.3 (C-6), 118.1 (C-1), 111.1 (C-5), 103.0(C-7), 41.9 (C-3), 17.4 (C-2)。以上波谱数据与文献数据基本一致[17],鉴定化合物5 为2,3-dihydro-4-hydroxy-2-oxo-1H-indole-3-acetonitrile。
化合物6:无色油状物;分子式C16H19NO8;ESI-MSm/z352 [M-H]-;1H-NMR (400 MHz,CD3OD)δ: 3.56~3.40 (4H, m, H-2′~5′), 3.71 (1H,dd,J= 12.1, 4.7 Hz, H-6′b), 3.83 (3H, s, -OCH3), 3.87(1H, dd,J= 12.2, 2.0 Hz, H-6′a), 5.72 (1H, d,J= 7.8 Hz, H-1′), 6.86 (1H, dd,J= 8.8, 2.3 Hz, H-5), 6.97(1H, d,J= 2.2 Hz, H-7), 7.94 (1H, d,J= 8.0 Hz, H-4),7.95 (1H, s, H-2);13C-NMR (100 MHz, CD3OD)δ:165.7 (C-8), 158.5 (C-6), 139.0 (C-7a), 133.2 (C-2),122.6 (C-4), 121.5 (C-3a), 112.8 (C-5), 107.6 (C-3),96.0 (C-7), 95.3 (C-1′), 78.8 (C-5′), 78.3 (C-3′), 74.2(C-2′), 71.2 (C-4′), 62.4 (C-6′), 55.9 (-OCH3)。以上波谱数据与文献数据基本一致[18],鉴定化合物6 为6-methoxyindole-3-carboxylic acidO-β-D-glucopyranosyl ester。
化合物7:淡黄色油状物;分子式C16H18N2O6;ESI-MSm/z333 [M-H]-;1H-NMR (400 MHz,CD3OD)δ: 3.53~3.42 (3H, m, H-2′~4′), 3.60 (1H,dd,J= 8.7, 7.7 Hz, H-5′), 3.72 (1H, dd,J= 12.0, 4.8 Hz, H-6′b), 3.90 (1H, dd,J= 12.1, 1.9 Hz, H-6′a),4.19 (2H, d,J= 3.0 Hz, H-8), 5.09 (1H, d,J= 7.8 Hz,H-1′), 6.80~6.75 (1H, m, H-7), 7.05 (2H, m, H-6, 8),7.13 (1H, s, H-2);13C-NMR (100 MHz, CD3OD)δ:153.1 (C-4), 140.0 (C-7a), 124.0 (C-2), 123.6 (C-6),121.3 (C-3a), 118.4 (C-9), 107.4 (C-7), 105.3 (C-5),104.8 (C-3), 102.5 (C-1′), 78.4 (C-5′), 78.2 (C-3′),75.2 (C-2′), 71.4 (C-4′), 62.5 (C-6′), 16.2 (C-8)。以上波谱数据与文献数据基本一致[19],鉴定化合物7 为cappariloside A。
化合物8:淡黄色粉末;分子式C34H42O19;ESI-MSm/z753 [M-H]-;1H-NMR (400 MHz,DMSO-d6)δ: 7.61 (1H, d,J= 15.8 Hz, H-3"), 7.55(1H, d,J= 15.8 Hz, H-3"′), 7.02 (2H, s, H-5", 9"),7.01 (2H, s, H-5"′, 9"′), 6.54 (1H, m, H-2"), 6.50 (1H,d,J= 15.9 Hz, H-2"′), 5.60 (1H, d,J= 6.4 Hz, H-1),5.37~5.44 (2H, m, H-3′, 4′), 5.30 (1H, d,J= 3.6 Hz,4-OH), 5.25 (1H, d,J= 5.8 Hz, 2-OH), 4.98 (1H, d,J= 5.0 Hz, 3-OH), 4.90 (1H, t,J= 6.3 Hz, 1′-OH),4.69 (1H, t,J= 5.7 Hz, 6′-OH), 4.46 (1H, d,J= 10.8 Hz, 4′-OH), 4.01~4.31 (4H, m, H-6, 1′a, 5′), 3.80(6H, s, 6", 8"-OCH3), 3.78 (6H, s, 6"′, 8"′-OCH3),3.57~3.74 (2H, m, H-6′a, 1′b), 3.48 (1H, dt,J= 9.1,4.5 Hz, H-6′b), 3.26 ~3.42 (3H, m, H-2~4);13C-NMR (100 MHz, DMSO-d6)δ: 166.7 (C-1"′),165.5 (C-1"), 148.0 (C-6", 8"), 148.0 (C-6"′, 8"′),145.8 (C-3"), 145.4 (C-3"′), 138.3 (C-7"), 138.3(C-7"′), 124.4 (C-4"), 124.3 (C-4"′), 114.7 (C-2", 2"′),106.1 (C-5", 9"), 106.1 (C-5"′, 9"′), 103.1 (C-1), 90.9(C-2′), 82.9 (C-5′), 77.1 (C-5), 73.1 (C-3′), 72.5 (C-3),71.4 (C-4′), 70.6 (C-2), 70.1 (C-4), 64.3 (C-1′), 63.6(C-6), 62.2 (C-6′), 56.1 (6", 8"-OCH3), 56.0 (6"′,8"′-OCH3)。以上波谱数据与文献数据基本一致[19],鉴定化合物8 为3′,6-二芥子酰基蔗糖。
化合物9:无色油状物;分子式C13H20O3;ESI-MSm/z247 [M+Na]+;1H-NMR (400 MHz,CD3OD)δ: 5.88 (1H, t,J= 1.4 Hz, H-2), 5.80 (2H, m,H-7, 8), 4.32 (1H, qd,J= 6.3, 3.9 Hz, H-9), 2.62~2.11 (2H, m, H-6), 1.92 (3H, dd,J= 3.7, 1.4 Hz,H-11), 1.24 (3H, d,J= 6.4 Hz, H-10), 1.07~0.99(6H, m, H-12, 13);13C-NMR (100 MHz, CD3OD)δ:201.3 (C-1), 167.5 (C-3), 136.9 (C-7), 130.1 (C-8),127.1 (C-2), 79.9 (C-4), 68.7 (C-9), 50.7 (C-6), 42.4(C-5), 24.5 (C-12), 23.8 (C-13), 23.5 (C-10), 19.6(C-11)。以上波谱数据与文献数据基本一致[20],鉴定化合物9 为吐叶醇。
化合物10:褐色粉末;分子式C7H6O3;ESI-MSm/z137 [M-H]-;1H-NMR (400 MHz, CD3OD)δ:9.69 (1H, s, H-1), 7.31 (1H, m, H-3, 6), 6.91 (1H, d,J= 7.8 Hz, H-7);13C-NMR (100 MHz, CD3OD)δ:193.1 (C-1), 153.8 (C-5), 147.2 (C-4), 130.8 (C-2),126.4 (C-7), 116.2 (C-6), 115.3 (C-3)。以上波谱数据与文献数据基本一致[21],鉴定化合物10 为3,4-二羟基苯甲醛。
化合物11:褐色粉末;分子式C7H6O4;ESI-MSm/z153 [M-H]-;1H-NMR (400 MHz, CD3OD)δ:7.45 (2H, m, H-3, 7), 6.82 (1H, d,J= 8.0 Hz, H-6);13C-NMR (100 MHz, CD3OD)δ: 170.3 (C-1), 151.5(C-5), 146.0 (C-4), 123.9 (C-7), 123.1 (C-2), 117.7(C-3), 115.7 (C-6)。以上波谱数据与文献数据基本一致[22],鉴定化合物11 为3,4-二羟基苯甲酸。
化合物12:无色油状物;分子式C6H6O3;ESI-MSm/z149 [M+Na]+;1H-NMR (400 MHz,CD3OD)δ: 9.53 (1H, s, H-1), 7.39 (1H, d,J= 3.6 Hz,H-3), 6.59 (1H, d,J= 3.6 Hz, H-4);13C-NMR (100 MHz, CD3OD)δ: 179.5 (C-1), 163.2 (C-5), 153.8(C-2), 125.0 (C-3), 110.9 (C-4), 57.6 (C-6)。以上波谱数据与文献数据基本一致[16],鉴定化合物12 为5-羟甲基糠醛。
化合物13:无色油状物;分子式C10H12O4;1H-NMR (400 MHz, CD3OD)δ: 7.41 (1H, d,J= 15.7 Hz, H-3), 6.70 (1H, d,J= 3.3 Hz, H-5), 6.42 (1H, d,J= 3.3 Hz, H-6), 6.26 (1H, d,J= 15.7 Hz, H-2), 4.57(2H, s, H-8), 4.21 (2H, q,J= 7.1 Hz, H-9), 1.30 (3H,t,J= 7.2 Hz, H-10);13C-NMR (100 MHz, CD3OD)δ:168.7 (C-1), 159.1 (C-7), 151.8 (C-4), 132.5 (C-3),117.4 (C-5), 115.9 (C-2), 111.0 (C-6), 61.6 (C-9),57.5 (C-8), 14.6 (C-10)。以上波谱数据与文献数据基本一致[23],鉴定化合物13 为2-羟甲基-5-呋喃丙烯酸乙酯。
化合物14:白色粉末;分子式C29H50O;ESI-MSm/z415 [M+H]+;1H-NMR (400 MHz, CDCl3)δ:5.36 (1H, d,J= 5.1 Hz, H-6), 3.53 (1H, ddd,J= 15.4,10.7, 4.4 Hz, H-3), 2.37~2.17 (2H, m, H-4);13C-NMR (100 MHz, CDCl3)δ: 141.0 (C-5), 121.9(C-6), 72.0 (C-3), 57.0 (C-14), 56.3 (C-17), 50.3(C-9), 46.0 (C-21), 42.5 (C-13), 42.5 (C-4), 40.0(C-12), 37.5 (C-10), 36.7 (C-1), 36.4 (C-18), 34.15(C-2), 32.1 (C-7), 31.9 (C-8), 29.4 (C-2), 28.5 (C-22),26.3 (C-15), 24.5 (C-27), 23.3 (C-11), 21.3 (C-29),20.0 (C-23), 19.6 (C-26), 19.2 (C-24), 12.2 (C-28),12.1 (C-25)。以上波谱数据与文献数据基本一致[16],鉴定化合物14 为β-谷甾醇。
4 体外调脂活性筛选
4.1 化合物对3T3-L1 前脂肪细胞存活率的影响
采用CCK-8 法[24],测试化合物1 和2 对3T3-L1前脂肪细胞存活率的影响。3T3-L1 前脂肪细胞使用DMEM 高糖培养基(含10%的胎牛血清、1%的双抗)于37 ℃和5% CO2的条件下培养。待细胞长至密度70%~80%,用胰蛋白酶将3T3-L1 前脂肪细胞消化后,用DMEM 高糖培养液将其制成4×104个/mL的细胞悬液,接种于96孔板,每孔100 μL,在37 ℃、5% CO2的条件下培养12 h;设对照组、给药组。吸弃原培养基,对照组加入含0.1% DMSO 的DMEM高糖培养基100 μL,给药组分别给予含10 μmol/L化合物的DMEM 高糖培养基100 μL,在原相同环境条件下继续培养48 h;吸弃原培养基,每孔加入100 μL 含有10% CCK-8 试剂的培养基溶液后,放入培养箱0.5 h 后取出,用酶标仪在450 nm 波长下测定吸光度(A),并计算细胞存活率。
结果表明,化合物1 和2 在10 μmol/L 浓度下对3T3-L 前脂肪细胞48h 内存活率均大于90%,因此选取5、10 μmol/L 的浓度用于后续活性研究,结果见表2。

表2 化合物1 和2 对3T3-L1 前脂肪细胞存活率的影响(x ±s , n=3)Table 2 Effects of compounds 1 and 2 on survival rate of 3T3-L1 preadipocytes (x ±s , n=3)
4.2 3T3-L1 前脂肪细胞胰岛素抵抗模型的建立
根据文献报道的方法[25],通过3T3-L1 前脂肪细胞胰岛素抵抗模型,测试化合物对该细胞胰岛素抵抗的影响,从而评价化合物的调脂活性。3T3-L1前脂肪细胞2×104个/孔接种于24 孔板,分为对照组、模型组、阳性对照组、给药组。待细胞在完全培养基中生长至融合度 100%后,更换新鲜的DMEM 高糖培养基,继续培养48 h;对照组更换2 mL 新鲜的DMEM 高糖培养基,模型组加入2 mL诱导分化培养基I(DMEM 高糖培养基中含牛胰岛素 10 μg/mL、3-异丁基-1-甲基黄嘌呤 0.5 mmol/L、地塞米松0.25 μmol/L、罗格列酮1 μmol/L),阳性药组加入2 mL 含5 mol/L 阳性药物洛伐他汀的诱导分化培养基I,给药组分别加入2 mL 含5、10 μmol/L化合物的诱导分化培养基I,培养48 h;对照组继续更换2 mL 新鲜的DMEM 高糖培养基,模型组换成2 mL 诱导分化培养基II(DMEM 高糖培养基中含牛胰岛素10 μg/mL),阳性对照组加入2 mL 含5 μmol/L 阳性药物洛伐他汀的诱导分化培养基II,给药组分别加入2 mL 含5、10 μmol/L 化合物的诱导分化培养基II,培养48 h;各组换为2 mL DMEM高糖培养基,培养48 h。在3T3-L1 细胞诱导分化第7 天,弃去原培养基,每孔加入200 μL PBS 洗去残余培养基后,弃去PBS。根据文献报道的方法[26],使用DMEM 高糖培养基配制含1 μg/mL 尼罗红染液,每孔加入尼罗红染液200 μL,避光染色10 min后,弃去尼罗红染液。每孔用PBS 洗涤细胞1 遍后,再加200 μL PBS。用酶标仪在激发波长485 nm 和发射波长572 nm 下检测各组A值,并根据公式计算各组细胞中相对脂肪含量。用荧光显微镜观察并拍照。
与对照组相比,模型组细胞中的相对脂肪含量明显增加(P<0.001)。与模型组相比,化合物1 在5、10 μmol/L 浓度下对3T3-L1 细胞中脂肪的生成均有显著的抑制作用(P<0.01、0.001),而化合物2 在10 μmol/L 浓度下显示一定的抑制脂肪生成的作用(P<0.05),结果见表3。此外,从图4 可以看出,采用尼罗红处理后,经诱导分化后的各组细胞内积累的大量脂滴被染成红色。将各给药预处理组细胞的尼罗红染色程度与模型组细胞比较,发现阳性药洛伐他汀、化合物1 和2 的细胞内脂滴均有不同程度地减少。综上所述,化合物1 和2 均具有潜在的调脂活性。
表3 化合物1 和2 对3T3-L1 前脂肪细胞内相对脂肪含量的影响 (±s , n=3)Table 3 Effects of compounds 1 and 2 on relative fat content in 3T3-L1 preadipocytes (± s , n=3)
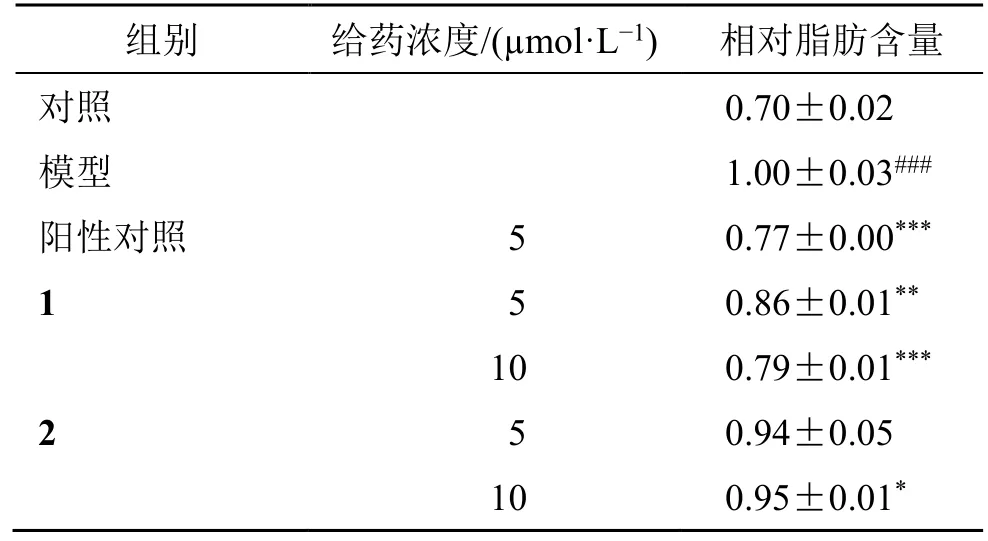
表3 化合物1 和2 对3T3-L1 前脂肪细胞内相对脂肪含量的影响 (±s , n=3)Table 3 Effects of compounds 1 and 2 on relative fat content in 3T3-L1 preadipocytes (± s , n=3)
与对照组比较:###P<0.001;与模型组比较:***P<0.001 **P<0.01 *P<0.05###P < 0.001 vs control group; ***P < 0.001 ** P < 0.01 *P < 0.05 vs model group
组别 给药浓度/(μmol·L-1) 相对脂肪含量对照0.70±0.02 1.00±0.03###阳性对照 5 0.77±0.00***1 5 0.86±0.01**10 0.79±0.01***模型2 5 0.94±0.05 10 0.95±0.01*
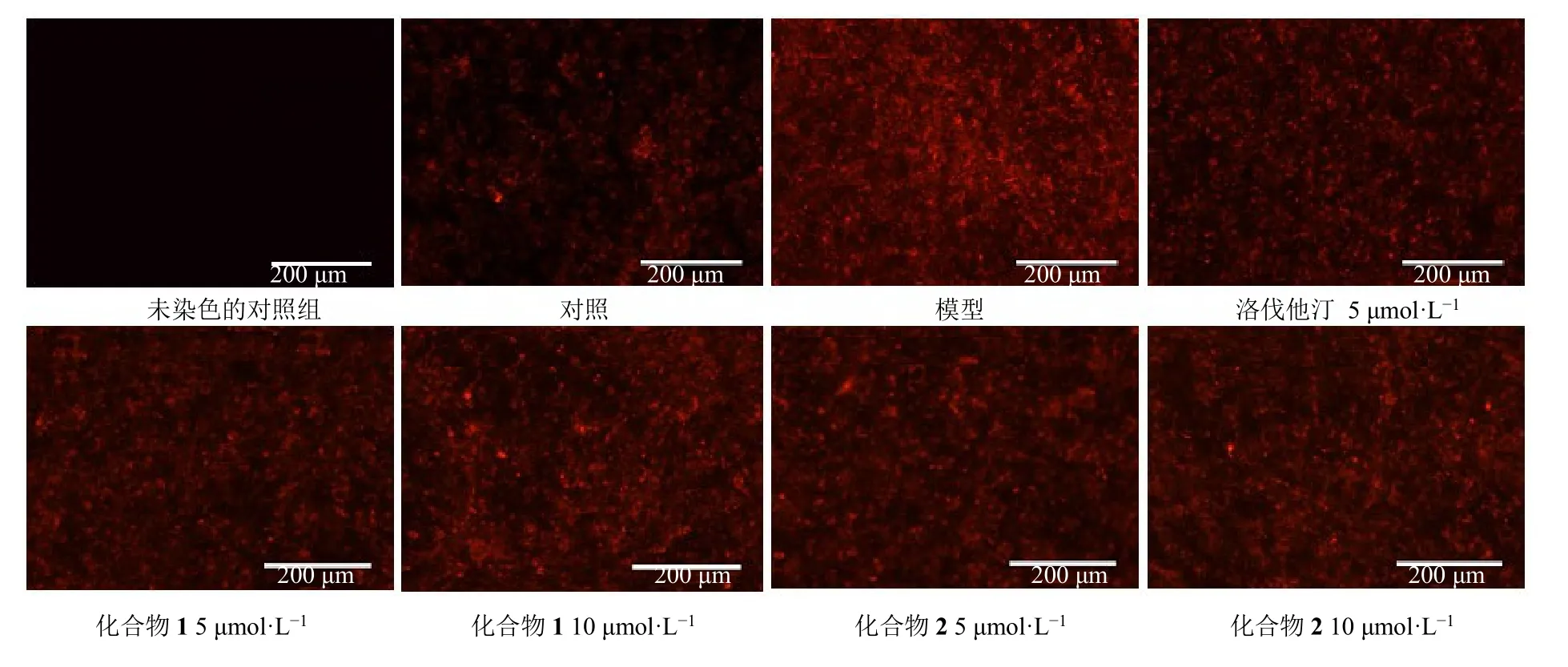
图4 化合物1 和2 对3T3-L1 细胞胰岛素抵抗模型中细胞形态和脂质积累的影响Fig. 4 Effects of compounds 1 and 2 on cell morphology and lipid accumulation in insulin-resistant 3T3-L1 adipocytes
5 讨论
从莱菔子70%乙醇提取物中分离得到14 个化合物,包括2 个新的含硫衍生物,5 个首次从莱菔子中分离得到的化合物。对这2 个新化合物进行了体外调脂活性筛选。结果表明,化合物1 和2 均具有潜在的调脂活性,其中化合物1 较2 在5、10 μmol/L 下显示出更好的调脂活性。本研究丰富了莱菔子的化学成分,并用胰岛素抵抗模型评价了化合物1 和2 的体外调脂活性,为莱菔子进一步的开发和利用提供了参考。
利益冲突所有作者均声明不存在利益冲突
