金银花黄酮苷类化学成分研究
2023-06-08魏晓芳沈婉莹李阳芳谢秋杰唐旭东葛岚岚
魏晓芳,沈婉莹,李阳芳,谢秋杰,唐旭东,葛岚岚,3*
1. 甘肃中医药大学药学院,甘肃 兰州 730000
2. 暨南大学第二临床学院深圳市人民医院龙华分院 中心实验室,广东 深圳 518120
3. 暨南大学第二临床学院深圳市人民医院龙华分院 病理科,广东 深圳 518120
4. 深圳清华大学研究院 创新中药及天然药物研究重点实验室,广东 深圳 518000
忍冬科(Caprifoliaceae)忍冬属在全世界约有200 种植物,主要分布在非洲北部、北美、欧洲和亚洲[1]。我国有98 种,以西南部分布最多[2]。金银花是忍冬属植物忍冬LonicerajaponicaThunb. 的干燥花蕾或带初开的花,又名双花、忍冬花等,分布在我国各省,尤其以河南、山东的野生资源最为丰富[3]。金银花味甘,性寒,归肺、心、胃经,具有清热解毒、疏散风热之功效,用于治疗痈肿疔疮、喉痹、丹毒、热毒血痢、风热感冒、温病发热等症,药用历史悠久,有“中药中的抗生素”之称[3-4]。作为清热解毒的良药,金银花在新型冠状病毒肺炎的防治中应用广泛,表现优异[1,5-6]。首载于梁代陶弘景的《名医别录》,既可入药,亦可做食疗[7-8]。现代药理作用显示金银花具有抗菌、抗炎、抗氧化、抗病毒、抗癌以及肝保护等活性[9-13]。迄今为止,从金银花中分离鉴定的化合物主要为黄酮类、有机酸类、环烯醚萜以及三萜皂苷类化合物[7,14-16]。现代药理学研究认为,金银花功效成分可能是其黄酮类活性成分[17-18]。为了更好地阐述金银花的物质基础,本课题组在前期的研究基础[17,19-21]上对金银花的化学成分进行了进一步的分离和纯化,从中分离鉴定了9 个黄酮苷类化合物,分别为3,5-二羟基-3′-甲氧基黄酮-7-O-β-D-葡萄糖苷(3,5-dihydroxy-3′-methoxyflavone-7-O-β-D-glucopyranoside,1)、槲皮素-3-O-葡萄糖苷(quercetin-3-O-glucopyranoside,2 )、 3,5,3′-三羟基黄酮-7-O-β-D- 葡萄糖苷(3,5,3′-trihydroxyflavone-7-O-β-D-glucopyranoside,3)、棉花苷(quercimeritrin,4)、烟花苷(nicotinflorin,5)、水仙苷(narcissin,6)、芦丁(rutin,7)、槲皮素-5-O-葡萄糖苷(quercetin-5-O-glucoside,8)、木犀草素-7-O- 新橙皮糖苷( luteolin-7-Oneohesperidoside,9),结构见图1。其中,化合物1和3 为新化合物,分别命名为金银花黄酮F(japoflavone F,1)和金银花黄酮E(japoflavone E,3);化合物2、4~6、8、9 为首次从该属植物中分离得到。为进一步探究金银花的有效成分,本实验对化合物1~9 进行了抗肿瘤活性筛选,结果显示,化合物1 对人肝癌HuH7细胞表现出显著的抑制活性,其半数抑制浓度(half maximal inhibitory concentration,IC50)为(43.4±1.1)μmol/L。

图1 化合物1~9 的化学结构Fig. 1 Structure of compounds 1—9
1 仪器与材料
Bruker DPX-400 核磁共振仪(德国Bruker 公司);Bruker microTOF-QⅡ液相色谱质谱联用仪(德国Bruker 公司);半制备高效液相色谱仪(泵LC-20A,检测器SPD-20A,广州睿柏公司);分析高效液相色谱仪(Essentia LC-16,日本岛津公司),Cosmosil C18反相制备柱(250 mm×20 mm,5 μm,日本);YMC-Pack ODS C18分析柱(250 mm×4.6 mm,5 μm,日本);Sephadex LH-20(北京GE 公司);薄层硅胶G 和色谱柱硅胶(青岛海洋化工厂);色谱级甲醇购自Sigma-Aldrich 公司(美国St. Louis公司);D-葡萄糖(批号20171023,质量分数大于99%)购自广东光华科技股份有限公司;其余试剂皆为分析纯,购自上海国药集团化学试剂公司。
金银花购自山东省临沂市平邑县,经甘肃中医药大学唐旭东教授鉴定为忍冬L.japonicaThunb.的花蕾,凭证标本(20170930)保藏于深圳市人民医院龙华分院中心实验室标本馆。采摘回来的新鲜样品先在60 ℃干燥箱中烘干,后阴避保存待用。
人肝癌SMCC 7721细胞和人肝癌HuH7细胞购自美国菌种保藏中心(American Type Culture Collection,ATCC)。
2 提取与分离
取干燥后的金银花(6.5 kg)粉碎,用75%乙醇在室温下进行多次冷浸、渗漉提取,合并提取液,减压浓缩得到浸膏(1.5 kg)。将总浸膏混悬于水,依次进行萃取,减压浓缩后分别得到环己烷部位(130.3 g)、醋酸乙酯部位(93.7 g)和正丁醇部位(199.8 g)。正丁醇部位(180 g)经正相硅胶柱色谱,以二氯甲烷-甲醇系统(0∶1~1∶0)梯度洗脱,合并后得到40 个流分。
Fr. 13(13.1 g)经Sephadex LH-20 凝胶色谱柱分离,二氯甲烷-甲醇(50∶50)等度洗脱,薄层分析合并后得到3 个组分。Fr. 13-3 经半制备高效液相色谱(46%甲醇)分离得到化合物1(1.03 mg,tR=13.5 min)和2(4.34 mg,tR=19.6 min)。Fr. 20(5.7 g)经Sephadex LH-20 凝胶色谱柱分离,二氯甲烷-甲醇(70∶30)等度洗脱,合并后得到6 个组分。Fr. 20-5 经半制备高效液相色谱(43%甲醇)分离得到化合物3(5.2 mg,tR=20.1 min)。Fr. 23(2.6 g)经Sephadex LH-20 凝胶色谱柱分离,二氯甲烷-甲醇(50∶50)等度洗脱,得到10 个组分。Fr. 23-5经半制备高效液相色谱(55%甲醇)分离得到化合物4(1.6 mg,tR=16.4 min)。Fr. 23-6 经半制备高效液相色谱(43%甲醇)分离得到化合物5(5.25 mg,tR=10.1 min)和6(1.24 mg,tR=20.6 min)。Fr. 25(18.5 g)经Sephadex LH-20 凝胶色谱柱分离,二氯甲烷-甲醇(50∶50)等度洗脱,得到3 个组分。Fr. 25-3 经半制备高效液相色谱(43%甲醇)分离得到化合物7(17.7 mg,tR=11.6 min)和8(6.7 mg,tR=23.8 min)。Fr. 33(9.6 g)经Sephadex LH-20 凝胶色谱柱分离,二氯甲烷-甲醇(50∶50)等度洗脱,得到3 个组分。Fr. 33-3 经半制备高效液相色谱(43%甲醇)分离得到化合物9(3.52 mg,tR=13.1 min)。
3 糖构型鉴定
取化合物3(1 mg),溶于4 mL 三氟乙酸(4 mol/L)溶液中,95 ℃条件反应4 h,待反应完成后,冷却至室温,用等体积的二氯甲烷(2 mL)萃取3次,水层减压蒸干,即为单糖酸水解产物,二氯甲烷层为苷元部分。取D-葡萄糖(1 mg)的对照品及上述酸水解产物分别加入0.5 mL 的无水吡啶和2 mg 的L-半胱氨酸甲酯盐酸盐,60 ℃条件下加热1 h,冷却至室温,分别加入10 μL 邻甲苯异硫氰酸酯,60 ℃加热1 h 后冷却,将反应液稀释1 倍后进行HPLC(乙腈-0.1%甲酸水溶液25∶75,1 mL/min,10 μL,分析波长为250 nm)分析,化合物3 的酸水解产物和D-葡萄糖的保留时间均为18.1 min。
4 结构鉴定
4.1 新化合物结构鉴定
化合物3:黄色粉末,TLC 薄层展开UV 下为亮黄色,盐酸-镁粉显色反应为紫红色,故推断为黄酮类化合物,HR-ESI-MSm/z: 471.089 8 [M+Na]+(计算值为 471.090 3)。1H-NMR (400 MHz,DMSO-d6)δ: 7.42 (1H, d,J= 8.0 Hz, H-4′), 7.37 (1H,s, H-2′), 6.79 (1H, t,J= 8.0 Hz, H-5′), 6.78 (1H, d,J=8.0 Hz, H-6′), 6.69 (1H, s, H-8), 6.42 (1H, d,J= 2.0 Hz, H-6), 5.06 (1H, d,J= 7.4 Hz, H-1′′);13C-NMR(100 MHz, DMSO-d6)δ: 146.1 (C-2), 120.0 (C-3),181.8 (C-4), 162.9 (C-5), 99.5 (C-6), 164.7 (C-7), 94.8(C-8), 161.2 (C-9), 102.7 (C-10), 127.3 (C-1′), 105.3(C-2′), 157.0 (C-3′), 115.9 (C-4′), 124.8 (C-5′), 113.0(C-6′), 100.0 (C-1′′), 73.2 (C-2′′), 76.4 (C-3′′), 69.6(C-4′′), 77.2 (C-5′′), 60.7 (C-6′′)。根据以上数据,判断该黄酮类化合物含有1 个四元取代A 环和1 个1, 3-二取代B 环。糖端基信号δH5.06 (1H, d,J= 7.4 Hz,H-1′′) 以及δC100.0 (C-1′′) 提示该化合物还含有一个连氧糖苷。通过与已知文献葡萄糖的信号对比[22],并根据糖端基氢的偶合常数(J= 7.4 Hz),以及水解后糖残基的HPLC 分析(tR=18.1 min),最终判断该糖为β-D-葡萄糖。HMBC 信号(图2)显示,H-6/8 与C-10 相关,H-8 与C-7 相关,H-6′与C-2/3相关,H-5′与C-3′相关,H-2′与C-3′/4′相关,H-4′与C-6′相关,H-1′′与C-7 相关。综合以上结果,最终鉴定化合物3 为3,5,3′-三羟基黄酮-7-O-β-D-葡萄糖苷,经SciFinder 数据库检索,为1 个新化合物,命名为金银花黄酮E。
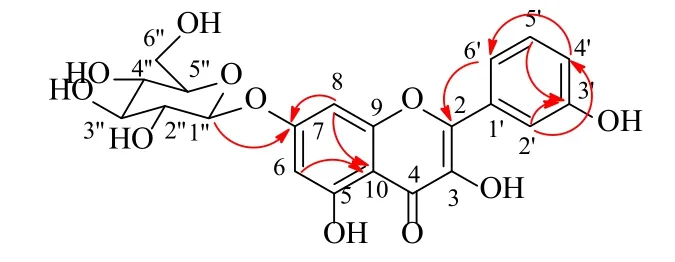
图2 化合物3 的重要HMBC 相关Fig. 2 Key HMBC of compound 3
化合物1:黄色粉末,TLC 薄层展开UV 下为亮黄色,盐酸-镁粉显色反应为紫红色,故推断为黄酮类化合物,HR-ESI-MSm/z: 485.142 0 [M+Na]+(计算值为 485.106 0),1H-NMR (400 MHz,DMSO-d6)δ: 7.57 (1H, d,J= 8.0 Hz, H-4′), 7.56 (1H,s, H-2′), 6.93 (1H, d,J= 8.0 Hz, H-6′), 6.92 (1H, t,J=8.0 Hz, H-5′), 6.85 (1H, s, H-8), 6.43 (1H, d,J= 2.0 Hz, H-6), 5.04 (1H, d,J= 7.4 Hz, H-1′′), 3.87 (3H, s,3′-OCH3);13C-NMR (100 MHz, DMSO-d6)δ: 148.2(C-2), 120.6 (C-3), 174.1 (C-4), 164.2 (C-5), 99.5(C-6), 165.4 (C-7), 95.0 (C-8), 162.6 (C-9), 103.2(C-10), 132.2 (C-1′), 110.3 (C-2′), 156.9 (C-3′), 115.9(C-4′), 122.4 (C-5′), 111.3 (C-6′), 56.0 (3′-OCH3),100.1 (C-1′′), 73.1 (C-2′′), 76.5 (C-3′′), 69.6 (C-4′′),77.3 (C-5′′), 60.6 (C-6′′)。结合1H-NMR 与13C-NMR信号,该化合物与化合物3 信号相似,仅多了1 个甲氧基的信号,通过比对黄酮母核环上氢信号,发现H-2′和H-4′的信号向低场位移了δ0.15 左右,说明该甲氧基连在B 环的3′位,最终鉴定化合物1 为3,5-二羟基-3′-甲氧基黄酮-7-O-β-D-葡萄糖苷,经SciFinder 数据库检索,为1 个新化合物,命名为金银花黄酮F。
4.2 已知化合物结构鉴定
化合物2:黄色粉末,TLC 薄层展开UV 下为亮黄色,盐酸-镁粉显色反应为紫红色,故推断为黄酮类化合物,1H-NMR (400 MHz, DMSO-d6)δ: 7.58(1H, d,J= 8.0 Hz, H-6′), 7.57 (1H, s, H-2′), 6.84 (1H,d,J= 8.0 Hz, H-5′), 6.39 (1H, s, H-8), 6.19 (1H, s,H-6), 5.46 (1H, d,J= 7.2 Hz, H-1′′);13C-NMR (100 MHz, DMSO-d6)δ: 156.3 (C-2), 133.3 (C-3), 177.4(C-4), 161.2 (C-5), 98.7 (C-6), 164.3 (C-7), 93.5(C-8), 156.1 (C-9), 103.9 (C-10), 121.2 (C-1′), 116.2(C-2′), 144.8 (C-3′), 148.2 (C-4′), 115.2 (C-5′), 121.6(C-6′), 100.9 (C-1′′), 74.1 (C-2′′), 76.5 (C-3′′), 69.9(C-4′′), 77.6 (C-5′′), 61.0 (C-6′′)。以上数据与文献数据[23]进行对比,鉴定化合物2 为槲皮素-3-O-葡萄糖苷。
化合物4:黄色粉末,TLC 薄层展开UV 下为亮黄色,盐酸-镁粉显色反应为紫红色,故推断为黄酮类化合物,1H-NMR (400 MHz, DMSO-d6)δ: 7.72(1H, d,J= 2.0 Hz, H-2′), 7.55 (1H, dd,J= 2.0, 8.0 Hz, H-6′), 6.90 (1H, d,J= 8.0 Hz, H-5′), 6.77 (1H, d,J= 2.0 Hz, H-8), 6.42 (1H, d,J= 2.0 Hz, H-6), 5.08(1H, d,J= 7.2 Hz, H-1′′);13C-NMR (100 MHz,DMSO-d6)δ: 147.6 (C-2), 136.1 (C-3), 176.0 (C-4),160.4 (C-5), 98.8 (C-6), 162.7 (C-7), 94.3 (C-8), 155.7(C-9), 104.7 (C-10), 120.0 (C-1′), 115.6 (C-2′), 145.1(C-3′), 147.9 (C-4′), 115.4 (C-5′), 121.8 (C-6′), 99.9(C-1′′), 73.1 (C-2′′), 76.4 (C-3′′), 69.6 (C-4′′), 77.2(C-5′′), 60.6 (C-6′′)。以上数据与文献数据[22]进行对比,鉴定化合物4 为棉花苷。
化合物5:黄色粉末,TLC 薄层展开UV 下为亮黄色,盐酸-镁粉显色反应为紫红色,故推断为黄酮类化合物,1H-NMR (400 MHz, DMSO-d6)δ: 7.98(2H, d,J= 9.0 Hz, H-2′, 6′), 6.88 (2H, d,J= 9.0 Hz,H-3′, 5′), 6.41 (1H, d,J= 2.0 Hz, H-8), 6.20 (1H, d,J= 2.0 Hz, H-6), 5.31 (1H, d,J= 7.0 Hz, H-1′′), 4.37(1H, s, H-1′′′), 0.98 (3H, d,J= 6.2 Hz, H-6′′′);13C-NMR (100 MHz, DMSO-d6)δ: 156.5 (C-2), 133.2(C-3), 177.4 (C-4), 161.2 (C-5), 98.8 (C-6), 164.2(C-7), 93.8 (C-8), 156.8 (C-9), 104.0 (C-10), 120.9(C-1′), 130.9 (C-2′), 115.1 (C-3′), 159.9 (C-4′), 115.1(C-5′), 130.9 (C-6′), 100.8 (C-1′′), 74.2 (C-2′′), 75.7(C-3′′), 69.9 (C-4′′), 76.4 (C-5′′), 66.9 (C-6′′), 101.3(C-1′′′), 70.3 (C-2′′′), 70.3 (C-3′′′), 71.8 (C-4′′′), 68.2(C-5′′′), 17.7 (C-6′′′)。以上数据与文献数据[24]进行对比,鉴定化合物5 为烟花苷。
化合物6:黄色粉末,TLC 薄层展开UV 下为亮黄色,盐酸-镁粉显色反应为紫红色,故推断为黄酮类化合物,1H-NMR (400 MHz, DMSO-d6)δ: 7.83(1H, s, H-2′), 7.49 (1H, d,J= 8.0 Hz, H-6′), 6.88 (1H,d,J= 8.0 Hz, H-5′), 6.34 (1H, s, H-8), 6.12 (1H, s,H-6), 5.39 (1H, d,J= 7.0 Hz, H-1′′), 4.40 (1H, s,H-1′′′), 3.81 (3H, s, OCH3), 0.96 (3H, d,J= 6.1 Hz,H-6′′′);13C-NMR (100 MHz, DMSO-d6)δ: 156.6(C-2), 132.9 (C-3), 177.2 (C-4), 161.1 (C-5), 100.9(C-6), 166.3 (C-7), 94.0 (C-8), 156.2 (C-9), 103.5(C-10), 121.1 (C-1′), 113.3 (C-2′), 146.9 (C-3′), 149.4(C-4′), 115.3 (C-5′), 122.2 (C-6′), 55.7 (3′-OCH3),101.4 (C-1′′), 74.3 (C-2′′), 76.4 (C-3′′), 70.1 (C-4′′),75.9 (C-5′′), 66.9 (C-6′′), 100.9 (C-1′′′), 70.3 (C-2′′′),70.6 (C-3′′′), 71.8 (C-4′′′), 68.3 (C-5′′′), 17.7 (C-6′′′)。以上数据与文献数据[25]进行对比,鉴定化合物6 为水仙苷。
化合物7:黄色粉末,TLC 薄层展开UV 下为亮黄色,盐酸-镁粉显色反应为紫红色,故推断为黄酮类化合物,1H-NMR (400 MHz, DMSO-d6)δ: 7.53(1H, d,J= 8.0 Hz, H-6′), 7.52 (1H, s, H-2′), 6.83 (1H,d,J= 8.0 Hz, H-5′), 6.38 (1H, s, H-8), 6.18 (1H, s,H-6), 5.33 (1H, d,J= 7.2 Hz, H-1′′), 4.37 (1H, s,H-1′′′), 0.98 (1H, d,J= 6.2 Hz, H-6′′′);13C-NMR (100 MHz, DMSO-d6)δ: 156.6 (C-2), 133.3 (C-3), 177.4(C-4), 161.2 (C-5), 98.7 (C-6), 164.1 (C-7), 93.6(C-8), 156.4 (C-9), 104.0 (C-10), 121.2 (C-1′), 116.3(C-2′), 144.8 (C-3′), 148.4 (C-4′), 115.2 (C-5′), 121.6(C-6′), 100.7 (C-1′′), 74.1 (C-2′′), 75.9 (C-3′′), 70.0(C-4′′), 76.5 (C-5′′), 67.0 (C-6′′), 101.2 (C-1′′′), 70.6(C-2′′′), 70.4 (C-3′′′), 71.9 (C-4′′′), 68.2 (C-5′′′), 17.7(C-6′′′)。以上数据与文献数据[26]进行对比,鉴定化合物7 为芦丁。
化合物8:黄色粉末,TLC 薄层展开UV 下为亮黄色,盐酸-镁粉显色反应为紫红色,故推断为黄酮类化合物,1H-NMR (400 MHz, DMSO-d6)δ: 7.56(1H, d,J= 8.0 Hz, H-6′), 7.55 (1H, s, H-2′), 6.77 (1H,d,J= 8.0 Hz, H-5′), 6.20 (1H, s, H-8), 6.01 (1H, s,H-6), 5.39 (1H, d,J= 7.2 Hz, H-1′′);13C-NMR (100 MHz, DMSO-d6)δ: 142.3 (C-2), 133.2 (C-3), 175.0(C-4), 156.6 (C-5), 99.5 (C-6), 161.1 (C-7), 94.0 (C-8),158.7 (C-9), 109.6 (C-10), 121.7 (C-1′), 115.2 (C-2′),145.0 (C-3′), 145.0 (C-4′), 115.3 (C-5′), 116.0 (C-6′),101.3 (C-1′), 74.2 (C-2′′), 76.6 (C-3′′), 70.0 (C-4′′), 77.5(C-5′), 61.0 (C-6′)。以上数据与文献数据[27]进行对比,鉴定化合物8 为槲皮素-5-O-葡萄糖苷。
化合物9:黄色粉末,TLC 薄层展开UV 下为亮黄色,盐酸-镁粉显色反应为紫红色,故推断为黄酮类化合物,1H-NMR (400 MHz, DMSO-d6)δ: 7.41(1H, d,J= 8.0 Hz, H-6′), 7.37 (1H, s, H-2′), 6.85 (1H,d,J= 8.0 Hz, H-5′), 6.72 (2H, s, H-3, 8), 6.35 (1H, s,H-6), 5.23 (1H, d,J= 7.4 Hz, H-1′′), 5.11 (1H, s,H-1′′′), 1.19 (3H, d,J= 6.0 Hz, H-6′′′);13C-NMR (100 MHz, DMSO-d6)δ: 164.6 (C-2), 103.0 (C-3), 181.8(C-4), 162.5 (C-5), 99.3 (C-6), 161.2 (C-7), 94.4(C-8), 157.0 (C-9), 105.4 (C-10), 120.7 (C-1′), 113.2(C-2′), 146.0 (C-3′), 150.7 (C-4′), 116.0 (C-5′), 119.3(C-6′), 97.8 (C-1′′), 77.0 (C-2′′), 76.3 (C-3′′), 70.4(C-4′′), 77.2 (C-5′′), 60.5 (C-6′′), 100.5 (C-1′′′), 69.7(C-2′′′), 70.5 (C-3′′′), 71.9 (C-4′′′), 68.4 (C-5′′′), 18.1(C-6′′′)。以上数据与文献数据[28]进行对比,鉴定化合物9 为木犀草素-7-O-新橙皮糖苷。
5 体外抗肿瘤活性
将SMCC 7721 细胞和HuH7 细胞接种于96 孔细胞培养板,每孔200 μL(含有1×105个肿瘤细胞),在37 ℃、5 % CO2培养箱中,并且在含10%FBS 的DMEM 培养基中,培养24 h,加入不同质量浓度(100、75、50、25、0 mg/mL)的黄酮苷类化合物,继续培养48 h;实验结束前4 h 加20 μL的MTT(5 mg/mL),继续在37 ℃、5% CO2条件下孵育4 h,吸取培养液后加入二甲基亚砜150 μL,振摇至结晶完全溶解,然后于酶标仪检测其吸光度(A)值,检测波长570 nm,参考波长630 nm,根据吸光值计算黄酮苷类化合物对SMCC 7721 和HuH7 细胞的抑制率及IC50。
A0为空白组A值;A为样品组A值
共检测了12 个金银花黄酮苷类化合物的抗肝癌活性,包括此前从金银花中分离的3 个黄酮苷类化合物,分别为紫云英苷、槲皮素-3-O-(6-香豆酰基)-β-D-葡萄糖苷和异鼠李素-3-O-(6-香豆酰基)-β-D-葡萄糖苷[17,19]。实验结果发现,紫云英苷和槲皮素-3-O-(6-香豆酰基)-β-D-葡萄糖苷对SMCC 7721 细胞有显著的抑制活性,IC50值分别为(66.4±2.9)、(73.5±4.8)μmol/L,其他10 个化合物的IC50值均大于100 μmol/L。而对HuH7 细胞,槲皮素-3-O-(6-香豆酰基)-β-D-葡萄糖苷和3,5-二羟基-3′-甲氧基黄酮-7-O-葡萄糖苷(1)显示出优异的抗肝癌活性,IC50值分别为(75.7±2.7)、(43.4±1.1)μmol/L,其余10 个化合物的IC50值均大于100 μmol/L。
6 讨论
本研究从金银花正丁醇部位分离鉴定了9 个黄酮苷类化合物,其中化合物1 和3 为新化合物,其他化合物(除化合物7 以外)均为首次从该属植物中分离得到。在此前的研究中,课题组已经从金银花中分离鉴定了18 个黄酮类化合物,包括3 个黄酮苷类[17,19],并验证了金银花黄酮类化合物具有较好的抗肝癌活性,其中japoflavone D 可通过诱导细胞发生凋亡发挥抗肝癌活性[21]。而本研究的结果进一步证明了黄酮类化合物的抗肝癌活性。金银花自古就有治疗“肝积”“肿毒”的记载[29],因此加强从金银花中分离鉴定药理活性显著的黄酮类成分研究是非常有意义的。
利益冲突所有作者均声明不存在利益冲突
