牛耳朵全草中化学成分及其生物活性研究
2023-06-08杨丽媛王朝阳陈俊磊邱珏琳杜彩霞魏英焕郝小江
杨丽媛,王朝阳,陈俊磊,邱珏琳,杜彩霞,魏英焕,郝小江,4*,顾 玮*
1. 贵州医科大学 省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014
2. 贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014
3. 贵州医科大学药学院,贵州 贵阳 550025
4. 中国科学院昆明植物研究所,云南 昆明 650201
牛耳朵Primulinaeburnea(Hance) Y. Z. Wang是苦苣苔科(Gesneriaceae)报春苣苔属PrimulinaHance 植物牛耳朵的全草。别名为岩白菜、石三七、石虎耳等,主产于贵州、广西、广东、湖南、湖北、四川等地。在《贵州民族常用天然药物》记载,牛耳朵根茎或全草入药,具有清肺止咳、凉血止血、解毒等功效,主要用于治疗阴虚肺热、咳嗽咯血、崩漏、带下、痈肿疮毒、外伤出血等症[1]。对牛耳朵的化学成分研究报道较少,目前仅有对于广西产牛耳朵的化学成分的研究报道,共从中鉴定27 个化合物,主要涉及苯乙醇苷类、醌类、黄酮类以及萜类等类型[2-8]。初步药理学研究表明其有抗肿瘤、抗菌、降压和抗氧化等作用[9-10],药理活性筛选主要针对牛耳朵乙醇提取物,且对单体化合物的药理活性研究较少。研究证明牛耳朵中的部分化合物尤其是蒽醌类化合物对人肺癌细胞株SPC-A1 有一定的细胞毒活性和显著的DPPH 自由基清除活性[4-5]。目前尚未见到对黔产牛耳朵进行化学成分研究。因此本研究拟对黔产牛耳朵的化学成分进行系统的分离鉴定,并重点对其体外细胞毒活性和抗氧化活性进行研究。
从牛耳朵醋酸乙酯萃取部位中共分离23 个化合物,分别鉴定为 1,6-dihydroxy-7-methoxy-2-methylanthr-quinone ( 1 )、 soranjidiol ( 2 )、1,4,7-trihydroxy-2-methyl-9,10-anthraquinone(3)、digiferruginol(4)、1,4-dihydroxy-2-hydroxymethyl-9,10-anthraquinone(5)、1,6,7-trihydroxy-2-methyl-9,10-anthracenedione ( 6 )、 (R)-7,8-dihydroxy-αdunnione ( 7 )、 3-amino-2-methoxycarbonyl-1,4-naphthoquinone(8)、木犀草素(luteoline,9)、异落叶松脂素 [(+)-isolariciresinol,10]、七叶内酯(esculetin,11)、酪醇(tyrosol,12)、对香豆酸(p-coumaric acid,13)、咖啡酸甲酯(caffeic acid methy ester,14)、benzylO-β-D-glucopyranoside( 15 )、 4-O-benzyl-D-glucopyranoside ( 16 )、3,4-dihydroxyphenylethyl alcohol 8-O-β-glucopyrnoside(17)、cuneataside A(18)、对羟基苯甲醛(4-hydroxybenzaldehyde,19)、尼泊金甲酯(methyl-4-hydroxybenzoate,20)、对羟基苯乙酮[1-(4-hydroxyphenyl)-ethanone , 21] 、 香 草 醛(vanillin,22)、香草酸(vanillic acid,23)。其中,化合物16 为新天然产物。化合物1~3、6 和8~22为首次从报春苣苔属植物中分离得到。进一步对分离得到化合物采用MTT 法筛选对人非小细胞肺癌A549 细胞的细胞毒活性;采用DPPH 法和ABTS法筛选其体外抗氧化活性。
1 材料与仪器
柱色谱硅胶(40~80、200~300、300~400 目)和薄层柱色谱硅胶GF254(青岛海洋化工厂);Sephadex LH-20 凝胶(Pharmacia 公司,美国);HITACHI 高效液相色谱仪(Primaide,日立高新技术集团,日本);反相填充材料RP-18(Merck 公司,德国);HPLC 色谱柱为Zorbax SB-C18(半制备柱,250 mm×9.4 mm,5 μm,安捷伦公司,美国);EYELA OSB-2200 旋转蒸发仪(东京理化器械株式会社,日本);INOVA-600MHz 核磁共振波谱仪(Bruker 公司,德国);HP 1100 型液相色谱质谱联用仪(惠普公司,美国);API Qstar Pulsar 质谱仪BioTek Epoch 全波长酶标仪(BioTek 公司,美国)。本实验所用石油醚、二氯甲烷、醋酸乙酯、丙酮、甲醇等有机溶剂均为工业级,重蒸后使用;色谱级的甲醇(云南新蓝景化学工业有限公司);氘代试剂(美国Cambridge Isotope Laboratories 公司)。人肺癌细胞A549 来源于ATCC。L-抗坏血酸(VC)购于上海麦克林生化科技有限公司;水溶性维生素E(VE)购于上海源叶生物科技有限公司。
牛耳朵全草于2021年3月采自贵州省安顺市紫云苗族布依族自治县岩上村,经贵州省中国科学院天然产物化学重点实验室顾玮副研究员鉴定为牛耳朵P.eburnea(Hance) Y. Z. Wang,凭证标本(GZCNP-G-2021-003)保存在贵州省中国科学院天然产物化学重点实验室。
2 方法
2.1 提取与分离
牛耳朵干燥全草30 kg 粉碎后过40 目筛,之后用80%甲醇水溶液加热回流提取6 次(每次3 h)过滤,合并滤液,减压浓缩得提取物浸膏(2.9 kg),用适量的水溶解浸膏成悬浊液,依次用石油醚,醋酸乙酯和正丁醇萃取至无色,减压浓缩各部分萃取液得到石油醚部位(505.0 g)、醋酸乙酯部位(210.0 g)和正丁醇部位(1.1 kg)。将醋酸乙酯部位(210.0 g)用硅胶柱色谱(40~80 目)进行分离,洗脱溶剂为石油醚-醋酸乙酯(50∶1、20∶1、10∶1、5∶1、2∶1、1∶1)及三氯甲烷-甲醇(20∶1、10∶1、5∶1、2∶1、1∶1),结合TLC 检测,将牛耳朵醋酸乙酯层分离得到9 个组分(Fr. A~I)。Fr. D(16.0 g)用硅胶柱色谱(200~300 目)进行分离,石油醚-醋酸乙酯(20∶1~2∶1)梯度洗脱得到Fr. D.1~D.6。Fr. D.4(1.7 g)经Sephadex LH-20 凝胶柱色谱得到化合物2(10.8 mg)和3(3.4 mg)。Fr. D.4.4(215.7 mg)经半制备RP-HPLC(甲醇-水-甲酸40∶60∶0.04,2.0 mL/min)得到化合物19(15.2 mg,tR=13.6 min)、20(2.4 mg,tR=26.7 min)和22(16 mg,tR=28.5 min)。Fr. D.5(1.8 g)在滤出不溶性粉末(Fr. D.5a)后经Sephadex LH-20 凝胶柱色谱得到化合物1(8.1 mg)、4(4.1 mg)和21(15.9 mg)。Fr. D.5a(272.0 mg)先用硅胶柱色谱(200~300 目)进行分离,石油醚-醋酸乙酯(30∶1~20∶1)梯度洗脱,后经Sephadex LH-20 凝胶柱色谱得到化合物5(22.3 mg)。Fr. E(5.4 g)用硅胶柱色谱(200-300目)进行分离,石油醚-醋酸乙酯(10∶1~1∶1)梯度洗脱得到Fr. E.1~E.4。Fr. E.3(2.5 g)用硅胶柱色谱(200~300 目)进行分离,三氯甲烷-醋酸乙酯(200∶1~10∶1)梯度洗脱得到化合物8(4.8 mg)、12(24.7 mg)、13(42 mg)和23(31 mg)。Fr. F(22.3 g)先经RP-C18柱色谱,甲醇-水(20∶80~100∶0)洗脱得到Fr. F.1~F.14。Fr. F.8 经重结晶得到化合物9(15.4 mg)。Fr. G(15.9 g)用RP-C18反相柱色谱,甲醇-水(10∶90~100∶0)洗脱得到Fr. G.1~G.9。Fr. G.2(590.0 mg)先用Sephadex LH-20 凝胶柱色谱分离,后经硅胶柱色谱(200~300目)分离,三氯甲烷-甲醇(60∶1~20∶1)洗脱得到化合物11(7 mg)。Fr. G.3(2.5 g)用硅胶柱色谱(200~300 目)进行分离,三氯甲烷-甲醇(100∶1~2∶1)洗脱得到Fr. G.3. 1~G.3. 7。Fr. G.3. 4(93.0 mg)经半制备RP-HPLC(甲醇-水-甲酸30∶70∶0.04,2.0 mL/min)纯化得到化合物10(59 mg,tR=51.6 min)。Fr. G.3. 6(817 mg)用硅胶柱色谱(200~300目)进行分离,三氯甲烷-丙酮(20∶1~1∶1)得到化合物14(4 mg)。Fr. G.3. 7(547.0 mg)经半制备RP-HPLC(甲醇-水-甲酸35∶65∶0.04,2.0 mL/min)得到化合物15(6.7 mg,tR=41.4 min)和16(8.3 mg,tR=89 min)。Fr. G.6(967 mg)用硅胶柱色谱(200~300 目)进行分离,三氯甲烷-甲醇(100∶1~5∶1)洗脱得到化合物6(20 mg)。Fr. H(72.7 g)用RP-C18柱色谱,甲醇-水(10∶90~100∶0)洗脱得到Fr. H.1~H.9。Fr. H.3(11.9 g)用硅胶柱色谱(200~300 目)进行分离,三氯甲烷-甲醇(15∶1~1∶1)洗脱得到Fr. H.3. 1~H.3. 5。Fr. H.3. 5(8.4 g)用Sephadex LH-20 凝胶柱色谱分离得到化合物17(2.3 mg)和18(7.3 mg)。Fr. H.7(670 mg)用硅胶柱色谱(200~300 目)进行分离,石油醚-醋酸乙酯(8∶1~1∶1)洗脱得到化合物7(15 mg)。
2.2 细胞毒活性筛选
2.2.1 A549 细胞培养 将A549 细胞复苏后,用含有10% FBS 血清的DMEM 培养基培养生长,于5%CO2、37 ℃的恒温培养箱中培养。
2.2.2 MTT 法检测牛耳朵化学成分对A549 的细胞毒活性 该实验参考文献报道的方法[11]稍加修改,取对数生长期的非小细胞肺癌A549 细胞,以5×103/孔的密度接种到无菌的96 孔培养板。待细胞贴壁后,设置空白组、对照组和实验组。实验组分别加入不同浓度化合物溶液。培养48 h 后,每孔分别加入MTT(5 mg/mL)溶液10 μL,在细胞培养箱内继续培养 4 h 后加入二甲基亚砜(dimethyl sulfoxide,DMSO)150 μL,充分震荡后溶解结晶,之后用酶标仪在490 nm 波长下检测各孔吸光度(A)值,按照下面公式计算细胞生长抑制率。每组设置3个复孔,实验重复3次。对于在质量浓度100 μg/mL下抑制率大于50%的化合物继续进行浓度梯度实验,并计算半数抑制浓度(half maximal inhibitory concentration,IC50)值。
2.3 抗氧化活性筛选
本研究分别用DPPH 方法和ABTS 方法对化合物的抗氧化活性进行筛选。DPPH 自由基清除活性研究参考本课题组前期报道的方法[12]。ABTS+自由基清除活性实验参考文献报道的方法[13]。取7 mmol/L 的 ABTS+与 2.6 mmol/L 的过硫酸钾(K2S2O8)溶液等体积混合均匀后室温避光静置过夜,临用前用甲醇溶液将ABTS+储备液进行稀释,使其A值在734 nm 下为0.70±0.02,制成ABTS工作液。将不同质量浓度(30、10、3.333 3、1.111 1、0.370 3、0.123 4 μg/mL)的样品溶液添加到稀释的ABTS+溶液中,混匀,避光反应6 min 后,用酶标仪在734 nm 下测定A值。以ABTS+工作液与无水甲醇溶液混合作为背景组(A0)。以VE 为阳性药,所有测定均平行重复3 次,计算IC50值。化合物对ABTS+自由基的清除率可按照公式计算得出。
3 结果
3.1 结构鉴定
化合物1:黄色粉末,分子式C16H12O5,ESI-MSm/z: 285 [M+H]+。1H-NMR (600 MHz, DMSO-d6)δ:7.51 (1H, d,J= 7.5 Hz, H-3), 7.58 (1H, d,J= 7.5 Hz,H-4), 7.50 (1H, s, H-5), 7.48 (1H, s, H-8), 2.25 (3H, s,-CH3), 3.95 (3H, s, -OCH3), 12.87 (1H, s, 1-OH);13C-NMR (150 MHz, DMSO-d6)δ: 159.8 (C-1), 133.5(C-2), 136.9 (C-3), 114.7 (C-4), 131.2 (C-4a), 118.4(C-5), 152.9 (C-6), 153.4 (C-7), 108.9 (C-8), 126.6(C-8a), 188.1 (C-9), 112.1 (C-9a), 180.6 (C-10), 127.4(C-10a), 15.7 (-CH3), 56.0 (-OCH3)。以上数据与文献报道的基本一致[14],鉴定化合物1 为1,6-dihydroxy-7-methoxy-2-methylanthr-quinone。
化合物2:橙黄色粉末,分子式C16H12O5,ESI-MSm/z: 253 [M-H]-。1H-NMR (600 MHz,DMSO-d6)δ: 7.54 (1H, d,J= 7.6 Hz, H-3), 7.62 (1H,d,J= 7.6 Hz, H-4), 7.48 (1H, d,J= 2.5 Hz, H-5), 7.22(1H, dd,J= 2.5, 8.5 Hz, H-7), 8.02 (1H, d,J= 8.5 Hz, H-8), 2.26 (3H, s, -CH3), 12.74 (1H, s, 1-OH);13C-NMR (150 MHz, DMSO-d6)δ: 159.7 (C-1), 133.1(C-2), 137.2 (C-3), 118.2 (C-4), 130.9 (C-4a), 111.8(C-5), 162.9 (C-6), 125.0 (C-7), 129.6 (C-8), 121.8(C-8a), 188.4 (C-9), 114.8 (C-9a), 180.1 (C-10), 134.6(C-10a), 15.4 (-CH3)。以上数据与文献报道的基本一致[15],故鉴定化合物2 为soranjidiol。
化合物3:红色粉末,分子式C15H10O5,ESI-MSm/z: 269 [M-H]-。1H-NMR (600 MHz, DMSO-d6)δ:7.24 (1H, s, H-3), 8.04 (1H, d,J= 8.5 Hz, H-5), 7.22(1H, dd,J= 2.5, 8.5 Hz, H-6), 7.47 (1H, d,J= 2.5 Hz,H-8), 2.22 (3H, s, -CH3), 13.06 (1H, s, 1-OH), 12.94(1H, s, 4-OH);13C-NMR (150 MHz, DMSO-d6)δ:156.9 (C-1), 112.2 (C-2), 129.3 (C-3), 156.5 (C-4),110.8 (C-4a), 130.0 (C-5), 122.5 (C-6), 164.0 (C-7),112.6 (C-8), 135.5 (C-8a), 187.3 (C-9), 139.9 (C-9a),185.6 (C-10), 125.2 (C-10a), 16.3 (-CH3)。以上数据与文献报道的基本一致[16],故鉴定化合物 3 为1,4,7-trihydroxy-2-methyl-9,10-anthraquinone。
化合物4:黄色粉末,分子式C15H10O4,ESI-MSm/z: 253 [M-H]-。1H-NMR (600 MHz, DMSO-d6)δ:7.91 (1H, d,J= 7.7 Hz, H-3), 7.77 (1H, d,J= 7.7 Hz,H-4), 8.19~8.21 (1H, m, H-5), 7.94~7.97 (2H, m,H-6, 7), 8.24~8.25 (1H, m, H-8), 4.66 (2H, s, H-1′),12.77 (1H, s, 1-OH), 5.48 (1H, s, 1′-OH);13C-NMR(150 MHz, DMSO-d6)δ: 158.4 (C-1), 138.3 (C-2),133.6 (C-3), 118.9 (C-4), 131.3 (C-4a), 126.6 (C-5),135.2 (C-6), 134.6 (C-7), 126.9 (C-8), 132.8 (C-8a),188.7 (C-9), 114.9 (C-9a), 181.8 (C-10), 133.3(C-10a), 57.5 (C-1′)。以上数据与文献报道的基本一致[16],故鉴定化合物4 为digiferruginol。
化合物5:红色粉末,分子式C15H10O5,ESI-MSm/z: 269 [M-H]-。1H-NMR (600 MHz, DMSO-d6)δ:7.27 (1H, s, H-3), 8.22 (2H, dd,J= 5.0, 4.0 Hz, H-5,8), 7.99~7.91 (2H, m, H-6, 7), 4.57 (2H, s, H-1′),12.93 (1H, s, 1-OH), 12.68 (1H, s, 4-OH), 5.57 (1H, s,1′-OH);13C-NMR (150 MHz, DMSO-d6)δ: 154.2(C-1), 144.7 (C-2), 124.5 (C-3), 157.0 (C-4), 110.7(C-4a), 126.5 (C-5), 134.9 (C-6), 135.0 (C-7), 126.5(C-8), 132.8 (C-8a), 186.2 (C-9), 111.4 (C-9a), 186.9(C-10), 132.6 (C-10a), 57.5 (C-1′)。以上数据与文献报道的基本一致[16],故鉴定化合物 5 为1,4-dihydroxy-2-hydroxymethylanthraquinone。
化合物6:黄色粉末,分子式C16H12O5,ESI-MSm/z: 269.1 [M-H]-。1H-NMR (600 MHz, DMSO-d6)δ: 7.53 (1H, d,J= 7.6 Hz, H-3), 7.46 (1H, d,J= 7.6 Hz, H-4), 7.44 (1H, s, H-5), 7.47 (1H, s, H-8), 2.22(3H, s, -CH3), 12.97 (1H, s, 1-OH);13C-NMR (150 MHz, DMSO-d6)δ: 159.8 (C-1), 133.5 (C-2), 136.7(C-3), 118.3 (C-4), 131.2 (C-4a), 113.1 (C-5), 151.4(C-6), 152.2 (C-7), 112.7 (C-8), 127.3 (C-8a), 187.9(C-9), 114.8 (C-9a), 180.8 (C-10), 126.1 (C-10a), 15.7(-CH3)。以上数据与文献报道的基本一致[17],故鉴定化合物6 为1,6,7-trihydroxy-2-methylanthracene-9,10-dione。
化合物7:红色粉末,分子式C15H14O5,ESI-MSm/z: 273.1 [M-H]-。1H-NMR (600 MHz, DMSO-d6)δ: 5.39 (1H, q,J= 6.4, 12.9 Hz, H-2), 8.16 (1H, d,J=8.2 Hz, H-5), 7.89 (1H, d,J= 8.2 Hz, H-6), 2.17 (3H,d,J= 6.9 Hz, 2-CH3), 2.18 (3H, s, 3α-CH3), 1.98 (3H,s, 3β-CH3);13C-NMR (150 MHz, DMSO-d6)δ: 90.9(C-2), 44.7 (C-3), 131.4 (C-3a), 180.6 (C-4), 124.0(C-4a), 119.7 (C-5), 119.9 (C-6), 152.1 (C-7), 150.5(C-8), 115.1 (C-8a), 183.0 (C-9), 157.9 (C-9a), 14.7(-CH3), 25.4 (3α-CH3), 20.3 (3β-CH3)。以上数据与文献报道的基本一致[5],故鉴定化合物 7 为(R)-7,8-dihydroxy-α-dunnione。
化合物8:黄色粉末,分子式C12H9NO4,ESI-MSm/z: 254 [M+Na]+。1H-NMR (600 MHz, CDCl3)δ:8.09 (d,J= 7.8 Hz, H-5), 7.71 (t,J= 7.8 Hz, H-6),7.82 (t,J= 7.8 Hz, H-7), 8.23 (d,J= 7.8 Hz, H-8),3.95 (3H, s, H-12), 9.12 (1H, brs, -NH2), 6.98 (1H,brs, -NH2);13C-NMR (150 MHz, CDCl3)δ: 172.9(C-1), 101.6 (C-2), 153.2 (C-3), 180.7 (C-4), 126.4(C-5), 136.1 (C-6), 132.6 (C-7), 127.6 (C-8), 129.7(C-9), 134.2 (C-10), 169.6 (C-11), 52.3 (C-12)。以上数据与文献报道的基本一致[18],故鉴定化合物8 为3-amino-2-methoxycarbonyl-1,4-naphthoquinone。
化合物9:黄色粉末,分子式C15H10O6,ESI-MSm/z: 285 [M-H]-。1H-NMR (600 MHz, CD3OD)δ:6.66 (1H, s, H-3), 6.18 (1H, d,J= 2.1 Hz, H-6), 6.44(1H, d,J= 2.1 Hz, H-8), 7.40 (1H, d,J= 2.3 Hz,H-2′), 6.89 (1H, d,J= 8.3 Hz, H-5′), 7.41 (1H, dd,J=2.3, 8.3 Hz, H-6′), 12.97 (1H, s, 5-OH);13C-NMR(150 MHz, CD3OD)δ: 163.9 (C-2), 102.9 (C-3), 181.7(C-4), 161.5 (C-5), 98.9 (C-6), 164.2 (C-7), 93.9(C-8), 157.3 (C-9), 103.7 (C-10), 121.5 (C-1′), 113.4(C-2′), 145.8 (C-3′), 149.8 (C-4′) , 116.1 (C-5′), 119.0(C-6′)。以上数据与文献报道的基本一致[19],故鉴定化合物9 为木犀草素。
化合物10:无色油状物,分子式C20H24O6,ESI-MSm/z: 359 [M-H]-。1H-NMR (600 MHz,CD3OD)δ: 1.97~2.03 (1H, m, H-2), 1.74~1.78 (1H,m, H-3), 2.77 (2H, d,J= 7.7 Hz, H-4), 6.65 (1H, s,H-5), 6.18 (1H, s, H-8), 6.67 (1H, d,J= 1.8 Hz, H-2′),6.74 (1H, d,J= 8.0 Hz, H-5′), 6.61 (1H, dd,J= 1.8,8.0 Hz, H-6′), 3.70 (1H, dd,J= 4.1, 11.3 Hz, H-9a),3.39 (1H, dd,J= 4.1, 11.3 Hz, H-9b), 3.64~3.67 (2H,m, H-10), 3.80 (3H, s, -OMe), 3.87 (3H, s, -OMe);13C-NMR (150 MHz, CD3OD)δ: 48.0 (C-1), 47.9(C-2), 39.9 (C-3), 33.6 (C-4), 129.9 (C-4a), 112.3(C-5), 147.2 (C-6), 145.9 (C-7), 117.4 (C-8), 138.6(C-8a), 62.2 (C-9), 65.9 (C-10), 134.1 (C-1′), 113.8(C-2′), 149.0 (C-3′), 145.2 (C-4′), 116.0 (C-5′), 123.2(C-6′), 56.3 (-OMe)。以上数据与文献报道的基本一致[20],故鉴定化合物10 为异落叶松脂素。
化合物11:无色片状晶体(三氯甲烷/甲醇),分子式C15H10O6,ESI-MSm/z: 177 [M-H]-。1H-NMR (600 MHz, DMSO-d6)δ: 6.16 (1H, d,J= 9.4 Hz, H-3), 7.86 (1H, d,J= 9.4 Hz, H-4), 6.98 (1H, s,H-5), 6.74 (1H, s, H-8);13C-NMR (150 MHz,DMSO-d6)δ: 160.8 (C-2), 111.5 (C-3), 144.5(C-4),112.3 (C-5), 142.9 (C-6), 150.5 (C-7), 102.6 (C-8),148.5 (C-9), 110.7 (C-10)。以上数据与文献报道的基本一致[21],故鉴定化合物11 为七叶内酯。
化合物12:白色针晶(甲醇),分子式C8H10O2,ESI-MSm/z: 137.1 [M-H]-。1H-NMR (600 MHz,CD3OD)δ: 3.71 (1H, t,J= 7.2 Hz, H-1), 2.74 (1H, t,J= 7.2 Hz, H-2), 7.06 (1H, d,J= 8.5 Hz, H-4), 6.71(1H, d,J= 8.5 Hz, H-5), 6.71 (1H, d,J= 8.5 Hz, H-7),6.71 (1H, d,J= 8.5 Hz, H-8);13C-NMR (150 MHz,CD3OD)δ: 64.6 (C-1), 39.4 (C-2), 130.9 (C-3), 130.9(C-4), 116.1 (C-5), 156.7 (C-6), 116.1 (C-7), 130.9(C-8)。以上数据与文献报道的基本一致[22],故鉴定化合物12 为酪醇。
化合物13:白色针晶(丙酮),分子式C9H8O3,ESI-MSm/z: 163 [M-H]-。1H-NMR (600 MHz,CD3OD)δ: 7.42 (2H, d,J= 8.6 Hz, H-2, 6), 6.81 (2H,d,J= 8.6 Hz, H-3, 5), 7.60 (1H, d,J= 16 Hz, H-7),6.28 (1H, d,J= 16 Hz, H-8);13C-NMR (150 MHz,CD3OD)δ: 127.2 (C-1), 131.1 (C-2), 116.8 (C-3),161.1 (C-4), 116.8 (C-5), 131.1 (C-6), 146.7 (C-7),115.6 (C-8), 171.0 (C-9)。以上数据与文献报道的基本一致[23],故鉴定化合物13 为对香豆酸。
化合物14:棕黄色粉末,分子式C10H10O4,ESI-MSm/z: 193 [M-H]-。1H-NMR (600 MHz,CD3OD)δ: 7.07 (1H, d,J= 2.0 Hz, H-2), 6.81 (1H, d,J= 8.2 Hz, H-5), 6.97 (1H, dd,J= 2.0, 8.2 Hz, H-6),6.29 (1H, d,J= 15.9 Hz, H-7), 7.57 (1H, d,J= 15.9 Hz, H-8), 3.78 (3H, s, -OCH3);13C-NMR (150 MHz,CD3OD)δ: 127.7 (C-1), 115.1 (C-2), 146.8 (C-3),149.6 (C-4), 116.5 (C-5), 122.9 (C-6), 114.8 (C-7),147.0 (C-8), 169.8 (C = O), 52.0 (-OCH3)。以上数据与文献报道的基本一致[24],故鉴定化合物14 为咖啡酸甲酯。
化合物15:淡黄色油状物,分子式C14H20O8,ESI-MSm/z: 293 [M+Na]+。1H-NMR (600 MHz,CD3OD)δ: 7.46 (2H, d,J= 7.3 Hz, H-2, 6), 7.36 (2H,t,J= 7.3 Hz, H-3, 5), 7.30 (1H, t,J= 7.3 Hz, H-4),4.98 (1H, d,J= 11.4 Hz, overlapped, H-7a), 4.72 (1H,d,J= 11.4 Hz, H-7b), 4.46 (1H, d,J= 7.7 Hz, H-1′),3.40~3.60 (4H, m, H-2′~5′), 3.94 (1H, d,J= 11.4 Hz, H-6′a), 3.76 (1H, dd,J= 4.5, 11.4 Hz, H-6′b);13C-NMR (150 MHz, CD3OD)δ: 138.9 (C-1), 129.3(C-2, 6), 129.1 (C-3, 5), 128.7 (C-4), 69.9 (C-7), 103.3(C-1′), 73.5 (C-2′), 77.9 (C-3′), 71.9 (C-4′), 78.9(C-5′), 62.5 (C-6′)。以上数据与文献报道的基本一致[25],故 鉴 定 化 合 物 15 为 benzylO-β-Dglucopyranoside。
化合物16:淡黄色油状物,分子式C13H18O6,ESI-MSm/z: 293 [M+Na]+。1H-NMR (600 MHz,CD3OD)δ: 7.45 (2H, d,J= 7.2 Hz, H-2, 6), 7.36 (2H,d,J= 7.2 Hz, H-3, 5), 7.31 (1H, d,J= 7.2 Hz, H-4),4.98 (1H, d,J= 11.4 Hz, H-7a), 4, 72 (1H, d,J= 11.4 Hz, H-7b), 4.45 (1H, d,J= 6.0 Hz, H-1′), 3.42 (1H, m,H-2′), 3.47~3.60 (3H, m, H-3′~5′), 3.94 (1H, d,J=11.4 Hz, H-6′a), 3.76 (1H, dd,J= 4.5, 11.4 Hz,H-6′b);13C-NMR (150 MHz, CD3OD)δ: 138.9 (C-1),129.3 (C-2, 6), 129.2 (C-3, 5), 128.7 (C-4), 69.9(C-7), 103.3 (C-1′), 73.5 (C-2′), 77.9 (C-3′), 71.9(C-4′), 78.9 (C-5′), 62.5 (C-6′)。以上数据与文献报道的基本一致[26],故鉴定化合物16 为4-O-benzyl-D-glucopyranoside。
化合物17:淡黄色油状物,分子式C14H20O8,ESI-MSm/z: 317 [M+H]+。1H-NMR (600 MHz,CD3OD)δ: 6.72 (1H, d,J= 8.0 Hz, H-2), 6.70 (1H, d,J= 1.9 Hz, H-5), 6.58 (1H, dd,J= 1.9, 8.0 Hz, H-6),2.18 (2H, m, H-7), 4.05 (1H, m, H-8a), 3.71 (2H, m,H-8b, H-6′a), 4.32 (1H, d,J= 7.8 Hz, H-1′), 3.21 (1H,m, H-2′), 3.29 (2H, m, H-3′, H-4′), 3.38 (1H, m, H-5′),3.89 (1H, dd,J= 2.1, 12 Hz, H-6′b);13C-NMR (150 MHz, CD3OD)δ: 131.5 (C-1), 116.3 (C-2), 146.1(C-3), 144.6 (C-4), 117.6 (C-5), 121.2 (C-6), 36.6 (C-7),72.1 (C-8), 104.3 (C-1′), 75.1 (C-2′), 77.9 (C-3′), 71.6(C-4′), 78.1 (C-5′), 62.7 (C-6′)。以上数据与文献报道的基 本 一 致[27], 故 鉴 定 化 合 物 17 为 3,4-dihydroxyphenylethyl alcohol 8-O-β-glucopyrnoside。
化合物18:无色油状物,分子式C14H18O8,ESI-MSm/z: 337 [M+Na]+。1H-NMR (600 MHz,CD3OD)δ: 6.87 (1H, d,J= 1.5 Hz, H-2), 6.76 (1H, d,J= 8.1 Hz, H-5), 6.74 (1H, dd,J= 1.5, 8.1 Hz, H-6),4.56 (1H, dd,J= 2.8, 10.6 Hz, H-7), 3.97 (1H, dd,J=2.9, 12 Hz, H-8a), 3.69 (1H, dd,J= 10.7, 11.9 Hz,H-8b), 4.46 (1H, d,J= 7.7 Hz, H-1′), 3.19 (1H, dd,J= 7.7, 9.7 Hz, H-2′), 3.62 (1H, dd,J= 8.8, 9.4 Hz,H-3′), 3.43 (1H, dd,J= 8.8, 9.7 Hz, H-4′), 3.49 (1H,m, H-5′), 3.92 (1H, dd,J= 2.1, 12.0 Hz, H-6′a), 3.75(1H, dd,J= 5.5, 12.0 Hz, H-6′b);13C-NMR (150 MHz, CD3OD)δ: 129.9 (C-1), 115.0 (C-2), 146.3(C-3), 146.5 (C-4), 116.1 (C-5), 119.4 (C-6), 78.8 (C-7),72.8 (C-8), 99.5 (C-1′), 80.9 (C-2′), 75.1 (C-3′), 71.8(C-4′), 79.8 (C-5′), 62.5 (C-6′)。以上数据与文献报道的基本一致[28],故鉴定化合物18 为cuneataside A。
化合物19:无色针晶(丙酮),分子式C15H10O6,ESI-MSm/z: 285.1 [M-H]-。1H-NMR (600 MHz,CD3OD)δ: 6.16 (1H, d,J= 9.4 Hz, H-3), 7.86 (1H, d,J= 9.4 Hz, H-4), 6.98 (1H, s, H-5), 6.74 (1H, s, H-8);13C-NMR (150 MHz, CD3OD)δ: 160.8 (C-2), 111.5(C-3), 144.5 (C-4), 112.3 (C-5), 142.9 (C-6), 150.5(C-7), 102.6 (C-8), 148.5 (C-9), 110.7 (C-10)。以上数据与文献报道的基本一致[29],故鉴定化合物19 为对羟基苯甲醛。
化合物20:无色针晶(甲醇),分子式C8H8O3,ESI-MSm/z: 151 [M-H]-。1H-NMR (600 MHz,CD3OD)δ: 7.84~7.91 (2H, m, H-2, 6), 6.81~6.86(2H, m, H-3, 5), 3.86 (3H, s, -OCH3);13C-NMR (150 MHz, CD3OD)δ: 122.4 (C-1), 132.8 (C-2, 6), 116.2(C-3, 5), 163.6 (C-4), 168.8 (-CHO), 52.2 (-OCH3)。以上数据与文献报道的基本一致[30],故鉴定化合物20为尼泊金甲酯。
化合物21:白色针晶(氯仿),分子式C8H8O2,ESI-MSm/z: 135 [M-H]-。1H-NMR (600 MHz,CDCl3)δ: 7.94 (2H, d,J= 8.8 Hz, H-2, 6), 6.97 (2H,d,J= 8.8 Hz, H-3, 5), 2.61 (3H, s, H-2′);13C-NMR(150 MHz, CDCl3)δ: 129.7 (C-1), 131.4 (C-2), 115.7(C-3), 161.5 (C-4), 115.7 (C-5), 131.4 (C-6), 198.7(C-1′), 26.4 (C-2′)。以上数据与文献报道基本一致[31],故鉴定化合物21 为对羟基苯乙酮。
化合物22:白色针晶(甲醇),分子式C8H8O3,ESI-MSm/z: 151 [M-H]-。1H-NMR (600 MHz,CDCl3)δ: 7.43 (1H, s, H-2), 6.94 (1H, d,J= 7.9 Hz,H-5), 7.42 (1H, d,J= 7.9 Hz, H-6), 9.74 (1H, s,-CHO), 3.91 (3H, s, -OCH3);13C-NMR (150 MHz,CDCl3)δ: 130.6 (C-1), 111.3 (C-2), 149.7 (C-3), 154.7(C-4), 116.3 (C-5), 127.9 (C-6), 192.9 (-CHO), 56.4(-OCH3)。以上数据与文献报道的基本一致[32],故鉴定化合物22 为香草醛。
化合物23:无色针晶(丙酮),分子式C8H8O4,ESI-MSm/z: 167 [M-H]-。1H-NMR (600 MHz,DMSO-d6)δ: 7.44 (1H, s, H-2), 6.84 (1H, d,J= 8.0 Hz, H-5), 7.44 (1H, d,J= 8.0 Hz, H-6), 3.37 (3H, s,3-OCH3), 9.87 (1H, s, 4-OH), 12.5 (1H, s, -COOH);13C-NMR (150 MHz, DMSO-d6)δ: 121.4 (C-1), 114.8(C-2), 147.0 (C-3), 150.8 (C-4), 112.5 (C-5), 123.2(C-6), 167.0 (-COOH), 55.3 (-OCH3)。以上数据与文献报道的基本一致[33],故鉴定化合物23 为香草酸。
3.2 细胞毒活性评价
3.2.1 对A549 细胞的细胞毒活性初筛结果 根据“2.2”项下方法,对其中18 个化合物进行了体外抗肿瘤活性的实验,结果如图1 所示,在浓度为100 μmol/L 时,化合物8 对A549 细胞增殖抑制率大于50%,其他化合物没有表现出显著的细胞毒活性。因此,进一步对化合物8 进行浓度梯度实验,计算其IC50值。
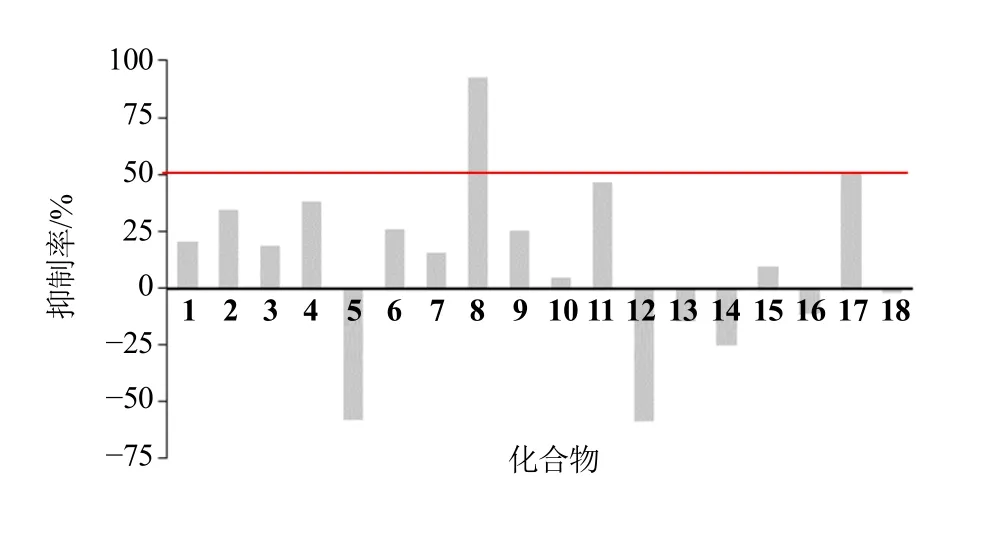
图1 牛耳朵化合物 (100 μmol·L-1) 对A549 细胞细胞毒活性初筛结果Fig. 1 Preliminary screening results of cytotoxic activity of compounds (100 μmol L-1) from P. eburnea on A549 cell line
3.2.2 化合物8 对A549 细胞的IC50值 化合物8对A549 细胞有显著的抑制作用(P<0.01),其IC50=(3.866±0.011)μmol/L,活性高于阳性药顺铂[IC50=(9.895±0.025)μmol/L]。
3.3 抗氧化活性筛选结果
根据“2.3”项下方法,对其中11 个化合物进行了体外抗氧化活性的实验,发现有6 个化合物有显著的抗氧化活性。结果见表1,化合物5~7、9~11 均表现出显著的抗氧化活性,其中化合物9 和11表现出的DPPH 自由基清除能力和ABTS 自由基清除能力均高于阳性药VC 和VE。
表1 化合物的DPPH 和ABTS 自由基抑制活性的结果(±s , n=3)Table 1 Results of DPPH and ABTS+ radical inhibitory activities of selected compounds (x ±s , n=3)

表1 化合物的DPPH 和ABTS 自由基抑制活性的结果(±s , n=3)Table 1 Results of DPPH and ABTS+ radical inhibitory activities of selected compounds (x ±s , n=3)
化合物 IC50/(μg·mL-1)DPPH ABTS+5 7.270±0.046 2.184±0.005 6 0.548±0.036 0.259±0.049 7 0.625±0.024 0.362±0.020 9 0.161±0.013 0.960±0.041 10 1.190±0.043 0.588±0.023 11 0.024±0.011 0.225±0.012 VC 0.306±0.021 VE 1.502±0.041
4 讨论
本实验从黔产牛耳朵的醋酸乙酯部位分离鉴定了23 个化合物,包含8 个醌类化合物,1 个黄酮类化合物,1 个木质素类化合物,1 个香豆素类化合物,8 个酚酸类化合物和4 个苷类化合物,其中化合物1~3、6 和8~22 为首次从报春苣苔属植物中分离得到。化合物8 对A549 细胞表现出显著的细胞毒活性。化合物5~7、9~11 均表现出显著的抗氧化活性,其中化合物9 和11 的抗氧化活性高于阳性药VC 和VE。本研究揭示了黔产牛耳朵中的化学成分,并印证了牛耳朵化学成分的抗肿瘤活性和抗氧化活性,为贵州牛耳朵资源的进一步开发和利用奠定了基础。
利益冲突所有作者均声明不存在利益冲突
