壮方壮肝逐瘀煎联合骨髓间充质干细胞移植对CCl4大鼠肝纤维化的影响
2023-05-30罗艺徽吴姗姗王振常吕艳杭
罗艺徽 吴姗姗 王振常 吕艳杭


〔摘要〕 目的 探討壮肝逐瘀煎联合骨髓间充质干细胞(bone marrow mensenchymal stem cell, BMMSC)移植对CCl4诱导的肝纤维化大鼠的影响。方法 取20只大鼠为正常对照组(A组),另取80只造模成功后的大鼠,随机分为模型组(B组)、单纯壮肝逐瘀煎组(C组)、单纯BMMSC组(D组)、壮肝逐瘀煎联合BMMSC组(E组),每组20只。A组、B组、D组灌服生理盐水(0.1 mL/kg,1次/d),C组、E组灌服壮肝逐瘀煎(0.1 mL/kg,1次/d),各组均连续干预12周。其中,第4周末,B组、C组尾静脉注射生理盐水,D组、E组尾静脉注射BMMSC。干预后,采用HE染色观察各组大鼠肝脏病理变化;采用全自动生化仪检测肝功能指标[谷草转氨酶(aspartate aminotransaminase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)、总胆红素(total bilirubin, TBIL)、白蛋白(albumin, ALB)]变化;采用RT-PCR检测肝组织甲胎蛋白(alpha fetoprotein, AFP)、ALB、细胞角蛋白18(cytokeratin 18, CK18)mRNA;采用Western blot检测表皮生长因子(epidermal growth factor, EGF)、肝细胞生长因子(hepatocyte growth factor, HGF)的表达;冷冻切片技术检测携带绿色荧光蛋白的BMMSC向肝脏归巢的情况。结果 B组肝小叶结构被广泛增生的纤维化组织分割并包绕成大小不等的圆形或类圆形的肝细胞团(即假小叶),肝细胞排列絮乱、坏死、变性及再生。C组、D组、E组肝小叶结构得到不同程度的恢复,肝细胞变性、水肿得到不同程度的改善。与A组比较,B组AST、ALT、TBIL明显升高(P<0.05),ALB和AFP、ALB、CK18 mRNA及HGF、EGF蛋白表达明显降低(P<0.05)。与B组比较,C组、D组、E组AST、ALT、TBIL明显降低(P<0.05),ALB和AFP、ALB、CK18 mRNA及HGF、EGF蛋白表达明显升高(P<0.05)。与E组比较,C组、D组AST、ALT、TBIL明显升高(P<0.05),ALB和AFP、ALB、CK18 mRNA及HGF、EGF蛋白表达明显降低(P<0.05)。免疫荧光结果显示,E组肝脏内携带绿色荧光蛋白数量明显高于A组、D组。结论 壮肝逐瘀煎联合BMMSC治疗可抗肝纤维化,可有效促进BMMSC向肝脏归巢,修复受损的肝组织。
〔关键词〕 壮肝逐瘀煎;骨髓间充质干细胞移植;联合治疗;归巢;CCl4;肝纤维化
〔中图分类号〕R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.03.012
Effects of Zhuangfang Zhuanggan Zhuyu Decoction combined with bone marrow mesenchymal stem cell transplantation on rats with CCl4-induced liver fibrosis
LUO Yihui, WU Shanshan, WANG Zhenchang, LV Yanhang
Guangxi International Zhuang Medicine Hospital, Nanning, Guangxi 530201, China
〔Abstract〕 Objective To investigate the effects of Zhuanggan Zhuyu Decoction (ZGZYD) combined with bone marrow mesenchymal stem cell (BMMSC) transplantation on rats with CCl4-induced liver fibrosis. Methods A total of 20 rats was taken as normal control group (group A). Another 80 model rats were randomly divided into model group (group B), ZGZYD group (group C), BMMSC group (group D), ZGZYD+BMMSC group (group E), with 20 rats in each group. Group A, B and D were administrated with physiology brine (0.1 mL/kg, once a day), while group C and E were administrated with ZGZYD (0.1 mL/kg, once a day). All groups were treated for 12 weeks. At the end of the 4th week, group B and C were injected with normal saline into caudal vein, meanwhile, group D and E were injected with BMMSC into caudal vein. After the intervention, the pathological changes of liver in each group were observed by HE staining; automatic biochemical instrument was used to detect the changes of liver function indexes [aspartate aminotransaminase (AST), alanine aminotransferase (ALT), total bilirubin (TBIL), albumin (ALB)]; RT-PCR was used to detect alpha fetoproteinb (AFP), ALB, and cytokeratin 18 (CK18) mRNA in liver tissue; the expression of epidermal growth factor (EGF) and hepatocyte growth factor (HGF) was detected by Western blot and the homing of BMSC with green fluorescent protein to liver tissue was detected by frozen section. Results The normal liver lobules in group B were segmented and surrounded by extensively proliferative fibrosis tissue into circular or quasi-circular hepatocyte masses of different sizes (false lobe), with disorganized hepatocytes and hepatocyte necrosis, degeneration and regeneration. While in group C, D and E, the liver lobular structure was recovered to different extent, and hepatocyte degeneration and edema were improved to varying degrees. Compared with group A, the AST, ALT and TBIL in group B were significantly higher (P<0.05), while ALB and AFP, ALB and CK18 mRNA, as well as protein expression of EGF and HCG were significantly lower (P<0.05). Compared with group B, the AST, ALT and TBIL in group C, D and E were significantly lower (P<0.05), but the ALB, and AFP, ALB, CK18 mRNA as well as protein expression of EGF and HCG were significantly higher (P<0.05). Compared with group E, the AST, ALT, and TBIL in group C and D were significantly higher (P<0.05), but the ALB, AFP, ALB, CK18 mRNA, protein expression of EGF and HCG were significantly lower (P<0.05). The results of immunofluorescence showed that the number of green fluorescent protein in the liver of group E was significantly higher than that of group A and D. Conclusion ZGZYD combined with BMMSC treatment can resist liver fibrosis, effectively promote BMMSC homing to the liver, and repair the damaged liver tissue.
〔Keywords〕 Zhuanggan Zhuyu Decoction; bone marrow mesenchymal stem cell transplantation; combination therapy; homing; CCl4; liver fibrosis
壮医是我国传统医学的重要组成部分,更是极具民族特色的医学。壮医的基础理论主要包括:“阴阳为本,天地人三气同步”的天人合一自然观,“三道”(气道、水道、谷道)、“两路”(龙路、火路)的生理病理观,“毒虚致百病”的病因病机,“调气、补虚、祛毒”的治疗原则和“主药、公药、母药、帮药”的方剂配伍用药原则[1]。壮医学把肝称为“咪叠”,肝纤维化可纳入壮医学“咪叠蛊”范畴。壮医学认为,“咪叠蛊”是由于人体正气亏虚,毒邪侵人体,“毒”邪寄生“咪叠”,阻塞“三道”“两路”,致嘘嘞(气血)瘀滞,“咪叠”疏泄功能失调,使内毒蕴生、三气不能同步[2]。壮肝逐瘀煎在已故全国老中医药专家学术经验继承工作指导老师林沛湘治疗慢性肝炎、肝硬化的有效验方基础上,融入颇具壮医特色的“泽兰”“虎杖”等药,在临床上运用已有近40年,能显著改善慢性肝炎、肝硬化患者的临床症状[3]。
骨髓间充质干细胞(bone marrow mensenchymal stem cell, BMMSC)是一类起源于中胚层的成体干细胞,具有自我更新及多向分化潜能,以修复受损的细胞、组织和器官,以达到治疗疾病的目的[4-6]。BMMSC是一种多功能干细胞,不仅可以在体内分化为正常的肝细胞及胆管上皮细胞,还可以通过分泌多种促进肝脏的生长因子,达到逆转肝纤维化的目的[7]。研究证实,BMMSC移植后对肝硬化患者近期效果显著,表现为肝功能明显好转,临床症状显著改善,但其远期效果不理想,限制了其广泛应用[8-10]。本研究通过壮肝逐瘀煎联合BMMSC阐述中医药的优势,通过中医药改善移植后的BMMSC生存微环境,促进BMMSC向肝样细胞分化。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年SPF级Wistar大鼠110只,雌雄各半,体质量120~150 g,5周龄的SPF级Wistar雄性大鼠10只,均购自广西医科大学实验动物研究所,实验动物合格证:SCXK(桂)2018-0001。本实验于广西中医药大学第一附属医院动物实验中心及医学分子生物学实验室、广西中医药大学实验动物中心、广西中医药大学基础医学院生化实验室及中医内科实验室完成。实验动物的管理及处置经广西中医药大学国际壮医院伦理委员会批准通过(伦理审批号:2016-S067)。大鼠饲养温度20~25 ℃,相对湿度50%~65%。
1.1.2 实验药物 壮肝逐瘀煎由生黄芪15 g(批号:180503),薏苡仁45 g(批号:180121),生牡蛎30 g(批号:180201),黄精20 g(批号:180204),枸杞子20 g(批号:180323),橘红12 g(批号:180526),泽兰30 g(批号:180522),鳖甲30 g(批号:170908),鸡内金15 g(批号:171004),虎杖20 g(批号:170929),大枣15 g(批号:171106)组成,免煎颗粒药物均购自江苏江阴天江药业有限公司,由广西中医药大学附属国际壮医医院药学部严格按照1∶6比例进行颗粒配方。
1.1.3 主要试剂 CCl4分析纯(国药集团化学试剂上海有限公司,批号:219006);花生油(山东烟台莱阳鲁花浓香花生油有限公司,批号:20190622);DMEM培养液(美国Gibco公司,批号:180229);细胞分离液(密度1.073 g/L,批號:161126)、胰蛋白酶(批号:181109)均购自德国Sigma公司;裂解液(批号:R0010)、缓冲液(批号:P1016)、TBST(批号:T1081)、脱脂奶粉(批号:D8340)、ECL显色剂(批号:PE0010)均购自北京索莱宝科技有限公司;表皮生长因子(epidermal growth factor, EGF,批号:ab83760)、肝细胞生长因子(hepatocyte growth factor, HGF,批号:ab77851)、β-actin(批号:ab8227)、羊抗兔抗体(批号:ab6721)均购自英国Abcam公司。
1.1.4 主要仪器 低温高速离心机(德国Eppendorf公司,型号:5417R);石蜡切片机(绍兴谱尔仪器设备有限公司,型号:SHANDON);全自动生化分析仪(南京颐兰贝生物科技有限公司,型号:ES-480);显微镜(日本Olympus公司,型号:IX71-22FL/PH);蛋白核酸分析仪(美国Beckman Coulter公司,型号:DU-640);凝胶成像仪(上海天能科技有限公司,型号:5200)。
1.2 实验方法
1.2.1 实验动物分组 随机取20只成年Wistar大鼠为正常对照组(A组),剩余的90只大鼠采用CCl4复合因素行肝纤维化造模。于第8周末随机处死10只,验证肝纤维化模型是否成功。取80只造模成功后的大鼠,随机分为模型组(B组)、单纯壮肝逐瘀煎组(C组)、单纯BMMSC组(D组)、壮肝逐瘀煎联合BMMSC组(E组),每组20只。
1.2.2 造模方法 采用CCl4植物油混悬液复合因素诱导肝纤维化方法进行造模[11],皮下注射40% CCl4(第1次为5 mL/kg,以后每隔3天为3 mL/kg),联合高脂、低蛋白食物(以玉米面为饲料,实验第1~2周加用0.5%胆固醇、20%猪油)。为了避免肝纤维化自然修复对实验结果造成的影响,所有造模大鼠灌胃给药开始后仍每周腹腔注射1次40% CCl4 3 mL/kg[11]。
1.2.3 大鼠BMMSC的提取 取10只5周龄雄性SD大鼠,颈椎脱臼处死。取股骨,保留骨骺,无菌处理后转移至超净工作台内,无菌血管钳夹碎两端骨骺,用吸满PBS的注射器冲出骨髓腔内的骨髓,收集于离心管内。将采集到的骨髓用细胞分离液分离。将密度为1.073 g/mL的细胞分离液先置于试管底部,然后按照3∶2的比例缓慢滴加获得的骨髓液,3000 r/min、半径30 cm离心30 min,弃上清液,用含10%胎牛血清的DMEM培养基重悬,接种于细胞培养瓶中,于37 ℃、5% CO2培养箱内培养。24 h后更换培养液,此后每3天换1次培养液,待细胞汇合度至70%时传代,培养至第4代,取2×106个BMMSC,经大鼠尾静脉注射,用于体内移植[12]。
1.2.4 给药方法 A组、B组、D组灌服生理盐水(0.1 mL/kg,1次/d),C组、E组灌服壮肝逐瘀煎(0.1 mL/kg,
1次/d)[11],各组均连续干预12周。其中,第4周末,B组、C组尾静脉注射生理盐水,D组、E组尾静脉注射BMMSC。
1.2.5 标本的采集与处理 干预后,禁食12 h,经1%戊巴比妥麻醉,股静脉采血后处死,开腹剖取肝脏,每只均取肝脏右叶相同部位的组织一块置入10%的甲醛,行常规石蜡切片,其余于液氮中保存肝组织,以备提取mRNA。
1.2.6 观察指标及检测方法
(1)一般情况。观察大鼠在实验期间的体质量改变、摄食量、对外界的反应、活动度的改变、毛发变化,同时记录大鼠死亡情况及时间。
(2)实验室指标。采用全自动生化仪检测大鼠血清谷草转氨酶(aspartate aminotransaminase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)、白蛋白(albumin, ALB)、总胆红素(total bilirubin, TBIL)。
(3)HE染色观察肝组织结构及纤维增生。各组肝组织相同部位进行石蜡切片并采用HE染色,在光学显微镜下观察肝组织结构及纤维增生等。
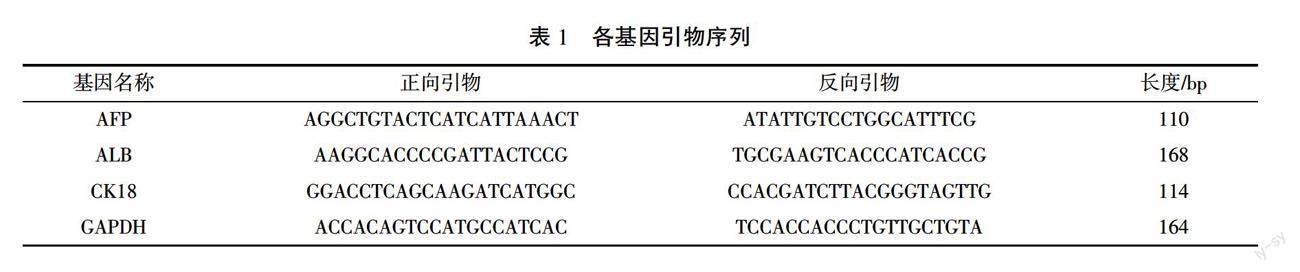
(4)RT-PCR检测甲胎蛋白(alpha fetoprotein, AFP)、ALB、细胞角蛋白18(cytokeratin 18, CK18)mRNA的表达。用Trizol提取肝组织总RNA,采用微量紫外光光度计测定其浓度及纯度,逆转为互补DNA。扩增条件:ALB,94 ℃ 1 min,58 ℃ 1 min,72 ℃ 1 min,35个循环;AFP,94 ℃ 45 s,51 ℃ 45 s,72 ℃ 45 s,35个循环;CK18,94 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min,35个循环;GAPDH,94 ℃ 30 s,54 ℃ 30 s,72 ℃ 40 s,33个循环。以GAPDH为内参,引物设计详见表1。
(5)Western blot检测EGF、HGF蛋白的表达。取30 mg组织块置于离心管中,加入200~400 μL裂解液,组织匀浆机匀浆后,4 ℃、12 000 r/min、半径30 cm离心5 min,取上清液,采用BCA法测定蛋白含量。加入4倍蛋白上样缓冲液,100 ℃变性5~10 min。80 V恒压电泳约20 min,待样品进入分离胶层后,换用100 V恒压电泳1~1.5 h;200 mA恒流转膜60~90 min。用TBST配制8%脱脂奶粉作为封闭液,将膜放入封闭液中封闭3 h。按抗体说明书上的推荐比例使用封闭液将一抗进行稀释,将膜放入稀释后的一抗中,于4 ℃孵育12 h。一抗孵育完成后,使用TBST洗膜3次,每次15 min。将膜放入按1∶3000比例稀释的二抗中,于37 ℃孵育1 h,使用TBST洗膜3次,每次15 min,使用ECL显色剂对膜进行显色,于凝胶成像仪中进行曝光成像。
(6)肝组织冰冻切片及荧光拍照。新鲜肝脏组织固定液固定24 h以上,随后组织放于15%的蔗糖溶液内,4 ℃冰箱内脱水沉底后转入30%的蔗糖溶液内,4 ℃冰箱内脱水沉底。将脱好水的组织使用包埋剂进行包埋,冰冻切片机切片,厚度8~10 μm,置于载玻片上,-20 ℃冰箱内保存备用。然后将冰箱内的冰冻切片复温,晾干水分于冷丙酮固定10 min,待丙酮完全干后于PBS(pH 7.4)中在摇床上晃动,洗涤3次,5 min/次。滴加4′,6-二脒基-2-苯基吲哚,避光室温孵育10 min。充分洗脱4′,6-二脒基-2-苯基吲哚后,使用抗淬灭封片剂封片,于倒置荧光显微镜下拍照。
1.3 統计学方法
采用SPSS 21.0统计软件。计量资料使以“x±s”表示,多组样本均数满足正态分布,各组间比较采用单因素方差分析,组间比较采用t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠一般情况比较
A组大鼠行动自如灵活,皮毛光泽,饮食及大小便正常;B组从造模开始,活动饮食较前减少,皮毛杂乱且无光泽,体质量下降,部分大鼠大便溏烂;C组大鼠的抵抗能力较B组增强;D组大鼠的进食量明显较之前增加;E组大鼠皮毛杂乱、体质量下降、大便溏烂得到不同程度的缓解。
2.2 各组大鼠肝功能指标变化
与A组比较,B组AST、ALT、TBIL明显升高(P<0.05),ALB明显降低(P<0.05)。与B组比较,C组、D组、E组AST、ALT、TBIL明显降低(P<0.05),ALB明显升高(P<0.05)。与E组比较,C组、D组AST、ALT、TBIL明显升高(P<0.05),ALB明显降低(P<0.05)。详见表2。
2.3 各组大鼠病理情况比较
A组可见清晰结构的肝小叶,肝细胞以中央静脉为中心,向四周呈现放射状顺序排列;B组正常肝小叶结构被广泛增生的纤维化组织分割并包绕成大小不等的圆形或类圆形肝细胞团(即假小叶),肝细胞排列絮乱,可见坏死、变性及再生,再生的肝细胞核深染、体积变大,部分见双核、中央静脉消失。C组、D组、E组肝小叶结构得到不同程度的恢复,浸润在肝小叶的炎症细胞较B组减少,胶原沉淀较B组减少,部分肝小叶条索纤维疏松变窄甚至消失,肝细胞变性、水肿得到不同程度的改善。详见图1。
2.4 各组大鼠肝组织AFP、ALB、CK18 mRNA的表达情况
与A组比较,B组AFP、ALB、CK18 mRNA表达明显降低(P<0.05)。与B组比较,C组、D组、E组AFP、ALB、CK18 mRNA表达明显升高(P<0.05)。与E组比较,C组、D组AFP、ALB、CK18 mRNA表达明显降低(P<0.05)。详见表3。
2.5 各组大鼠肝组织中HGF、EGF蛋白的表达情况
与A组比较,B组HGF、EGF蛋白表达明显降低(P<0.05)。与B组比较,C组、D组、E组HGF、EGF蛋白表达明显升高(P<0.05)。与E组比较,C组、D组HGF、EGF蛋白表达明显降低(P<0.05)。详见图2、表4。
2.6 各组大鼠肝组织BMMSC归巢情况
E组肝脏内携带绿色荧光蛋白数量明显高于A组、D组。详见图3。
3 讨论
目前,我国乙型肝炎病毒感染人数已经居世界首位,每年有近50万人死于乙型肝炎病毒相关性疾病,如肝硬化甚至肝癌,其中50%为肝硬化及其相关并发症所致,致死率极高[13]。原位肝移植虽是终末期肝病较为理想的治疗方法,但因肝脏供体的紧缺、严重的免疫排斥反应及高昂的医疗费用,接受肝移植的患者相对较少。BMMSC是一种多功能干细胞,来源充足,易于获取,经多次传代具有稳定的生物活性,故为理想的组织工程种子细胞,不仅可以在体内分化为正常的肝细胞及胆管上皮细胞,还可以通过分泌多种促进肝脏的生长因子,逆转肝纤维化过程[14-15]。而CCl4诱导建立的肝纤维化模型在形态学、病理生理学等方面与人肝纤维化相似,已广泛应用于研究组织病理及相关药物抗纤维化的药效评价[16]。
BMMSC诱导分化为肝细胞可解决肝细胞的来源问题,为各种肝病治疗提供了可能。HGF、EGF、转化生长因子-β1、白介素-10、胰岛素、去甲肾上腺素等在肝细胞再生过程中起重要作用[17-20]。其中,HGF主要在肝脏库普弗细胞与肝窦内皮细胞中产生,HGF对肝细胞有促进有丝分裂作用[21]。HGF是作用于肝脏发育及肝再生的过程中最基本的细胞因子,参与胚肝发育及肝脏的发生、发展及肝再生的过程[22-24]。因此,HGF是体外诱导BMMSC向肝细胞方向分化的关键性细胞因子。EGF是表皮上生长家族的重要调节因子之一,是一种促有丝分裂因子,能促进BMMSC增殖、分化。AWAN等[25]研究证实采用EGF治疗慢性乙型病毒性肝炎患者,可显著改善肝功能,刺激肝细胞DNA进一步有效合成,促进肝细胞再生。日本学者早在2000年通过RT-PCR技术检测发现新鲜分离的大鼠骨髓细胞中存在表达AFP的细胞[26]。经不同浓度的HGF体外诱导培养,可检测到表达ALB、AFP mRNA的肝细胞样细胞[27]。本研究中,壮肝逐瘀煎、BMMSC及两者联合干预大鼠肝纤维化,结果显示3种方法肝组织中HGF、EGF均较B组明显升高,3种方法大鼠的肝功能较B组明显改善,且两者联合效果最为显著。
王振常教授认为湿热瘀毒残留难尽是肝炎肝纤维化或者肝硬化的启动因子和持续因子,是其基本病机[28]。湿热瘀毒所引起的人体各脏腑功能失调、气血阴阳失和、肝脾失调、三焦气化不利是生痰瘀之本,痰瘀阻络,络脉不通反过来影响气道的通畅。所以王教授主张治疗肝纤维化、肝硬化当以壮肝逐瘀为要,壮肝即是扶正,该方通过扶助正气为主,以达到“正气尚存,邪不可干”的功效,逐瘀即是祛邪,主要以清热化湿解毒、活血化瘀为主要功效,湿、热、瘀、毒得化,则气机升降可恢复,气、血、津、液则运行无畅,肝肾功能得以恢复。“正气得充,邪气得去”,全方共奏“壮肝逐瘀”之效。用壮医药特色理论诠释其方意,以生黄芪为主药,补后天脾气,又兼补肺健脾以通“气道”,利水托邪毒外出,振奋后天中州脾土之气,有“鼓舞脾脏之气顾护中州,防止肝之邪毒向脾脏传变”之意;以薏苡仁、泽兰、虎杖为公药,利水渗湿、散瘀止痛解毒以通调“水道”;黄精、枸杞子、生牡蛎、鳖甲为母药,补气养阴、滋补肝肾、益阴潜阳、软坚散结;鸡内金、橘红共为帮药,行气消食健脾,兼补脾肾之精,通調“谷道”;大枣调和诸药。诸药合用,共奏攻毒补虚、壮肝逐瘀之效。壮肝即是恢复正气,养肝阴、促进肝组织气血津液的恢复,保证BMMSC的归巢、增殖、分化、再生、修复的功能。逐瘀即是活血化瘀,保证了气血津液的畅通,达到“血和则经脉通行”,为BMMSC在血液及肝脏中提供良好的运行环境。行血是通过调整血脉的畅通,保障BMMSC在归巢肝脏时畅利通行。祛瘀是通过解除肝脏组织血液运行不畅、改善受损组织血液的瘀滞状态,从而改善BMMSC迁移至肝脏的病理环境。
综上所述,壮肝逐瘀煎联合BMMSC移植能协同发挥作用,一方面发挥了改善肝纤维化的作用,另一方面通过壮肝逐瘀促进BMMSC向肝细胞转分化、促进BMMSC归巢于肝脏,共同发挥抗肝纤维化的作用,促进肝脏迅速恢复。
参考文献
[1] 吕艳杭,吴姗姗,李凤珍,等.基于壮医药理论的新型冠状病毒肺炎的发病机制及防治策略[J].广西医学,2021,43(20):2474-2476,2480.
[2] 唐秀松,庞宇舟,方 刚,等.庞宇舟教授壮医毒病理论与应用[J].中国民族医药杂志,2020,26(8):13-17.
[3] 吕艳杭,吴姗姗,王振常,等.柔肝化纤颗粒治疗乙肝肝硬化腹水的临床疗效及对肝纤维化、氧化应激水平的影响[J].西部中医药,2021,34(3):19-24.
[4] 吕艳杭,吴姗姗,王振常,等.柔肝化纤颗粒联合骨髓间充质干细胞移植术治疗肝硬化失代偿期的临床疗效及其对血清炎性因子水平和免疫功能及氧化应激反应的影响[J].中国全科医学,2021,24(3):355-362.
[5] 吕艳杭,吴姗姗,王振常,等.柔肝化纤颗粒联合骨髓间充质干细胞移植治疗乙肝肝硬化的临床观察[J].中医药导报,2019,25(20):115-118.
[6] ZHOU W Y, LIN J X, ZHAO K, et al. Single-cell profiles and clinically useful properties of human mesenchymal stem cells of adipose and bone marrow origin[J]. The American Journal of Sports Medicine, 2019, 47(7): 1722-1733.
[7] CHU D T, PHUONG T N T, TIEN N L B, et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells[J]. International Journal of Molecular Sciences, 2020, 21(3): 708.
[8] WANG G L, REN C E, JIANG J Y. Effects of bone marrow mesenchymal stem cells on repair and receptivity of damaged endometrium in rats[J]. The Journal of Obstetrics and Gynaecology Research, 2021, 47(9): 3223-3231.
[9] FENG X R, YIN W, WANG J L, et al. Mitophagy promotes the stemness of bone marrow-derived mesenchymal stem cells[J]. Experimental Biology and Medicine, 2021, 246(1): 97-105.
[10] DING N, LI E M, OUYANG X B, et al. The therapeutic potential of bone marrow mesenchymal stem cells for articular cartilage regeneration in osteoarthritis[J]. Current Stem Cell Research and Therapy, 2021, 16(7): 840-847.
[11] 吳姗姗,王振常,黎 妍,等.中药复方壮肝逐瘀煎对肝纤维化模型大鼠微循环的影响[J].中华中医药学刊,2020,38(1):151-156,277.
[12] 李强强,谢亚东,张怀斌,等. SD大鼠骨髓间充质干细胞分离培养及鉴定的实验研究[J].现代生物医学进展,2021,21(13):2410-2414,2446.
[13] LIU L, GUO S J, SHI W W, et al. Bone marrow mesenchymal stem cell-derived small extracellular vesicles promote periodontal regeneration[J]. Tissue Engineering, 2021, 27(14): 962-976.
[14] LIU X, XIE J N, YANG L F, et al. Bone marrow mesenchymal stem cells enhance autophagy and help protect cells under hypoxic and retinal detachment conditions[J]. Journal of Cellular and Molecular Medicine, 2020, 24(6): 3346-3358.
[15] CHEN Z K, CHEN D Z, CAI C, et al. BMSCs attenuate hepatic fibrosis in autoimmune hepatitis through regulation of LMO7-AP1-TGFβ signaling pathway[J]. European Review for Medical and Pharmacological Sciences, 2021, 25(3): 1600-1611.
[16] WANG J C, LIU S Z, SHI J Y, et al. The role of lncRNAs in osteogenic differentiation of bone marrow mesenchymal stem cells[J]. Current Stem Cell Research and Therapy, 2020, 15(3): 243-249.
[17] ZHANG H, ZHANG W, BAI G C, et al. Bone morphogenetic protein-7 promotes neuronal differentiation of bone marrow mesenchymal stem cells in vitro[J]. BioMed Research International, 2021, 2021: 7239783.
[18] BI Y, GUO X, ZHANG M, et al. Bone marrow derived-mesenchymal stem cell improves diabetes-associated fatty liver via mitochondria transformation in mice[J]. Stem Cell Research and Therapy, 2021, 12(1): 602.
[19] YAO Y X, BI Z, WU R F, et al. METTL3 inhibits BMSC adipogenic differentiation by targeting the JAK1/STAT5/C/EBPβ pathway via an m6 A‐YTHDF2-dependent manner[J]. The FASEB Journal, 2019, 33(6): 7529-7544.
[20] LIU Y, LI M, YIN Z H, et al. SUMO-modified bone marrow mesenchymal stem cells promoted the repair of articular cartilage in rats[J]. Cell Biology International, 2020, 44(2): 560-568.
[21] ZHANG J, QIN X L, DENG Y F, et al. Transforming growth factor-β1 enhances mesenchymal characteristics of buffalo bone marrow-derived mesenchymal stem cells[J]. Cellular Reprogramming, 2021, 23(2): 127-138.
[22] KISSELEVA T, BRENNER D. Molecular and cellular mechanisms of liver fibrosis and its regression[J]. Nature Reviews Gastroenterology and Hepatology, 2021, 18(3): 151-166.
[23] SUN T, LI H L, BAI Y, et al. Ultrasound-targeted microbubble destruction optimized HGF-overexpressing bone marrow stem cells to repair fibrotic liver in rats[J]. Stem Cell Research and Therapy, 2020, 11(1): 145.
[24] KASRAEIAN M, GHASEMI E, DIANATPOUR M, et al. In utero xenotransplantation of mice bone marrow-derived stromal/stem cells into fetal rat liver: An experimental study[J]. International Journal of Reproductive Biomedicine, 2020, 18(9): 701-712.
[25] AWAN S J, BAIG M T, YAQUB F, et al. In vitro differentiated hepatic oval-like cells enhance hepatic regeneration in CCl4-induced hepatic injury[J]. Cell Biology International, 2017, 41(1): 51-61.
[26] ZHANG Q L, PAN Y, JI J J, et al. Roles and action mechanisms of WNT4 in cell differentiation and human diseases: A review[J]. Cell Death Discovery, 2021, 7: 287.
[27] XU Q Q, XIA W J, ZHOU L Z, et al. Determination of hepatic iron deposition in drug-induced liver fibrosis in rats by confocal micro-XRF spectrometry[J]. American Chemical Society Omega, 2022, 7(4): 3738-3745.
[28] 呂艳杭,吴姗姗,王振常,等.柔肝化纤解毒颗粒联合TACE治疗原发性肝癌疗效及对其血清指标和免疫功能的影响[J].中华中医药杂志,2022,37(4):2386-2390.
〔收稿日期〕2022-09-27
〔基金项目〕国家自然科学基金地区科学基金项目(81960910,81660745,81360598)。
〔第一作者〕罗艺徽,女,硕士,高级讲师,研究方向:中医药防治脾胃肝病临床教育与实验研究。
〔通信作者〕*王振常,男,教授,硕士,博士研究生导师,E-mail:Wangzhenchang924@163.com。
