加味丹参饮预防心肌缺血再灌注损伤作用机制的网络药理学分析与实验验证研究
2023-05-30胡旭东彭木子陈铭廖菁陈聪
胡旭东 彭木子 陈铭 廖菁 陈聪

〔摘要〕 目的 基于網络药理学预测加味丹参饮预防心肌缺血再灌注损伤(myocardial ischemia reperfusion injury, MIRI)的活性成分、作用靶点及信号通路,并进行实验验证研究。方法 通过TCMSP、UniProt等数据库搜集加味丹参饮相关成分及靶点;通过GeneCards、OMIM以及DRUGBANK数据库获取MIRI疾病相关靶点;利用STRING平台分析构建蛋白互作网络模型;通过Metascape平台分析“药物-成分-靶点”及其参与的生物学过程及信号通路,而后采用Cytoscape 3.7.1软件构建“加味丹参饮成分-MIRI靶点-通路”网络。加味丹参饮预防性给药灌胃1周后,采用结扎大鼠左前降支的方法,建立实验性MIRI大鼠模型。通过ELISA观察MIRI大鼠血清丙二醛(malonic dialdehyde, MDA)、肌酸激酶同工酶MB(creatinekinase-MB, CK-MB)、乳酸脱氢酶(lactate dehydrogenase, LDH)、超氧化物歧化酶(superoxide dismutase, SOD)水平,HE染色观测心肌病理改变,qRT-PCR、Western blot检测大鼠血清心肌组织环氧合酶2(prostaglandin-endoperoxide synthase 2, PTGS2)、蛋白激酶B1(akt serine/threonine kinase 1, Akt1)表达水平。结果 初步筛选获得加味丹参饮中的活性成分102个,药物疾病交集基因140个,核心靶点54个;其中,Akt1、原癌基因JUN(Jun proto-oncogene, JUN)、信号转导与转录激活因子3(signal transducer and activator of transcription 3, STAT3)、PTGS2等靶点可能与MIRI密切相关,富集分析预测加味丹参饮预防MIRI主要涉及调节癌症相关通路等20条通路,并且其中5条通路中Akt1处于PTGS2上游。动物实验结果显示,加味丹参饮能够显著提高MIRI大鼠血清MDA、CK-MB、LDH水平(P<0.05),同时降低SOD水平(P<0.05),抑制心肌组织中Akt1、PTGS2表达水平(P<0.05),减轻心肌组织坏死。结论 加味丹参饮可能同时抑制Akt1、PTGS2两个靶点,缓解过度心肌损伤,发挥预防MIRI作用。
〔关键词〕 心肌缺血再灌注损伤;加味丹参饮;网络药理学;MIRI大鼠模型;作用机制;蛋白激酶B1;环氧合酶2
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.03.016
Network pharmacology analysis and experimental verification of mechanism of Jiawei Danshen Decoction in preventing myocardial ischemia-reperfusion injury
HU Xudong1, PENG Muzi2, CHEN Ming1, LIAO Jing1, CHEN Cong1*
1. College of Chinese Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Institute of Innovation and Applied Research in Chinese Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To predict active constituents, drug targets, and signaling pathways of Jiawei Danshen Decoction (JWDSD) in the prevention of myocardial ischemia-reperfusion injury (MIRI) based on network pharmacology and to perform experimental validation. Methods The related constituents and targets of JWDSD were obtained from the Chinese Medicine Systems Pharmacology Database and Analysis Platform (TCMSP) and UniProt; the MIRI-related targets were obtained from GeneCards, OMIM and DrugBank databases; the protein-protein interaction (PPI) network model was analyzed and constructed by String platform; the “drug-component-target” and the involved biological processes and signaling pathways were analyzed by the Metascape platform, and then the “JWDSD component-MIRI target-pathway” network was constructed by Cytoscape 3.7.1 software. The MIRI rat model was established by ligating the left anterior descending artery of rats one week after preventive gavage administration of JWDSD. The serum malonic dialdehyde (MDA), creatinekinase-MB (CK-MB), lactate dehydrogenase (LDH) and superoxide dismutase (SOD) level of MIRI rats were observed with ELISA, the pathological change of myocardium of the rats was observed by HE staining, and the serum prostaglandin-endoperoxide synthase 2 (PTGS2) of rats myocardium and the expression level of akt serine/threonine kinase 1 (Akt1) were detected by qRT-PCR and Western blot. Results The total of 102 active constituents in JWDSD, 140 drug-disease intersection genes and 54 core targets were obtained by preliminary screening. Akt1, Jun proto-oncogene (JUN), signal transducer and activator of transcription 3 (STAT3), PTGS2 and other targets may be closely related to MIRI. KEGG enrichment analysis predicted that the prevention of MIRI by JWDSD mainly by the regulation of 20 pathways, including cancer-related pathways, and Akt1 is upstream of PTGS2 in 5 pathways. Animal experiment showed: JWDSD could significantly increase the serum levels of malondialdehyde (MDA), creatine kinase isoenzyme MB (CK-MB), and lactate dehydrogenase (LDH); meanwhile, it could decrease the level of superoxide dismutase (SOD) (P<0.05), inhibit the expression levels of Akt1 and PTGS2 in myocardial tissue and reduce myocardial tissue necrosis in MIRI rats (P<0.05). Conclusion JWDSD may inhibit Akt1 and PTGS2 targets at the same time, thereby alleviating excessive myocardial damage and preventing MIRI.
〔Keywords〕 myocardial ischemia-reperfusion injury; Jiawei Danshen Decoction; network pharmacology; MIRI rat model; mechanism of action; akt serine/threonine kinase 1; prostaglandin-endoperoxide synthase 2
在心血管疾病中,急性心肌梗死致死率一直居高不下,目前,虽然可以通过扩张冠脉和溶栓等手段进行有效治疗,但血液重新灌注后进一步加剧心肌损伤,导致梗死面积扩大并引发严重的心律失常,这种梗死后再灌注引起不可逆严重损伤的现象被称为心肌缺血再灌注损伤(myocardial ischemia reperfusion injury, MIRI),是临床上常见且亟须解决的问题[1-4]。
中药复方调治冠心病的优势日渐突出,加味丹参饮化裁于陈修园所著《时方歌括》中的丹参饮,由丹参、黄芪、檀香、赤芍、川芎、当归、红花和生地黄组成,具有益气健脾、活血化瘀的功效,临床应用疗效显著[5-7]。研究证实,该方通过多环节、多靶点、多层次调控细胞凋亡、抗炎等途径减轻MIRI,尤其是在改善症状方面潜力巨大,但其多环节、多靶点作用的确切机制尚未清晰[5-8]。
网络药理学是医学、生物学、信息学等多学科理论与研究手段整合的结果,能够系统综合地反映药物对疾病网络的干预机制[9-10]。这与中医药论治的整体动态性原则及复方多成分、多靶点、多途径互相作用的特点有很强的趋同性。为此,网络药理学成为研究中药复方作用机制崭新而有效的技术支持,进一步帮助揭示中药复方科学内涵,传承、发展和完善中医药理论[11-12]。
故本研究基于网络药理学技术方法,探究加味丹参饮预防MIRI的分子机制,并进行动物实验验证,为后续更进一步研究提供必要的理论与实验基础。
1 方法
1.1 加味丹参饮成分靶点搜集及药物-成分-靶点网络图的构建
使用TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)检索加味丹参饮复方组成药物的活性成分。根據中药成分药代动力学参数筛选活性成分,以口服生物利用度≥30%和类药性≥0.18为限定条件。从TCMSP数据库收集该药对的潜在作用靶点,通过SWISS数据库(http://www.gpmaw.com/html/swissprot.html)筛选P≥0.6的靶点进行补充,并通过文献检索补充,全面搜集,并使用UniProt数据库(http://www.uniprot.org/uniprot/)将靶点蛋白英文名统一规范为基因名称。
运用Cytoscape 3.7.1构建加味丹参饮组成药物-药物成分-靶点网络图,利用Cytoscape 3.7.1内置分析工具计算有效成分及靶点的网络拓扑参数,获取包括连接度、介度及紧密度等数据,最终筛选获取重要靶点及发挥药效的主要活性成分。
1.2 MIRI相关靶点获取
以“myocardial ischemia reperfusion injury”和“coronary heart disease”为关键词,挖掘GeneCards数据库(https://www.genecards.org)、OMIM数据库(http://www.omim.org)中调治MIRI的潜在靶点,进入DRUGBANK数据库(https://www.drugbank.ca)寻找调治MIRI的临床一线西药作用靶点予以补充。合并3个疾病数据库靶点后,删除重复值得到MIRI相关靶点。
1.3 加味丹参饮成分-MIRI靶点网络构建及核心靶点筛选
为明确加味丹参饮药物与MIRI两者靶点之间的交互作用,取两者交集并绘制韦恩图。进而将交集靶点输入至STRING 11.0数据库(https://string-db.org)构建蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络模型,并通过Cytoscape 3.7.1对数据进行可视化与数据分析,筛选核心靶点。
1.4 加味丹参饮成分-MIRI靶点功能与通路的富集
Metascape平台(http://metascape.org/gp/index.html)具有注释功能且能够及时更新基因数据资料。将加味丹参饮调治MIRI的靶点输入Metascape平台,设置P<0.01,富集分析获取与其相关的主要信号通路与生物学过程,采用微生信对数据结果进行可视化。
1.5 加味丹参饮成分-MIRI靶点-通路网络图的构建
运用Cytoscape 3.7.1构建加味丹参饮成分-MIRI靶点-通路网络图,利用Cytoscape 3.7.1内置分析工具计算有效成分及靶点参数,并根据结果获取核心靶点及发挥药效的主要活性成分。
2 动物实验验证
2.1 实验药物
加味丹参饮:黄芪20 g(广州工业制药有限公司,批号:2106211);丹参20 g、川芎6 g、红花6 g、当归6 g(安徽普仁中药饮片有限公司,批号:21072031B、2108221、2111253、2107122);檀香6 g(湖南仁上正元中药饮片有限公司,批号:2021092702);赤芍10 g(长沙新林制药有限公司,批号:220101);生地黄12 g(江苏龙凤堂中药有限公司,批号:21121441C),饮片由湖南中医药大学第一附属医院提供,经湖南中医药大学中药鉴定教研室龚力民主任鉴定均为正品。煎煮后去渣,浓缩至药液浓度为2 g/mL(含生药),于4 ℃冰箱保存备用。
2.2 实验动物
湖南斯莱克景达实验动物有限公司购进36只雄性SD大鼠,SPF级,体质量(150±20) g,動物合格证号430727211102830068,许可证号SCXK(湘)2019-0004。饲养于湖南中医药大学实验动物中心标准化动物房(相对湿度50%~70%,温度23~25 ℃,昼夜交替),普通饲料,自由饮水。本实验由湖南中医药大学伦理委员会批准,动物实验伦理编号LLBH202108250004。
2.3 试剂及仪器
PTGS2抗体、Akt1抗体、GAPDH抗体、β-actin(肌动蛋白)(武汉博士德生物工程有限公司,批号分别为A00084、BM1612、BM0627、BM1623);三氯甲烷、异丙醇、无水乙醇(上海国药集团化学试剂有限公司,批号分别为10006818、80109218、10009218);大鼠肌酸激酶同工酶MB、乳酸脱氢酶、丙二醛、超氧化物歧化酶ELISA试剂盒(江苏菲亚生物科技有限公司,批号分别为FY3500、FY3480、FY8503、FY3262)。
352型酶标仪、AC8型洗板机(Thermo Labsystems);TGL-16型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);TC-XP型基因扩增仪(杭州博日科技有限公司);DYY-7C型电泳仪(北京六一生物科技有限公司);VE-180型电泳槽(上海天能科技有限公司);SH01D型高速离心机(上海知信实验仪器有限公司);SCIENTZ-24型组织匀浆器、SCIENTZ-1500F型超声破碎仪(宁波新芝生物科技有限公司)。
2.4 动物分组、模型制备及给药
将所购SPF级雄性SD大鼠,于实验室饲养笼内适应性饲养1周,按照随机数字表法分为空白组、假手术组、模型组、加味丹参饮组,每组9只大鼠。空白组动物术前连续7日给予生理盐水灌胃,每天1次;假手术组动物术前同空白组,术中绕冠状动脉左前降支穿线,但不结扎;模型组动物术前同空白组,术中绕冠状动脉左前降支穿线,结扎30 min后进行再灌注90 min;加味丹参饮组动物术前连续7日给予加味丹参饮6.19 g/kg生药量灌胃,缺血再灌注时间同模型组。参照本课题组前期造模方案[6]制备MIRI实验大鼠模型,手术造模前,禁食12 h,禁水4 h,进行称重,3%浓度的戊巴比妥钠按照0.04 g/kg体质量对大鼠进行腹腔注射麻醉,麻醉成功后,固定,气管切开,于切口处接小动物呼吸机,暴露胸腔,在左心耳根部1~2 mm处进针,结扎大鼠左冠状动脉前降支。心电图显示ST段弓背向上抬高,QRS波群改变,J点偏移超过0.1 mV,缺血区心肌组织颜色变白为结扎成功标志。结扎一段时间后松开扎线实现再灌注,ST段出现回落,可见梗死区心肌充血,表明再灌注成功,再灌注90 min后,腹主动脉取血,离心机分离上清用于指标检测;完成腹主动脉取血后,立即取心,冲洗净血液后,每组6只切取左半心,放入冻存管中后快速放置于液氮罐内,后转移至-80 ℃冰箱冻存用于qRT-PCR、Western blot检测,再将每组剩余3只大鼠取全心,用4%的多聚甲醛液进行固定,用于病理染色观察。
2.5 指标检测
2.5.1 ELISA检测大鼠血清MDA、SOD、CK-MB、LDH水平 采用ELISA法检测各组大鼠血清中MDA、SOD、CK-MB、LDH表达水平,实验步骤按照试剂盒方法进行操作。
2.5.2 HE染色观察大鼠心肌病理变化 沿左心室冠状面中部切取环状心肌组织块,使用4%多聚甲醛固定,乙醇梯度脱水后进行石蜡包埋,进行HE染色,光学显微镜下拍照。
2.5.3 qRT-PCR检测心肌组织PTGS2、Akt1基因表达 收集各组心肌组织,取适量冻存大鼠左心室心肌组织,采用Trizol法提取心肌组织中总RNA。将总RNA逆转录为cDNA后,进行qRT-PCR扩增,反应结束后,观察扩增曲线、溶解曲线及CT值,以2-ΔΔCt数据分析法对各基因表达进行相对定量计算,再将结果用于统计分析。引物序列为PTGS2正向5'-CTGATGACTGCCCAACTCCC-3',反向5'-CTGGGCAAAGAATGCGAACA-3',长度143 bp;Akt1正向5'-CGACGTAGCCATTGTGAAGGAG-3',反向5'-ATTGTGCCACTGAGAAGTTGTTG-3',长度173 bp;GAPDH正向5'-CTGGAGAAACCTGCCAAGTATG-3',反向5'-GGTGGAAGAATGGGAGTTGCT-3',长度138 bp。PCR扩增条件为:95 ℃预变性5 min,95 ℃5 s,56 ℃ 10 s,72 ℃ 25 s循环40次。
2.5.4 Western blot检测心肌组织PTGS2、Akt1蛋白表达 大鼠心肌组织约100 mg,剪碎后置入盛有2.0 mL RIPA蛋白裂解液(含磷酸酶抑制剂)的匀浆器中充分匀浆;于冰上静置60 min,使其充分裂解。将裂解后的组织匀浆转移至1.5 mL的离心管中,以4 ℃、12 000 r/min离心15 min(离心半径6 cm);取上清,采用BCA法测定各样本蛋白浓度,并调整至一致;加入等体积蛋白上样缓冲液,煮沸5 min使其变性。取10 μL蛋白样品上样,依次进行SDS凝胶电泳、转膜、抗原封闭、加入一抗PTGS2(1∶500)、Akt1(1∶500)、GAPDH(1∶1000)孵育过夜、加入羊抗兔二抗(1∶2000)室温孵育2 h等步骤。最后,采用ECL显色液显色,于凝胶成像仪下显影、拍照;以GAPDH蛋白条带灰度值为内参,采用Quantity One软件分析目的蛋白的相对表达水平。
2.6 统计学分析
所有数据以SPSS 13.0进行统计,Graphpad Prism 7软件进行分析。结果以“x±s”表示,組间比较以one-way ANOVA单因素方差分析及q检验,以P<0.05为差异有统计学意义。
3 结果
3.1 加味丹参饮成分靶点筛选及药物-成分-靶点网络图的构建
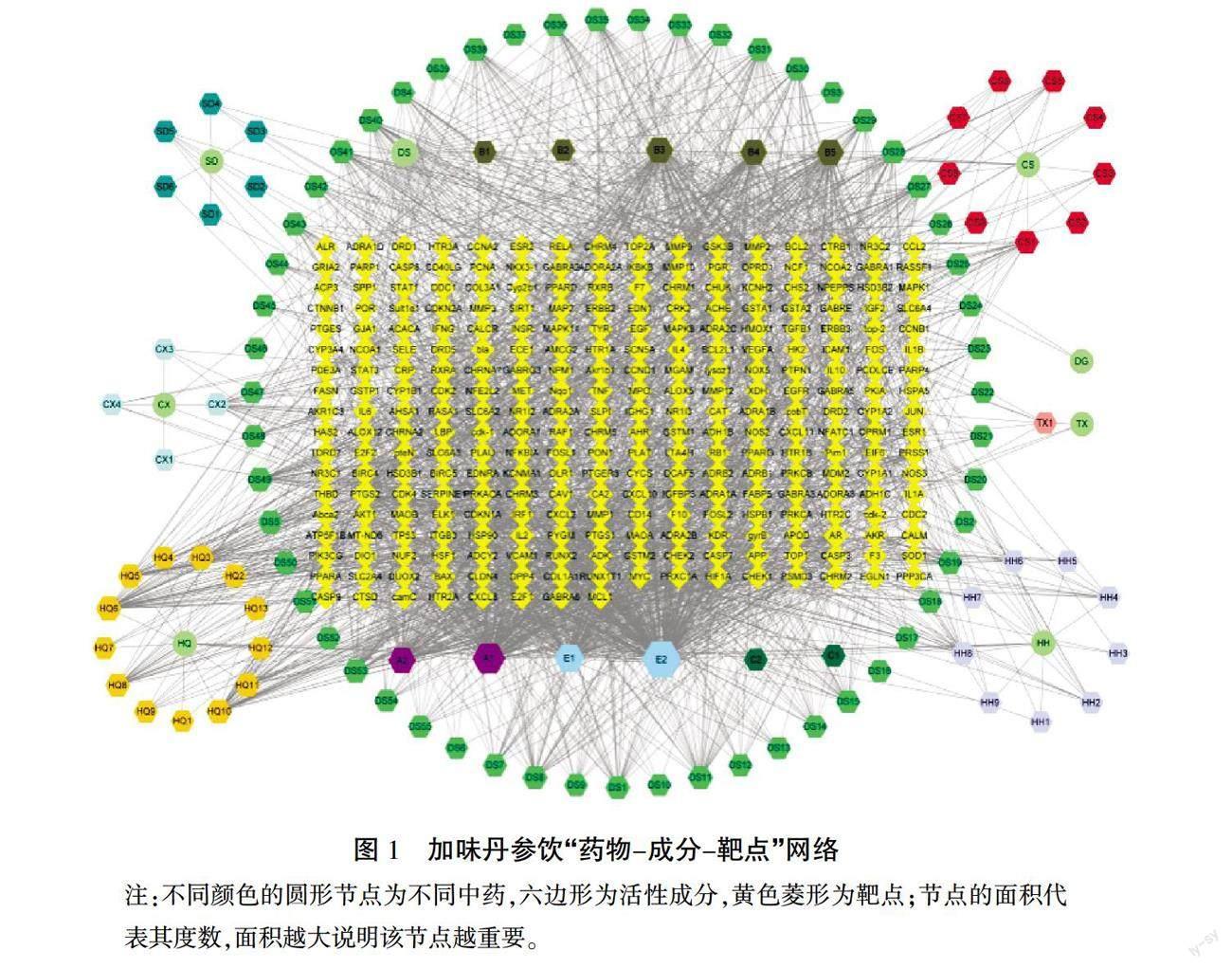
使用TCMSP数据库检索加味丹参饮复方组成药物的活性成分,根据中药成分药代动力学参数筛选活性成分,获得活性成分102种。通过TCMSP数据库和SWISS数据库收集该药对的潜在作用靶点,并使用UniProt数据库将靶点蛋白英文名统一规范为基因名称,获得对应靶点279个。
运用Cytoscape 3.7.1构建加味丹参饮药物-成分-靶点网络图,见图1。网络分析表明,槲皮素Degree为306,介度为0.429 0,紧密度为0.509 0,预测槲皮素为复方的主要活性成分,其次为木犀草素(连接度为174,介度为0.097 9,紧密度为0.404 7)、山柰酚(连接度为124,介度为0.079 2,紧密度为0.409 7)、β-谷甾醇(连接度为79,介度为0.042 3,紧密度为0.388 0)。PTGS2在网络中的连接度为89,介度为0.118 9,紧密度为0.519 7,预测PTGS2为加味丹参饮复方的最主要靶点,PTGS1与NOCA2亦为相对重要的靶点。
3.2 加味丹参饮成分-MIRI靶点PPI网络构建及核心靶点筛选
通过GeneCards数据库获得MIRI靶点1454个,从OMIM数据库与DRUGBANK数据库分别补充获得靶点226个和97个,合并后删除重复值,最终得到1591个MIRI疾病靶点。
将筛选的加味丹参饮靶点与MIRI疾病靶点取交集,并绘制韦恩图,得到交集靶点140个,见图2。随后将交集靶点输入至STRING 11.0平台,得到加味丹参饮-MIRI靶点PPI网络,网络图包括128个节点,635条边。为进一步筛选获取核心靶点,将STRING数据库获得的结果文件导入Cytoscape 3.7.1中的内置分析工具,对网络进行分析,筛选条件按degree排列,degree中位数为9.9,筛选大于中位数的靶点进行可视化处理,见图3,其中Akt1、JUN、STAT3、MAPK1、TNF等在网络中连接程度较高,说明这些靶点属于核心靶点。
3.3 加味丹参饮成分-MIRI靶点功能与通路的富集
通过Metascape数据平台对加味丹参饮调治MIRI核心靶点进行富集分析,借助微生信平台对结果可视化。结果表明,加味丹参饮主要参与的生物学过程包括生物对创伤反应(response to wounding)、炎症反应(inflammatory response)、对无机物的反应(response to inorganic substance)等;相关靶点调治冠心病的功能主要富集于蛋白结构域特异性结合(protein domain specific binding)、DNA结合转录因子结合(DNA-binding transcription factor binding)、蛋白同源二聚体化活性(protien homodimerization activity)、蛋白激酶活性(protein kinase activity)等,见图4。相关通路主要有pathways in cancer信号通路、AGE-RAGE 信号通路、proteoglycans in cancer信号通路以及PI3K-AKT通路等。详见图5。
3.4 加味丹参饮成分-MIRI靶点-通路网络图的构建
运用Cytoscape 3.7.1构建加味丹参饮成分-MIRI靶点-通路网络,见图6。通过Cytoscape 3.7.1内置的NetworkAnalyzer分析加味丹参饮预防MIRI网络拓扑学参数,得到核心成分及作用靶点。Cytoscape网络分析表明,PTGS2在网络中的连接度为86,介度为0.267 8,紧密度为0.550 1,预测PTGS2为加味丹参饮调治MIRI的重要靶点。与此同时,结果显示PTGS2与Akt1同时在排名20条通路网络中的pathways in cancer等5条通路中同时出现,Akt1均处于PTGS2上游。
3.5 动物实验验证
3.5.1 大鼠血清MDA、SOD、CK-MB、LDH表达水平
与空白组相比,模型组大鼠血清中MDA、CK-MB、LDH含量明显升高,SOD含量明显降低(P<0.01);与模型组相比,加味丹参饮组大鼠血清中MDA、CK-MA、LDH明显含量下降(P<0.01),其中加味丹参饮组表达高于假手术组;与模型组相比,加味丹参饮组与假手术组大鼠血清中SOD含量明显升高(P<0.01)。详见表1。
3.5.2 HE染色观察大鼠心肌病理变化 HE染色结果显示,与空白组相比,模型组大鼠心肌组织局部坏死,细胞结构模糊,心肌细胞走形紊乱。与模型组相比,加味丹参饮组大鼠心肌组织结构明显改善,细胞走形规律,轮廓完整,坏死减少。详见图7。
3.5.3 心肌组织PTGS2、Akt1基因表达 与空白组大鼠相比,模型组大鼠PTGS2 、Akt1 mRNA表达增强(P<0.01);与模型组大鼠相比,加味丹参饮组与假手术组大鼠Akt1、PTGS2 mRNA表达显著减弱(P<0.01)。详见表2。
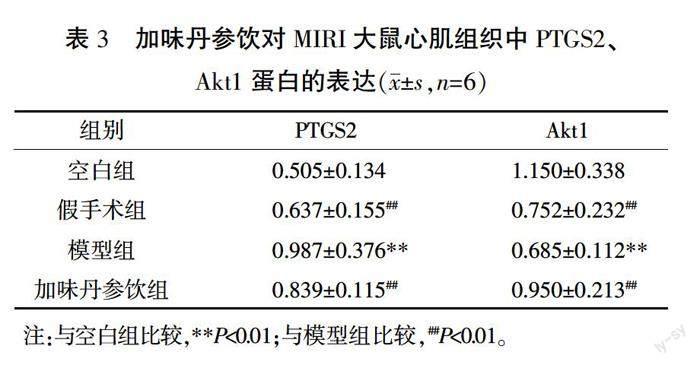
3.5.4 心肌组织PTGS2、Akt1蛋白表达 与空白组大鼠比较,模型组大鼠PTGS2蛋白表达显著上调,Akt1蛋白表达显著下调(P<0.01);与模型组大鼠比较,加味丹参饮组大鼠PTGS2蛋白表达明显减少(P<0.01),其中加味丹参饮组蛋白表达高于假手术组;与模型组大鼠比较,加味丹参饮组大鼠Akt1蛋白表达显著上调(P<0.01),其中加味丹参饮组蛋白表达高于假手术组。详见图8和表3。
4 讨论
急性心肌梗死是危害广大人民群众生命健康的主要疾病之一,再灌注治疗是标准治疗方案。然而,在强化内科治疗基础上,无论采用介入治疗还是外科血运重建策略,仍然有相当一部分患者无法从中完全获益,中医药的介入为临床诊治MIRI提供了广阔空间[13-14]。陈欣等[15]使用丹参通络解毒汤干预MIRI模型大鼠,证明该方可通过抑制自噬减轻损伤,其作用机制可能与下调肺癌转移相关转录本1(MALAT1)基因表达和抑制Toll样受体4/核转录因子-κ(BTLR4/NF-κB)信号通路有关。李泽华等[16]发现黄芪的主要成分黄芪甲苷,可通过上调核因子E2相关因子2/血红素加氧酶1(NRF2/HO-1)信号通路缓解心肌损伤和抑制细胞凋亡。萧闵等[17]观察金香丹预处理对MIRI大鼠模型的影响,结果表明NOD样受体热蛋白结构域3(NLRP3)表达受到抑制,白细胞介素-1β(IL-1β)表达降低,从而保护心肌细胞,缓解MIRI。
MIRI与冠心病同属于中医学“胸痹”的范畴[18],而近年来我国冠心病患病人群中,中医辨证以气虚血瘀型最常见[19],其病理性质为本虚标实,以气虛为本,以血瘀为标。益气活血法在胸痹治疗上即补已虚之心气,化停滞之瘀血,是针对气虚血瘀病因病机特有的治疗法则。加味丹参饮全方由丹参、黄芪、檀香、赤芍、川芎、当归、红花、生地黄组成,具有益气活血、通络止痛的功效。丹参、黄芪为君药,益气活血;臣以赤芍、红花活血祛瘀;佐以当归、生地黄养血活血通经;川芎活血行气止痛,檀香能理气止痛,兼散寒共为佐使。加味丹参饮预处理可通过抑制P38丝裂原活化蛋白激酶(p38MAPK)信号通路,降低其下游基因环氧合酶-2(COX-2)和细胞间黏附分子-1(ICAM-1)的表达,减轻心肌损伤[7]。亦有研究显示其减轻心肌损伤的机制与其促进内源性硫化氢生成,上调心肌组织胱硫醚-γ-裂解酶(CSE)mRNA及蛋白表达有关[6]。亦或通过下调Beclin1、LC3A/B、p62和ATG5等基因的表达,抑制自噬信号通路,发挥缓解MIRI的作用[8]。
本研究通过网络药理学初步筛选出加味丹参饮调治MIRI的主要靶点为Akt1、PTGS2等,Akt1是影响心肌细胞活性与功能的主要决定因素之一,激活Akt1可以调控下游的因子影响细胞的增殖、凋亡、自噬等过程[20-21]。研究表明[22],治疗高胆固醇血症的药物阿托伐他汀可以保护高糖环境下心肌微血管内皮细胞免受氧化应激和凋亡,这种保护作用部分可能与Akt1相关。转染Akt1基因能够减轻心肌I/R损伤,其作用机制可能与Akt1抑制心肌缺血再灌注诱导的线粒体膜通透性转换,从而具有保护线粒体的功能相关[23]。COX-2由基因PTGS2表达而产生,在正常生理条件下表达量极低,而在心血管疾病过程中,其过度表达与炎症反应的发生密切相关[24];郑妩媚等[25]研究表明,COX-2的高表达可引发过度炎症反应,在诱导心肌损伤的过程中起到重要作用。本研究证明,网络药理学预测的PTGS2、Akt1确实为加味丹参饮调节MIRI的作用靶点,KEGG分析显示在相关性靠前的pathways in cancer等5条通路中,Akt1均处于PTGS2上游。
本研究网络药理学预测Akt1与PTGS2为加味丹参饮预防MIRI重要靶点,且Akt1作用于PTGS2上游。动物实验结果表明,加味丹参饮干预MIRI大鼠与模型组大鼠相比,血清中MDA、CK-MB、LDH含量明显升高,SOD含量明显降低,Akt1和PTGS2 mRNA表达下降,Akt1蛋白表达提升,并且心肌细胞坏死和纤维化程度较低。以上结果证实,加味丹参饮可能同时抑制Akt1、PTGS2两个靶点,进而缓解过度心肌损伤,发挥预防MIRI作用。
参考文献
[1] LI L, WANG Y, GUO R, et al. Ginsenoside Rg3-loaded, reactive oxygen species-responsive polymeric nanoparticles for alleviating myocardial ischemia-reperfusion injury[J]. Journal of Controlled Release, 2020, 317: 259-272.
[2] GUO X, HU S, LIU J J, et al. Piperine protects against pyroptosis in myocardial ischaemia/reperfusion injury by regulating the miR-383/RP105/AKT signalling pathway[J]. Journal of Cellular and Molecular Medicine, 2021, 25(1): 244-258.
[3] ZHU N, LI J, LI Y L, et al. Berberine protects against simulated ischemia/reperfusion injury-induced H9C2 cardiomyocytes apoptosis in vitro and myocardial ischemia/reperfusion-induced apoptosis in vivo by regulating the mitophagy-mediated HIF-1α/BNIP3 pathway[J]. Frontiers in Pharmacology, 2020, 11: 367.
[4] YUAN X X, JUAN Z D, ZHANG R, et al. Clemastine fumarate protects against myocardial ischemia reperfusion injury by activating the TLR4/PI3K/Akt signaling pathway[J]. Frontiers in Pharmacology, 2020, 11: 28.
[5] 陈 聪,黄政德,廖 菁,等.加味丹参饮不同组方对心肌缺血再灌注损伤COX-2、ICAM-2、P38 MAPK蛋白表达的影响[J].辽宁中医杂志,2016,43(12):2636-2638,2703.
[6] 陈 聪,成细华,任 婷,等.加味丹参饮作用内源性H2S合成途径保护心肌缺血/再灌注损伤的实验研究[J].湖南中医药大学学报,2019,39(10):1183-1188.
[7] 陈 聪,任 婷,胡 华,等.加味丹参饮预处理对大鼠心肌缺血再灌注损伤的保护作用[J].湖南中医药大学学报,2016,36(6):11-15.
[8] 陈 聪,刘 洋,童巧珍,等.加味丹参饮通过抑制H2S介导的自噬信号通路对心肌缺血再灌注损伤的治疗作用[J].数字中医药,2021,4(3):241-250.
[9] 但文超,何庆勇,曲 艺,等.基于网络药理学的枳术丸调治血脂异常的分子机制研究[J].世界科学技术-中医药现代化,2019,21(11):2396-2405.
[10] 張圆圆,靳培培,顾 悦,等.基于网络药理学、分子对接及实验验证探讨加味升降散治疗IgA肾病的作用机制[J].中国实验方剂学杂志,2022,28(7):162-171.
[11] 张丰荣,祝 娜,李志勇,等.基于网络药理学角度探讨清瘟败毒饮对细胞因子风暴的干预机制[J].中国中药杂志,2020,45(7):1499-1508.
[12] 邵 珺,朱思思,黄 瑶,等.基于网络药理学探讨血府逐瘀汤治疗失眠的作用机制[J].世界科学技术-中医药现代化,2021,23(9):3326-3336.
[13] ZHENG S, HUANG H, LI Y, et al.Yin-Xing-Tong-Mai Decoction attenuates atherosclerosis via activating PPARγ-LXRα-ABCA1/ABCG1 pathway[J]. Pharmacological Research, 2021, 169: 105639.
[14] SHEN Y C, SHEN Y J, LEE W S, et al. Two benzene rings with a boron atom comprise the core structure of 2-APB responsible for the anti-oxidative and protective effect on the ischemia/reperfusion-induced rat heart injury[J]. Antioxidants, 2021, 10(11): 1667.
[15] 陈 欣,李鑫辉,王静雯,等.丹参通络解毒汤对IRI模型大鼠心肌细胞自噬的调控机制[J].中医学报,2020,35(6):1252-1257.
[16] 李泽华,关贤颂,蒋路平.黄芪甲苷通过NRF2/HO-1信号通路减轻小鼠心肌缺血再灌注损伤[J].中国病理生理杂志,2021,37(12):2147-2153.
[17] 萧 闵,向晶晶,王 威,等.金香丹抑制NLRP3/IL-1β/Caspase-1信号通路缓解大鼠心肌缺血再灌注损伤[J].中国实验方剂学杂志,2021,27(20):87-94.
[18] 王士超,吴 伟,刘 芳,等.国医大师邓铁涛教授治疗心血管病学术思想和冠心病治疗经验初探[J].中西医结合心脑血管病杂志,2016,14(10):1167-1170.
[19] 陈贵珺,王恒和.近5年我国冠心病中医证型地域分布规律研究[J].辽宁中医杂志,2018,45(6):1142-1146.
[20] 王兴红,郑亚萍,李海霞.槲皮素对大鼠心肌缺血再灌注损伤的影响[J].中国实验方剂学杂志,2013,19(4):266-270.
[21] 徐启丽,邹常超,莫丽莉,等.网络药理学分析及实验验证银丹心脑通保护MIRI的作用机制[J].安徽医科大学学报,2022,57(1):131-138.
[22] 葛广豪,候月梅.阿托伐他汀保护高糖环境下心肌微血管内皮细胞损伤的机制研究[J].中华老年医学杂志,2018,37(9):1026-1030.
[23] 王 静,李东野,夏 勇,等.转染Akt1基因对缺血再灌注大鼠心肌线粒体通透性转换的影响[J].中国病理生理杂志,2010,26(1):80-85.
[24] 李 杨,周 岚,汪 典,等.不同剂量活血、破血中药对动脉粥样硬化小鼠主动脉PTGS2、PADI4、ITGAM基因表达的影响[J].疑难病杂志,2016,15(11):1182-1186.
[25] 郑妩媚,初海平,王 燕,等.力竭运动后不同时相大鼠心肌p-p38MAPK、NF-kB、COX-2表达的动态变化[J].中国应用生理学杂志,2016,32(1):88-91.
〔收稿日期〕2022-09-02
〔基金项目〕国家自然科学基金青年项目(81704065);宁夏自治区重点研发项目(2020BFH02003);湖南省教育厅科学研究项目(20C1392、20C1416、
19B415);湖南省卫生健康委科研计划项目(202202084742);湖南中医药大学科研基金重点项目(2021XJJJ003);黄政德全国名老中医药专家传承工作室资助项目。
〔第一作者〕胡旭东,男,硕士研究生,研究方向:藏象理论与心血管。
〔通信作者〕*陈 聪,女,硕士,副教授,硕士研究生导师,E-mail:50634383@qq.com。
