母猪健康和闭锁卵巢有腔卵泡的转录组测序比较分析
2023-05-29程颖魏全伟王喆雷坤吴昊泽夏雨婷茆达干石放雄
程颖,魏全伟,王喆,雷坤,吴昊泽,夏雨婷,茆达干,石放雄
(南京农业大学动物科技学院,江苏 南京 210095)
猪是一种重要的经济动物,猪肉是我国主要的肉类来源之一,其繁殖性能的研究也一直被人们所重视。对哺乳动物而言,卵泡发育是繁殖的一个重要进程,卵巢中的卵泡发育包括卵泡募集、生长、成熟、破裂、黄体形成和最终闭锁。卵泡发育是一个复杂的过程,整个过程受到多种因子以及生理周期的精准调控,只有不到1%的优势卵泡能够在发育成熟后成功排卵,大多数的卵泡终将闭锁退化[1]。卵泡闭锁是卵泡在发育的不同阶段逐渐退化并最终被机体清除的生理现象。有关卵泡闭锁机制的研究是个永恒的主题,对生长卵泡的研究表明,引起卵泡闭锁的首要原因是颗粒细胞凋亡[2],当颗粒细胞凋亡达到一定程度后表现为卵泡闭锁现象。颗粒细胞的有丝分裂和持续快速增殖是处在发育中优势卵泡的一个重要特征[3]。因此,颗粒细胞的增殖、分化和存活对于卵泡发育至关重要。有研究证明与卵泡闭锁相关的lncRNA通过影响miR-183-96-182簇和FoxO1轴的活性诱导颗粒细胞凋亡[4]。
广义上的转录组是指某一特定细胞或组织所转录RNA的总和,而有参转录组测序则是一种并行分析大量基因的工具,将测序获取的数据与参考基因组进行对比,便可分析转录本的遗传信息[5]。这项技术可以从整体水平上反映出基因在细胞中的表达情况及其调控规律,为探究颗粒细胞的功能和卵泡发育过程中可能涉及的因子提供新的研究方式[6]。转录组测序是通过对不同组别mRNA表达水平的研究分析筛选差异显著的特异基因,进而确定基因在生物学过程中所发挥的功能及其调控机制。代谢组学揭示了氨基酸代谢和胆酸代谢紊乱可能是导致猪卵泡闭锁的原因之一[7]。
Terenina等[8]的测序研究明确了参与猪卵泡闭锁过程的11个标志基因,但只研究了基因网络,没有综合分析具体的信号通路及其生物学功能。本试验利用Illumina高通量转录组测序技术,对转录组数据确定健康卵泡颗粒细胞和晚期闭锁卵泡颗粒细胞的差异表达基因,同时探究雌性生殖系统中卵泡闭锁的潜在分子标记物,继而分析卵泡闭锁可能涉及的分子机制。
1 材料与方法
1.1 试验材料
从屠宰场中采集杜长大三元杂交猪6月龄母猪的卵巢,将其放入装满4 ℃生理盐水和双抗的保温杯中,于2 h内运到实验室,用75%乙醇冲洗1次,再用加入双抗的PBS轻轻漂洗2次,最后把卵巢放入添加双抗的生理盐水中。在超净台内用10 mL的一次性无菌注射器抽取卵泡液,注入1.8 mL冻存管中,3 000 r·min-1离心5 min后弃掉卵泡液,保留管内颗粒细胞,将其放入-80 ℃冰箱中冷冻保存,以备后续的RNA提取。
样品的选取标准是3~5 mm、正常形态的卵泡。其中的健康卵泡外观呈健康的粉红色,卵泡膜表面血管丰富完整,分布均匀,卵泡液清澈。早期闭锁卵泡内层稍呈絮状化,壁呈暗色,卵泡表观为灰白色,血管较少且颜色变淡,卵泡液稍混浊。晚期闭锁卵泡颜色灰暗,表面几乎没有毛细血管,内部絮状化严重,卵泡液浑浊且脱落凋亡的颗粒细胞较多。
1.2 主要试剂
柱式RNA提取试剂盒(RC112-01)、反转录试剂盒(R323-01)、高灵敏性染料法定量PCR检测试剂盒(Q33-02)和高纯度耐热聚合酶(P112-01)均购自诺唯赞生物科技有限公司。
1.3 猪卵巢石蜡切片制备及HE染色
取卵巢组织,用4%多聚甲醛溶液固定48 h,依次进行不同梯度浓度乙醇脱水、组织修整、二甲苯透明、高温透蜡、石蜡包埋、切片等步骤制备石蜡切片,其中切片厚度5 μm。
对切片进行脱蜡水化,苏木素染色15 s,自来水冲洗、伊红染色3~5 s,随后进行梯度浓度乙醇脱水,将载玻片放入二甲苯中透明,用中性树胶封片,用光学显微镜观察并拍摄HE染色切片的图像。
1.4 颗粒细胞的转录组测序
1.4.1 RNA提取、文库的构建及测序采用Trizol法分别提取健康卵泡颗粒细胞和晚期闭锁卵泡颗粒细胞的总RNA,每组3个重复,用NanoDrop ND-1000(NanoDrop)和琼脂糖电泳法对其进行纯度和完整性检验。在确定每组细胞总RNA的量不低于0.1 ng后对每个样品进行单独建库。文库检测合格后使用Illumina NovaseqTM6000平台对所有文库进行测序。
1.4.2 测序数据质控测序后的数据去除测序接头和低质量的测序数据,统计原始测序量、有效测序量和Q20、Q30、GC含量,使用Cutadapt过滤掉不合格的序列后得到有效数据,综合评价后再进行下一步分析。
1.4.3 生物信息学分析将有效数据用HISAT2比对到基因组上,得到bam文件,使用StringTie软件对基因或转录本进行初组装,将所有样本的初组装结果进行合并,用gffcompare软件检测转录本与参考注释的比较,得到最终的组装注释结果,并使用R包edgeR进行显著差异分析。将差异倍数(fold change,FC)>2或FC<0.5且校正后的P值(FDR)<0.05的基因定义为差异基因,并对其进行GO和KEGG富集分析。
1.5 实时荧光定量PCR验证
以转录组差异表达基因分析结果为依据,随机挑选出7个与卵泡发育或激素分泌相关的基因进行荧光定量验证。首先在GenBank设计引物,细胞色素P450 1B1(cyp1b1)、磷酸二酯酶重组蛋白(ped10a)、核蛋白1(nupr1)、还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nox4)、低密度脂蛋白受体(ldlr)、促黄体激素受体(lhcgr)、细胞色素P450 19A1(cyp19a1)基因的引物序列见表1。将冻存的颗粒细胞用柱式RNA提取试剂盒提取总RNA,再按照逆转录试剂盒的要求将RNA反转录为cDNA,再以gapdh为内参进行荧光定量PCR检测,最后按照2-ΔΔCT法分析各基因的相对表达量。具体反应体系和程序严格按照高灵敏法染料定量PCR试剂盒说明书和仪器说明操作。

表1 荧光定量PCR所用引物Table 1 Primers used for quantitative real-time PCR analysis
1.6 数据分析
试验数据均使用SPSS 19.0软件进行单因素方差分析和差异显著性测验,用GraphPad Prism 8.0绘图。

图1 各阶段猪卵泡及颗粒细胞HE染色Fig.1 HE staining of porcine follicles and granulosa cells at different stages
2 结果与分析
2.1 各级卵泡、颗粒细胞的形态学观察
如图1所示:健康卵泡结构完整,整体是饱满的圆形,其中一部分壁层颗粒细胞紧贴在卵泡膜细胞周围形成颗粒细胞层,一部分卵丘颗粒细胞将卵母细胞包围起来形成卵泡腔。健康颗粒细胞间隙较小、细胞膜完整,呈正常的细胞形态且健康颗粒细胞数量较多。早期闭锁卵泡中开始出现颗粒细胞的脱落,颗粒细胞间连接不再紧密,大量的颗粒细胞核固缩,染色体、细胞质溶解,凋亡颗粒细胞会散布在卵泡腔中,但卵泡基膜仍较为完整。晚期闭锁卵泡颗粒细胞几乎全部脱落于卵泡腔中,颗粒细胞间隙变大,颗粒细胞层消失,凋亡的颗粒细胞体积进一步缩小,颗粒细胞与卵泡膜之前出现腔隙,卵泡壁塌陷,卵泡腔不规则,颗粒细胞数减少,卵母细胞微绒毛消失。卵泡膜内层细胞增大,被结缔组织分隔成团索状。
2.2 测序样品的相关性分析
通过样品的表达量信息进行相关性分析可以判断出每组样本间的聚类情况,相关系数越大时样本的聚类性越好。从图2可以看出,2个分组的3个样品组间相关系数都大于0.99,说明组内样品差异极小,重复性较好,个体差异可以被忽略不计,可以进行后续分析。
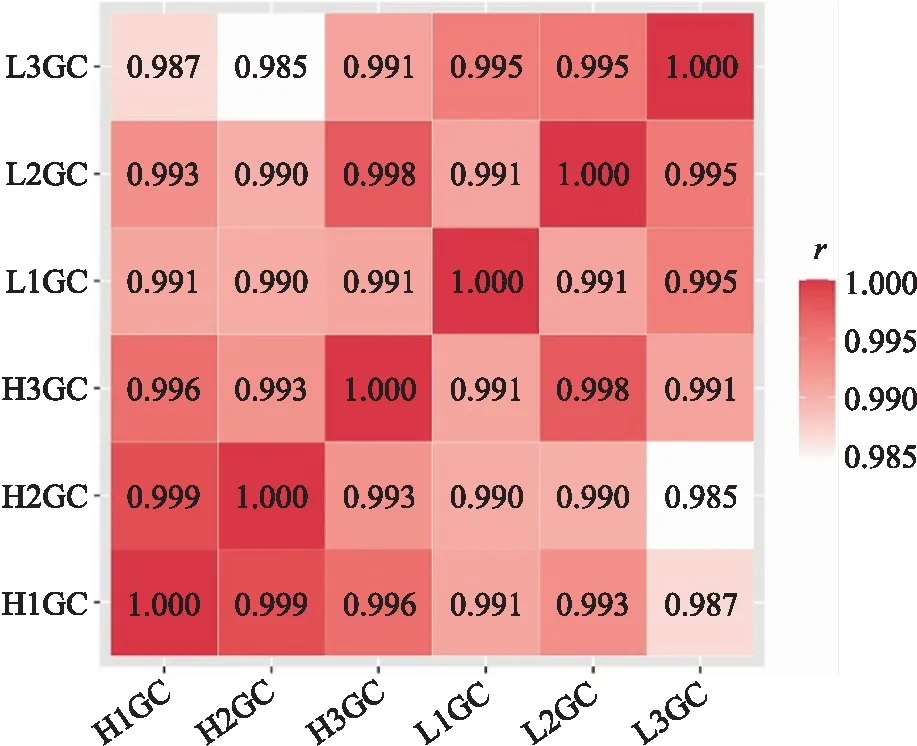
图2 样品间的相关性分析图Fig.2 Correlation analysis plot between samplesH1GC:健康卵泡颗粒细胞组1 Healthy folliclar granulosa cell group 1;H2GC:健康卵泡颗粒细胞组2 Healthy folliclar granulosa cell group 2;H3GC:健康卵泡颗粒细胞组3 Healthy folliclar granulosa cell group 3;L1GC:闭锁卵泡颗粒细胞组1 Late atretic folliclar granulosa cell group 1;L2GC:闭锁卵泡颗粒细胞组2 Late atretic folliclar granulosa cell group 2;L3GC:闭锁卵泡颗粒细胞组3 Late atretic folliclar granulosa cell group 3.

图3 猪卵泡颗粒细胞差异表达基因的高级火山图Fig.3 Advanced volcano plot of differentially expressedgenes in porcine follicular granulosa cells火山图距离原点越远差异越显著。The further away from the origin the more significant the difference.
2.3 转录组差异表达的基因分析结果
差异表达基因通常从差异倍数和显著水平两方面进行评估,本次测序采用的筛选标准为FC≥2或 FC≤0.5(即log2FC≥1)且P<0.05。火山图(图3)可以较为直观地反映不同组间差异表达基因的整体分布情况,符合标准的差异表达基因不到25%。火山图显示:与闭锁卵泡颗粒细胞相比,健康卵泡颗粒细胞有204个上调基因,567个下调基因。差异基因聚类分析的热图可以通过样品基因谱的相近程度判断组内不同样品基因的表达情况,蓝色代表低表达基因,红色代表高表达基因。
2.4 差异表达基因的GO富集分析
Gene ontology(简称GO)是一个通过将基因功能性富集为分子功能、细胞组成和参与的生物过程 3个大方面来描述生物体中基因和基因产物属性的国际标准化的基因功能分类体系。图4中3种基因功能根据每个细化功能的差异基因数目降序排列,分别挑选Top25、Top15、Top10 的细化功能进行展示。其中生物过程富集基因显著的功能包括转录正调控、细胞增殖正调控、蛋白磷酸化、氧化还原、血管生成正调控、细胞内信号转导;细胞组成富集差异基因较多的位置有细胞质、线粒体、细胞膜等;分子功能富集差异基因显著的有蛋白结合、DNA转录因子活性、ATP结合以及金属离子结合。

图4 差异表达基因的GO分析Fig.4 GO analysis of differentially expressed genes
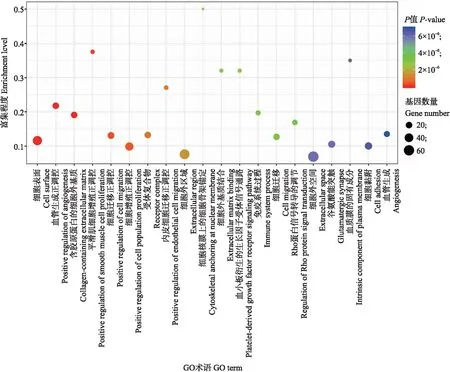
图5 GO分析散点图Fig.5 Scatter plot of GO analysis
图5则根据富集的显著性展示了前20的基因细化功能。纵坐标是富集因子,为该代谢路径下差异基因数与所有注释到该路径基因数的比值,数值越大表示富集程度越大。横坐标表示富集程度排名靠前的基因或代谢路径,代表基因的细化功能,但同一个基因可能会有多个细化功能。图中圆点的颜色代表P值,是经过多重校验的P值,越红表示P值越小,富集越明显。点的大小表示该路径中差异基因的个数,点越大表示基因数越多。
2.5 差异表达基因KEGG通路富集分析
KEGG富集分析是以富集的显著性(P<0.05)为根据挑选了前20条通路进行了绘图展示。如图6所示,去除疾病因素,排名靠前的显著性通路有PI3K-Akt信号通路、卵巢类固醇生成、破骨细胞分化和细胞因子间受体相互作用等功能通路。

图6 差异基因KEGG通路富集分析Fig.6 KEGG pathway enrichment analysis of differentially expressed genes
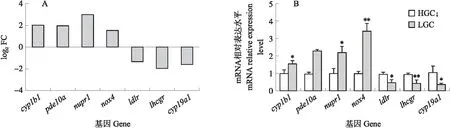
图7 转录组测序结果(A)与qPCR验证基因表达水平(B)Fig.7 Data of RNA-Seq(A)and relative expression levels of selected genes determined by qPCR(B)*P<0.05,**P<0.01.
2.6 差异基因的qPCR验证
在卵泡发育相关的众多差异基因中,以健康卵泡颗粒细胞为对照,随机挑选4个上调基因cyp1b1、pde10a、nupr1和nox4和3个下调基因ldlr、lhcgr和cyp19a1,通过qPCR验证测序结果的准确性。结果如图7所示,7个差异基因在健康卵泡颗粒细胞(HGC)与闭锁颗粒细胞(LGC)的表达水平和转录组测序结果趋于一致,这些结果均证实了转录组测序结果的可靠性。
3 讨论
本试验结果显示,健康卵泡颗粒细胞相较于闭锁卵泡颗粒细胞而言,存在771个差异基因,320种细化功能,48条差异显著的信号通路,其中涵盖了血管生成、氧化应激、细胞增殖、激素分泌以及能量代谢等方面,该结果为后续深入研究颗粒细胞凋亡导致卵泡闭锁的分子机制提供理论依据。
卵泡发育的完整过程包括原始卵泡的形成、激活,由初级卵泡逐渐生长为次级卵泡、三级卵泡,最终排卵,其中颗粒细胞在每个阶段均发挥调控作用[9]。研究表明,哺乳动物的原始卵泡库在个体出生前后形成并且无法更新,可以直接确定雌性动物一生中生育储备的总量,而原始卵泡库的数量由卵母细胞的选择与前颗粒细胞的数量限制两方面共同决定,并且前颗粒细胞引导的信号通路可以直接激活原始卵泡的发育[2]。颗粒细胞在卵泡进入生长阶段后开始表达卵泡刺激素(FSH)的受体,同时大量增殖以维持内分泌[10]。在卵泡的发育过程中,卵母细胞和颗粒细胞间会形成间隙连接(gap junction)。一方面,颗粒细胞通过间隙连接持续低水平发送环磷酸腺苷(cyclic adenosine monophosphate,cAMP)信号等物质至卵母细胞,调控卵母细胞的生长、代谢以及成熟;另一方面,卵母细胞也对卵丘细胞的扩展、颗粒细胞的增殖分化以及颗粒细胞类固醇激素的合成与分泌产生影响[11]。在排卵过程中,颗粒细胞伸出突起,穿过基底膜,为血管和卵泡膜细胞在排卵后黄体发育时侵入颗粒细胞层打下基础。总之颗粒细胞的增殖和凋亡与卵泡发育紧密相关,因此对不同阶段颗粒细胞进行有参转录组测序具有重要意义。
本研究通过猪卵泡颗粒细胞的转录组测序GO功能富集分析发现颗粒细胞凋亡的过程受到多种因素调控,其中包括Rho蛋白信号转导、GTP酶活性正调控、ERK1和ERK2级联的正调控、细胞增殖正调控、血管生成(angiogenesis)、免疫系统等。Rho蛋白属于小GTPase蛋白家族的一个分支,参与调节基因表达、细胞骨架重组、细胞周期进程、细胞壁合成以及丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAP)激酶信号的转导。GTP酶则是能与GTP结合的一种酶,可以催化GTP水解,与能量代谢紧密相关。细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)是一种丝氨酸/苏氨酸蛋白激酶,是一种信号转导蛋白,ERK被激活后可以进入细胞核并调节基因表达和转录因子活性,同时参与对细胞增殖、分化以及凋亡的调控。血管生成对于卵泡的生长发育而言至关重要[12],从表观形态来观察健康卵泡和闭锁卵泡的区别,可以明显看出闭锁卵泡膜表面几乎没有血管。血管连接卵泡内外的物质交换,是运输营养物质、氧气和代谢产物的重要通道。氧化应激是引起颗粒细胞凋亡和卵泡闭锁的主要原因之一[13],卵泡中免疫系统中最主要发挥的功能便是抗氧化,其中FoxO转录因子被认为是调节氧化应激和细胞凋亡的关键介质[14]。
本试验基于以上细化功能,从771个差异显著的基因中筛选出7个与卵泡发育相关的基因来进行测序结果的验证工作。晚期闭锁卵泡颗粒细胞与健康卵泡颗粒细胞相比,cyp1b1、pde10a、nupr1、nox4属于表达上调基因,ldlr、lhcgr、cyp19a1属于表达下调基因。CYP1B1和CYP19A1同属于细胞色素P450家族,CYP1B1的表达会促进氧化应激诱导的凋亡[15],同时它也参与细胞群增殖的负调控,在肿瘤细胞中过度表达,是一种肿瘤生物标志物。CYP19A1是在雌激素合成过程中的关键酶,并参与了卵泡发育这一繁殖过程[16]。PDE10A是一种磷酸二酯酶,是环磷酸腺苷(cAMP)的一个关键调节因子[17],在生物系统的转导和细胞信号传递等多种途径中发挥作用[18]。NUPR1是一种肿瘤应激相关小分子核蛋白[19],在多种应激反应中传导细胞信号,涉及多种通路调节细胞的增殖和凋亡。NOX4是烟酰胺腺嘌呤二核苷酸氧化酶(NOX)的一种亚型[20],它的高表达可诱导细胞损伤并导致缺氧诱导因子1α(HIF1α)等多个信号通路异常[21]。低密度脂蛋白受体(LDLR)和黄体生成素-绒毛膜促性腺激素受体(LHCGR)都与雌激素的分泌息息相关,LHCGR也是黄体功能、卵泡成熟和排卵所必需的调控因子[22]。
从KEGG富集分析结果中我们注意到,显著差异的通路有PI3K-Akt信号通路、卵巢类固醇生成、补体和凝血级联、破骨细胞分化、吞噬体、自然杀伤细胞介导的细胞毒性、白细胞跨内皮迁移、细胞因子间受体相互作用、ECM-受体相互作用、Jak-STAT信号通路、皮质醇的合成与分泌、趋化因子信号转导途径、钙信号通路、轴突指导等。PI3K-Akt通路中的磷脂酰肌醇3激酶(PI3K)可以被多种因子激活[23],继而激活下游关键靶点蛋白激酶(protein kinase B,Akt),Akt被激活后进入细胞核和细胞质,使Akt的目标靶基因被磷酸化或被激活、被抑制,继而引发一系列代谢效应[24]。PI3K-Akt介导的通路对于调节细胞增殖和存活发挥着重要的作用,在卵巢中维持着原始卵泡静止和卵泡激活发育的平衡[25],并且该通路下游连接不同作用的各个底物,从而引导不同的功能效应。卵巢类固醇生成通路与卵巢功能和卵泡发育密切相关,该通路包括lhcgr、igf1r、star、cyp19a1、cyp1b1、fshr等合成类固醇的功能基因,直接或间接参与卵巢类固醇激素和孕酮的合成[26],而以上激素对正常的子宫功能、妊娠的建立和维持以及乳腺发育至关重要[27]。Costermans等[28]研究发现,猪卵泡大小与卵泡液雌二醇的浓度在卵泡发育初期就已经存在正相关关系,因为卵泡越大雌二醇浓度越高。在哺乳动物中,JAK/STAT通路是多种细胞因子和生长因子的主要信号传导机制,通路中JAK1、STAT1和STAT3均在颗粒细胞中表达[29],尤其在原始卵泡中表达,表明JAK/STAT通路是哺乳动物颗粒细胞与卵泡相互作用的途径之一。皮质醇是一种内源性糖皮质激素,可以调节多种生理功能,它的产生主要受促肾上腺皮质激素(ACTH)影响,ACTH对皮质醇合成的刺激作用取决于cAMP依赖性信号传导[28],但也涉及细胞溶质Ca2+的增加,cAMP和Ca2+都会诱导StAR的表达[30],刺激线粒体内胆固醇转移,以及从胆固醇到皮质醇的途径中的类固醇生成(例如CHE、CYP17A1、CYP11B1),而类固醇的生成与猪卵泡发育和闭锁过程密切相关[31]。趋化因子信号由免疫细胞表达的趋化因子受体(G蛋白偶联受体)转导,受体激活后,继而激活多种下游通路,导致肌动蛋白重组和细胞极化,其中小GTPase家族的成员都参与了这个过程,并会有一氧化氮和活性氧的产生,活性氧和一氧化氮等物质会使猪卵泡中的颗粒细胞受到氧化应激而凋亡,颗粒细胞凋亡至一定程度后则会引发卵泡闭锁[32]。钙信号会调节细胞线粒体的一些活动,包括ATP的产生,以维持细胞的生物能量。另外,L型钙通道在卵巢中被激活后,会增加钙离子介导的孕酮合成[33]。
以上数据表明,颗粒细胞凋亡与卵泡闭锁息息相关,而其中涉及血管生成、能量代谢、激素分泌以及氧化应激等方面的基因、蛋白和信号通路,后续研究将围绕差异表达基因或通路进行更深入的试验。因此,对于颗粒细胞转录组数据的分析可能是深入了解卵泡闭锁机制的起点,也是减少卵泡闭锁现象的关键点。
