卵泡刺激素对原癌基因c-myc在鸡卵泡上表达的影响
2023-05-29刘小凡谢晓磊吴咏梅陆应林虞德兵
刘小凡,谢晓磊,吴咏梅,陆应林,虞德兵*
(1.南京农业大学动物科技学院,江苏 南京 210095;2.山东省莱阳市农业农村局,山东 莱阳 265200)
卵泡是雌性动物正常繁殖的重要组织。发育成熟的雌性家禽只有左侧的卵巢和输卵管,其卵泡发育有很严格的等级制度,分为原始卵泡、初级卵泡、等级前卵泡[包括小白卵泡(SWF,<2 mm)、大白卵泡(LWF,3~5 mm)、小黄卵泡(SYF,6~8 mm)]和等级卵泡(F1—F6)[1-3]。产蛋高峰期母鸡卵巢中含有 30~100个直径为1~8 mm的卵泡,但只有5%的卵泡能发育成小黄卵泡,大量的小卵泡发生闭锁。在一个排卵周期中,只有F1排卵后才会有一个小黄卵泡被选择进入等级卵泡阶段,等级序列中的优势卵泡再顺序发育[3-5]。
卵泡刺激素(follicle stimulating hormone,FSH)是一种垂体分泌的糖蛋白激素,是正常性腺发育和繁殖所必需的激素。FSH的瞬时增加使每个卵泡波的启动提前,刺激卵泡簇的募集[6-8],FSH通过促卵泡激素受体(follicle-stimulating hormone receptor,FSHR)促进细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP))形成,刺激未成熟颗粒细胞激活其增殖和分化所需基因[9]。FSH不仅能维持母鸡等级前卵泡生育能力,还能增加颗粒细胞的存活率[10-11]。FSH通过刺激鸡等级前卵泡颗粒细胞的增殖促使其进入等级发育[5]。
c-myc是原癌基因家族(c-myc、N-myc、L-myc)中最重要的成员,也是一个重要的转录因子。细胞生长需要c-myc的参与,c-myc又能诱导很多基因的表达,因此,它是细胞生长的主要调节器。c-myc对细胞具有双重作用,既可以刺激细胞增殖,又可以促进细胞凋亡。Myc通过增强与Bax激活和细胞色素c释放相关的线粒体中凋亡信号通路来诱导细胞凋亡[12]。有研究认为c-myc可能通过参与Wnt途径和Notch信号转导通路启动原始卵泡的生长发育[13],还可能通过PI3K信号传导通路来调节在原始卵泡启动中发挥重要作用的p27kip1基因水平[14]。c-myc对卵泡早期颗粒细胞发育、卵泡退化、卵泡发育和黄体形成以及卵泡闭锁期间细胞死亡有一定的影响[15-17]。目前,有关c-myc在禽类的卵泡发育及生殖过程中的研究较少。本试验旨在通过研究c-myc在各等级卵泡中的表达以及FSH对c-myc的诱导作用来探究鸡卵泡发育的机制,为家禽繁殖育种技术与方法的改造优化提供理论依据。
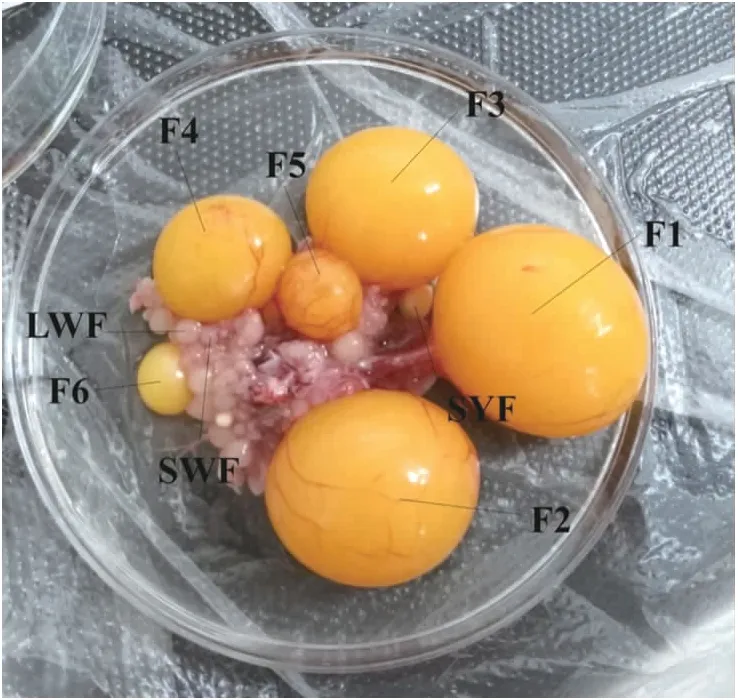
图1 高产母鸡不同阶段卵泡Fig.1 Follicles at different stages in high-laying chickenF1—F6:1~6等级卵泡Grade 1-6 follicles;SWF:小白卵泡Small white follice;LWF:大白卵泡Large white follicle;SYF:小黄卵泡Small yellow follice. 下同The same below.
1 材料与方法
1.1 试验材料
试验所用产蛋鸡是200~250日龄的京红1号,购自南京彭福养鸡场。试验母鸡自由采食、饮水,鸡舍内保持适宜的温度、湿度和光照。
试验所用主要试剂:PBS缓冲液、DMEM/F12细胞培养基、胎牛血清、胰酶、双抗及ITS(Gibco公司),RNA提取试剂盒和转染所用试剂Lipofectamine 2000(Invitrogen公司),RT-qPCR试剂盒(abm公司),c-Myc一抗(abcam公司),RNA反转录试剂盒[宝生物工程(大连)有限公司]和FSH(宁波第二激素厂)。
1.2 方法
1.2.1 卵泡颗粒层、膜层的分离和保存将试验鸡用乙醚深度麻醉后通过颈部放血处死。处死后打开母鸡的腹腔,取出卵泡置于预热的PBS中(图1)。选取SWF、LWF、SYF以及F4、F1卵泡(n≥3),用手术剪把卵泡从卵巢上剪下,放入装有预热的PBS培养皿中。分离F1、F4卵泡膜层和颗粒层时,首先用一个镊子固定卵泡最外层的结缔组织,另一个镊子剥离附着在卵泡上的结缔组织,清洗卵泡,确定结缔组织均已剥离;然后,用一个镊子的一角刺破卵泡,2个镊子同时从撕破口朝两边撕开卵泡,迅速使卵泡卵黄朝下平铺在培养皿中。随后,用镊子的背面轻轻敲打卵泡膜层,使膜层和颗粒层分开,用镊子轻轻挑起膜层,另一个镊子贴近膜层,把粘连的颗粒层与膜层分开,直至卵泡的整个膜层被剥离。最后把分离好的膜层置于PBS中,清洗后装入离心管中,用镊子把铺在卵黄上的颗粒层轻轻捞起,置于PBS中,清洗后装管。
分离SYF、LWF、SWF时,首先用镊子把附着在卵泡上的结缔组织清理干净,然后用镊子的一角刺破卵泡,2个镊子同时撕开卵泡,使卵泡卵黄朝上彻底平铺在盛有PBS的培养皿中,再用镊子把上层的卵黄轻轻拨走以露出颗粒层。最后用一个镊子固定膜层,另一个镊子两角并拢,贴着膜层把颗粒层分离下来,轻轻清洗干净后装管,膜层经清洗后也装入离心管中。
装入离心管中的膜层和颗粒层储存在液氮中,经组织破碎仪破碎后,用RNA提取试剂盒提取RNA,RT-qPCR 检测c-mycmRNA的表达水平。
1.2.2 免疫组化检测屠宰母鸡,取出卵泡,用预热的PBS清洗后再用4%多聚甲醛固定;经过一定浓度梯度的乙醇和二甲苯脱水和脱色,再经石蜡包埋后,切成5 μm的组织切片。组织切片于60 ℃恒温箱中烘 1 h。制作好的石蜡切片再经过一系列浓度梯度的二甲苯和乙醇分别进行脱蜡和水化处理,用双蒸水(ddH2O)冲洗后置于pH6.0的10 mmol·L-1柠檬酸缓冲液中煮沸以修复抗原,冷却后用ddH2O洗涤,再用3% 过氧化氢-甲醇溶液裂解细胞以灭活内源性过氧化氢酶。清洗后用10%山羊血清封闭切片40 min,之后用含5% 山羊血清、3% 牛血清白蛋白的磷酸盐吐温缓冲液(PBST)稀释的一抗4 ℃孵育过夜。取出切片,用PBST清洗4次,加入酶标二抗,室温孵育1 h。洗净后加DAB显色液到切片上,湿盒显色5~10 min后在蒸馏水中终止染色,再进行苏木精复染、脱水透明、封片。以PBST取代一抗作为空白对照。
1.2.3 卵泡培养和激素处理取出小黄卵泡后,用预热的PBS漂洗干净,按照每孔1个卵泡的密度接种24孔培养板。用基础培养基[含DMEM/F12培养基、1% 胎牛血清(FBS)、1% 双抗]在37 ℃、5% CO2的培养箱中预培养16 h。弃去基础培养基后将卵泡分为2组,每组至少8个重复。空白对照组:ITS培养基,含DMEM/F12培养基、1% ITS(胰岛素、转铁蛋白、亚硒酸)细胞培养添加物、1% 双抗;FSH处理组:含50 ng·mL-1FSH的ITS培养基。2组分别处理小黄卵泡36 h后,对照组和FSH组的卵泡一半用4%多聚甲醛固定,另一半用机械分离法分离卵泡的膜层和颗粒层,分别用RNA提取试剂盒提取RNA,采用 RT-qPCR 检测相关基因mRNA的表达。
1.2.4 HE染色及颗粒层厚度测量对照组和FSH组的4个卵泡均经4%多聚甲醛固定,参照1.2.2节步骤制成石蜡切片。依据苏木素-伊红(HE)染色试剂盒说明书对切片进行染色、封片,使用光学显微镜筛选出每个卵泡染色最清晰的3张切片,对每张切片从3个不同的角度进行拍照,利用Image-pro plus 6.0 软件对每张切片的20倍视野下的颗粒细胞和颗粒层厚度进行测量及统计。
1.2.5 RT-qPCR 检测基因的表达在NCBI网站查找相关基因序列,利用Primer 5.0软件设计基因引物(表1)。参照RNA提取试剂盒说明书提取RNA后用反转录试剂盒反转录成cDNA。以β-actin为内参基因,用qPCR试剂盒检测相关基因表达水平。反应产物经熔解曲线检测特异性。用2-ΔΔCT法计算目的基因的相对表达水平。
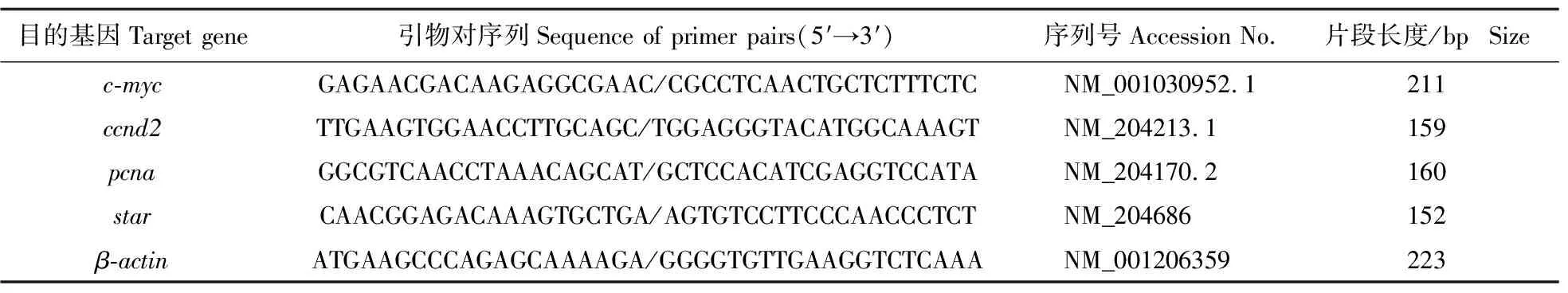
表1 基因引物序列Table 1 Primer sequences for qPCR
1.2.6 鸡小黄卵泡颗粒细胞的培养和c-mycsiRNA转染采用机械分离法分离鸡小黄卵泡的颗粒层,用含有双抗的PBS清洗2次,经胰酶消化、过筛、清洗后用基础培养基调整细胞含量后接种细胞培养板,置于37 ℃、5% CO2培养箱中预培养16 h。根据c-myc基因序列,交由上海吉玛公司合成2对c-mycsiRNA(序列如表2)。使用Lipofectamine 2000将2对c-mycsiRNA转染至2组颗粒细胞中,并设阴性对照(NC)组,筛选出敲减效果最好的c-mycsiRNA对。将预培养后的颗粒细胞分为3组,每组至少3个重复。NC组:先用NC转染细胞24 h,再用ITS培养基培养细胞24 h;sic-myc组:先用敲减效果最好的c-mycsiRNA转染细胞24 h,再用ITS培养基培养细胞24 h;sic-myc+FSH组:先用敲减效果最好的c-mycsiRNA转染细胞24 h,再用50 ng·mL-1FSH处理细胞24 h。收集颗粒细胞,提取RNA,采用RT-qPCR检测c-mycmRNA的表达水平。

表2 c-myc siRNA位点序列Table 2 Sequence of c-myc siRNA site
1.3 数据的统计分析

2 结果与分析
2.1 c-myc mRNA在卵泡中的表达
如图2所示:c-mycmRNA在SWF、LWF、SYF、F4和F1卵泡上都有表达,c-mycmRNA在SYF和SWF颗粒层中的表达水平极显著高于F1、F4和LWF(P<0.01)(图2-A),在SYF上表达水平最高。c-myc转录水平在等级前卵泡的卵泡膜中极显著高于等级卵泡(P<0.01),且在等级前卵泡中随卵泡发育逐渐升高,在SYF上表达量最高(图2-B)。此结果提示c-myc参与了鸡卵泡的发育调控。

图2 c-myc在鸡卵泡上的表达Fig.2 The expression of c-myc mRNA in chicken follicle柱上大写字母不同表示在0.01水平上差异显著。下同。Different uppercase letters on the column indicate significant difference at the level of 0.01. The same below.
2.2 c-Myc蛋白在鸡卵泡中的定位
用免疫组化法检测c-Myc蛋白在卵泡中的表达。结果(图3)显示:c-Myc蛋白阳性染色定位于细胞核,为黄棕色颗粒,如图3-A箭头所示(红圆处已进行局部放大)。结果提示c-Myc蛋白在卵泡的颗粒层和膜层都有表达。

图3 c-Myc蛋白在鸡卵泡的免疫组化定位检测Fig.3 Immunocytochemical reation of c-Myc protein for follicle of chickenA. c-Myc 蛋白在卵泡上的定位(红色箭头表示阳性表达细胞)The protein of c-Myc localization(positive expression cells are red arrows);B. 阴性对照 The negative.O:卵母细胞Oocyte;GL:颗粒细胞层Granular layers;ML:卵泡膜层Membrane layers. 下同The same below.
2.3 FSH处理对鸡小黄卵泡颗粒层和膜层的影响
小黄卵泡的HE染色结果显示:对照组中颗粒层由2~3层颗粒细胞构成(图4-A),而FSH组中颗粒细胞层数明显增加,可达6~7层,如图4-B(画红圆处被局部放大)。与对照组相比,FSH组的鸡小黄卵泡颗粒层的厚度增加25.5%(P<0.05,图4-C),颗粒细胞的密度极显著增加27.8%(P<0.01,图4-D)。

图4 经卵泡刺激素(FSH)处理后鸡小黄卵泡的形态学测量结果Fig.4 The measurement results of morphological changes of chicken SYF treated by follicle stimulation hormone(FSH)A. 对照组 Control group;B. FSH处理组 FSH group;C. 小黄卵泡颗粒层的厚度The thickness of granular layer for SYF;D.小黄卵泡颗粒细胞密度The density of granular layer for SYF. *P<0.05, **P<0.01.下同 The same below.
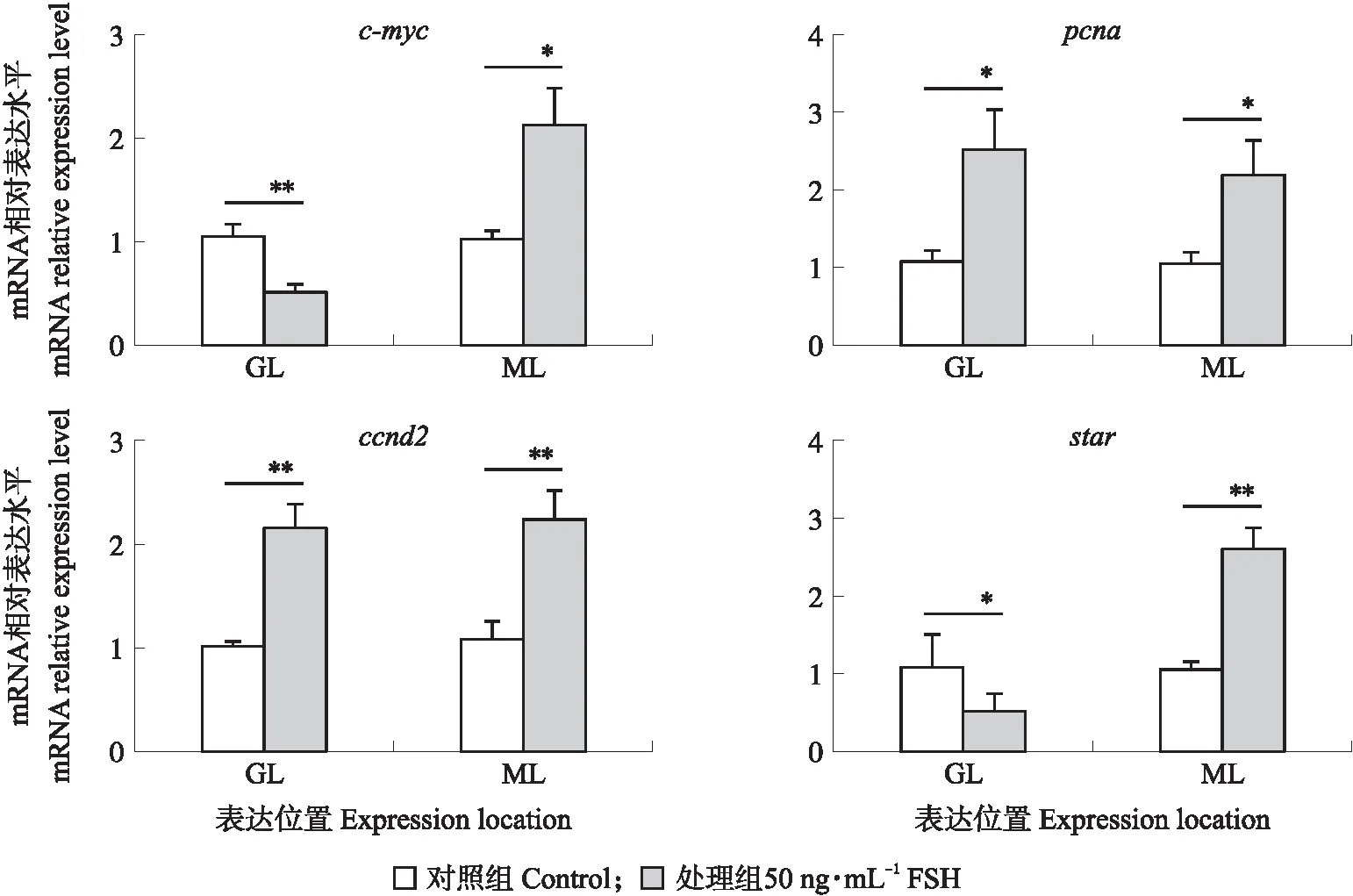
图5 c-myc、pcna、ccnd2、star mRNA在FSH处理的小黄卵泡中的表达Fig.5 Expression of c-myc,pcna,ccnd2,star mRNA in SYF follicle treated by FSH
2.4 FSH对c-myc 在体外培养小黄卵泡中的表达影响
用RT-qPCR检测SYF颗粒层和膜层中c-myc和增殖细胞核抗原(proliferating cell nuclear antigen,pcna)基因、类固醇激素合成急性调节蛋白(steroid acute regulatory protein,star)基因和周期蛋白D2(cyclin D2,ccnd2)基因的表达水平。如图5所示:与对照组相比,FSH处理36 h后,c-mycmRNA在SYF颗粒层中的表达水平极显著降低(P<0.01),而在膜层中的表达水平显著增加(P<0.05);FSH组pcnamRNA在颗粒层和膜层的表达水平均显著高于对照组(P<0.05);与对照组相比,ccnd2 mRNA表达水平在颗粒层上极显著升高(P<0.01),starmRNA表达水平在颗粒层显著降低(P<0.05),而ccnd2和starmRNA在膜层的表达水平均极显著升高(P<0.01)。
2.5 c-myc敲减后FSH对c-myc在SYF上表达的影响
如图6-a所示:与对照组相比,SYF颗粒细胞转染sic-myc 1和sic-myc 2后,c-mycmRNA的表达水平均极显著降低(P<0.01),因sic-myc 2的敲减效率更好,选择其作为后续材料。如图6-b所示:敲减c-myc后加入FSH,与NC组相比,sic-myc组的c-mycmRNA表达水平极显著降低(P<0.01),而sic-myc+FSH组的c-mycmRNA表达水平无显著变化(P>0.05)。
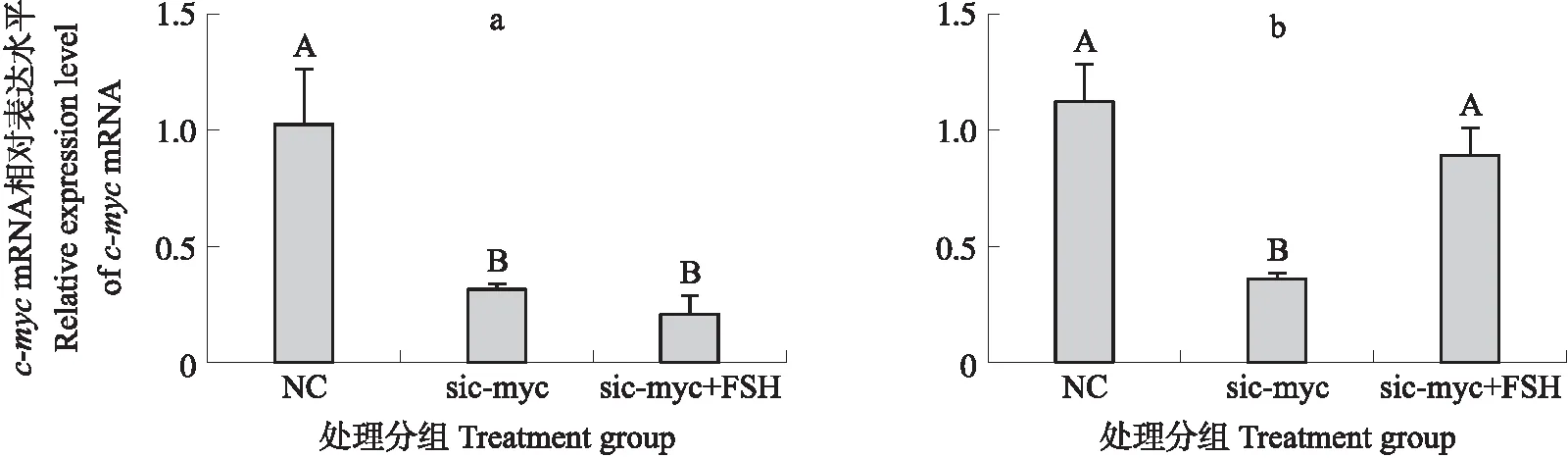
图6 FSH对c-myc敲减后小黄卵泡颗粒细胞c-myc表达的影响Fig.6 The effect of FSH on the expression of c-myc in SYF granular cells after c-myc knockdowna. siRNA干扰效果筛选Sifting of siRNA effect;b. c-myc 敲减对FSH的影响The regulaion of FSH after c-myc knockdown in granular cell of SYF. NC:阴性对照 The negative control.
3 讨论
3.1 c-myc对鸡卵泡发育的影响
家禽卵泡分类有很严格的等级体系,由等级前卵泡进入到排卵前卵泡。若母鸡卵泡不断成熟和排卵,维持周期性发育,则有较高的产蛋率。本研究选择SWF、LWF、SYF、F4 和F1这5个等级的卵泡进行c-myc基因的表达水平检测。c-mycmRNA在猪早期小卵泡(1~2 mm)颗粒细胞中大量表达,而在大卵泡(3~11 mm)颗粒层中未见表达[18]。陈五妍[19]在研究小鼠卵泡发育、闭锁、黄体形成和退化过程中发现,c-Myc 蛋白在原始卵泡时期未见表达,但在其他时期都有微量表达,且在早期黄体中表达量达到最大值。路洪涛等[20]发现在鹅等级前卵泡中myc在初级卵泡中表达最高,在中白卵泡中最低。而在本试验中,免疫组化显示c-Myc 蛋白在卵泡的膜层和颗粒层均有表达,c-mycmRNA在等级前卵泡中的颗粒层和膜层的表达水平均显著高于排卵前卵泡F4和F1,且在SYF中表达水平最高,这可能与种属及颗粒层、膜层分开检测有关,说明c-myc参与了卵泡的发育调控,提示该基因可能与卵泡闭锁和优势卵泡的选择有密切关系。
3.2 FSH处理对小黄卵泡增殖和分化的影响
卵泡发育成熟和维持正常功能的重要条件是卵母细胞、颗粒细胞和膜细胞的相互作用[21]。禽类发育中,进入优先等级的关键点是6~8 mm的小黄卵泡[22],本研究使用50 ng·mL-1FSH 培养小黄卵泡36 h以探究c-myc对卵泡的作用。pcna可客观评价细胞的增殖状态[23-24],ccnd2在卵巢每个阶段的卵泡颗粒细胞中表达,调控细胞周期G1期、G2期向S期过渡,对细胞周期起正调控作用[25]。经过FSH处理后,小黄卵泡的颗粒层厚度增加了25.5%,密度增加了27.8%,FSH组的卵泡颗粒层上的pcnamRNA和ccnd2 mRNA表达水平均显著高于对照组,再次证实了FSH能促进颗粒细胞的增殖[5]。StAR是一种线粒体蛋白,是调节类固醇激素生成过程的重要因子,常被用来衡量类固醇生成状况及细胞分化的指标。Lim等[26]发现FSH能瞬时诱导c-Myc蛋白在大鼠体外培养的原代支持细胞的表达。有研究结果表明 c-Myc 蛋白表达的降低与终端分化有关[27]。在本试验中,FSH能增加体外培养的小黄卵泡膜层c-mycmRNA的表达水平,但降低了体外培养的小黄卵泡颗粒层c-myc和star表达水平。体外培养颗粒细胞和膜细胞时,FSH处理会促进细胞生长,但用FSH处理单独的颗粒细胞就不会出现这种现象[28],推测FSH体外培养卵泡促进了卵泡细胞的生长,诱导了颗粒细胞和膜细胞的增殖,但也使颗粒细胞提前进入终端分化。
3.3 FSH处理对小黄卵泡颗粒细胞中c-myc转录的影响
在本试验中,FSH能诱导敲减了c-myc的颗粒细胞表达c-myc,这说明c-myc可能通过FSH的诱导而对鸡卵泡的发育起作用。等级前卵泡的颗粒细胞中BTC(β-cellulin,β细胞素蛋白)和TGF-α(transforming growth factor α,转化生长因子α)通过MAPK/Erk促进了c-myc的表达[29],ERK信号通路中myc和srf基因在鹅等级前卵泡发育中起一定的作用[20],细胞因子bFGF和FSH通过PI3K-AKT和ERK信号通路刺激颗粒细胞的增殖和抗凋亡以促进早期鸡卵巢原始卵泡的激活[30]。可进一步研究c-myc是否由FSH通过ERK信号通路而对卵泡闭锁和优势卵泡的选择起作用。
综上所述,c-myc在鸡等级前卵泡中的表达水平高于排卵前卵泡,且在SYF中表达水平最高。FSH能降低c-myc在体外培养的鸡小黄卵泡颗粒细胞上的表达,且能挽回由c-myc敲减导致的c-myc表达水平降低的趋势,这为进一步研究c-myc在鸡卵泡发育中的作用奠定基础。
