植物登陆过程中exocyst复合体的演化
2023-05-29刘文龙胡钢周光磊李炳君吴冬杰刘松奇鲍依群谭小云
刘文龙,胡钢,周光磊,李炳君,吴冬杰,刘松奇,鲍依群,谭小云
(南京农业大学生命科学学院,江苏 南京 210095)
化石证据和分子生物学证据表明,在大约4.7亿年前,轮藻门双星藻纲的某种藻类从水生环境登上陆地,随后在进化中发生一系列形态、结构以及生活方式的演化,逐步适应陆地环境,这个过程被称为植物登陆(plant terrestrialization)[1-2]。植物登陆改变了地球大气环境和陆地环境,为海洋动物登陆提供了基础,因此是地球生命进化史上的关键事件之一。为了适应陆地干旱、高盐、温度剧烈变化、紫外线强烈照射等逆境条件,植物在登陆过程中发生了一系列适应性进化,包括:胚和种子的产生,维管束的形成,根、茎、叶的分化,生活史和繁殖方式的改变等[2-3]。这一系列进化的基础是植物基因组的改变,其方式包括全基因组复制(whole genome duplication,WGD)、基因复制(gene duplication)和基因变异(gene mutation)、水平基因转移(horizontal gene transfer,HGT)等[4-5]。其中,囊泡运输相关基因的进化,导致细胞内囊泡运输机制的改变,是这种适应性进化的重要原因之一[2]。
囊泡运输是真核细胞物质运输的一种重要形式,指物质包被在囊泡中运输到其他区室的过程。它分为4个基本步骤:囊泡形成、转运、拴系和融合[6]。其中拴系是指囊泡和靶膜之间的识别和靠近,以确保囊泡精确定位。拴系过程主要由拴系因子介导[7]。exocyst复合体是真核细胞中保守的拴系因子,由Sec3、Sec5、Sec6、Sec8、Sec10、Sec15、Exo84和Exo70共8种亚基组成。研究表明酵母中Sec3、Sec5、Sec6、Sec8、Sec10、Sec15处于exocyst的内部,而Exo84和Exo70处于exocyst的外部[8]。在酵母和哺乳动物中,exocyst主要介导外泌囊泡的拴系过程,参与细胞分裂和细胞外泌等过程[9]。和酵母以及动物相比,被子植物exocyst亚基基因的拷贝数更多[10],因此在结构和功能上具有更加广泛的多样性。例如拟南芥exocyst参与细胞极性生长、细胞壁合成、维管束形成、细胞分裂、细胞自噬、抗病、抗盐、抗细胞凋亡等过程[11-13]。因此,exocyst复合体在植物适应陆地环境中发挥了重要作用。然而,在植物登陆过程中,exocyst亚基基因是如何演化以帮助植物适应陆地环境?人们对这个问题的了解还很有限。
近20年来,多种藻类(如绿藻门植物和轮藻门植物)[14-15]和低等陆生植物(如苔藓和蕨类等)物种[16-17]的基因组测序完成,为研究exocyst复合体在植物登陆过程中的演化规律创造了条件。本研究从绿藻门、轮藻门、苔藓、蕨类、裸子植物和被子植物中选取16种代表性植物,对其exocyst复合体亚基的氨基酸序列进行序列比对、进化分析、保守基序分析、高级结构预测和比较,进而研究它们的进化规律;并以拟南芥为陆生植物代表分析其特有的Exo70G家族蛋白的亚细胞定位及其在干旱胁迫和盐胁迫中的表达。在植物登陆过程中,exocyst内部亚基并没有发生显著变化,而表面亚基的数量和结构发生了显著改变,特别是Exo70亚基,其基因大量复制、分化产生多个类群,包括陆生植物特有的类群GroupⅢ(Exo70G),其基因在干旱胁迫和盐胁迫下高表达,可能对于植物抗干旱胁迫和盐胁迫具有重要的价值。本研究不仅有助于了解植物登陆的分子机制,也有助于了解植物对于干旱高盐环境的适应机制,为提高农作物抗旱抗盐能力的基因改造工作奠定理论基础。
1 材料与方法
1.1 代表性植物物种exocyst亚基鉴定
选取16种具有代表性的藻类和陆生植物物种。藻类为:绿藻门植物金牛鸵球藻(Ostreococcustauri,Ota)、小球藻(Chlorellavariabilis,Cva)、莱茵衣藻(Chlamydomonasreinhardtii,Cre),轮藻门植物中斑藻(Mesostigmaviride,Mvi)、克里藻(Klebsormidiumnitens,Kni)、轮藻(Charabraunii,Cbr)、双星藻(Spirogloeamuscicola,Smu);陆生植物为:苔藓植物角苔(Anthocerosangustus,Aan)、小立碗藓(Physcomitrellapatens,Ppa)、地钱(Marchantiapolymorpha,Mpo),蕨类植物卷柏(Selaginellamoellendorffii,Smo)、细叶满江红(Azollafiliculoides,Afi),裸子植物银杏(Gingkobiloba,Gbi)、买麻藤(Gnetummontanum,Gmo),被子植物无油樟(Amborellatrichopoda,Atr)和拟南芥(Arabidopsisthalinana,Ath)。通过NCBI(https://www.ncbi.nlm.nih.gov/)网站下载这些物种的基因组、蛋白及cDNA 序列。利用Pfam 数据库(http://pfam.sanger.ac.uk/)获得不同exocyt亚基的保守序列与不同物种基因组数据库进行BLASTp搜索,筛选这些物种中exocyst亚基蛋白序列。
1.2 蛋白质序列比对和进化树构建
不同物种exocyst不同亚基序列分别运用Clustal W 工具进行多序列比对,然后利用MEGA 7.0 软件对完成比对的序列进行系统进化树构建,构建方法采用最大似然法(Maximum-likelihood method),Bootstrap值设为1 000,分析16个物种exocyst不同亚基蛋白的系统进化关系。
1.3 蛋白质保守基序分析
采用在线基序分析工具MEME(multiple expectation maximization for motif elicitation)(http://meme.sdsc. edu/meme4_3_0/intro.html)对16个物种exocyst不同亚基蛋白进行保守基序分析。
1.4 蛋白质高级结构预测
采用在线基序分析工具Robetta Fold(https://robetta.bakerlab.org/)[18]对感兴趣的蛋白进行高级结构预测,预测结果利用PyMol软件进行可视化。
1.5 盐胁迫、干旱胁迫处理以及基因表达分析
利用100 mmol·L-1NaCl模拟盐胁迫,以100 g·L-1的PEG6000模拟干旱胁迫,对拟南芥幼苗处理24 h后利用TaKaRa RNAiso Plus(Cat# 9109)试剂提取RNA,采用TaKaRa反转录试剂盒(Cat# RR047A)进行反转录,利用实时定量荧光PCR仪进行Real-time PCR,以TUA2基因为内参。
1.6 蛋白定位分析
构建Exo70G1-GFP克隆,转化农杆菌,混合红色荧光蛋白(RFP)或高尔基体定位蛋白甘露糖苷酶(Man1)接RFP(Man1-RFP)、反式高尔基体网络(TGN)定位蛋白(VTI112)接RFP(VTI12-RFP)同时注射至烟草表皮细胞,48 h后利用激光共聚焦显微镜观察并拍照。
2 结果与分析
2.1 代表性的藻类和陆生植物物种中exocyst复合体亚基的序列鉴定
选择7种代表性的藻类,包括:绿藻门植物金牛鸵球藻、小球藻和莱茵衣藻,均为单细胞绿藻,其中小球藻代表低等的早期绿藻;轮藻门植物中斑藻、克里藻、轮藻和双星藻,其中中斑藻为低等单细胞轮藻,克里藻为纤维状不分枝多细胞轮藻,轮藻是具备类似根茎叶器官分化的多细胞藻类,双星藻是被认为最接近陆生植物的轮藻[3]。9种代表性的陆生植物,包括:苔藓类植物小立碗藓、地钱和角苔,它们开始具有胚的结构,但没有维管组织,没有根茎叶分化,只能在潮湿的陆地环境生活;蕨类植物卷柏和满江红,这类植物开始具有维管组织,具备根茎叶的分化,可以从土壤中汲取水分和无机盐,呈孢子繁殖,受精过程依赖水;裸子植物银杏和买麻藤,这类植物开始以种子繁殖,更加适应陆地环境,但没有花的结构,受精过程部分依赖水;原始被子植物无油樟和模式植物拟南芥,它们具备了花的结构,具有更加先进的繁殖方式。总体而言,这些物种代表具有从低等到高等,从依赖水环境到逐步摆脱水生环境的演化规律。
通过BLAST鉴定16个物种中exocyst复合体不同亚基的氨基酸序列(图1)。发现3种单细胞绿藻和1个低等单细胞轮藻中斑藻并不具备完整的exocyst,如金牛鸵球藻缺失4个亚基(Sec8、Sec15、Exo84和Exo70),而中斑藻缺少3个亚基(Sec10、Sec15和Exo84),而从克里藻之后多细胞轮藻和陆生植物均具备完整的exocyst,说明完整的exocyst对于轮藻多细胞化以及植物登陆是必需的。
随着进化等级的提高,exocyst复合体表面亚基(Exo84和Exo70)拷贝数呈现增多的趋势,尤其是Exo70亚基拷贝数显著增加,例如克里藻只有1个Exo70亚基,而拟南芥拥有23个(图1)。暗示exocyst复合体表面亚基的多样化可能使其功能多样化,从而使高等植物细胞囊泡运输更加复杂化,以适应更加复杂的生存环境。
2.2 藻类和陆生植物中exocyst内部亚基的进化分析和比较
对酵母的研究显示,exocyst复合体8个亚基的组装具有高度层次性,首先是Sec3-Sec5、Sec6-Sec8和Sec10-Sec15两两结合,然后这3对再组装,形成exocyst复合体内部,因此这6个亚基被称为exocyst内部亚基,最后Exo84和Exo70再结合,占据exocyst复合体的表面,因此这2个亚基也被称为exocyst的表面亚基[8]。表面亚基除了和内部亚基结合外,还通过部分序列与膜脂如磷脂酰肌醇等结合,以实现囊泡拴系功能[19-20]。
16个代表性植物中,exocyst复合体每个内部亚基基因拷贝数都不超过3个。序列比对显示,藻类和被子植物的序列相似性均在60%以上,进化分析显示这些亚基的分子进化基本与物种进化同步。通过保守基序分析发现,从克里藻开始的多细胞轮藻和陆生植物,exocyst内部亚基都高度保守,含有相同的保守基序(图2)。高级结构预测显示,它们大多数的高级结构都类似于酵母的同源蛋白。总体而言,在植物登陆过程中,这些内部亚基的数量和结构并没有发生显著变化。因此,推测这些亚基的进化并不是陆生植物exocyst功能多样化的主要原因。
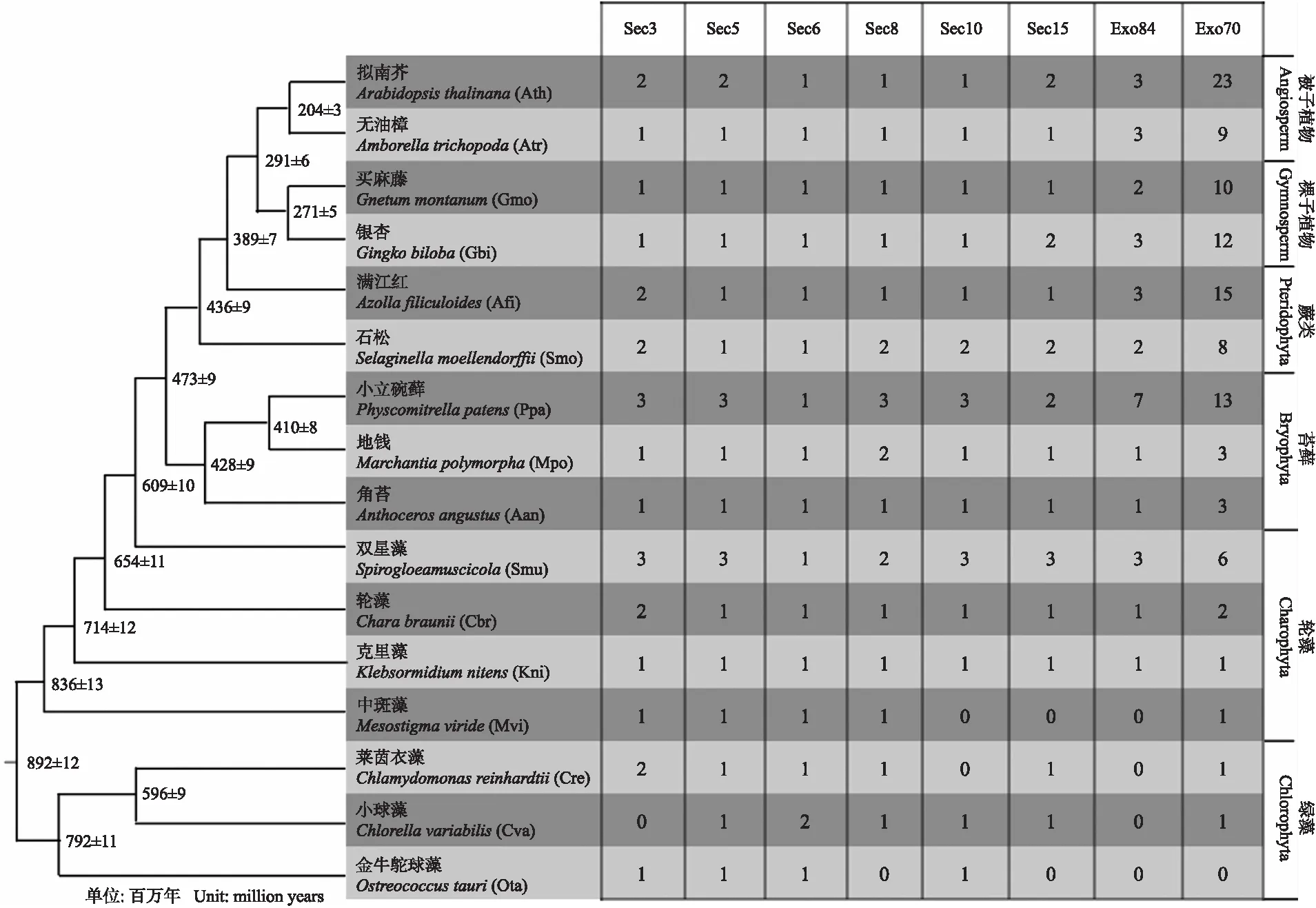
图1 代表性植物物种的exocyst亚基数量Fig.1 Number of exocyst subunits in representative plant species

图2 植物登陆过程中exocyst内部亚基的进化Fig.2 Evolution of exocyst internal subunits during plant terrestrializationA、B、C、D、E和F分别代表藻类和陆生植物中Sec3、Sec5、Sec6、Sec8、Sec10和Sec15的进化分析以及保守基序分析。A,B,C,D,E and F represent the evolutionary analysis and conserved motif analysis of Sec3,Sec5,Sec6,Sec8,Sec10 and Sec15 in algae and land plants,respectively.
2.3 藻类和陆生植物Exo84亚基进化分析和比较
大多数植物Exo84亚基基因的拷贝数为1~3,双星藻(Spirogloeamuscicola)中拥有3个Exo84亚基,早期陆生植物小立碗藓中则具有7个Exo84亚基(图3-A),说明在植物从水中到陆地生活的转换时期,Exo84亚基基因经历频繁的复制并保留了多个拷贝。
通过保守基序分析将植物Exo84亚基分为15个基序,其中最原始的克里藻和轮藻Exo84亚基具有13个保守基序。在轮藻向双星藻进化的过程中,在C末端增加了一个基序14,该基序富含丝氨酸,容易形成氢键,可能有利于Exo84和其他蛋白互作。在双星藻向苔藓进化的过程中,在N末端增加了基序15,该基序富含碱性氨基酸和丝氨酸,前者一般带正电荷(图3-B、C)。这2个基序大大增加Exo84的极性,有利于与其他分子互作。然而,在某些蕨类植物和种子植物中,多个物种Exo84亚基的基序15丢失,说明该基序对于维管植物的后续进化也并非必需。

图3 植物登陆过程中Exo84亚基的进化Fig.3 Evolution of Exo84 subunit during plant terrestrializationA.16种代表性植物的Exo84亚基进化分析和保守基序分析,红框代表藻类向陆生植物演化时增加的2个保守基序(基序14和基序15);B. 基序14和基序15的氨基酸序列;C. 轮藻、双星藻和角苔Exo84亚基的三级结构以及基序14、15的位置和结构比较。A. Exo84 subunit evolutionary analysis and conserved motif analysis of 16 representative plant species. Red boxes represent two conserved motifs(motif 14 and motif 15)added during the evolution of algae to land plants. B. Amino acid sequences of motif 14 and 15;C. Spatial structure of Exo84 subunit and comparison of the location of motif 14 and 15 in Chara braunii,Spirogloea muscicola and Anthoceros angustus.
2.4 藻类和陆生植物Exo70亚基的分类
植物Exo70亚基显示了高度多样性,如拟南芥含有23个Exo70亚基基因,说明在植物进化过程中,Exo70基因进行多次复制,并保留多个拷贝。在克里藻及前期的藻类中,Exo70基因的数量不超过1个,从轮藻开始增加为2个。双星藻拥有6个Exo70亚基,这种增加可能是为了适应半水生的环境。在苔藓植物角苔中,Exo70基因的数量减至3个,可能是在适应陆地环境后,丢失了一部分多余的Exo70基因。在大多数维管植物中,Exo70基因的数量维持在10个左右,但是在晚生的被子植物中,Exo70基因的数量呈现快速增长,尤其在拟南芥中增加至23个。
16个藻类和陆生植物物种的Exo70氨基酸序列比对和进化树分析结果(图4)表明,它们分为4个类群(GroupⅠ—Ⅳ),其中GroupⅠ为早期单细胞绿藻和轮藻的Exo70亚基,它们代表绿色植物Exo70亚基的基部类群,只在原始单细胞藻类(如单细胞绿藻和中斑藻)中存在。在进化形成多细胞丝状轮藻克里藻的过程中(约7~8亿年前),编码Exo70亚基的基因分化为2支,一支进化成GroupⅡ&Ⅲ,另一支进化成GroupⅣ。在克里藻之后,陆生植物形成前(约5~7亿年前),GroupⅡ&Ⅲ类群Exo70亚基中分化出一个陆生植物特有类群GroupⅢ,自此和GroupⅡ分开。另外,GroupⅣ最初在双星藻中形成,然后进化成绿色植物其他的Exo70亚基类群,是多样性最为丰富的一个类群。Žrsky等[21]对拟南芥Exo70进行8个亚家族(Exo70A—Exo70H)的分类,GroupⅡ也可称为Exo70A类群,因为其只包含拟南芥Exo70A亚家族在内的单系类群;GroupⅢ也可以称之为Exo70G类群,因为它是只包含拟南芥Exo70G亚家族在内的单系类群;GroupⅣ包含拟南芥其他6个Exo70亚家族成员及其祖先。GroupⅠ只存在于早期单细胞轮藻和单细胞绿藻中;GroupⅢ只存在于陆生植物中;GroupⅡ 存在于克里藻及其后的绿色植物中;GroupⅣ存在于双星藻及其后的绿色植物中。
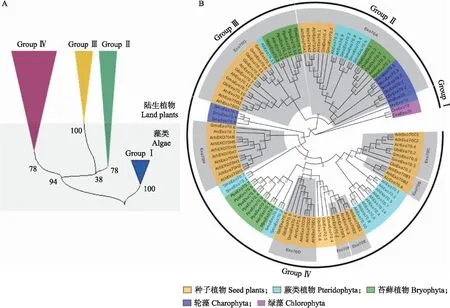
图4 代表性物种中Exo70亚基的进化和聚类分析Fig.4 Evolution and cluster analysis of Exo70 subunits in representative speciesA.代表性植物的Exo70亚基进化聚类总概图,Exo70亚基可以分为4个类群(Group)。B. 代表性植物的Exo70亚基进化和聚类详图。GroupⅡ也可称之为Exo70A类群;GroupⅢ也可称之为Exo70G类群;GroupⅣ包含其他6个Exo70亚家族。A. Phylogenetic clustering diagram of Exo70 subunit of representative plants. The Exo70 subunit can be divided into four groups. B. Detailed map of Exo70 subunit evolution and clustering of representative species. GroupⅡ is also called Exo70A group;GroupⅢ is also called Exo70G group;GroupⅣ contains six other Exo70 subfamilies.
2.5 藻类和陆生植物Exo70亚基的比较
由于Exo70亚基数量众多,选择其中具有代表性的序列来分析和比较早期陆生植物和藻类Exo70的一级结构和高级结构,以探究其在登陆中的分子演化过程。保守基序分析显示,小球藻中Exo70亚基含有7个基序,除了基序3,均存在于所有绿色植物Exo70亚基中,因此基序1、2、4、5、6、7可以看成绿色植物Exo70的基本基序(图5-A)。陆生植物GroupⅡ的Exo70亚基特征是在轮藻的基础上增加N端的基序9和C端的基序11。在GroupⅣ类群中,陆生植物的Exo70亚基比藻类的多出一段基序13(图5-A),也就是说,这2个类群在登陆过程中,均在N端增加一段保守基序,N端一般是Exo70亚基和脂质互作的部位,因此这种改变可能影响Exo70与某些脂质的互作。
通过保守基序分析比较陆生植物特有的GroupⅢ类群Exo70亚基和其他类群Exo70,发现该类群Exo70的第3个α-螺旋束上存在一段特有的基序(基序15),取代其他类群Exo70相似位置的基序3,因此基序15是GroupⅢ类群Exo70的特有基序(图5-B)。高级结构预测显示,基序3和基序15都是由2个相邻的α-螺旋组成,但是基序3形成的2个α-螺旋夹角非常小,接近于0度,而基序15形成的2个α-螺旋夹角接近于直角(图5-C),使得α-螺旋束更加松散,可能有利于其构象改变或与互作蛋白结合。

图5 代表性物种中Exo70亚基的保守基序分析以及高级结构比较Fig.5 Conserved motif analysis and spatial structures comparison of Exo70 subunits in representative speciesA.代表性Exo70亚基保守基序分析;B. 各种特异性基序的氨基酸序列;C. GroupⅢ Exo70(MpoExo70.3)亚基中基序15和其他亚基(CvaExo70)基序3的高级结构比较。方框表示陆生植物所特有的基序。A. Conserved motif analysis of representative Exo70 subunit;B. Amino acid sequences of various specific motifs;C. Comparison of the spatial structures of motif 15 in GroupⅢ Exo70(MpoExo70.3)subunit and motif 3 in other subunits(CvaExo70). The boxes represent motifs that are unique to land plants.
2.6 GroupⅢ(Exo70G亚家族)Exo70的表达和定位分析
Exo70G类群是陆生植物特有的Exo70亚基类群,暗示它们在植物适应陆地环境中发挥重要功能。为验证这个假设,首先模拟干旱或高盐的条件处理拟南芥植株,然后利用RT-qPCR方法,检测Exo70G基因(AthExo70G1和AthExo70G2)的表达。研究结果显示这2个基因的表达量在胁迫条件下与对照相比均显著上升(图6-A、B),说明Exo70G基因的表达受干旱胁迫或盐胁迫的诱导,暗示其可能在抗旱或抗盐中发挥功能。
进一步利用烟草瞬时表达研究Exo70G1的亚细胞定位发现,该亚基定位在反式高尔基体网络(trans-Golgi network,TGN)上(图6-C)。Wu等[22]研究曾发现Exo70A1定位在细胞质和细胞膜附近,Exo70B1定位在自噬体上[23],Exo70E2定位在外泌体上[24],因此Exo70G1的定位和它们相比差异显著[11]。TGN作为植物细胞内蛋白外泌、内吞和分选的中转位点,在植物响应干旱胁迫和盐胁迫过程中发挥重要作用。Exo70G1可能参与TGN物质转运过程,从而在植物抗逆过程中发挥功能。
3 讨论
3.1 exocyst复合体进化对植物登陆具有重要意义
植物从水生环境登上陆地,面临着干旱、高盐、土壤微生物胁迫、紫外线强烈照射等不利环境因素,因此,植物体在形态、生理以及生活方式发生一系列的改变来适应,例如产生维管组织输送水分和矿物质,产生根系以固定在土壤中。exocyst复合体的进化,是植物细胞囊泡运输机制进化的一个重要内容,对于植物适应陆地环境起重要作用。玉米中exocyst复合体Sec3亚基对根毛发育是必需的[25],拟南芥Exo70A亚基在维管组织形成中发挥关键作用[26],Exo70H亚基在植物抗病过程中发挥作用[27]。
植物细胞内膜系统有多个内膜区室,如高尔基体、内质网、内体等。这些区室的囊泡拴系因子(如COG、DS1等)在登陆过程中并没有像exocyst一样变得高度多样化。exocyst在植物登陆过程中高度复制和进化,其产生多样化的结构和功能的原因可能:1)exocyst最初是介导外泌囊泡拴系的拴系因子,直接参与细胞内外物质和信息交流,因此对胞外环境的改变最为敏感。2)和动物细胞以及单细胞藻类相比,陆生植物细胞是相对固定的。不同部位细胞通过不对称分裂和极性生长来形成高度特化的组织和器官,这个过程需要各种特化的囊泡外泌途径输送养分或细胞壁物质,这样才符合exocyst复合体的多样化特点。

图6 拟南芥Exo70G亚基在盐胁迫和干旱胁迫下表达分析以及亚细胞定位分析Fig.6 Expression analysis and subcellular localization analysis of Exo70G subunitin Arabidopsis thaliana under salt and drought stressA. Exo70G1基因的表达受盐胁迫和干旱胁迫的诱导;B. Exo70G2基因的表达受盐胁迫和干旱胁迫的诱导;C.Exo70G1定位在反式高尔基体网络上。Control:未处理的对照品;NaCl:100 mmol·L-1 NaCl处理;PEG6000:100 g·L-1的PEG6000处理;Man1:高尔基体标记蛋白(甘露糖苷酶);VTI12:反式高尔基网络标记蛋白。标尺为10 μm。A. Exo70G1 expression was induced by salt stress and drought stress;B. Exo70G2 gene expression was induced by salt stress and drought stress;C.Exo70G1 is located on the trans Golgi network.Control:Samples without treatment;NaCl:Samples with 10 mmol·L-1 NaCl treatment;PEG6000:Samples with 100 g·L-1 PEG6000 treatment;Man1:Golgi body marker protein(mannosidase);VTI12:trans-Golgi network marker protein. Bar=10 μm.
3.2 Exo70亚基扩张与植物适应陆地环境的关系
Exocyst复合体包含8个亚基,然而在登陆过程中,只有2个表面亚基在数量和结构上发生了显著改变,特别是Exo70亚基拷贝数大幅增加,结构和功能发生多种改变,是导致陆生植物exocyst复合体多样化的主要原因。我们推测有以下原因:1)Exo70作为表面亚基,一方面结合内部亚基,一方面结合膜的信号脂质如磷脂酰肌醇来引导拴系过程[20]。在植物细胞质膜的不同部位,或者是不同区室内膜的信号脂质成分和含量不同。通过改变Exo70结合脂质的区域(N端),可以使它结合不同部位的信号脂质,进而使exocyst复合体参与不同部位的囊泡拴系。2)植物exocyst另外一个表面亚基Exo84丧失了结合膜脂的能力,因此exocyst结合不同部位膜脂的功能全部依赖于Exo70亚基,造成Exo70亚基具有高度多样化的必要。
植物基因家族扩张的方式主要包括全基因组复制、片段复制和水平基因转移。小立碗藓中发生的全基因组复制导致其Exo70基因增加至13个[28]。另外,片段复制也是Exo70基因增加的一种原因,在接近陆生植物物种双星藻(Peniummargaritaceum)中,发现大量转座序列,其Exo70基因增加至30多个[29],当然这些基因很多可能是无效基因,从而在进化的过程中被淘汰。目前并没有发现土壤微生物Exo70基因转移到植物中的证据。因此,全基因组复制和片段复制是Exo70基因家族扩张的主要方式。
在进化过程中,复制产生的基因如果不利于植物适应环境,将很快在自然选择中被清除掉。Exo70基因家族在登陆过程中扩张为3个类群(Ⅱ、Ⅲ、Ⅳ),意味着在适应陆地环境过程中,这3个类群均发挥重要且不同于在早期藻类中的新功能。其中GroupⅡ(Exo70A)类群已经被证实在细胞分裂和维管束形成中发挥功能。而GroupⅣ包含的某些成员如Exo70H、Exo70B在抗病中发挥作用,这些都有助于植物适应陆地环境。
3.3 Exo70G亚家族形成与植物适应陆地环境的关系
Exo70G亚家族(GroupⅢ)Exo70亚基为陆生植物所特有,暗示着该亚基对于植物适应陆地生活发挥重要功能。和其他类群的Exo70亚基相比,Exo70G亚家族成员在中间的α-螺旋束区域中以基序15替换了原有的一个保守基序3,这类替换在其他Exo70亚家族中极为少见。α-螺旋束是多种拴系因子的保守互作区域,不同蛋白往往通过该区域和Exo70互作。Exo70G亚家族在该部位序列的改变是否影响其蛋白互作,还有待于进一步探讨。
本研究中,拟南芥Exo70G基因在盐胁迫和渗透压胁迫下高表达,暗示它在抵抗陆地环境胁迫中发挥功能。拟南芥Exo70G1亚基定位在TGN上,TGN是植物细胞囊泡外泌和内吞的重要中转站。在抗盐胁迫和干旱胁迫过程中,TGN参与调节Na+/K+离子转运蛋白的亚细胞定位,从而发挥重要作用[30]。我们推测Exo70G也可能在TGN上参与某些物质的运输,从而在抗盐胁迫和干旱胁迫过程中发挥作用,这可能是植物抗适应陆地干旱、高盐环境的一种进化策略。该假设还需要进一步验证。
