花状Ce-BiOBr的制备及其高效光催化降解卡马西平
2023-05-22朱婉蓉宋继梅裴泽平
朱婉蓉,宋继梅,裴泽平,杨 捷
(安徽大学 化学化工学院,安徽 合肥 230601)
药物活性化合物的广泛使用,对生态环境和人类健康构成了威胁.其中,卡马西平(carbamazepine, 简称CBZ)是一种常见的抗癫痫药物,广泛用于治疗癫痫、抑郁症、神经痛和心律失常等疾病[1].由于卡马西平的广泛使用,生活用水、地下水、土壤、城市污水甚至饮用水中都存在卡马西平,其不仅造成严重的环境污染,更对人类的健康构成威胁[2].据调查,虽然它们在环境中的浓度较低,但在某些情况下,低剂量CBZ对中枢神经系统和消化系统仍然有很强的毒性作用[3].因此,迫切需要一种环保、高效的方法来降解这种有机污染物.
光催化作为一种高级氧化工艺,它主要通过活性氧降解多种有机和无机污染物,是一种有效的废水处理方法[4].近年来,BiOBr半导体因其特殊的层状结构、优异的化学稳定性得到越来越多的关注,然而,由于太阳能利用率低、光生电子和空穴的快速重组等固有缺陷,BiOBr的应用受到了一定的限制[5].因此,人们通常采用异质结的构建、贵金属沉积、晶格缺陷、形貌的调控以及离子掺杂等手段来改善其光催化性能[6].其中,离子掺杂可以减小能带能量,改善光吸收,促进界面电荷转移,产生更多的活性物种.特别是稀土元素的原子最外层只有2个电子,在与其他元素化合时失去最外层电子,留下4f亚层电子,与过渡金属元素不同(未填满电子处于d层),未填充满的4f轨道可以接收和传递光生电子,从而促进光生载流子的有效分离,并使其迁移到表面参与反应[7-8].而Ce掺杂更是引起了许多研究者的兴趣,被认为是一种很有前景的方法.主要有以下两种原因:(1)由于Ce3+(0.102 nm)和Bi3+(0.103 nm)的半径大小相近,Ce3+可以很容易地引入Bi基半导体的晶体结构中[9]; (2)在氧化还原条件下,Ce3+/Ce4+氧化还原反应促进了电子空穴的分离[10].例如,Hu等[11]采用水热法成功合成了Ce-BiOBr纳米板,发现Ce3+的成功掺入,使其光催化降解罗丹明B的效率有所提高,仅在40 min降解率可达到99.22%,通过电化学阻抗等测试手段发现,Ce-BiOBr光催化剂的电子空穴分离率有很大的提高.Surisa等[12]通过酒石酸辅助沉淀法合成了不同Ce掺杂量的氧化锌纳米粒子,结果发现,在掺杂Ce元素之后,ZnO粒子尺寸变小,电子空穴得到极大的分离,在60 min内能降解95.2%的亚甲基蓝,复合物光催化活性明显提高.Huang等[13]通过水热反应成功获得了Ce,F共掺杂的Bi2WO6催化剂,在Ce和F的协同作用以及Ce3+/Ce4+的氧化还原电对作用下,光诱导载流子高效分离与迁移,实现罗丹明B(RhB)的高效降解.由此可见,稀土金属Ce的掺杂是一种改善光催化活性的有效方法.
笔者通过溶剂热法合成了一系列Ce-BiOBr光催化剂,通过加入不同比例的Ce(Ⅲ),用不同体积比的乙二醇与水作为溶剂来探究Ce-BiOBr的光催化降解卡马西平的性能.同时研究了共存无机阴阳离子对光催化降解卡马西平的影响.根据紫外可见吸收光谱、光电化学性能测试结果,提出Ce-BiOBr在可见光下光催化降解污染物可能的反应机制.
1 实验部分
1.1 催化剂的制备
(1) 不同比例铈掺杂BiOBr催化剂的制备
称取2 mmol Bi(NO3)3·5H2O加入50 mL去离子水中,超声溶解,磁力搅拌10 min后加入不同质量的Ce(NO3)3·6H2O, 搅拌1 h,随后加入2 mmol NaBr,磁力搅拌1 h后,得到乳白色溶液.将上述溶液转移至反应釜中,180 ℃反应24 h.最后有大量白色沉淀生成,冷却,离心分离出产物,用蒸馏水和无水乙醇分别洗涤3次,最后,将所得产物放入真空干燥箱60 ℃干燥12 h,得到不同Ce 掺杂摩尔比的BiOBr催化剂,分别记为2.5%Ce-BiOBr, 5%Ce-BiOBr, 7.5%Ce-BiOBr, 10%Ce-BiOBr.按照同样的方法,在不加入Ce(NO3)3·6H2O的条件下,合成纯BiOBr.
(2) 不同比例的乙二醇与水作溶剂的Ce-BiOBr催化剂的制备
向不同体积比的乙二醇与水混合溶液(V总=50 mL)中加入2 mmol Bi(NO3)3·5H2O, 超声溶解,磁力搅拌10 min后加入0.1 mmol Ce(NO3)3·6H2O,搅拌1 h,再加入2 mmol NaBr,磁力搅拌1 h后将溶液转移至反应釜中,180 ℃反应24 h.冷却,离心,洗涤,干燥.最终得到体积比分别为V(EG)∶V(H2O)= 8,4,2,1,0.5,0.25,0.125的5%Ce-BiOBr,分别记为8EG-5%Ce-BiOBr, 4EG-5%Ce-BiOBr, 2EG-5%Ce-BiOBr, 1EG-5%BiOBr, 0.5EG-5%Ce-BiOBr, 0.25EG-5%Ce-BiOBr, 0.125EG-5%Ce-BiOBr.
1.2 催化剂的表征
采用X-射线粉末衍射仪(XRD)对样品的晶体结构和物相进行分析,测试条件为:Cu-Kα射线(λ=1.540 nm), 管电压为40.0 kV, 管电流为100 mA, 测试范围2θ=10°~80°.利用VGESCA210光电子能谱对样品的元素、价态进行X射线光电子能谱(XPS)分析.用扫描电镜(SEM S-4800)来观察催化剂的形貌和尺寸.用傅里叶变换红外光谱仪(FT-IR, Nicolet 380)测定化学键的振动类型,测试范围为4 000~400 cm-1.使用N2吸附/解吸等温线的比表面积分析仪(ASAP2460)即BET法来测定各样品的比表面积.样品的可见光吸收范围与强度通过紫外-可见漫反射光谱(DRS, Shimadzu UV2600)测试,测试波长范围为200~1 200 nm.电化学阻抗是利用标准三电极体系在RST5000F电化学工作站上进行测试,测量条件:300 W氙灯光源,电解液为0.5 mol·L-1Na2SO4溶液.
1.3 光催化降解实验
利用光催化降解卡马西平来评价各催化剂的光催化活性.称取50 mg样品,分散于50 mL的模拟污染物溶液(10 mg·L-1)中,在黑暗条件下搅拌30 min,达到吸附-解吸平衡.再用装有滤波片(λ>400 nm)的300 W氙灯照射悬浮液,每隔相同时间取样,离心取上清液,并用紫外可见分光光度计测定吸光度A.根据不同时间测定的溶液吸光度来计算降解率D
D(%)=[(c0-ct)/c0×100],
(1)
其中:c0和ct分别是CBZ在初始及时间为t时的浓度.根据Langmuir-Hinshelwood动力学模型对降解速率拟合
ln(c0/ct)=kt(k:一级速率常数).
(2)
2 结果与讨论
2.1 催化剂的结构分析
通常利用X射线衍射(XRD)来测试所制备样品的物相及结构,图1给出了5%Ce-BiOBr 样品的XRD衍射花样,其衍射峰的位置与BiOBr标准卡片(PDF#09-0393) 相一致.没有其他杂质峰的出现,这可能是由于Ce3+取代了BiOBr中的Bi3+, 也进一步说明Ce元素的掺杂并没有影响BiOBr的晶体结构[14].
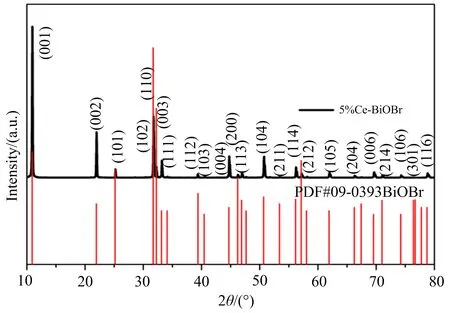
图1 5%Ce-BiOBr样品的XRD衍射花样
证明样品中Ce元素的存在,使用X射线光电子能谱(XPS)对5%Ce-BiOBr样品进行了表征,结果如图2所示.

图2 5%Ce-BiOBr的XPS谱图(a)以及Bi4f (b), Br3d (c), Ce3d(d)的XPS高分辨图谱
由图2(a)可知,催化剂中含有Bi,Br,O,C和Ce元素.图2(b)为Bi4f的XPS高分辨图,结合能位于159.1,164.4 eV处,分别对应于Bi4f7/2和Bi4f5/2,说明Bi元素是以Bi3+形式存在[15].与此同时,如图2(c)所示,结合能分别位于68.1,69.3 eV时,归属于Br3d5/2和Br3d3/2,证明了Br元素是以Br-的形式存在[16].对Ce元素进行分峰拟合,发现在870 ~ 920 eV之间有多个峰 (图2(d)), 在884.1,900.3 eV处的衍射峰归属于Ce3+;此外,在887.3,906.2 eV处的峰属于Ce4+[17].结果表明:Ce元素成功掺杂进入BiOBr中,且Ce-BiOBr纳米片中的Ce元素是以Ce3+和Ce4+的价态共存.
BiOBr和5%Ce-BiOBr在4 000~ 400 cm-1范围内的FT-IR谱图如图3所示.

图3 BiOBr和5%Ce-BiOBr 的FT-IR谱图
图3中催化剂在3 640 ~2 670 cm-1的特征峰分别属于水中O—H键的伸缩振动[18],而在1 720~1 305 cm-1的特征峰可能来源于大气中吸附的CO2[18].在509 cm-1处较强的振动峰主要归因于Bi—O键的伸缩振动[19].
2.2 催化剂的形貌表征
通过扫描电镜SEM来观察催化剂的形貌结构,结果如图4(a)~(b)所示,BiOBr是由尺寸大小为1~2 μm左右的片状结构所组成,微米片的大小不太规整,但是在掺杂了5%Ce元素之后发现BiOBr片尺寸略微变小,大小均匀(图4(c)~(d)).

图4 BiOBr((a)~(b))和5%Ce-BiOBr((c)~(d))的SEM照片
为了进一步观察使用不同比例的乙二醇与水作为溶剂时BiOBr的形貌结构,对其进行了扫描电镜测试,结果如图5所示.

图5 V(EG)∶V(H2O)=0.25((a)~(b)), 0.5((c)~(d)), 1((e)~(f)), 2((g)~(h))的5%Ce-BiOBr的SEM照片
如图5(a)~(b)所示,当用体积比为0.25的EG与H2O作为溶剂时,0.25EG-5%Ce-BiOBr仍然是片状结构.但观察发现,在加入乙二醇作为溶剂后,0.25EG-5%Ce-BiOBr片状明显变大,厚度变薄.当乙二醇的含量越来越高,EG与H2O体积比为0.5 的5%Ce-BiOBr片变得更薄,大小均匀,并且趋向于自行组合形成类似花状的微米片团簇(图5(c)~(d));当乙二醇进一步增多,EG与H2O体积比为1时,BiOBr微米片的形貌、大小和0.5EG-5%Ce-BiOBr较为相似(图5(e)~(f));而乙二醇与水体积比为2时, 催化剂的尺寸明显变小,厚度增加,形貌均匀(图5(g)~(h)).
综上,观察发现乙二醇与水作为溶剂时,能明显改变催化剂的形貌.当加入少量乙二醇时,因为乙二醇的2个羟基作为双齿配体,Bi3+与 EG配位形成螯合物[20](式(5)),此时水溶液中同时存在BiO+和Bi[EG]n3+,Bi[EG]n3+对BiOBr生长具有配位效应,影响BiOBr的生长,使得BiOBr片变大变薄.而乙二醇进一步变多时(EG与H2O体积比为0.5),Bi[EG]n3+形成的螯合物越来越多,另外水和乙二醇中都含有大量的含氧基团,使得这些基团很容易相互作用形成氢键,而氢键的饱和性与方向性使得微米片易形成类似花状的团簇[21].当EG与H2O体积比为1时,氢键的饱和性和有限的Bi[EG]n3+螯合物使得BiOBr的形貌和EG与H2O体积比为0.5时较为相似.当乙二醇含量过多(EG与H2O体积比为2),使得溶液的黏度增大,阻碍离子迁移,从而阻碍了BiOBr的空间结构生长,使得BiOBr变小变厚,变得更加均匀[22].
整个过程涉及如下化学反应
Bi3++H2O→BiO++2H+,
(3)
BiO++Br-→BiOBr ,
(4)
Bi3++nEG→Bi[EG]n3+,
(5)
Bi[EG]n3++H2O→BiO[EG]n++ 2H+,
(6)
BiO[EG]n++Br-→BiOBr+nEG.
(7)
2.3 探究Ce的最佳掺杂比例、乙二醇与水最佳比例
为了探究不同比例的Ce(Ⅲ)和用乙二醇作为溶剂时,BiOBr的光催化性能如何,笔者做了光催化降解罗丹明B(RhB)的实验,结果如图6所示.

时间负值表示黑暗下搅拌吸附-解析过程.图6 不同比例Ce-BiOBr对罗丹明B的光催化降解曲线(a);不同比例乙二醇和水作为溶剂时5%Ce-BiOBr对罗丹明B的光催化降解曲线(b)
由图6(a)可知,在BiOBr中掺杂Ce(Ⅲ)后,样品的光催化活性均有所改善,尤其是5%Ce-BiOBr光催化降解RhB的效果最好,降解率在12 min能达到96%,而BiOBr,2.5%Ce-BiOBr,7.5%Ce-BiOBr,10%Ce-BiOBr在12 min的降解率分别为83%,89%,94%,93%.此外,当使用乙二醇和水不同比例作为溶剂时(图6 (b)),加入乙二醇作为溶剂时,光催化活性明显改善,当乙二醇与水体积比为0.5时,光催化效果最好,6 min内可降解94%的RhB.由此可见,稀土金属离子Ce3+的掺杂、乙二醇作为溶剂对BiOBr的光催化性能都有了很大的改善,且掺杂5%的Ce和用乙二醇与水体积比为0.5作为溶剂时,催化剂的光催化活性最高.
2.4 光催化降解卡马西平
卡马西平(C15H12N2O)是一种由3个六元环、羰基、氨基官能团所构成的有机物,结构较为稳定,很难将其降解成无毒无害的小分子.如Anucha等[23]通过溶胶-凝胶法合成的TiO2与水热共沉淀法合成的CuWO4进行复合,制备的光催化剂需2 h实现100%卡马西平的降解,可见卡马西平是一种较难降解的药物.为了探究Ce-BiOBr催化剂是否对难降解药物(如卡马西平、四环素、左氧氟沙星等)也有良好的光催化活性,笔者使用难降解的卡马西平(CBZ)为模拟污染物进行光催化降解实验,以此来评估Ce-BiOBr的光催化活性.实验结果如图7所示.

时间负值表示黑暗下搅拌吸附-解析过程.图7 光催化降解CBZ的速率曲线(a);对应的一级动力学曲线(b)
如图7(a)所示,在光照70 min后,乙二醇与水的体积比为0,8,4,2,1,0.5,0.25,0.125的 5%Ce-BiOBr的光催化降解率分别为72%,73%,82.3%,83%,89%,98%,82.5%,82%.其中,当乙二醇与水的体积比为0.5时,Ce-BiOBr的光催化活性最强.为了解光催化剂降解CBZ的反应动力学,应用Langmuir-Hinshelwood动力学进行拟合,结果如图7(b)所示,光催化降解卡马西平的反应遵循一级动力学规律.其中0.5EG-5%Ce-BiOBr光催化降解CBZ的速率常数最大,k=0.039 min-1.综上表明,0.5EG-5%Ce-BiOBr是一种高效的光催化剂.
2.5 溶液中无机离子的影响
众所周知,工业污水排放径流中经常会存在一些无机离子,可能会对光催化降解过程产生一定的影响[24].因此笔者采用浓度均为10 mg·L-1的 NaCl, KCl, CaCl2, MgCl2, Na2CO3, NaNO3, Na2SO4等,研究常见的无机阳离子Na+,K+,Ca2+,Mg2+以及无机阴离子Cl-,CO32-,NO3-,SO42-对0.5EG-5%Ce-BiOBr光催化降解CBZ的影响,结果如图8所示.
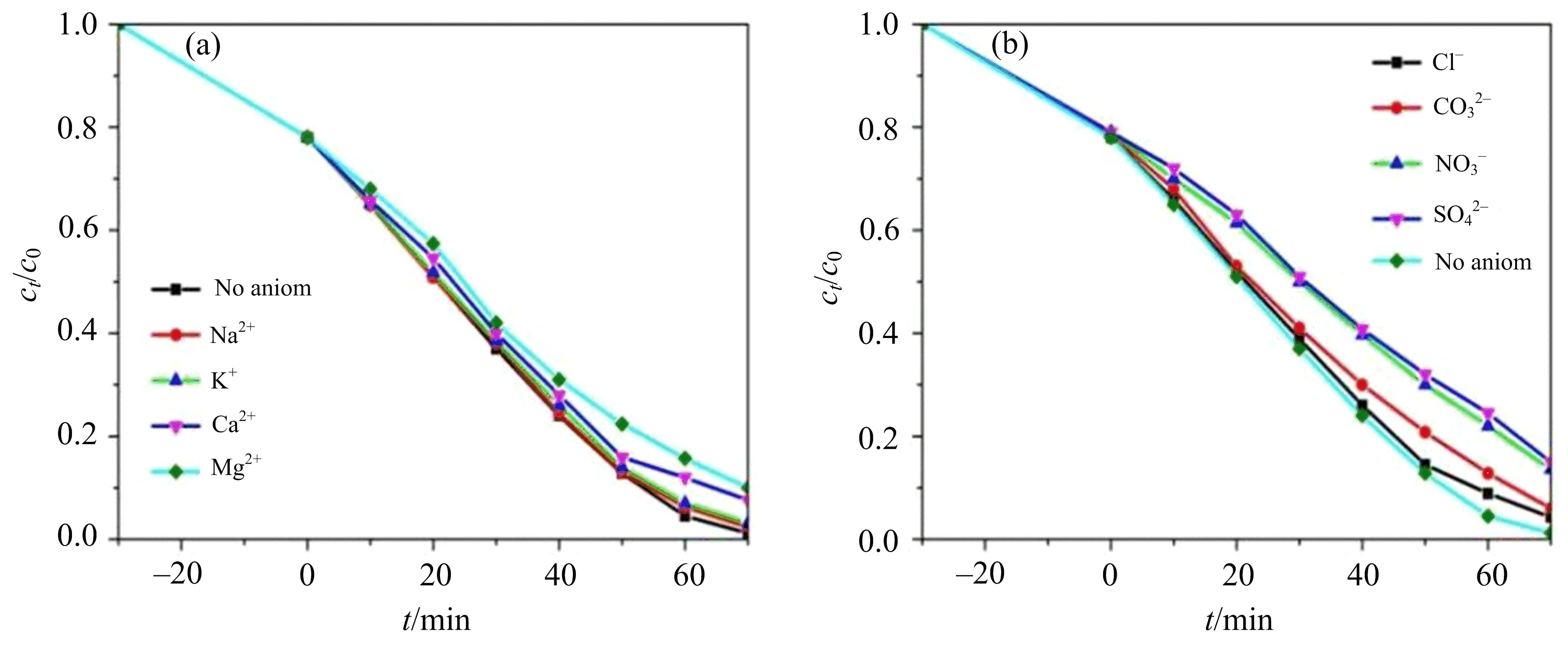
(a)无机阳离子;(b)无机阴离子;时间负值表示黑暗下搅拌吸附-解析过程.图8 无机离子对0.5EG-5%Ce-BiOBr光催化降解CBZ的影响
从图 8(a)的结果发现,Na+和K+的存在对光催化降解卡马西平无明显影响,而Ca2+和Mg2+的加入使0.5EG-5%Ce-BiOBr对卡马西平的降解率从98%降低到 92%和89%,说明Ca2+和Mg2+对卡马西平的降解有一定的抑制作用,这可能是由于Ca2+和Mg2+具有更高的电荷,更容易吸附在催化剂的表面,从而与污染物竞争活性位点,降低降解率[25].
由图8(b)可发现,在加入10 mg·L-1Cl-,CO32-,NO3-以及SO42-后,降解率分别降到94%,92%,88%和86%,这些阴离子对光催化降解卡马西平均有一定的抑制作用,其中SO42-的抑制作用最明显.可能是因为Cl-,CO32-,NO3-和SO42-均是自由基淬灭剂[26-27],使得溶液中的活性物种数目减少,从而降解率降低.SO42-的抑制作用最明显的原因可能是一方面SO42-是较强的自由基猝灭剂;另一方面,SO42-具有更大的分子尺寸,从而导致空间位阻较大,阻碍了污染物在催化剂表面的吸附[28].
另外,有报道称,NO3-对光催化降解效率的抑制过程可能是因为NO3-与价带的空穴以及·OH反应[29],如式(8)~(9),导致NO3-消耗部分的h+和·OH 活性物种,活性物种数目减少,光催化降解卡马西平的效率降低.
NO3-+hVB+→·NO3,
(8)
NO3-+ ·OH→·NO3+OH-.
(9)
2.6 Ce-BiOBr光催化降解卡马西平的机制探讨
为了进一步研究Ce-BiOBr催化剂光催化性能得到很大提升的原因,采用紫外可见漫反射测试,结果如图9所示.
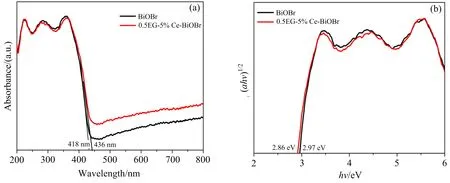
图9 纯BiOBr和0.5EG-5%Ce-BiOBr的紫外可见漫反射光谱图(a)和光学带隙转换图(b)
由图9(a)可以看出,制备的光催化剂在可见光下均有吸收.相比之下,5%Ce-BiOBr催化剂吸光能力没有明显的提高.采用经典的Tauc方法,根据给定的方程估计样品的能带隙
(αhv)0.5=A(hv-Eg),
(10)
其中:α,h,v,A,Eg分别为吸收系数、普朗克常数、光频率、常数、催化剂带隙.计算出BiOBr和5%Ce-BiOBr对应的带隙(Eg)分别为2.97 eV和2.86 eV,Ce元素的掺杂使得BiOBr的带隙略有减小.
光生电子-空穴对的分离率也是影响光催化活性的关键因素.在可见光照射下,电子与空穴分离效率越高,载流子转移速度越快,对催化剂的光催化活性越有利[30].电化学阻抗谱是一种研究表面电荷转移的有效方法.图10是样品的电化学阻抗谱图.

图10 BiOBr和0.5EG-5%Ce-BiOBr的电化学阻抗谱图
通常,电化学阻抗谱图中圆弧半径越小,说明电极表面电荷转移时电阻越小,光生载流子分离效率越高[31].从实验结果可知(图10),0.5EG-5%Ce-BiOBr的圆弧半径更小,说明具有较高的电子-空穴分离率及较快的载流子转移速度,这也是Ce-BiOBr光催化活性更好的原因之一.
众所周知,催化剂的比表面积越大,越有利于污染物的吸附,从而更有利于催化剂光催化降解污染物[32].因此,利用N2吸附-脱附等温曲线对催化剂的比表面积进行测试,结果如图11所示.

图11 BiOBr,5%Ce-BiOBr和0.5EG-5%Ce-BiOBr 的N2吸收-脱附等温曲线
图11所示,BiOBr, 5%Ce-BiOBr和0.5EG-5%Ce-BiOBr的等温线均为H3滞回,IV型,表明催化剂中均存在介孔结构,比表面积分别为3.64,13.47,23.81 m2· g-1.由此可见,催化剂具有最大的比表面积,光催化降解污染物效率也最高.
要想探讨催化的光催化作用机制,还需要了解催化剂的导带(CB)和价带(VB)电位.催化剂的价带位置可由X射线光电子能谱测定,结果如图12所示.
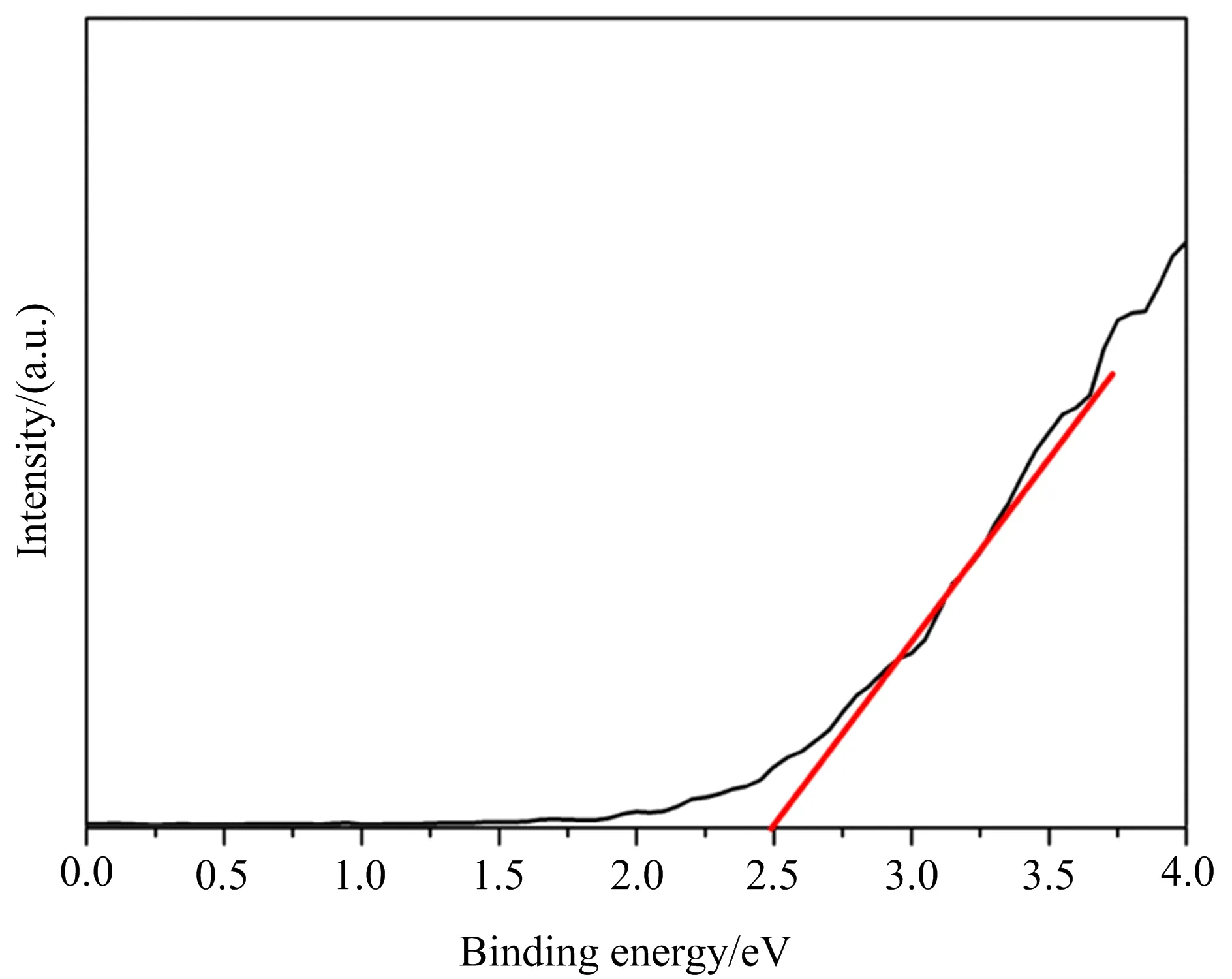
图12 0.5EG-5%Ce-BiOBr的XPS价带(VB)谱图
由图12可知,0.5EG-5%Ce-BiOBr的价带最大值为2.5 eV.根据经验公式:EVB=ECB+Eg可知,ECB=-0.36 eV.
为了深入研究0.5EG-5%Ce-BiOBr光催化剂光催化降解卡马西平的过程中哪种活性物种起主要作用,笔者在光催化降解过程中加入活性物种捕获剂,分别用对苯醌(BQ)、异丙醇(IPA)、乙二胺四乙酸(EDTA)对·O2-,·OH和h+进行捕获,结果如图13所示.

时间负值表示黑暗下搅拌吸附-解析过程.图13 在不同捕获剂存在的条件下0.5EG-5%Ce-BiOBr光催化剂对卡马西平的降解
图13显示,在溶液中加入BQ和IPA之后,0.5EG-5%Ce-BiOBr对卡马西平的降解率从98%降低到76.3%和77.2%,明显抑制了催化剂的光催化活性;在加入EDTA之后,光催化降解CBZ的效率降低到87.3%,光催化效果同样有所抑制.由此可知,在0.5EG-5%Ce-BiOBr作为催化剂降解CBZ的过程中,超氧自由基(·O2-)、羟基自由基(·OH)和空穴(h+)是主要的活性物种.有文献报道称,超氧自由基是降解卡马西平速率更快、更重要的活性物种[33],因此加入BQ之后光催化降解抑制作用最强.
在此基础上,笔者提出了0.5EG-5%Ce-BiOBr催化剂光催化降解卡马西平可能的光催化机制如图14所示.

图14 0.5EG-5%Ce-BiOBr光催化降解CBZ可能的机制示意图
如图14所示,0.5EG-5%Ce-BiOBr对卡马西平可能的光催化机制如下:在可见光照射下,BiOBr中的电子被激发到导带上,留下价带上的空穴,产生大量的电子-空穴对.由于BiOBr导带电势(-0.36 eV)比O2/·O2-(-0.33 eV)[33]更负,因此,BiOBr导带上的电子可以将O2转化为超氧自由基.而导带还原能力较强的电子也可以直接将Ce4+还原为Ce3+,价带氧化能力较强的空穴可再次将Ce3+氧化成Ce4+,构成这样的Ce4+/Ce3+氧化还原循环,从而促进了电子-空穴对的有效分离[9,33].此外BiOBr价带上的空穴可将溶液中的H2O分子氧化成羟基自由基(·OH),从而降解污染物.当然,空穴也可以直接氧化卡马西平,将其转化为CO2和H2O.基于以上分析,可能的化学反应式如(1)~(5)
BiOBr+hv→BiOBr (e-+h+),
(1)
O2+e-(BiOBr)→·O2-,
(2)
Ce4++e-(BiOBr)→Ce3+,
(3)
Ce3++h+(BiOBr)→Ce4+,
(4)
H2O+h+(BiOBr)→·OH.
(5)
综上,Ce-BiOBr催化剂的光催化性能如此优异的主要原因是:(1)在掺杂稀土金属Ce之后,Ce3+/Ce4+的氧化还原电位极大地促进了光生载流子的分离效率;(2)用乙二醇做溶剂之后,使得催化剂的比表面积明显增大,从而活性位点增多,更有利于污染物的吸附.
2.7 催化剂循环稳定性实验
为了评估催化剂的实际应用前景,对光催化剂进行循环稳定性以及光催化剂在降解前和降解后的XRD测试,结果如图15所示.

图15 0.5EG-5%Ce-BiOBr光催化降解CBZ的循环实验结果(a)和5次循环前后催化剂的XRD图谱(b)
图15(a)显示,经过5次循环之后,催化剂的催化效率从98%降到91.6%,仍然具有良好的循环稳定性.除此之外,图15(b)显示,5次循环使用之后,催化剂的XRD衍射峰位置未发生明显变化,说明0.5EG-5%Ce-BiOBr的稳定性良好.
3 结束语
笔者成功合成了掺杂不同比例Ce的Ce-BiOBr光催化剂,探究了混合溶剂乙二醇和水对光催化剂的形貌影响.发现,0.5EG-5%Ce-BiOBr光催化剂的活性最强,70 min内降解98%的卡马西平.其原因可能主要是稀土金属Ce的掺杂极大地改进了光生电子空穴的分离;加入乙二醇时,复合物的形貌发生了变化,比表面积也明显增大,有更多的活性位点.因此,稀土金属Ce的掺杂以及乙二醇作溶剂制备的Ce-BiOBr光催化剂有着良好的应用前景.
* * * * * *
致谢:感谢安徽省无机/有机杂化功能材料化学重点实验室的资助.同时,感谢孙松老师的指导与帮助.
