烟叶中曲霉菌含量的荧光定量PCR检测方法的建立及应用
2023-05-22潘晓薇欧阳璐斯
潘晓薇,王 予,欧阳璐斯,陶 红,周 瑢,彭 琛
(广东中烟工业有限责任公司 技术中心,广东 广州 510385)
烟草是以收获叶片为主的重要经济作物,烟叶在储存期经过自然醇化或人工发酵,可以提高烟叶燃吸品质和可用性[1].烟叶自然醇化的贮藏周期长,由于烟叶吸湿性强[2],而烟叶中又含有微生物生长所需要的各种营养物质[3],因此一旦条件适宜[4],烟叶在贮藏过程中极易滋生各种微生物而发生霉变.随着霉菌的滋生,烟叶正常的组织结构被破坏,外观色泽发暗,原有的香气消失,散发出难闻的酸臭气味,刺激性增大,吃味苦涩,烟丝原有的韧性和弹性消失[5].此外,因生霉而产生的气味会遗留在烟包内,使未霉的烟叶也产生霉味[6],严重影响整批烟叶的质量.有些种类的霉菌甚至会在代谢过程中产生致癌物质,如黄曲霉毒素[7],影响吸烟者的健康.因此,积极做好贮藏烟叶的霉变防治工作,为卷烟产品提供优质原料就显得十分必要[8].而建立快速的微生物污染检测方法是做好霉变防治工作的关键.
目前国内外检测霉菌的方法很多,例如传统培养鉴定法、代谢产物检测法、鉴定用培养基法、免疫测定法及分子生物学方法等[9-12].而在烟草行业中,最常见的检测烟叶霉变的方法是通过感官检验烟叶是否霉变,如眼看、手捏、鼻闻等[13],这就需要检验人员具有非常丰富的经验.也可以通过传统的培养鉴定法检测菌落密度来进行判定[14],如烟叶中霉菌数量处于2.5×103~3.0×103CFU·g-1,则认为其已经发生霉变[15].由于传统培养鉴定法操作烦琐,耗时长,近年来逐步被麦角甾醇测定法取代[16],麦角甾醇测定法更为快速、客观,但是由于其灵敏度有限,往往只能用于霉变已经发生后的判定而无法实现预警.荧光定量PCR检测方法与目前常用方法相比,具有更准确、灵敏度更高等优点,因此具有更加广泛的应用前景[17].
研究发现,霉变烟叶中含有的微生物包括:曲霉属(Aspergillus)、青霉属(Penicillium)、根霉属(Rhizopus)、木霉属(Trichoderma)、毛霉属(Mucor)、腐霉属(Pythium)、芽孢杆菌属(Bucillus)、葡萄状穗霉属(Stachybotrys)、轮枝孢霉属(Verticillium)、酵母菌属(Lactobacillus)等[18],但其发育繁殖的最适温度各不相同,在某种生长环境下往往以其中一种为主[19].其中,曲霉菌在霉变烟叶分离出的微生物中含量最高,分布最广[20],且其中的部分种类可以产生危害人体健康的毒素.在高温高湿的环境中,曲霉菌更是绝对的优势菌群,对曲霉菌的有效监控就变得更有意义.因此,笔者选择曲霉菌(Aspergillus)为研究对象,利用荧光定量PCR(fluorescence quantitative PCR,简称qPCR)技术建立一种快速、准确、灵敏度高的烟叶霉变检测方法并利用该方法对仓储烟叶中的曲霉菌含量变化情况进行分析.
1 材料与方法
1.1 材料和试剂
1.1.1 材 料
实验用真菌标准株:烟曲霉Aspergillusfumigatus(CICC40537)、黑曲霉Aspergillusniger(CICC2039)、米曲霉Aspergillusoryzae(CICC2002)购买于中国工业微生物菌种保藏管理中心(CICC).
1.1.2 试 剂
察氏培养基购自广东环凯微生物科技有限公司;Taq酶、PMD18-T载体、质粒纯化试剂盒及DNA marker均购自宝日医生物技术(北京)有限公司;荧光定量PCR试剂及基因组提取试剂盒购自赛默飞世尔科技(中国)有限公司;引物合成和基因测序由生工生物工程(上海)股份有限公司完成.
1.2 方 法
1.2.1 霉菌接种与培养
用一次性无菌塑料接种环分别蘸取安瓿瓶中的菌种以三点式点种于察氏平板培养基上,用封口膜封住并将培养基倒置于30 ℃霉菌培养箱中培养4~7 d.用接种环蘸取少量霉菌孢子,接种于100 mL察氏液体培养基中,30 ℃振荡培养2~3 d,用移液器吸取含有霉菌孢子的培养基于1.5 mL EP管中,加入20%甘油,-80 ℃冻存.用生理盐水冲洗培养3~4 d后的霉菌培养皿,收集孢子,制成混悬液,用于提取基因组.
1.2.2 霉菌基因组提取及ITS序列扩增
使用真菌基因组DNA提取试剂盒分别提取烟曲霉、米曲霉、黑曲霉的基因组,通过琼脂糖凝胶电泳确定提取出基因组DNA后,使用真菌ITS区通用引物ITS-1(5'-TCCGTAGGTGAACCTGCCG-3’)和ITS-4(5’-TCCTCCGCTTATTGATATGC-3’),以提取的基因组DNA为模板进行PCR扩增,反应体系为50 μL:Buffer,5 μL;dNTP,4 μL;Taq酶,0.5 μL;引物各1 μL;模板DNA,2 μL;H2O,36.5 μL.PCR程序为:94 ℃预变性3 min后进入循环,每个循环为94 ℃变性30 s、60 ℃退火30 s、72 ℃延伸30 s,共30个循环后,72 ℃延伸10 min.通过琼脂糖凝胶电泳检测扩增情况,得到的PCR产物送生工生物工程(上海)股份有限公司进行测序,通过BLAST和MEGA软件分析获得基因序列.
1.2.3 引物探针设计
找出3种曲霉菌基因序列中相对保守的部分,通过在NCBI基因库中进行BLAST分析,确定所选取的区域高度保守且属间特异,与其他细菌、真菌及烟草基因的核酸序列之间无较高同源性.利用 Primer Premier 5.0软件针对所选取的基因片段设计曲霉菌的引物及探针,其DNA序列分别为:上游引物,5’-GTC TTT GAA CGC ACA TTG CGC-3;下游引物,5’-ATA CGC TCG AGG ACC GGA C-3’;探针,5’-FAM-CCT GTC CGA GCG TCA TTG CTG CCC TCA-BHQ1-3’.
1.2.4 质粒标准品制备
将烟曲霉ITS区扩增产物经过切胶回收纯化后,与pMD18-T载体进行连接,并转化到Top10感受态细胞中,经培养后用PCR及限制性内切酶鉴定出阳性菌株,纯化质粒后送至生工生物工程(上海)股份有限公司进行测序.测序正确的质粒作为笔者研究中荧光定量PCR法的标准品.
1.2.5 荧光定量PCR方法
反应总体系为20 μL:其中Taqman Master Mix 10 μL;上下游引物及探针各0.4 μL;模板DNA 0.1 μL;ddH2O 8.7 μL.扩增程序为:50 ℃保持2 min,然后95 ℃预变性10 min后进入循环,每个循环为95 ℃变性15 s、60 ℃退火及延伸1 min,共40个循环后,60 ℃延伸1 min.在每个循环末收集荧光信号.
1.2.6 特异性实验
为了验证引物、探针的特异性,确定其与其他真菌及烟叶基因组无同源性,分别提取酵母、烟叶及米曲霉的基因组DNA作为模板进行荧光定量PCR反应,以是否出现扩增曲线来检测该方法的特异性.
1.2.7 重复性实验
重复性实验包括了批内和批间重复性实验,批内重复性实验是对同一模板、同一反应体系同时进行测定,批间重复性实验是对同一样本在反应体系相同的条件下进行连续5 d重复测定.该实验采取浓度为1.00,0.05,0.01 μg·mL-1的3 个不同浓度标准品质粒DNA稀释液进行批内和批间重复性实验,每个样本重复测定20 次,利用SPSS 19.0统计软件计算批内及批间循环阈值(cycle threshold,简称Ct)的变异系数(coefficient of variation,简称CV).CV=标准差/平均值×100%.
1.2.8 灵敏度实验
质粒DNA溶液使用蛋白核酸分析仪进行定量,取测定好浓度的标准品质粒DNA溶液,使用倍比稀释法,按照1∶5倍比稀释待测样本,以这些待测样本为模板进行荧光定量PCR分析,找出检测为阳性时的最低浓度,即为该方法的检测灵敏度.
1.2.9 标准曲线
将已知拷贝数的阳性质粒倍比稀释作为模板,进行荧光定量PCR 扩增,得到相应的扩增曲线,并计算Ct 值与阳性质粒拷贝数的线性对应关系,产生相应的标准曲线.
1.3 模拟霉变实验
将1 kg烟叶混匀后置于霉菌培养箱中,在25 ℃,80%湿度的条件下放置30 d,观察其从未霉变状态,经过临近霉变状态和霉变初期状态直至重度霉变状态的过程.整个过程中每隔24 h从中取出10~20 g烟叶,经过处理后分别用荧光定量PCR及3M测试片计数的方法对霉菌含量进行检测并对两种方法的检测情况进行比较.
2 结果与讨论
2.1 荧光定量PCR方法建立
2.1.1 荧光定量PCR方法特异性检测
特异性检测结果如图1所示.

1:米曲霉;2:酵母;3:烟草.图1 特异性检测扩增曲线
图1显示,以质粒标准品为模板进行的扩增反应检测到明显的S形曲线,而以酵母基因组和烟草基因组为模板进行的扩增反应在40个循环内均未出现S形曲线,说明未有特异性扩增.由此可见,引物探针特异性良好,与其他真菌及烟叶基因无交叉反应.
2.1.2 荧光定量PCR方法重复性检测
日内及日间重复性的结果如表1所示.

表1 以质粒为模板的重复性实验
表1显示,日内、日间重复性实验的高、中、低浓度反应均有扩增,且同一浓度的扩增曲线都基本重合,计算日内、日间重复性实验扩增曲线的Ct值变异系数,结果均小于5%(在0.09%至2.02%之间),表明该方法有较好的稳定性和重复性.
2.1.3 荧光定量PCR方法的灵敏度检测
按照1∶5的稀释倍数对定量后的质粒标准品溶液进行倍比稀释,共稀释18管(T1~T18).每管浓度如表2所示.

表2 不同稀释点模板浓度 copies·mL-1
进行荧光定量PCR反应,每个浓度做3个平行,所得结果如图2所示.

图2 不同浓度模板扩增曲线
图2显示,T16即浓度为9.42 copies·mL-1时,仍能够看到扩增曲线,因此该荧光定量PCR反应体系的检测灵敏度可达约10 copies·mL-1.
2.1.4 荧光定量PCR方法的标准曲线
以阳性质粒标准品按照倍比稀释后作为模板进行荧光定量PCR扩增,以阳性质粒的基因拷贝数为x轴,以Ct值为y轴,建立标准曲线.得到的标准曲线方程为:y=-3.727x+39.82.相关系数R2=0.999,说明标准曲线拟合程度良好.
2.2 模拟霉变实验
2.2.1 烟叶外观变化
在25 ℃,80%湿度的培养箱中放置的烟叶大约在第19天,边缘的部分烟叶开始出现肉眼可见的白色絮状物,之后开始不断增加,到第25天已经可以观察到大量的白色发霉物,有些烟叶开始逐渐显现出青灰色,打开霉菌培养箱时可以闻到一些湿腐的气味.到第30天霉变已经非常严重,整盘烟叶都覆盖有絮状白毛,有些地方已经出现绿色甚至黑褐色霉斑,已有较为明显的霉味.
2.2.2 测试片法检测霉菌含量随时间变化结果
对每天抽取的烟叶样品使用3M快速霉菌酵母测试片进行霉菌菌落数的检测,所得结果列于表3.
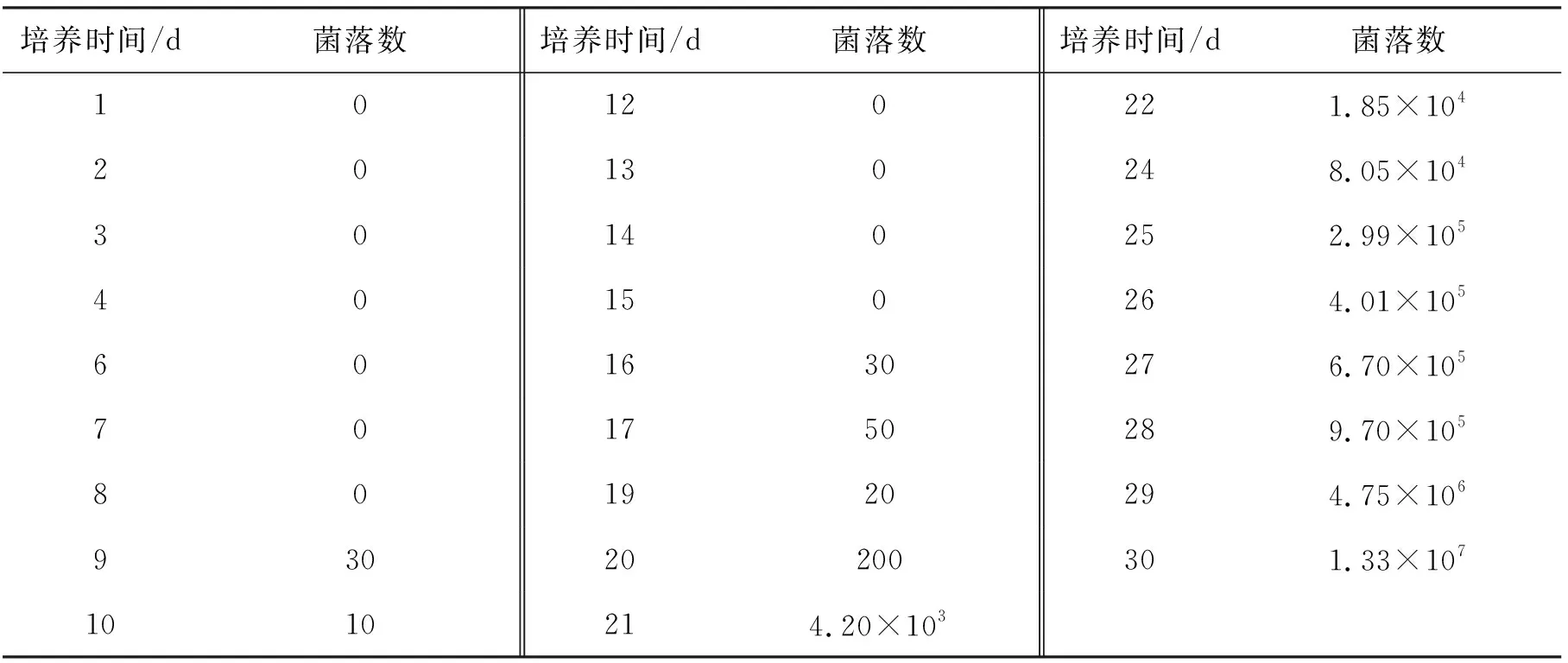
表3 3M测试片法检测霉菌含量随存放时间变化情况 CFU·g-1
杨蕾[21]的研究结果表明,霉菌数达到一定量(104CFU·g-1左右)时,会开始快速增长,并以霉菌量=104CFU·g-1为分界点,将霉菌计数<104CFU·g-1判为未霉变样品.根据表3中的检测结果,在第22天的时候烟叶中的霉菌数量超过104CFU·g-1,已经达到霉变样品,在第21天,霉菌数量在103~104CFU·g-1之间,属于临近霉变的状态,20 d之前(包括第20天)均属于未霉变状态.
2.2.3 荧光定量PCR法检测霉菌含量随时间变化结果
对每天抽取的烟叶样品使用荧光定量PCR法进行曲霉菌含量的检测,所得结果列于表4.

表4 荧光定量PCR法检测曲霉菌基因拷贝数随存放时间变化情况 copies·g-1
结合烟叶外观观察及3M测试片检测的结果,以及文献中霉变的判定标准,笔者认为,当烟叶中曲霉菌基因拷贝数达到109~1011copies·g-1之间时,烟叶处于临近霉变的状态,基因拷贝数超过1011copies·g-1,烟叶已经达到霉变状态,而基因拷贝数<109copies·g-1时则认为烟叶处于未霉变状态.
2.2.4 两种方法检测结果的比较
将3M测试片法的检测结果及荧光定量PCR法的检测结果分别作为纵坐标,方便对两种方法的检测结果进行比较.如图3所示:(a)图为整个30 d霉变过程的折线图,两种方法均呈现同样的趋势,即开始十几天时霉菌的数量维持在极低的范围无太大变化,在出现拐点之后随即进入对数生长期,对数生长期代表曲霉菌在这个时期大量增殖,从而导致霉变产生.而两种方法的检测结果的“拐点”有较为明显的差异.将第14天~第22天的数据放大得到(b)图,可以看出,3M测试片法在第20天~第21天时出现数量的增殖拐点,而荧光定量PCR法的检测结果则是在第14天~第15天时已经开始出现上升趋势,到第17天时出现明显的大幅度增加.
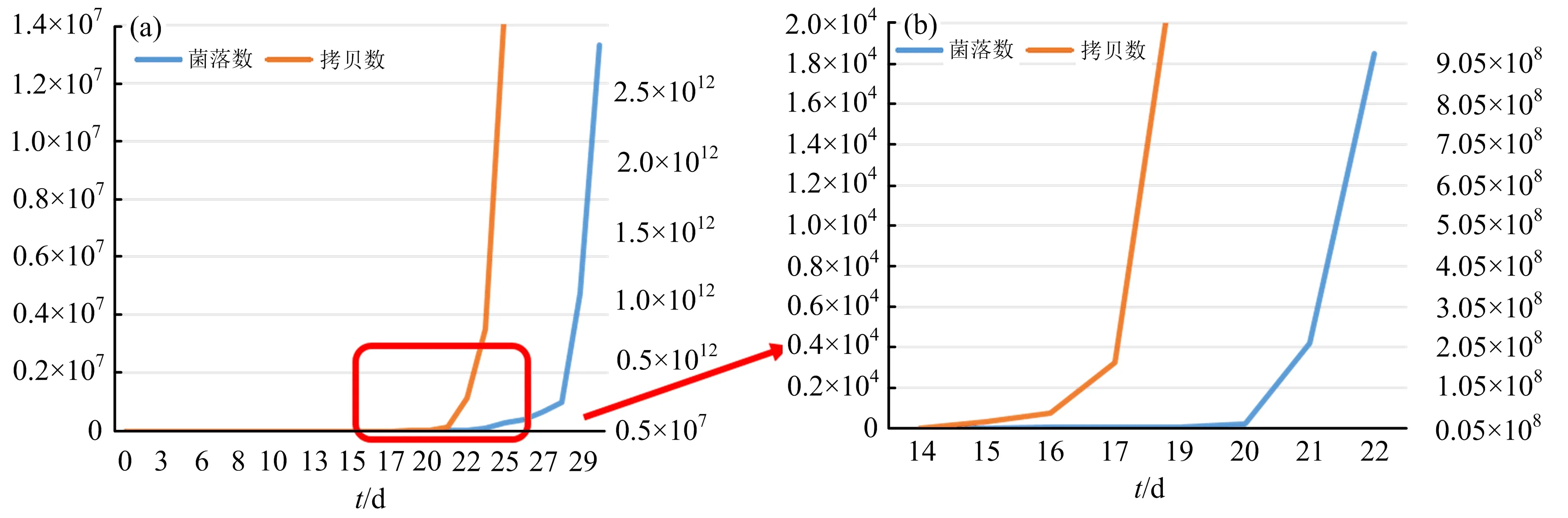
(a) 第1天~第30天;(b) 第14天~第22天.图3 以霉变天数为横坐标,分别以测试片(左侧纵坐标)及qPCR(右侧纵坐标)检测结果为纵坐标做曲线两种方法的检测结果比较
结合霉变实验过程中对烟叶外观的观察结果,第17天时尚未观察到烟叶有霉变反应,第19天时烟叶边缘已出现霉变迹象.因此,可以认为,3M测试片法可用于对烟叶霉变的判别,而qPCR法则可以更早地提示霉变的发生,这可能是由于,细胞的分裂过程是由染色体的复制开始的,因此基因拷贝数的增加优先于菌落数的增加.实验中发现,第15天~第17天时,荧光定量PCR方法已经可以检测到曲霉菌基因数进入对数生长期,呈现明显上升趋势,但是用3M测试片并未检测到霉菌数量的明显增加,从外观及气味上未出现霉变的情况,与普通烟叶无外观上的差异.由于该研究中的模拟烟叶霉变过程是在实验室条件下进行,为促进霉变的发生,采用的温度、湿度条件都是非常适宜霉菌繁殖的条件,因此大大加快了整个霉变反应的进程.而在实际仓储条件中,霉变的过程会相对缓慢,这个临界期也会相对变长,因此可以利用荧光定量PCR检测方法对烟叶的临界霉变状态进行预警,从而在霉变发生之前及时对即将产生霉变的烟叶进行处理.
3 结束语
曲霉菌荧光定量PCR检测体系的建立,一个关键点在于引物探针的特异性[5-6].笔者根据ITS区序列设计引物探针,然后在3种曲霉菌ITS1区的保守序列设计引物并与其他霉菌序列进行比对验证,确保其具有遗传保守性.通过实验证实了该荧光定量PCR检测曲霉菌的方法具有较好的特异性、灵敏度和重复性,说明该方法可以对烟叶中的曲霉菌含量进行高效灵敏的检测.通过对实验室模拟霉变的烟叶进行检测,认为当烟叶中曲霉菌基因拷贝数达到109~1011copies·g-1之间时,烟叶处于临近霉变的状态,基因拷贝数>1011copies·g-1时烟叶为霉变状态,基因拷贝数<109copies·g-1时烟叶则为未霉变状态.通过与其他测试方法的比较发现,利用荧光定量PCR检测方法可以更早地发现烟叶即将发生霉变的前兆,从而有利于提前对其进行处理.
