一株溶磷真菌的筛选及相关促生特性初探
2023-05-22刘俊清金晓雪宋科稷张建峰
刘俊清,金晓雪,宋科稷,贾 芳,张建峰
(吉林农业大学 生命科学学院,秸秆综合利用与黑土地保护教育部重点实验室,吉林 长春 130118)
磷作为一种营养元素,不仅在植物生长发育过程中发挥着重要的作用,同时还是维持植物进行新陈代谢(如细胞分裂、大分子生物合成、信号的转导率及光合作用等)必需的营养源[1].但是,因为土壤本身的化学固定效应,土壤中含有的有效无机磷浓度却极低.绝大部分有机磷农药和部分无机态磷肥都以难溶性磷酸盐的形态出现,植株根系无法充分吸收和利用,磷源匮乏成了制约农作物产量增长的主要原因之一[2-3].
为了防止农作物减产并满足不断增长的人口对食物的需求,自20世纪60年代以来,全世界广泛使用磷肥,包括磷酸一铵、磷酸二铵、过磷酸钙和不同配方的NPK(NPK指的是氮、磷、钾3种元素),以提供额外的磷[4].在农业中过度使用化学肥料会带来许多的环境问题,如对水、空气和土壤的污染;同时由于化学肥料在农作物中以残留物的形式存在,严重危害着人类的健康[5].为了作物及人类的健康,需要一种替代磷肥的有效性策略,通过环境生态方法保持土壤中磷的临界(最佳)浓度,而不是为了满足作物需求而过量使用破坏土壤和微生物群落特性的化学肥料[1].
溶磷微生物是一种有前途的生物菌剂,可替代化肥和农药,可将不溶性磷溶解成可溶形态,并减少农田磷肥的投入.解磷菌的种类繁多,与不同的土壤、不同的植物或作物根际等有关,主要有细菌、真菌和放线菌,在土壤中细菌的数量占绝大多数.溶磷微生物大量存在于土壤中,通过试验发现,施入土壤的溶磷微生物不仅能提高土壤中有效磷的含量,还可增加速效钾含量,从而改善土壤肥力,同时,还可提高土壤酶活性[6].温室和田间试验表明,溶磷菌接种促进了土壤中的植物生长,表明它们作为新型生物肥料具有提高土壤肥力的潜力.
笔者从胡枝子根际土壤中筛选出了1株高效溶磷真菌,对其菌种分类进行了鉴定,并对其溶磷特性及促生特性进行了研究,以期为生物菌剂的制备提供技术支持,为农业可持续发展提供重要的种质资源.
1 材料与方法
1.1 材 料
1.1.1 供试土壤
土壤样品主要来自吉林省伊通市胡枝子根际土壤.
1.1.2 培养基制备
1.1.2.1 溶磷培养基(NBRIP)
每升水含有:葡萄糖10 g,(NH4)SO40.5 g,MgSO4·7H2O 0.3 g,NaCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,KCl 0.3 g,Ca3(PO4)25 g,DdH2O 1 000 mL,固体培养基加入18 g琼脂粉,pH自然,115 ℃灭菌20 min[7],所用试剂均为分析纯试剂.
1.1.2.2 LB培养基
10 g胰蛋白胨,酵母提取物 5 g,NaCl 10 g,蒸馏水1 000 mL,pH 7.2~7.4,固体培养基需加入18 g琼脂粉,121 ℃灭菌20 min[8],所用试剂均为分析纯试剂.
1.1.2.3 PDA 固体培养基
土豆200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,pH自然[7],所用试剂均为分析纯试剂.
1.1.2.4 色氨酸培养基
L-色氨酸0.5 g,胰蛋白胨 10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1 000 mL,所用试剂均为分析纯试剂.
1.1.2.5 无氮培养基
葡萄糖10 g,KH2PO40.2 g,MgSO4·7H2O 0.2 g,CaSO4·2H2O 0.1 g,蒸馏水1 000 mL,所用试剂均为分析纯试剂.
1.1.3 供试磷源
磷酸钙、磷酸铝、磷酸铁,均为分析纯试剂.
1.2 溶磷菌的分离、筛选
称取10 g胡枝子根际土样加入250 mL锥形瓶并加入90 g水置于摇床震荡30 min,后静置10 min,用移液枪吸取1 mL上清至装有9 mL蒸馏水的试管中稀释至10-2,并取1 mL至新的装有9 mL蒸馏水的试管稀释至10-3,以此类推稀释至10-4,10-5,10-6,取100 μL不同浓度菌液涂布于溶磷培养基于37 ℃恒温培养箱培育5 d.
从7个不同浓度初筛培养基得到的单个菌落平板划线至NBRIP筛选培养基进行3次复筛和纯化,筛选出了3株溶磷效果较好的菌株,封存在甘油中,于-80 ℃保藏.
采用钼锑抗比色法对3株溶磷菌的溶磷量进行了测定,解磷量分别为151.21,2 003.95,178.65 mg·L-1,其中X1的解磷量最大,为2 003.95 mg·L-1,说明该菌株对 Ca3(PO4)2有很强的溶解能力,经过多次传代培养后,X1解磷效果仍保持良好,选择X1进行后续实验.
1.3 溶磷菌的鉴定
1.3.1 菌株的形态学鉴定
将筛选得到的溶磷菌接种到PDA培养基中,28 ℃培养,观察并记下菌落颜色、大小、形状、透明度等状况,从平板上挑出菌丝,采用乳酸石炭酸棉蓝染色法进行染色,显微镜观察,对菌株进行初步的形态学鉴定.
1.3.2 菌株的分子生物学鉴定
挑选生长良好、稳定性强的菌株送至吉林省库美生物科技有限公司进行菌株鉴定.将获得的DNA序列输入GenBank,用Blast程序与数据库中的序列进行比较分析,并利用MEGA5.1进行系统发育树的构建.
1.4 菌株溶磷能力的测定
1.4.1 标准曲线的绘制
分别准确吸取5 mg·L-1磷(KH2PO4)标准溶液0,2,4,6,8,10 mL于50 mL容量瓶中,同时加入与显色测定所用的样品溶液等体积的空白溶液,加入二硝基酚指示剂2~3滴,并用100 g·L-1碳酸钠溶液或50 mL·L-1硫酸溶液调节至溶液刚呈微黄色,准确加入5 mL钼锑抗显色剂,摇匀,加水定容,即得含磷(P)量分别为0.0,0.2,0.4,0.6,0.8,1.0 mg·L-1的标准溶液,摇匀,于室温15 ℃以上放置30 min,在波长700 nm处测定其吸光度,以吸光度为纵坐标,磷浓度(mg·L-1)为横坐标,绘制标准曲线[9].
将待测发酵液(离心后取上清液)适量(第1次做需摸索稀释倍数)移至50 mL容量瓶中,用水稀释至总体积约3/5处,加入二硝基酚指示剂1~2滴,并用100 g·L-1氢氧化钠溶液或50 mL·L-1硫酸溶液调节至溶液刚呈微黄色,准确加入5 mL钼锑抗显色剂,摇匀,加水定容,室温15 ℃以上放置30 min.显色的样品溶液在紫外分光光度计上,以空白培养基为参比液调节仪器零点,进行比色测定,在波长700 nm处测定其吸光度,再从标准曲线上查得相应的含磷量[10].
1.4.2 溶磷菌对不同磷源的溶磷动态分析
将保存的菌种在PDA培养基上划线培养,在培养箱中28 ℃培养72 h后用蒸馏水冲洗,制成孢子悬液(1×108CFU·mL-1),备用.
分别将50 mL NBRIP培养基倒入150 mL锥形瓶中(每个锥形瓶单独称量磷酸钙0.35 g、磷酸铝0.3 g、磷酸铁0.5 g),分别按照2%接种量接种孢子悬液,以空白不接种培养基为对照,置于摇床中培养(160 r·min-1,28 ℃),每处理3个重复.分别在培养1,2,3,5,7,9,11,13 d时测量溶磷量、pH和生物量.取4mL菌液于12 000 r·min-1离心5 min,取上清液,用钼蓝比色法测定磷含量.
1.5 溶磷菌促生特性的研究
1.5.1 溶磷菌产IAA能力的测定
将纯菌种接种于LB培养基中,在(28±2) ℃,120 r·min-1转速的恒温摇床中震荡培养至对数生长期.随后,从培养至对数生长期的菌液中取2 mL菌液离心去上清,用1 mL PBS洗涤沉淀再悬浮在磷酸盐缓冲液(PBS)中,将约1 mL菌悬液(相当于107cells·mL-1的细胞密度)加入色氨酸培养基中,在(28±2) ℃,120 r·min-1连续振荡48 h后,取2 mL细菌培养液,12 000 r·min-1离心10 min.取上清液约1 mL,加入等体积的Salkowski试剂(Salkowski试剂:内含 0.5 mol·L-1FeCl3溶液10 mL、35%高氯酸500 mL),于使用前混合摇匀,避光保存.室温黑暗静置30 min后观察,颜色变红表明IAA产生.同时在530 nm波长处用紫外分光光度计测定IAA浓度,并与IAA标准曲线进行比较,计算出IAA浓度.
1.5.2 溶磷菌产氨能力的测定
将菌液以2%接种量接种于100 mL蛋白胨水培养基中(蛋白胨10 g·L-1,氯化钠5 g·L-1,pH 7.0±0.2),重复3次实验,在28 ℃,160 r·min-1下培养,每隔2 d采集培养样品,1 000 r·min-1离心1 min.然后将上清液与纳斯勒试剂反应,用紫外分光光度计在420 nm处测量吸光值,以空白培养基作为对照.
1.5.3 溶磷菌固氮能力和纤维素酶活性的测定
将菌株接种在无氮培养基中,通过观察菌株生长的状况来判定菌株的固氮能力.将菌株接种在以ACC为唯一碳源的固体培养基平板上,对ACC脱氨酶的产生进行测定,若菌株在平板上生长则证明该菌株具有产ACC脱氨酶的能力.菌株纤维素酶活性的定性测定:将菌株接种至羧甲基纤维素钠固体培养基平板上,培养5 d后,用1 g·L-1刚果红溶液进行染色30 min,弃去染色液,倒入0.5%的NaCl溶液,进行脱色,脱色15 min后,观察透明圈;菌株纤维素酶活性的定量测定:将菌株接种至液体羧甲基纤维素钠培养基中进行发酵,在28 ℃,160 r·min-1转速的恒温摇床中震荡培养,每间隔1 d取发酵菌液,采用DNS法测定菌株纤维素酶活性.
1.6 统计分析
所有实验均进行3次重复处理,所有数据均使用SPSS 19.0版计算平均值、标准偏差,使用Origin 8.0版和Photoshop CS 8.0版处理图片.
2 结果与分析
2.1 溶磷菌筛选结果
经NBRIP筛选培养基筛选出了1株溶磷效果较好的菌株(X1),如图1(左)所示,其透明圈明显,采用钼锑抗比色法对该溶磷菌的溶磷量进行了测定,解磷量为2 003.95 mg·L-1,对 Ca3(PO4)2有很强的溶解能力;经过多次传代培养后,X1解磷效果仍保持良好,说明其对不溶性磷酸盐的分解效果比较稳定.
对菌株X1的溶磷能力进行了初步测定,将菌株X1接种至NBRIP固体培养基上,经培养7 d后,如图1(右)所示,具有较明显的透明圈,其D/d比值为1.08,说明菌株的溶磷能力大小并不是与其溶磷指数呈正比相关.

左图:初筛培养基平板,箭头示透明圈;右图:筛选的菌株接种到NBRIP培养基平板,箭头示透明圈.图1 溶磷菌菌株X1的筛选
2.2 溶磷菌鉴定结果
菌株X1在PDA固体培养基上,菌株生长迅速,菌落干燥,不透明,气生菌丝呈絮状,产孢面呈暗绿色,背面为淡黄色,如图2(左)所示.从左图的平板上挑出菌落置于载玻片上在显微镜下观察,根据显微镜镜检图(图2(右))可以看出,菌丝和孢子呈扫帚状,与青霉菌形态相似.

左图:PDA平板菌落形态;右图:显微镜下菌丝孢子形态(×1 000).图2 溶磷菌菌株X1的形态特征
利用引物(TCCTCCGCTTATTGATATGC)扩增菌株X1 18S rDNA,得到334 bp的目的DNA序列TCATATGCTTGTCTCAAAGATTAAGCCATGCATGTCTAAGTATAAGCACTTTATACTGTGAAACTGCGAATGGCTCATTAAATCAGTTATCGTTTATTTGATAGTACCTTACTACATGGATACCTGTGGTAATTCTAGAGCTAATACATGCTAAAAACCCCGACTTCAGGAAGGGGTGTATTTATTAGATAAAAAACCAACGCCCTTCGGGGCTCCTTGGTGAATCATAATAACTTAACGAATCGCATGGCCTTGCGCCGGCGATGGTTCATTCAAATTTCTGCCCTATCAACTTTCGATGGTAGGATAGTGGCCTACCATGGTGGCAACGGGT,对DNA序列进行测序.利用Blast软件与MEGA中的相似序列进行同源性比较,结果显示(图3),菌株X1与斜卧青霉的同源性达97%,因此将其鉴定为斜卧青霉菌属(Penicilliumdecumbens).(上述工作委托吉林省库美生物技术有限公司完成)
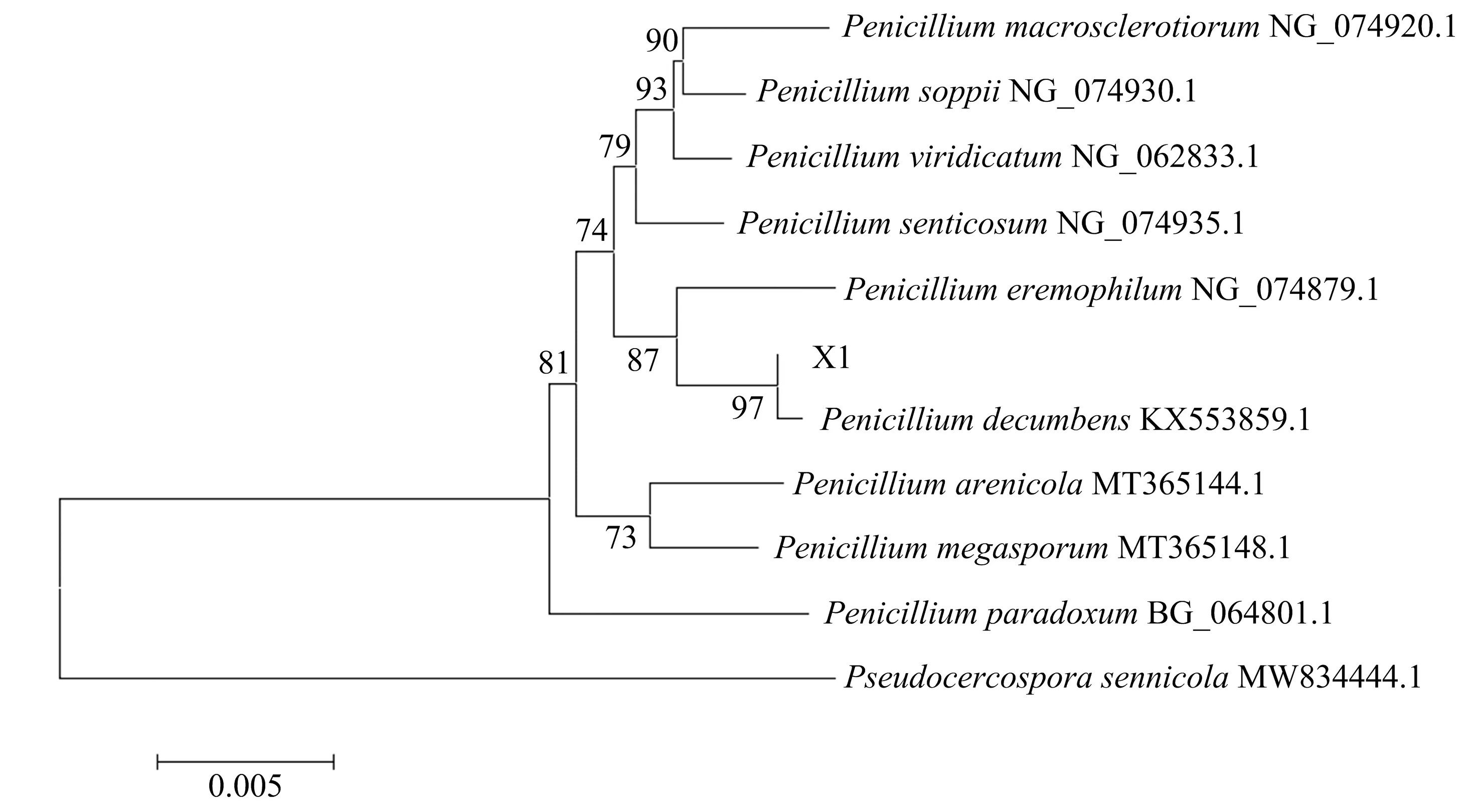
图3 根据溶磷菌菌株X1 18S rDNA构建的系统发育树
2.3 斜卧青霉X1对不同磷源溶解情况
为了解斜卧青霉X1动态溶磷的特性,测定了斜卧青霉X1对磷酸钙、磷酸铝、磷酸铁的动态溶磷能力,结果如图4所示.斜卧青霉X1对不同磷源均具有溶解能力,且溶解特性差别较大,其中对磷酸钙的溶解能力最强,其次是磷酸铝,对磷酸铁的溶解能力较低.

图4 斜卧青霉X1以磷酸钙为磷源的溶磷动态、生物量和pH变化
如图4所示,斜卧青霉X1以磷酸钙为唯一磷源,在初期阶段(2 d内)溶磷量上升幅度很小,直至第3天溶磷量才大幅上升,此时pH也降低至3.29.随着发酵时间的延长,在第9 天时,斜卧青霉X1对磷酸钙的溶磷量达到最大值,为2 003.95 mg·L-1,同时此时的生物量也达到了最高,为12.93 g·L-1.
如图5所示,斜卧青霉X1以磷酸铝为唯一磷源,从第1天溶磷量就开始大幅提高,此时发酵液的pH也开始迅速下降,直至第5 天,斜卧青霉X1对磷酸铝的溶磷量达到了最大值387.88 mg·L-1,且此时发酵液的pH也降至最低值3.05.
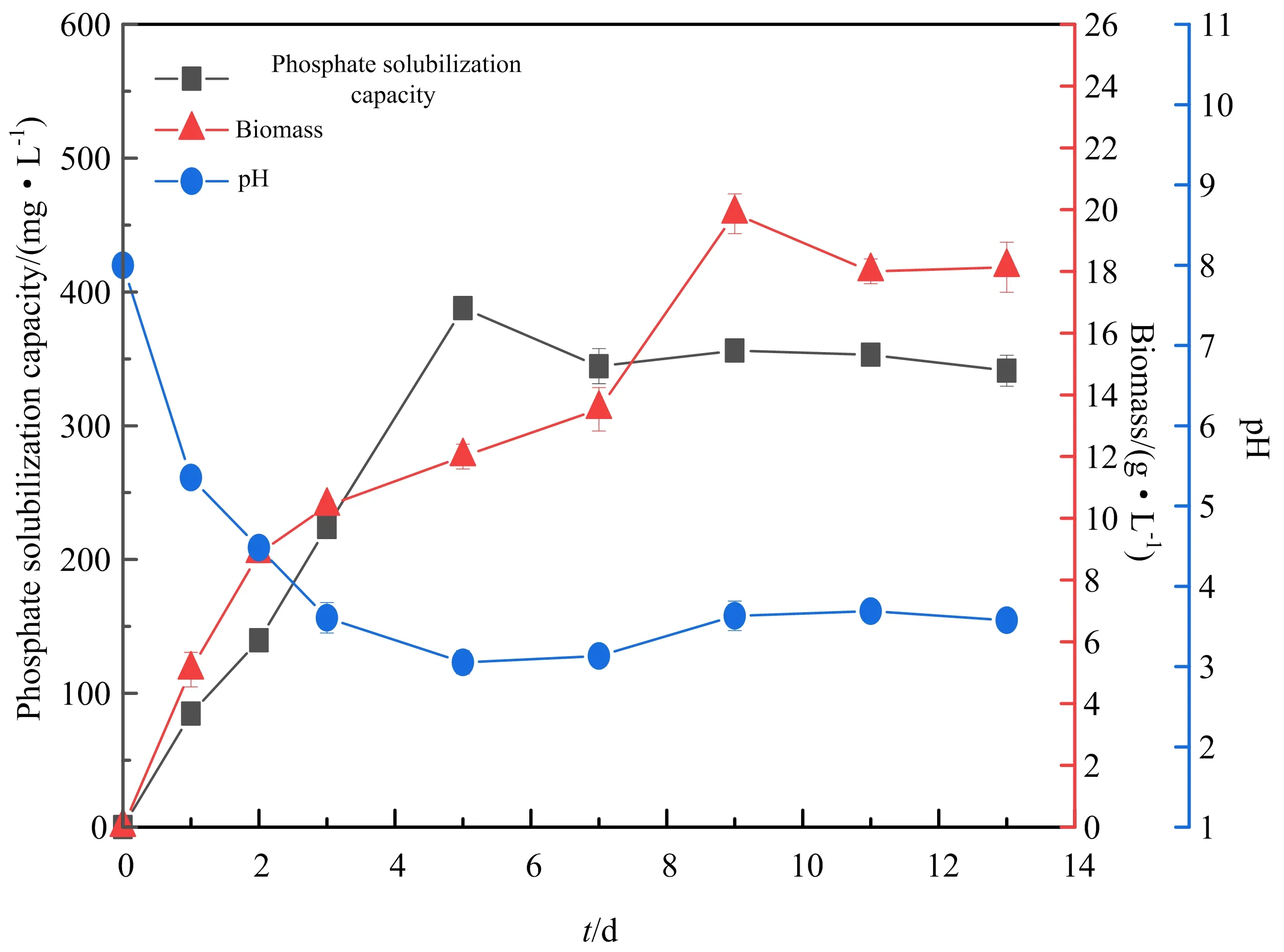
图5 斜卧青霉X1以磷酸铝为磷源的溶磷动态、生物量和pH变化
由图6可知,斜卧青霉X1以磷酸铁为唯一磷源时,从第1天开始,溶磷量就迅速提高,此时发酵液的pH也开始迅速下降,直至第3 天,斜卧青霉X1对磷酸铁的溶磷量达到了最大值30.76 mg·L-1,发酵液中的pH最低可降至2.42.
2.4 溶磷菌X1作为菌剂的相关促生能力初探
采用Salkowski试剂比色法测定斜卧青霉X1分泌IAA量最大值为14.93 mg·L-1,纳斯勒试剂反应法测定斜卧青霉X1产氨量最大值可达509.24 mg·L-1.
对斜卧青霉X1的产ACC脱氨酶能力、固氮能力以及产纤维素酶能力进行定性测定,结果如图7所示.由图7(左)可知,斜卧青霉X1可以在以ACC为唯一碳源的平板上生长,说明斜卧青霉X1具有分泌ACC脱氨酶的能力,能够有效地促进植物生长.由图7(中)可知,斜卧青霉X1可以在无氮培养基上生长,说明斜卧青霉X1具有一定的固氮能力,可以为植物提供丰富的氮源,供植物生长所需.由图7(右)可知,斜卧青霉X1在羧甲基纤维素钠平板上可以生长,且经刚果红染色以及NaCl脱色后,平板上可以明显看到透明圈,经DNS法定量测定,斜卧青霉X1产纤维素酶活性为34.41 U·mL-1.

图7 斜卧青霉X1产ACC脱氨酶(左)、固氮能力(中)、产纤维素酶(右)验证平板图
3 讨 论
土壤溶磷微生物不仅可以通过溶磷作用促进植物对磷的吸收、促进植物生长,还可以通过自身分泌一些代谢产物促进植物生长.有研究认为,溶磷微生物可以促进植物对磷的吸收,不是因为它将土壤中的有效磷释放出来,而是因为溶磷微生物分泌的促生长物质刺激根系的伸长进一步增加植物对土壤中磷的吸收[11].目前研究发现,溶磷微生物能够分泌生长素(IAA)、赤霉素(GA)、细胞分裂素(CK)、1-氨基环丙烷-1-羧酸(ACC)、铁载体(siderophores)、挥发性氢氰酸(HCN)和脱落酸(ABA)等物质,同时溶磷微生物还具有解钾、固氮等作用[12].范丙全等[13]从种植葵花的盐碱地中筛选出了1株高效的溶磷真菌日本曲霉M1,其对磷酸钙的溶解量最高可达1 020.89 mg·L-1,pH最低可降至3.36.张建峰等[7]从长春市农安县西盐碱地筛选出了1株溶磷能力较强的菌株,绳状青霉P1,该菌株对磷酸钙的最高溶解量为1 276.75 mg·L-1,对磷酸铝和磷酸铁有较好的溶解能力,最高溶磷量为96.02,15.34 mg·L-1.笔者筛选出的高效溶磷真菌斜卧青霉X1对磷酸钙最高溶解量为2 003.95 mg·L-1,对磷酸铝和磷酸铁的溶解量可达387.88,30.76 mg·L-1,在溶解磷酸钙方面,斜卧青霉X1的溶磷效果优于日本曲霉M1以及绳状青霉P1,且对于磷酸铝和磷酸铁的溶解效果也优于绳状青霉P1,这为制备微生物菌肥提供了重要的理论支持.
ACC脱氨酶和IAA均有助于植物的生长.笔者的平板验证实验表明,斜卧青霉X1可以产生ACC脱氨酶和IAA来促进植物的生长.此外,氮是叶绿素的主要成分,与光合作用有密切关系.因此斜卧青霉X1的固氮作用可以更好地促进植物的光合作用,为植物的生长发育提供更多的氮源.纤维素类物质是自然界中最廉价、含量最丰富的可再生资源.微生物是纤维素酶的主要来源,利用酶解法使纤维素类物质糖化,由于其能耗低,反应温和,是提高纤维素利用的重要手段之一.笔者所研究的卧青霉X1可以产生纤维素酶,酶活性为34.41 U·mL-1,对纤维素具有一定的降解能力,因此斜卧青霉X1可以与秸秆等有机肥结合,制备成微生物菌剂,应用于农业种植.该研究结果可为生物肥料的研制提供有效的技术支持.
4 结束语
笔者从胡枝子根际土壤中筛选出了1株溶磷真菌斜卧青霉X1,对不同磷源均具有溶解能力,其中对磷酸钙最高溶解量可达2 003.95 mg·L-1,且斜卧青霉X1还可以分泌IAA来促进植物生长,具有一定产氨及固氮能力,为微生物菌剂的研制提供了较好的菌种资源,以期为农业可持续发展提供重要的科学依据和理论支持.
