结构修饰提高酶稳定性、活性*
2023-05-16黄金莎闫云君
黄金莎 徐 莉 闫云君**
(1)华中科技大学生命科学与技术学院,武汉 430074;2)华中科技大学分子生物物理教育部重点实验室,武汉 430074)
酶作为一种绿色可持续的生物催化剂[1],在工业中应用广泛,如用于纺织、洗衣、造纸和食品行业的淀粉酶[2],用于造纸和纸浆行业的木聚糖酶[3-4],用于食品、制药、纺织和化妆品行业的脂肪酶[5-6],以及用于制药、食品和纺织行业的谷氨酰胺转氨酶[7]等。自然进化的酶通常不适合在恶劣环境中使用或催化自然界中不存在的新型反应,很少是工业用途的最佳选择[8-10]。为此,蛋白质工程策略被用来改善酶的稳定性和催化多样性,以满足不断增长的生物技术应用需求[11-14]。随着对结构-功能关系的深入了解,结构修饰已成为增强或改变其稳定性/催化活性的有利工具[15-18]。本综述集中讨论了近年来基于结构修饰的蛋白质工程策略在改善酶稳定性或/和催化活性方面的成功应用(图1)。
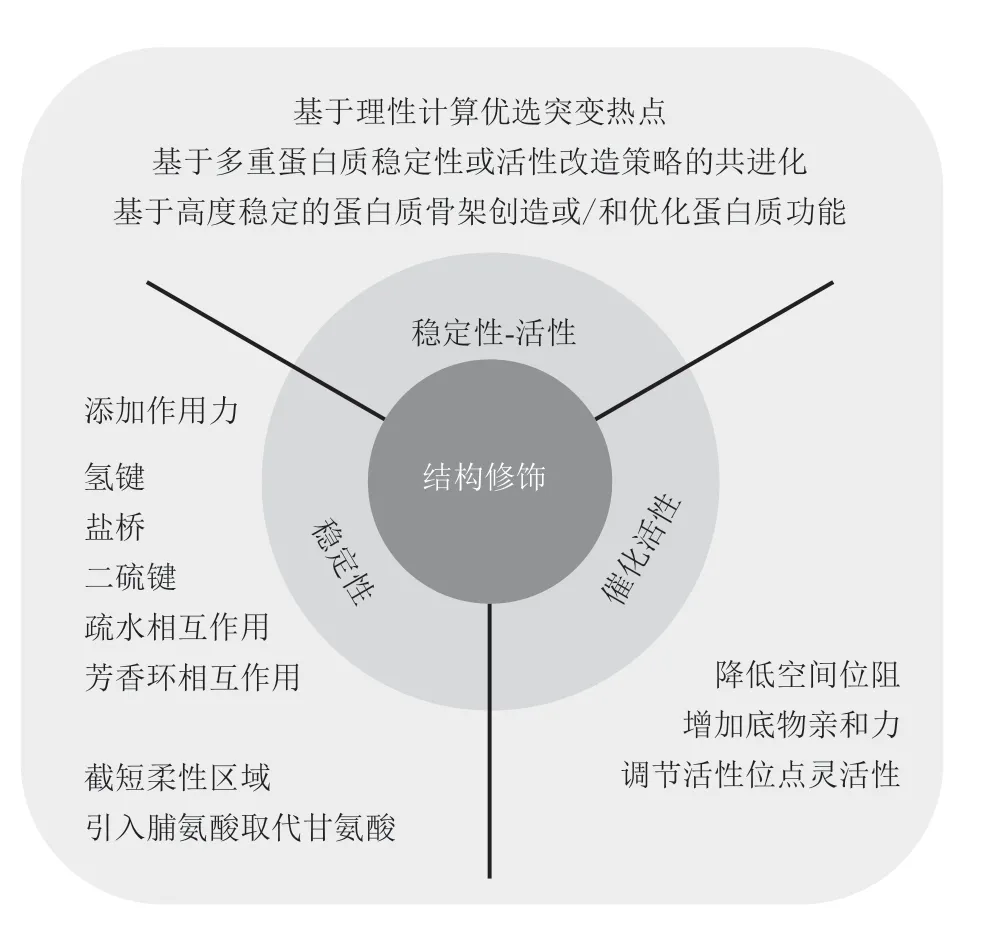
Fig.1 Structural modification to optimize enzyme thermostability or/and catalytic activity图1 改善酶热稳定性或/和催化活性的结构修饰策略
1 稳定性改造
高温有助于加速反应和底物的溶解度,并减少微生物污染的风险,因此,热稳定性是衡量酶工业应用可行性的一个关键因素,是酶分子在高温下保持结构和功能完整性的一种特征。热稳定性的酶通常具有良好的动力学稳定性,能够在相对苛刻的条件下进行预处理,并在高温下保持高度的耐热性和催化能力[19-20]。同时,蛋白质的稳定性与表达水平有关[21-22],追求蛋白质稳定性也是满足实际应用需要的合理表达量的重要原因。报道指出,对结构不稳定的蛋白质进行稳定性处理后可以使其表达量提高100 倍以上[23]。此外,稳定的蛋白质倾向于显示更好的溶解度[24]。虽然稳定性不直接影响蛋白质的聚集,但对于不稳定蛋白质,解折叠导致埋藏的疏水侧链暴露,聚集趋势增加[25]。最后,在蛋白质工程中,具有较高热稳定性的酶可以接受更广泛的有益突变,同时保留其原始结构,因而表现出更大的进化潜力[26]。
1.1 热稳定性常用表示方法
最常用于描述蛋白质热稳定性的参数是熔解温度(melting temperature,Tm)、半衰期(t1/2)、热半失活温度(T50)和解折叠吉布斯自由能(ΔG)。Tm表征蛋白质二级或三级结构的可逆或不可逆的展开,被认为是评估热稳定性最有参考价值的指标之一,其数值可通过差示扫描荧光(differential scanning fluorimetry,DSF)进行测定[27-28]。t1/2是在给定温度下保持一半活性所需的时间,代表了酶的动力学稳定性[29]。T50是50%的蛋白质发生不可逆转变的温度,可通过分析热处理后蛋白质的活性来确认[30]。值得注意的是,由于酶分子在解折叠的同时伴随酶活力的损失,Tm和T50虽不完全相同,但通常显示非常接近的相关性[31]。蛋白质解折叠吉布斯自由能(ΔG)定义了野生型和突变体之间的平衡,即更稳定的蛋白质包含更少部分的变性分子[32]。
1.2 热稳定性主要影响因素
由于蛋白质的稳定性取决于其分子结构,结构修饰技术是一种改善蛋白质热稳定性可行且有效的方法[33-35]。影响蛋白质热稳定性的主要因素包括非共价作用(疏水性、氢键数目、盐桥、芳香环相互作用)、共价相互作用(二硫键)、脯氨酸和甘氨酸数目及柔性区域的分布等[36-37]。
1.2.1 疏水相互作用
疏水相互作用的增加可以降低蛋白质在高温下解折叠的速率,在稳定蛋白质三级结构中起着关键作用[38]。最近的研究表明,因为大多数天然酶具有一个良好的疏水核心,因此通过单一的突变,特别是通过随机突变提高热稳定性越来越困难[37]。计算机辅助策略引入非极性氨基酸或者去除不稳定因素(埋藏的带电残基、不合理的氢键等)已成为一种极具潜力的改良热稳定性方法[39]。为了提高土曲霉(Aspergillus terreus)转氨酶的热稳定性,研究人员[40]通过B 因子和解折叠自由能的计算,使用非极性氨基酸取代极性氨基酸或带电氨基酸,获得了4 个稳定的突变体(T130M、T130F、E133F和D134L),其值增加了0.7~5.0℃。结构分析表明,135位点的异亮氨酸(I)与130位点的甲硫氨酸(M)或苯丙氨酸(F)、132 位点的脯氨酸(P)与133位点的苯丙氨酸(F)分别形成了新的疏水相互作用(图2a),是其热稳定性改善的重要原因。基于RosettaDesign框架的RosettaVIP协议可以搜索蛋白质结构内部折叠不合理的疏水空隙,准确地识别稳定性残基,使蛋白质疏水核心折叠更加稳定。Borgo 和Havranek[41]基于此方法自动设计甲硫氨酸氨肽酶,通过选择引入疏水相互作用的点突变提高其核心折叠的质量。突变体eMAP5-fold中引入的5个突变(V24I、C45L、V207I、A152I 和F156L)减小了掩埋在内部的空隙体积,使其Tm值增加17.6℃。
1.2.2 氢键
氢键是稳定蛋白质二级结构的重要因素,对维持其构象稳定性也至关重要[19,42]。研究表明,嗜热酶的晶体结构中存在较多数量的氢键,且氢键是最多被引用解释热稳定性提高的物理性质[37]。氢键引入是定向进化的一种常见方式。Akbulut等[43]利用DNA shuffling 和定点突变方法构建了短小芽孢杆菌(Bacillus pumilus)脂肪酶突变体L3-3,在50℃的半衰期提高了约9 倍。该突变体含有3 个重要突变(G14S、A15G 和V109S),其中G14S 和A15G 位于连接折叠β1 和螺旋αa 的loop(10~15)中,额外创建了两个氢键S14-G11和S14-N18加强loop 区域的刚性。另外,109 位点的丝氨酸(S)侧链分别与N48的Nδ2原子(螺旋αB的N端残基)和A81 的主链氧(螺旋αC 中)直接形成氢键,将loop(109~123)固定在核心的二级结构,也增加了螺旋αB的N端刚性(图2b)。蛋白质内的高柔性区域在热变性中很可能是最先开始解折叠,预测和刚化蛋白质柔性部位的刚化柔性位点的策略(rigidifying flexible sites,RSF)也是提高酶热稳定性的一种有效方法[44]。上海交通大学的冯雁教授团队[30]通过识别并突变南极假丝酵母(Candidaantarctica)脂肪酶B 催化丝氨酸(S105)10范围内结构灵活的残基,得到了突变体D223G/L278M。该突变在α10螺旋内形成了额外的氢键网络,增加了片段的刚性,使48℃下的半衰期增加了13倍,值增加了12℃。
1.2.3 盐桥
盐桥通常位于蛋白质的表面,在高温下对蛋白质的稳定性发挥积极作用,盐桥数目越多蛋白质越稳定[42,45-46]。因此,基于结构的蛋白质表面盐桥设计是提高蛋白质热稳定性又一个重要手段。研究表明,灵活性可以作为盐桥设计的重要指标,在柔性区域添加盐桥有助于增强其结构刚性。利用分子动力学模拟确定了嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)脂肪酶的一个高度灵活的区域(序列160~200),通过设计突变G165D 和F73R 引入新的盐桥,从而增加脂肪酶的热稳定性。与野生型脂肪酶相比,突变体在50℃时的半衰期提高了900倍以上,最适温度从35℃提高到90℃[47]。引入盐桥的另一个方法是将热不稳定区域的不带电残基突变为带电残基。江南大学的李兆丰教授团队[48]基于理性设计策略,在热葡糖苷酶地芽孢杆菌(Geobacillus thermoglucosidans)STB02 1,4-α-葡聚糖分支酶中分别引入5 个盐桥,获得的突变体(Q231R-D227、 Q231K-D227、T339E-K335、 T339D-K335 和 I571D-R569) 在60℃下的半衰期比野生酶增加了17%~51%,证明了非天然盐桥对蛋白质稳定性的重要贡献。2023年,该团队结合B因子和可及表面积计算,在两个氨基酸位点(73 和137 位)构建了新的盐桥(图2c)。结果显示,在137 位点处引入的谷氨酸(E)与R140 形成了额外的静电相互作作用,加强了GBE的loop结构,其半衰期提高了36.6%[49]。
1.2.4 芳香环相互作用
芳香环相互作用(π stacking,π-π stacking)是一种距离小于7的两个芳香环之间的非共价作用,同时具备氢键和疏水作用的特点,是蛋白质结构稳定的重要机制[50]。通过多序列比对和结构分析,使用疏水色氨酸(W)取代位于皱褶念珠菌(C. rugosa)脂肪酶的非保守酰基结合残基G414,不仅与邻近残基形成了新的疏水网络,还与F125和F415产生了新的芳香相互作用(图2d),获得的突变体G414W 在60℃时的半衰期提高了6.5 倍,提高了14℃,最适温度增加了15℃[51]。通过在嗜热脂肪地芽孢杆菌(G. stearothermophilus)T6脂肪酶溶剂通道中加入芳香族残基(苯丙氨酸、酪氨酸或色氨酸),Gihaz等[52]揭示了新芳香环相互作用(π-π或CH-π)对增强酶在有机溶剂中稳定性的重要性。研究表明,通过该方法获得的单点突变体L360F 稳定性比野生型提高了81 倍,且苯丙氨酸(F)在双重突变体A187F/L360F 中的组合使其在甲醇中的Tm值增加了7℃。
1.2.5 二硫键
二硫键是通过一对半胱氨酸被氧化后形成的,可以降低蛋白质解折叠状态下的构象熵,在稳定蛋白质的三维结构中起着重要作用(图2e)[53-54]。研究表明,通过在甲硫氨酸脱氨酶远离活性部位引入二硫键突变获得的突变体M3在50℃的半衰期增加了2.3倍[55]。引入二硫键的关键问题是突变位置的选择,在不合适的位置引入额外的二硫键有可能损害其内在的活性和稳定性[56]。江南大学的李兆丰教授团队基于结构信息和计算机工具(MODIP、Disulfide by Design2、FoldX 和AlphaFold2)设计了两个嗜糖假单胞菌(Pseudomonas saccharophila)STB07 淀粉酶突变体(A211C-S214C 和S409CQ412C),与野生型相比,突变体A211C-S214C 在60℃时的半衰期增加2.6 倍,突变体S409C-Q412C的热稳定性没有显著变化。通过结合结构差异分析和MD模拟发现,loop8(140~167)的刚性对蛋白质局部和全局稳定十分重要,而二硫键S409CQ412C 距离loop8 较远,只能选择性地稳定突变体结构的CBM20区域(尤其是loop30),因此尽管引入了相同数量的二硫键,突变体A211C-S214C 显示出比S409C-Q412C 更好的热稳定性。目前,二硫键工程具有一套比较成熟的设计流程[54]:首先,使用二硫键预测工具设计潜在的二硫键;然后,根据突变位置、几何结构及突变引起的自由能变化,剔除不合理的二硫键;最后,通过Ellman 实验验证二硫键的形成,并分析突变体稳定性。
1.2.6 引入脯氨酸或取代甘氨酸

Fig. 2 Introduction of non-covalent/covalent interactions by structural modification to improve thermal stability图2 结构修饰引入非共价/共价相互作用提高酶热稳定性
天然氨基酸中,脯氨酸具有最低的构象熵,甘氨酸具有最高的构象熵。同二硫键一样,脯氨酸和甘氨酸都是基于“熵稳定”的策略增强蛋白质的热稳定性[44]。因此,在灵活性区域引入脯氨酸等刚性氨基酸或取代甘氨酸等柔性氨基酸,也是提高酶稳定性的有效途径[37]。为了提高柄蓝状菌(Talaromyces stipitatus)1,4-b-D-半乳糖内切酶的半衰期,基于B-FITTER 和PoPMuSiC 在K31 和T172位点分别引入脯氨酸突变,其55℃的半衰期分别增加了55%和56%;同时,在半理性设计的基础上获得了突变体G305A,其在55℃的半衰期为(114.4±8.1) min,与野生型相比大约提高了9倍[57]。为了提高来源于Bacillus pumilus的木聚糖酶的稳定性,Bhat 等[58]选择该酶N 端区域的前6个残基RTITNN进行突变,并通过分子动力学模拟评估突变体的稳定性。研究表明,通过采用脯氨酸(P)和缬氨酸(V)取代第5 位和第6 位的天冬氨酸(D),引入刚性构象的氨基酸,增强了C端与N端的远程相互作用,实现了酶稳定性的提高。
1.2.7 截短柔性区域
蛋白质中的柔性环(loop)和无序端部结构(N 和C 端)也是导致不稳定性的因素之一,可通过截短方式进行调控[37]。研究人员通过删除1,4-α-葡聚糖分支酶C 端的最后26 个残基,提高蛋白质的整体刚性,获得的截短突变体不仅具有更高的热稳定性和可溶性,且其酶活性未受到显著损害[29]。突变或删除远端无序可变的loop区中氨基酸残基也可以改善蛋白质稳定性。湖南农业大学的吴永尧教授团队[59]发现,与天然甘露聚糖酶Man1312 相比,N 端残基(V3、N7 和Q11)的缺失显著增加了酶的热稳定性,其中三位点突变体MandVNP 的最适温度提高了10℃,Tm值提高了8℃。
增加非共价键(疏水相互作用、氢键、盐桥和芳香环相互作用)和“熵稳定”策略(引入二硫键、增加脯氨酸、减少甘氨酸和柔性区域截短)已被证明在获得热稳定突变体方面非常有效。蛋白质工程作为改善蛋白质稳定性的有力工具备受关注,表1总结了一些基于蛋白质结构信息辅助酶稳定性改造的常用工具或方法。

Table 1 Summary of several popular tools or methods for enzyme stability表1 辅助酶稳定性改造的常用工具或方法
2 催化活性改造
除了热稳定性外,酶的催化特性(包括催化活性、底物特异性和对映选择性)也是影响最终产品生成速率的一个重要因素[74-75]。然而,天然酶的底物特异性强且底物谱窄,通常只能催化单一底物或具有类似结构的底物[76]。结构指导下的蛋白质工程可以通过改变酶的底物结合口袋或结合通道中氨基酸的类型,降低空间位阻、拓宽催化口袋、增加底物亲和力和调节活性位点的灵活性,优化底物结合和产物释放,从而改善酶的功能[77-80]。
2.1 拓宽底物结合口袋,降低空间位阻
酶促反应中,空间位阻效应对酶活性和立体选择性有很大影响[77]。通过使用较小侧链氨基酸如甘氨酸(G)、丙氨酸(A)、半胱氨酸(C)、丝氨酸(S)、脯氨酸(P)和缬氨酸(V)等,能够减轻底物结合口袋和底物间不利的空间位阻,增加其催化活性[36]。清华大学于慧敏教授团队[81]首先通过分子对接和分子动力学模拟,确定与底物结合的关键残基;然后通过由苯丙氨酸(F)、天冬氨酸(D)、缬氨酸(V)和丙氨酸(A)组成的简化氨基酸字母表生成了一个小而精的突变体库来微调底物结合口袋。通过引入突变,将125位点大侧链的酪氨酸(Y)替换为小侧链的丙氨酸(A),不仅扩大了底物结合口袋的体积,还与底物形成额外的疏水相互作用,显著增强了突变体RbTAM1(Y125A)的活性。基于结构信息和生物信息学,中国农业大学的江正强教授团队[82]对酸热脂环酸芽孢杆菌(Alicyclobacillus acidocaldarius)糖苷水解酶的底物结合裂隙中的关键氨基酸进行定点诱变以提高其水解活性,通过引入K238A 和W239Y突变减少了K238 和W239 形成的空间位阻,其酶活性分别提高了112.9%和36.4%。同时,上海健康医学院的邵雷研究员[83]合理选择了高加索乳杆菌(Lactobacillus kefiri)醇脱氢酶(LkADH)催化口袋及其周围5个氨基酸残基进行迭代突变,最终获得的突变体seq5 (Y190P/I144V/L199V/E145C/M206F)表现出最高酶活性和优秀的立体选择性(对映体过量(ee)>99%)。分子模拟结果表明,通过改变结合口袋的大小和构建更多的非共价作用,增强了突变体对底物二芳基酮的活性。因此,使用侧链较小的氨基酸替换侧链较大的氨基酸,不仅能够最小化催化口袋空间位阻效应,还能与底物形成额外的非共价相互作用,从而提高酶活性。
2.2 增加底物亲和力
研究表明,使用较大侧链疏水残基取代较小侧链疏水残基,能够缩短底物与结合口袋中相关残基间的距离,提高酶的催化效率[84]。研究人员[85]通过分子对接分析大阪伊德氏杆菌(Ideonella sakaiensis)聚酯水解酶和底物(对苯二甲酸乙二醇酯,PET)之间的相互作用,确定底物结合口袋周围6个关键残基。其中,I179与底物直接作用影响底物定位,因此当I179 被突变为具有较大侧链且更疏水的苯丙氨酸(F)时,能够定位底物PET的苯环方向,缩短其与关键残基的作用距离,显著提高催化效率。与野生型PETase 相比,突变体I179F 的Km减少了3.8 倍,kcat/Km值增加了15.6 倍,对PET 的降解效率提高了2.1 倍。酶与底物之间的结合自由能与酶的催化效率是负相关的,可通过虚拟突变预测酶-底物结合自由能的变化筛选目标位点,获得理想催化剂[86-87]。为了提高茂源链霉菌(S. mobaraenesis)谷氨酰胺转氨酶TGm1的催化活性,研究人员[86]使用Discovery Studio柔性对接构建42 个FRAPD-TGm1/CBZ-Gln-Gly 对接结构,并在活性位点Cys64 的15 Å 范围内进行虚拟饱和诱变。基于酶-底物复合物集合自由能变,产生了15个结合自由能低于-0.8 kcal/mol的突变体。其中突变E28T对活性有正向影响,使FRAPD-TGm1的比活力增加了23.7%。
2.3 调节活性位点灵活性
活性位点的构象灵活性是影响酶催化活性的另一个重要因素,调节活性区域的灵活性也是酶进化的一种有效策略[88]。以菊粉外切酶InuAGN25 为例,通过取代催化口袋中的刚性脯氨酸(P236),增加突变体P236E催化结构域的灵活性,进而提高其催化活性[89]。天冬氨酸酶是一种高特异性的氨裂解酶,Cui 等[78]通过在天冬氨酸酶底物结合区或接近活性口袋的区域引入适当突变,设计了高效的多功能C-N 裂解酶。 在靠近链霉菌(Streptomycessp.)82F2 酰胺水解酶(DAH)催化中心S86 附近,存在一个对氨解至关重要的小口袋,其中I338是底物识别的重要残基。Elyas等[90]发现使用较小的丙氨酸(A)、甘氨酸(G)或丝氨酸(S)取代338位点的异亮氨酸(I)可同时改变DAH 结合口袋空间和形状、局部灵活性以及静电环境,增加催化中心S86 对酰基受体(Ac-d-Phe-OMe)的亲和力,显著提高突变体的催化效率。此外,Alcalde等[91]发现底物进入通道对酶催化效率也至关重要。在这项工作中,作者使用体积较小的丙氨酸(A)和亮氨酸(L)取代非特异性过加氧酶血红素通道表面两个较大的苯丙氨酸(F76和F191),通过增加参与血红素通道形成的α 螺旋的灵活性改变其拓扑结构,使得底物通道的访问受到限制,从而降低突变体AaeUPO催化效率。
基于结构信息,聚焦活性位点残基,结合通道残基和结合口袋中柔性位点,改变催化口袋的结合形状及与底物分子的亲和力,能够更加高效合理地创制具有所需催化功能的催化剂[35]。近年来,人们开发了一些辅助催化功能改造的工具或策略,用于快速筛选合适的突变位点(表2)。

Table 2 Summary of applicable tools or strategies for enzyme function prediction表2 辅助酶催化功能改造的常用工具或策略
3 组合策略辅助酶的热稳定性和活性共进化
值得注意的是,新功能的产生或现有功能的改进,导致进化偏离原始序列,进而可能会影响催化剂的其他特性[36,99]。许多研究表明,热稳定性的提高往往伴随着结构僵化,导致酶活性降低[86,100-101],而在底物结合区或接近活性口袋区域的灵活性突变将可增加整体构象的灵活性,从而改变酶的热稳定性[32,36,101]。鉴于稳定性和催化活性间可能的负相关性,可采用以下几种策略以同时克服操纵蛋白质功能和维持蛋白质稳定性所带来的挑战。
3.1 基于理性计算优选突变热点
自然进化中,保守性区域对发挥酶分子正常的生物学功能至关重要,不同位置氨基酸的进化保守性和突变耐受性是相关的[102]。因此,为了提高突变文库的质量,科研人员通常避免选择进化上高度保守的位置进行突变[54,103-104]。华中科技大学的闫云君教授团队[105]通过深度序列分析,确定了米黑根毛霉(Rhizomucor miehei)脂肪酶中氨基酸在同源序列中的保守性等级,并将影响催化性质的关键位点从通过理性设计算法预测的突变中排除,构建了“小而精”突变体文库。研究表明,表面残基对突变的耐受性要比埋在核心中的残基高得多,因此将“热点”集中在暴露于溶剂的残基能尽量减少突变引起的不稳定性和对酶功能的影响[106]。为了改善疣孢青霉(Penicillium verruculosum)内切葡聚糖酶的热稳定性,Bashirova 等[107]在酶结构表面引入二硫键,构建两个突变体S127C-A165C(DSB2)和Y171C-L201C(DSB3)。与野生酶相比,突变体在70℃和80℃下的半衰期增加了1.5~2倍,且对羧甲基纤维素和β葡聚糖的比活力增加了15%~21%。提高突变体文库质量的另一个强大方法是分析位点灵活性或解折叠自由能变。FRESCO是基于能量分析和分子动力学模拟提高酶稳定性的有效策略(图3)[72]。该策略首先使用多种算法(Rosetta ddg、FoldX 和Disulfide Discovery)生成稳定突变,然后结合分子动力学模拟剔除增加灵活性的不合理突变,在保持柠檬烯环氧化物水解酶完整催化功能的同时实现了酶稳定性的更大飞跃(Tm+35°C)。解折叠自由能是反映蛋白质稳定性的重要参数,随着计算机科学技术的发展,可通过相关软件或程序预测突变对目标蛋白质解折叠自由能的影响(ΔΔGfolding=ΔGfolding(突变体)-ΔGfolding(野生型)),精简突变位点,避免突变引起的不稳定性。研究人员[40]首先基于B 因子策略选择Aspergillus terreus转氨酶中柔性残基构建饱和突变体文库,然后使用FoldX 计算突变体和野生型的折叠自由能值的变化,最终选择了更刚性的氨基酸取代突变位点。获得的双重突变体T130M/E133F 在40℃的t1/2提高了3.3倍,提高了5.0℃。同样的,华中科技大学的闫云君教授团队[108]组合使用Rosetta、I-Mutant和FoldX三种理性设计方法计算突变对自由能的影响,构建了一个C. rugosa脂肪酶的有限突变体文库。在该文库中,突变体D457F 的热稳定性最高,其在50℃时的t1/2比野生酶延长了5.5倍,最适温度提高了10℃。

Fig. 3 Scheme illustration of FRESCO:generating stable mutations with multiple algorithms[72]图3 FRESCO流程图:组合使用多种算法生成稳定的突变[72]
3.2 基于多重蛋白质稳定性或活性改造策略的共进化
除了优选突变热点,还可以采用共进化策略同时提高稳定性和活性[32]。云南师范大学的周峻沛等[89]发现,同时提高外源性胰岛素酶末端的刚性和催化结构域的灵活性,可以改善该胰岛素酶的低温活性和热稳定性。与野生酶相比,基于改造获得的8 重突变体RfsMut8S 在50℃下的热稳定性大大提高,同时低温活性明显改善。鉴于在活性部位插入大量的突变可能会损害酶的稳定性,华中科技大学的闫云君教授团队[54]基于不同结构域组合使用多重改造策略,以实现催化活性和稳定性的共进化。首先,使用Rosetta Cartesian_ddg 策略计算底物结合口袋中氨基酸突变对酶-底物复合物间结合能的影响,预测增加酶与底物亲和力的单点突变。选择活性最高的Cartesian_ddg设计,再利用组合算法(disulfide by design、MODIP 和BridgeD)计算出潜在的可形成二硫键的氨基酸突变对,最终获得的突变体E265V/S267W/S61C-S115C/E190C-E238C对不同碳链长度对硝基苯酚酯的催化活性提高1.5~3.8 倍,且Tm值 提 高8.5℃。DuraPETase 是 基 于GRAPE策略获得的高度稳定的突变体[109],江南大学的吴敬教授团队[110]通过整体刚性改进(N233C/S282C)、关键区域灵活性调整(H214S)和蛋白质表面静电荷优化(S245R)协同提高DuraPET的热稳定性和生物降解能力(图4)。构建的突变体DuraPETase-4M 在96 h 后可降解93.3%的无定形PET粉末和69.8%的PET预制膜,对这两种底物的降解速率分别达到DuraPETase 的3.2 和5.4 倍。另外,在酶的折叠过程中,残基侧链原子之间的疏水相互作用会产生空腔,江南大学的夏小乐教授团队[111]提出了一种基于计算技术(high hydrostatic pressure molecular dynamics,B-Fitter)的由内而外的空腔工程(cavity engineering)策略,探索了Rhizomucer miehei脂肪酶空腔体积及空间分布的变化对热稳定性和催化活性的影响。结果表明,内腔体积的减少和空间重排不仅有助于提高酶的稳定性,还通过优化底物通道改善了其催化效率。其中,三重突变体T21V/S27A/T198L 的Tm值升高了11.0℃,在65℃时半衰期增长了28.7倍,比活力增加了9.9倍(高达5 828 U/mg),是目前报道的具有较高酶活性的脂肪酶之一。以上研究很好地证明了通过积累一系列对蛋白质活性、稳定性有积极作用的突变实现活性和稳定性共进化的可能性。

Fig. 4 Synergistically improve the thermostability and biodegradability of DuraPETase via enhanced overall rigidity,key region flexibility adjustment and electrostatic charge optimization[110]图4 通过整体刚性改进、关键区域灵活性调整和蛋白质表面静电荷优化协同提高DuraPET酶的热稳定性和生物降解能力[110]
另外,当某一功能被破坏后,可通过额外的设计及时修复“受损”的工程突变体。以β葡萄糖苷酶Bgl6为例,中山大学的刘玉焕教授团队[99]首先利用计算机辅助工程策略和重塑底物结合口袋生成了稳定性增强、活性增加的突变体,但对底物的耐受性相对降低。为了避免在高浓度葡萄糖溶液下酶分子的不稳定性,重新设计了活性部位空腔的关键区域,在多重选择压力下最终得到了同时改善热稳定性(半衰期为20倍)、活性(kcat/Km为5.6倍)和葡萄糖耐受性(ΔIC50为200 mmol/L)的突变体M12(图5)。

Fig. 5 Simultaneous optimization of multiple properties(thermostability, activity and glucose tolerance)of β-glucosidase Bgl6 in combination with computer-aided strategies,pocket engineering and region redesign strategies[99]图5 利用计算机辅助策略、口袋工程及区域重新设计策略同时优化β葡萄糖苷酶Bgl6的热稳定性、活性和葡萄糖耐受性[99]
3.3 基于高度稳定的蛋白质骨架创造或/和优化蛋白质功能
蛋白质工程的最终目标是创造或优化蛋白质的功能。在赋予新功能的突变中,蛋白质的存活能力与其稳定性呈正相关[25-26,32]。因此,可选用高度稳定的蛋白质作为功能性改造的起始结构,以平衡突变造成的不稳定影响[23,25,100]。Arnold 及其同事[26]通过对稳定性较差(T50=47℃)和较好(T50=62℃)的P450 BM3突变发现,高稳定的蛋白质对突变具有很强的耐受性,允许接受更广泛的有益突变,并能折叠到其原始结构表现出新的或改进的功能。PaDa-I是高度稳定的真菌非特异性过氧合酶突变体[112],Alcalde等[113]将其置于FuncLib设计中,以快速生成功能性多点突变体。经过一次FuncLib设计,在其催化核心中发生2~5个改变,生成了24个突变体。与PaDa-I 相比,将底物从烷基转变为芳香羟基后,其催化效率提高了10倍。
保持蛋白质足够的稳定性是从文库中获得有利突变体的前提条件[32]。如果特定的生化或/和生物活性要求选择不稳定的蛋白质作为起始骨架,可以在赋予新功能前初步提高亲代蛋白质的稳定性(即先稳定蛋白质,后进行功能改造)[100]。PROSS 设计旨在获得具有更高的稳定性和表达性的突变体,只允许在活性部位之外进行设计[24]。FuncLib旨在提高催化活性或改变底物范围,设计过程仅限于活性部位的残基[96]。基于此,Fleishman 等[114]首先应用PROSS 对3 个漆酶的可表达性和稳定性进行了设计。然后,选择了最稳定PROSS 设计作为FuncLib 活性位点设计的起点,在底物氧化位点内实施3~7次突变,获得了具有广泛亲和力及高度稳定性的酶。同样地,Shah等[115]首先将环状芽胞杆菌(B. circulans)木聚糖酶(BCX)插入融合到激烈火球菌(Pyrococcus furiosus)嗜热麦芽糊精结合蛋白(PfMBP), 得到了复合物PfMBPBCX165。该复合物不仅完整保留了BCX一级序列还具有增强的热稳定性,有助于探索整个BCX 序列空间进行功能进化。然后作者[116]将PfMBPBCX165中的BCX序列随机突变,通过文库筛选发现突变T50R可以在不影响热稳定性前提下,增强PfMBP-BCX165 在碱性pH 中的活性。另外,江南大学陈坚院士团队的刘松副教授课题组[86]组合使用多种理性设计策略提高了S. mobaraenesis谷氨酰胺转氨酶热稳定性及催化活性。首先,基于Rosetta Cartesian_ddg 进行了虚拟脯氨酸扫描,获得热稳定性增强的突变体TGm1。在此基础上,对突变体TGm1中Cys64的15 Å内的残基进行虚拟饱和突变及解折叠自由能变计算,获得了结合自由能降低且活性提高的突变体TGm2(比活力是突变体TGm1的1.44倍)。
4 结论与展望
稳定性和催化活性在酶的广泛应用中有着举足轻重的作用。通过结构修饰的酶工程策略是改善酶特性的一个理想方法,研究人员能够根据需求塑造酶的物理和催化特性。研究表明,通过引入额外的或新的作用力(氢键、盐桥、芳香环相互作用、疏水相互作用和二硫键)、增加脯氨酸、减少甘氨酸及截短柔性区域等,增强结构刚性,可获得满足实际应用需求的耐受高温的生物催化剂。而通过降低空间位阻、拓宽催化口袋、增加底物亲和力和调节活性位点灵活性,则可实现酶催化功能的高效性和多样性。但是,在稳定性或催化功能改造的过程中,新突变的引入会削弱其他功能,致使进化过程中稳定性和催化活性相互制约。为了克服这个问题,本文通过总结包括基于理性计算优选突变热点、基于多重蛋白质稳定性或活性改造策略的共进化,以及基于高度稳定的蛋白质骨架创造或/和优化蛋白质功能等多种策略,探讨了同时提高热稳定性和催化活性的可行性。
目前,蛋白质工程主要是针对自然界中现有的酶进行改造,以获得特定催化特性。如何操纵高度稳定的蛋白质,使其能够更好地容忍赋予新功能所需的突变,成为科研人员面临的主要挑战。为了解决这一问题,David Baker 团队在从头设计酶领域做出了巨大贡献并取得了突破性进展,不仅可以获得具有优良特性的蛋白质变体,还能减少随后修复不稳定蛋白质的时间和工作强度,使功能蛋白质的“定制”不再是幻想[117-119]。同时,AlphaFold[120]诞生并在蛋白质结构预测方面取得了重大成果,使得未解析结构的天然蛋白质的结构修饰研究再上新台阶,为更清晰地认识酶的进化、创新生物催化系统翻开新的篇章。
