RhoB的翻译后修饰与细胞命运*
2023-05-16曾涛玲王洪睿
曾涛玲 王洪睿
(厦门大学生命科学学院,厦门 361102)
谨以此文献给邹承鲁先生百年诞辰,先生一生致力于科学研究,治学严谨,坚持真理,展示了一代学术大师的领袖风范,实为我等后辈之楷模。
Rho 家族小G 蛋白属于Ras 超家族小GTP 酶,在细胞骨架重组、基因表达及细胞周期的调控中起着重要的开关作用[1-2]。目前已知Rho家族有20多个成员,其中RhoA、Rac1 和Cdc42 的研究最为广泛和深入,特别是关于它们在细胞骨架、细胞极性以及细胞运动方面所起的关键调控作用方面的研究[3]。RhoA、RhoB 和RhoC 同属Rho 亚家族,然而,尽管它们都参与了细胞骨架的动态调控过程,它们的细胞生物学功能和特性却不尽相同,在包括肿瘤在内的许多疾病的发生发展中的作用也有很大的不同[4]。近年来,关于RhoB的功能及其在疾病特别是肿瘤的发生发展中作用的研究也受到越来越多的关注。
与RhoA 促进细胞增殖的作用不同,过表达RhoB 的细胞生长更为缓慢,并易于发生凋亡。敲低内源的RhoB后,癌细胞对抗癌药物表现出不敏感性,凋亡比例明显下降,并且小鼠腹腔注射RhoB-/-肿瘤细胞的成瘤效率明显高于RhoB+/+细胞[5-6]。此外,在化学诱变剂处理的情况下,RhoB敲除型小鼠的皮肤癌症发病率要明显高于野生型小鼠[7]。同时,临床样本也显示,随着肺癌和头颈癌等恶性程度的增加,RhoB 的蛋白质水平呈逐渐下降的趋势[8-9],这些研究结果表明RhoB 是个重要的抑癌因子[10-12]。然而,随着对RhoB研究的深入,人们发现,在一些类型的肿瘤如胶质母细胞瘤和乳腺癌中,RhoB 很可能起着促进肿瘤生长的作用[13]。RhoB在不同类型的肿瘤发生发展中具有不同作用的分子机制尚有待进一步的深入研究,然而目前对RhoB调控的研究大都停留在其转录水平的调控上,关于RhoB蛋白的翻译后修饰,特别是除了脂化修饰以外的其他翻译后修饰对其功能影响的研究仍然十分缺乏。
1 RhoB的脂化修饰
RhoA、RhoB 和RhoC 具有很高的同源性(~85%),与RhoA 和RhoC 的氨基酸序列相比,RhoB 最大的不同是其C 端的氨基酸序列。除了C端保守的CAAX 序列(其中C=Cys,A=aliphatic(脂肪族氨基酸),X=any amino acid(任意氨基酸))中的半胱氨酸残基(Cys)可以被脂化修饰,相比于RhoA 和RhoC,RhoB 的C 端还有另外两个半胱氨酸残基(Cys189 和Cys192)也可以被脂化修饰。RhoA 和RhoC 的CAAX 序列中的半胱氨酸残基只可以被香叶酰香叶酰化(geranylgeranyl)修饰,而RhoB 的CAAX 序列中的半胱氨酸残基既可以被香叶酰香叶酰化修饰,也可以被法尼基(farnesyl)修饰。此外,RhoB 的Cys189 和Cys192 还可以被棕榈酰基(palmitoyl)修饰[4](图1)。

Fig. 1 Domain organization of Rho GTPases图1 Rho家族蛋白的结构域示意图
RhoB的C端脂化修饰的可变性使得RhoB在细胞内的定位与RhoA 和RhoC 有着很大的区别。RhoA 和RhoC 主要分布于细胞膜和细胞质中,而RhoB 分布于细胞膜、内体(endosome)、多泡体(multivesicular body,MVB)以及细胞核上,并因此导致了其细胞和生理功能上的特异性[4,14-17]。内体和多泡体是细胞囊泡运输(endosome trafficking)的枢纽环节,有研究报道RhoB参与介导细胞内的囊泡运输,在原癌基因酪氨酸蛋白激酶src(SRC)、蛋白激酶B(AKT)和表皮生长因子受体(epidermal growth factor receptor,EGFR)的运输囊泡运送到到细胞膜与之融合的过程中起着重要的调控作用[18-22]。有趣的是,人们发现用来靶向Ras蛋白的法尼基化修饰的法尼基转移酶抑制剂(farnesyltransferase inhibitors,FTIs)能够显著抑制RhoB 的法尼基化修饰,进而导致RhoB 的香叶酰香叶酰化修饰水平上调[15],并且RhoB香叶酰香叶酰化修饰水平的上调能够诱导肿瘤细胞的生长抑制和凋亡[15-16,23-24]。目前法尼基转移酶抑制剂在临床上并未取得预期效果的原因有很多,其中RhoB作为法尼基转移酶抑制剂的一个关键靶点,其在肿瘤发生发展中的作用和分子机制有待更进一步的深入研究和阐明,以期能够推动法尼基转移酶抑制剂在肿瘤临床治疗上的应用。
2 RhoB的磷酸化修饰
虽然磷酸化修饰是细胞和机体内蛋白质分子最为普遍的翻译后修饰方式,但相对于脂化修饰,Rho家族蛋白磷酸化修饰的研究却非常有限,目前关于RhoB磷酸化修饰的研究也仅有少数几篇文章报道。Tillement等[25]报道了酪蛋白激酶1(casein kinase 1,CK1)可以特异性地磷酸化RhoB 的185位丝氨酸残基(Ser185)而不能磷酸化修饰RhoA和RhoC。抑制CK1 介导的RhoB Ser185 的磷酸化修饰会导致RhoB活性水平上调,从而促进细胞骨架微丝的形成并抑制EGFR 的内吞降解。因此,RhoB 的Ser185 的磷酸化修饰在抑制RhoB 的活性上可能起着重要的作用。另外,Ballif等[26]通过蛋白质组学的方法鉴定出了RhoB的另一个磷酸化位点,154位的酪氨酸残基(Tyr154),但是该位点磷酸化的生物学功能及介导该位点磷酸化的上游激酶都不清楚。
我们的研究发现,细胞在单链DNA 损伤的情况下,激活的Chk1 激酶会磷酸化RhoB 的173 和175位的苏氨酸残基(Thr173 和Thr175),而Thr173和Thr175的磷酸化修饰会促进RhoB从细胞质膜上解离下来进入细胞质,在细胞质中与催化SUMO 化修饰的SUMO E3 连接酶PIAS1(protein inhibitor of activated STAT1)结合进而被进一步SUMO化修饰。阻断RhoB的Thr173和Thr175的磷酸化修饰会抑制单链DNA 损伤诱导的RhoB 从细胞质膜上的解离,而将Thr173 和Thr175 突变成谷氨酸(Glu)模拟Thr173和Thr175的磷酸化修饰则会使RhoB 在细胞未受DNA 损伤的情况下就从细胞质膜上解离下来进入细胞质,充分说明Thr173和Thr175的磷酸化修饰在调控RhoB与细胞质膜的结合中起着重要的作用[27]。
3 RhoB的泛素化修饰
与经典的Ras超家族蛋白质分子的活性调控方式一样,RhoA、RhoB 和RhoC 的活性主要也是通过与GTP 或GDP 的结合来调控的[28]。但是,与RhoA 和RhoC 在细胞中属于组成性表达不同,RhoB 的表达属于诱导性表达,紫外线照射、抗癌药物处理、表皮生长因子(epidermal growth factor,EGF)以及血小板衍生生长因子(platelet derived growth factor,PDGF)等处理均可使RhoB的表达水平快速上调[5,29-31]。相应地,RhoB 的mRNA 和蛋白质的半衰期都非常短,分别只有20 min 和2.5 h,而RhoA 和RhoC 相对则要稳定得多,RhoB因此被认为是一个短寿蛋白[32]。
细胞内调节蛋白质水平的经典途径是泛素化修饰介导的蛋白酶体或溶酶体的降解途径。蛋白质的泛素化修饰是通过一系列的酶促反应来实现的。泛素蛋白经过泛素活化酶(E1)的活化后,被转移到泛素缀合酶(E2)上,再通过泛素连接酶(E3)共价连接到特定的目标蛋白质上[33]。在人类细胞中,目前发现有2种E1、40种E2以及600多种E3。每一种E3 可以识别一定的目标蛋白质底物,从而决定了蛋白质泛素化降解的特异性[34]。同时,一个蛋白质底物可以有不同的E3 在不同的条件下对其进行泛素化修饰,以达到精细调控的目的。
Nedd4 家 族 的Smurf1 (SMAD ubiquitination regulatory factor-1)是第一个被发现的能够泛素化降解RhoB 的E3 泛素连接酶。Nedd4 家族属于HECT 类型E3 泛素连接酶,都由1 个C2 结构域、2~4个WW结构域,以及一个具有保守序列的有催化活性的HECT 结构域所构成,因此又称为C2-WW-HECT家族[35]。Smurf1最早是被鉴定为细胞转化生长因子TGF-β信号途径的下游分子Smad1的泛素调节因子,在调控细胞生长和胚胎发育中起着重要的作用[36]。有趣的是,我们之前的研究发现,Smurf1 可以泛素化降解RhoA,在细胞极性、运动和上皮细胞的上皮-间质转化中起着重要的作用[37-38],并且Smurf1是通过其C2结构域来识别小G蛋白底物RhoA的[39]。进一步发现,Smurf1可以同样通过C2 结构域识别RhoB,并对RhoB 进行Lys48 位的泛素化修饰来介导RhoB 的降解。通常状态下,细胞通过Smurf1泛素化降解RhoB使其蛋白质水平处于一个相对较低的水平;当细胞受到外界刺激如紫外照射导致单链DNA 损伤时,细胞会激活ATM/ATR信号通路,其中ATR会激活其下游的蛋白激酶Chk1 以磷酸化Smurf1 的Thr145、Thr161 和Thr682,Smurf1 的磷酸化修饰会诱导其自身的泛素化降解,使得RhoB蛋白得以累积,促进细胞的凋亡[40](图2)。

Fig. 2 Schematics of Smurf1-mediated RhoB ubiquitination图2 Smurf1介导的RhoB泛素化降解
另外,其他研究者进一步发现RhoB还可以被RING类型Cullin家族的E3泛素连接酶复合体所泛素化修饰。Xu等[41]发现Cullin 2-RBX1 E3泛素连接酶复合体可以泛素化降解RhoB,在肝癌的发生发展中可能起着重要的作用。Kovacevic 等[42]发现,Cullin 3-RBX1-KCTD10 E3 泛素连接酶复合体可以对RhoB 进行K63 泛素化修饰,介导RhoB 通过溶酶体途径降解来调控内皮细胞屏障的完整性,并且进一步的研究发现,Cullin 3-RBX1-KCTD10介导的RhoB 泛素化降解对于HER2 阳性的乳腺癌中的Rac1的激活是必需的[43]。此外,Liu等[44]发现,Cullin3-TNFAIP1 E3泛素连接酶复合体可以介导RhoB通过泛素蛋白酶体途径降解来影响肝癌细胞的炎症反应。
4 RhoB的SUMO化修饰
前面提到细胞在紫外照射等刺激诱导单链DNA损伤的情况下,激活的Chk1激酶不仅会磷酸化修饰Smurf1 促进Smurf1 的自身泛素化降解使得RhoB 蛋白得以累积[40],而且还会直接磷酸化RhoB 以诱导RhoB 从细胞质膜上解离下来进入细胞质与PIAS1 结合[27]。PIAS1 对RhoB 进行SUMO化修饰,而SUMO化修饰的RhoB则会与哺乳动物雷帕霉素靶蛋白复合体1 (mammalian target of rapamycin complex 1,mTORC1)抑制复合体中的结节性硬化症蛋白2(tuberous sclerosis 2 protein,TSC2)结合,将其转运至溶酶体以抑制mTORC1的活性,从而启动细胞自噬。阻断RhoB 的SUMO化修饰会抑制单链DNA 损伤引起的细胞自噬和进一步的细胞凋亡[27](图3)。
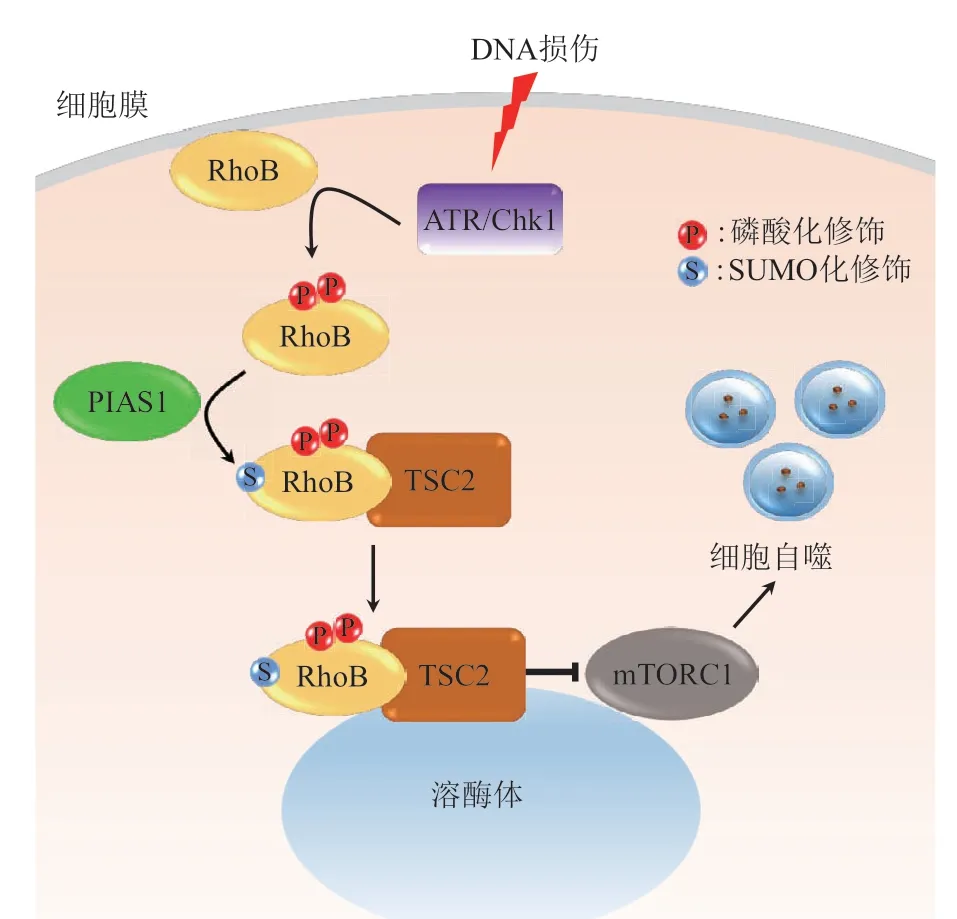
Fig. 3 Schematics of RhoB sumoylation and autophagy图3 RhoB的SUMO化修饰与细胞自噬
综上所述,RhoB 的泛素化修饰和SUMO 化修饰在调节RhoB的水平和活性上起着完全相反的作用。细胞在正常状态下会通过Smurf1 泛素化降解RhoB 使RhoB 处于低水平状态,使得细胞能够正常生长;而当细胞的DNA 受到损伤的情况下,DNA损伤应答信号通路ATR/Chk1一方面通过磷酸化修饰Smurf1促进Smurf1的自身降解来提高RhoB的蛋白质水平,另一方面则通过磷酸化修饰RhoB使其从细胞质膜上解离进入细胞质被SUMO 化修饰,从而将TSC2转运至溶酶体抑制mTORC1的活性以诱导细胞自噬,并且进一步导致细胞的死亡(图4)。由此可见,RhoB 可以通过不同的翻译后修饰来决定细胞的命运。

Fig. 4 RhoB determines cell fate by switching between ubiquitination and sumoylation图4 RhoB泛素化修饰和SUMO化修饰之间的转变与细胞命运
5 总结与展望
RhoB 在肿瘤的发生发展中起着重要作用,并且与肿瘤耐药性密切相关,RhoB 的研究将对于理解肿瘤的发病机理并探索特异的肿瘤治疗方法具有重要的意义。但是,关于RhoB在不同类型的肿瘤中所起不同作用的分子机理还不完全清楚,不同类型的组织和细胞环境是否存在着特异性的修饰类型或修饰位点?除了DNA 损伤外,是否还存在其他生理性刺激来调控RhoB 的水平及活性?而目前RhoB 自身的水平和活性调控机制的研究也相当缺乏,亟待进一步的深入和完善。
蛋白质的翻译后修饰是调控蛋白质水平及活性的关键因素,目前已知的蛋白质翻译后修饰已达数百种,除了文中提到的已知的翻译后修饰,RhoB很可能还有许多其他尚未发现的翻译后修饰在不同的生理或病理情况下调节其水平、活性、细胞定位以及相互作用蛋白质的改变等。因此,针对RhoB的翻译后修饰进行系统深入的研究将会对了解其调控机制和生物学功能起到积极的促进作用,也是全面阐明RhoB信号通路相关的分子机理不可或缺的一环。
