人线粒体RNA加工及调控*
2023-05-16熊清平刘如娟王恩多1
熊清平 刘如娟 王恩多1,
(1)中国科学院分子细胞科学卓越创新中心/上海生物化学与细胞生物学研究所,上海 200031;2)上海科技大学生命科学与技术学院,上海 201210)
1 线粒体DNA(mitochondrial DNA,mt-DNA)的转录
人线粒体基因组是一个环状的双链DNA分子,由重链(heavy-strand) 和轻链(light-strand) 组成,共含16 569 个碱基对[1-3]。线粒体基因组共编码37 个基因, 分别为2 个线粒体rRNA(mitochondrial rRNA, mt-rRNA) 基 因、 22 个tRNA(mitochondrial tRNA,mt-tRNA)基因和13个参与氧化磷酸化过程的蛋白质基因[4-6]。线粒体DNA 以一种多顺反子的方式进行转录,其转录起始源于D-loop(displacement loop)区,包含轻链启动子(light-strand promoter,LSP)、重链启动子1(heavy-strand promoter 1,HSP1)和2(heavystrand promoter 2,HSP2)[7-8]。从LSP 起始转录的产物含有8个tRNA分子和1个mRNA(mitochondrial mRNA,mt-mRNA)分子;从HSP1起始转录的产物含有2个rRNA分子和2个tRNA分子;从HSP2 起始转录的产物含有2 个rRNA 分子、12个mRNA分子和13个tRNA分子。
一系列核编码的蛋白质因子参与线粒体DNA的转录过程,其核心转录因子有:线粒体RNA 聚合酶(mitochondrial RNA polymerase,POLRMT)、线粒体转录起始因子(mitochondrial transcription factor A, TFAM)、线粒体转录激活因子(mitochondrial transcription factor B2,TFB2M)、线粒体转录延伸因子(mitochondrial transcription elongation factor,TEFM)和线粒体转录终止因子(mitochondrial transcription termination factor 1,MTERF1)[9]。在转录开始时,TFAM 首先结合在位于转录起始位点上游的启动子处,TFAM的结合会招募POLRMT 结合在启动子上,接着进一步招募TFB2M与POLRMT的结合,组装成一个完整的转录起始复合物。关于转录起始复合物的发生机制,目前有两种说法。一种说法认为TFAM先结合到mt-DNA 上,再分别招募TFB2M 和POLRMT,但目前只有体外实验验证这种说法,没有足够的体内实验数据支持该观点[10-11]。另一种说法是TFAM先结合到mt-DNA 上,然后再招募TFB2M 和POLRMT 的复合体[11-12]。因此,线粒体编码基因转录过程中转录起始复合物的组装机制还有待进一步研究。接着,TEFM开始加入,促进转录的有序进行。关于转录的终止,之前的研究表明转录终止因子MTERF1 会结合在16S rRNA 的3'端处,从而使从HSP1 起始的转录终止[13]。而最近的研究发现,转录终止因子MTERF1 在由HSP 驱动的转录的终止中不起作用,而是负责LSP 起始转录的终止[14]。而HSP 转录的终止机制目前尚不清楚,有可能涉及其他蛋白质因子,有待进一步探究。
2 线粒体RNA的转录后加工
线粒体DNA 经过转录后获得连续的、长的多顺反子转录产物,在多顺反子转录产物中,大多数的mt-rRNA 和mt-mRNA 被mt-tRNA 间隔,称为“tRNA标点模型 (tRNA punctuation model)”[15-16],当多顺反子的前体转录产物上的tRNA 被切割下来时,rRNA 和mRNA 才能被释放出来[17]。
对多顺反子上的前体tRNA进行切割加工功能的两种酶为内切核糖核酸酶P(endoribonuclease P,RNase P) 复合体和elaC 核糖核酸酶Z 2 (elaC ribonuclease Z 2,ELAC2,也称为RNase Z),两者分别依次作用于前体tRNA 的5'端和3'端[18-20]。人线粒体中的RNase P 不同于细菌或细胞核中的RNase P——含有RNA作为催化亚基,人线粒体的RNase P 复合体是完全由蛋白质组成的异源三聚体[18,21]。最新的三级结构解析结果显示,RNase P复合体由TRMT10C (也称为MRPP1) 单体、SDR5C1(也称为MRPP2或HSD17B10)四聚体和PRORP (也 称 为MRPP3)单体组成的[22]。TRMT10C 和SDR5C1 除了作为RNase P 复合体的一部分,还分别为tRNA 甲基转移酶[23]和类固醇脱氢酶[24]。两者在行使RNase P 功能时,首先形成一个结合前体tRNA的亚复合体,再招募内切酶PRORP 通过激活核酸酶结构域发挥精确切割前体tRNA 的功能[22,25]。同时,体外实验数据表明,TRMT10C 和SDR5C1 亚复合体除了发挥RNase P的功能外,还显著提高了RNase Z 对前体tRNA 3'端的切割效率,以及促进了新生tRNA 的“CCA”加尾进程[26]。负责前体tRNA 3'端加工的RNase Z有长短两种形式的蛋白质,长形式的RNase Z(long form RNase Z,RNase ZL)定位于线粒体和细胞核中,短形式的RNase Z(short form RNase Z,RNase ZS)定位于细胞质中[27]。在人基因组中,RNase ZL和RNase ZS分别是由ELAC2和ELAC1编码的[27]。目前为止,大肠杆菌、芽孢杆菌和海栖热袍菌中的RNase ZS结构得以解析[28-30]。RNase ZS是同源二聚体,其活性中心由Zn2+依赖性金属β 内酰胺酶和作为tRNA 结合位点的突出柔性臂组成[31]。对于RNase ZL而言,只有酿酒酵母中的RNase ZL的结构得以解析。结构显示,RNase ZL是由两个金属β内酰胺酶结构域组成的,通过长接头连接。N 端结构域包含了结合tRNA 的柔性臂,C端结构域包含催化残基,两端协同发挥作用[32]。目前,人源RNase ZL和RNase ZS的结构还未被解析。当源于重链和轻链的多顺反子转录产物上的tRNA 被切 割 后,mt-rRNA 和mt-mRNA被释放出来。同时,轻链上非编码区产生的RNA 产物也被释放出来,这些RNA 为线粒体长非编码RNA(mitochondrial long noncoding RNA,mt-lncRNA),如 lncND5、 lncND6 和 lncCytb,还有一类mt-lncRNA 嵌合于线粒体的编码区中[33-34],这些mt-lncRNA被报道与细胞内信号传导以及肿瘤转化和癌症进展相关[35-38]。
在多顺反子转录产物加工过程中,除了经典的tRNA 切割方式加工以外,还有一种非经典的加工方式,针对于非mt-tRNA 间隔的mt-mRNA 的加工(如ATP8-ATP6-CO3、ND5-CYTB 和ND4-ND4L)。据报道称,参与这一过程的酶有可能为Fas激活的丝氨酸/苏氨酸激酶(Fas-activated serine/threonine kinase,FASTK)家族[39]。FASTK家族共有5个成员,FASTK1~5,各自在线粒体RNA调控中具有不同的功能[40]。其中,FASTK5被报道可能与ATP8-ATP6-CO3 的加工有关[41]。此外,FASTK4 可能参与ND5-CYTB 处的加工,FASTK4 缺失时,ND5-CYTB 的前体RNA 量增加,相应的成熟的mt-ND5和mt-CYTB 量减少[42]。对于FASTK 家族调控mt-RNA加工的机制目前还不是完全清楚,有待进一步阐述。对于线粒体多顺反子转录产物的非经典加工方式也有待进一步研究,可能还有其他的因子在其中发挥重要作用。
2.1 线粒体编码的tRNA的加工
线粒体多顺反子转录产物上的tRNA被切割下来后,这些tRNA 需要添加一系列的化学修饰和“CCA”加尾才能形成成熟形式的mt-tRNA[43]。在线粒体tRNA 中,共有18 种修饰类型,分布于137个不同的位点,平均每个线粒体tRNA 上含有6 个修 饰 位 点[44]。tRNA反密码子环中的第34 位 是“摆动”碱基,该位点的修饰对mRNA的精确识别至关重要。在线粒体tRNA中,U34可与U、C、A和G 进行识别配对,被称为“四向摆动规则”(four-way wobble rule)[45]。而U34位上的一些特定修饰可使U34只与嘌呤碱基A和G进行配对,不识别嘧啶碱基U 和C。如由MTO1 和GTPBP3 负责催化的5-牛磺酸甲基尿苷(5-taurinomethyl uridine,τm5U)修饰[46-47],以及由MTU1 在τm5U 修饰的基础上进一步催化产生的5-牛磺酸甲基-2-硫代尿苷(5-taurinomethyl-2-thiouridine, τm5S2U) 修饰[48-49]。线粒体tRNA上第34位除了有约束其识别配对能力的修饰外,也存在扩展其识别配对能力的修饰。如由NSUN3 和ALKBH1 分步进行催化的5-甲酰基胞苷(5-formylcytidine,f5C)修饰,使mt-tRNAMet第34位的C不仅可以与G配对,同时也能与A配对[50-53]。线粒体tRNA上除了第34位存在较多修饰外,第9、10位以及第37位也存在较多的修饰。第9 位的1-甲基鸟苷(1-methylguanosine,m1G) 和1-甲基腺苷(1-methyladenosine,m1A)修饰和第10位的N2-甲基鸟苷(N2-methylguanosine,m2G)修饰影响tRNA 的二级结构,同时对维持tRNA三级结构的稳定性也很重要[54-55]。第37位的修饰能促进密码子与反密码子的相互作用,抑制移码和四联密码子的产生,保证翻译的精确性和保真性[7,56-57]。如由TRIT1 负责催化的N6-异戊烯腺苷(N6-isopentenyladenosine, i6A) 修 饰[58], 由OSGEPL1 催化的N6- 氨基苏氨酰腺苷(N6-threonylcarbamoyladenosine, t6A)修饰以及TRMT5 催化的m1G 修饰等[59]。线粒体tRNA 也跟细胞质tRNA一样,其D环和TΨC环上也分别含有二氢尿苷(dihydrouridine,D) 修饰和假尿苷(pseudouridine,Ψ)修饰。其中Ψ55修饰可以调节tRNA 分子的构造和结构柔性,促进tRNA 分子的稳定性[60-62]。
线粒体tRNA 中3'端的“CCA”是没有被编码在线粒体基因组上的,需要特定的“CCA”加尾酶TRNT1 加尾[63-64]。TRNT1 对线粒体tRNA 和细胞质tRNA都有加尾作用。同时,TRNT1会对结构不稳定的细胞质tRNA进行两次“CCA”加尾,在tRNA 的3'端生成“CCACCA”,这种“CCACCA”序列是一种降解信号,使结构不稳定的tRNA被降解。因此,“CCA”加尾酶TRNT1 严格控制tRNA的质量[65-67]。但在线粒体中是否也存在同样的质量控制尚不清楚。
2.2 线粒体编码的mRNA的加工
线粒体mRNA 的加工成熟过程不同于细胞核中mRNA 的加工成熟过程。当线粒体mRNA 从前体转录产物上被释放出来后,线粒体mRNA 不需要进行5'端加帽;其次,线粒体基因组上没有内含子,因此线粒体mRNA 不需要进行剪接;此外,大部分线粒体mRNA虽然需要进行3'端的多聚腺苷酸化,形成3'端的poly-A 尾,但其通常只有45~55个核苷酸,远远小于细胞核中mRNA 的poly-A 尾的长度[68]。有研究表明,负责多聚腺苷酸化反应的酶为富含亮氨酸和五肽结构域的蛋白质(leucine-rich pentatricopeptide rich domain containing protein,LRPPRC),LRPPRC 定位于线粒体基质中,与茎环互作的RNA 结合蛋白质(stem-loop-interacting RNA-binding protein,SLIRP) 相互作用,形成LRPPRC/SLIRP 复合物[69]。据报道称,LRPPRC/SLIRP 复合物是RNA伴侣,能够稳定RNA 结构,促进线粒体mRNA 的稳定、翻译以及多聚腺苷酸化反应[70]。同时,SLIRP能够有效保护LRPPRC不被降解[71]。LRPPRC的缺失会导致线粒体mRNA的多聚腺苷酸化减少,mRNA 的稳定性降低,以及线粒体翻译异常[72]。
ND6 mRNA 是唯一一个由线粒体轻链转录得到的mRNA,其并不进行3'端的多聚腺苷酸化。FASTK能够结合ND6 mRNA 的3'非翻译区(3'-UTR),促进ND6 mRNA 的稳定和保护其不被降解。当在小鼠或培养的细胞中去除FASTK 时,导致ND6 mRNA 的表达水平下降以及线粒体复合物I的活力降低[73-74]。
目前为止,关于线粒体mRNA 上修饰的报道比较少,尚且只有关于m1A修饰的报道。TRMT61B负责催化mt-CO1、mt-CO2、mt-CO3、mt-CYB 和mt-ND4L 的mRNA 上的m1A 修饰。当在细胞中过表达TRMT61B基因时,mt-CO2 和mt-CO3 的蛋白质表达水平上升[75]。此外,mt-ND5 mRNA上也存在m1A 修饰,是由TRMT10C 负责催化修饰,其m1A 修饰的含量是所有mt-mRNA 上最高的[75-76]。据报道称,mt-ND5 mRNA 上的m1A 的修饰水平具有高度的组织特异性,由于m1A修饰破坏了A∶U配对,会导致翻译异常[76]。
2.3 线粒体编码的rRNA的加工
线粒体rRNA被释放出来后,需要进行转录后修饰才能参与核糖体的组装[77]。在线粒体12S 和16S rRNA中共含有10个转录后修饰位点,其中包含9 个甲基化修饰位点和1 个假尿嘧啶修饰位点(表1)。这些修饰能够促进线粒体rRNA 的加工和核糖体的组装。当催化m62A936 和m62A937 的TFB1M 缺失时,会导致核糖体小亚基的稳定性下降,12 rRNA的降解速度加快[78]。催化Um1369修饰的MRM2 表达量下降时,使线粒体核糖体大亚基的数量减少,这种数量的减少可能是由于39S的稳定性下降导致的[79]。此外,当催化16S rRNA和mt-tRNAPhe上Ψ 修饰的RPUSD4 的表达量下降时,会导致16S rRNA 和核糖体大亚基的数量减少,从而导致线粒体翻译受损[80],但并不影响mt-tRNAPhe的稳态和氨基酰化[81]。线粒体rRNA的修饰之间可能也存在交互作用(crosstalk)。当催化m4C839 修饰的METTL15 表达量降低时,由NSUN4 催化的m5C841 修饰水平也下降,并且这种修饰水平的下降可以通过再次表达METTL15 而得到回补[82-84]。此外,线粒体甲基转移酶METTL17 的缺失,会引起m4C839 和m5C841 的修饰水平都下降[84],但METTL17的催化底物目前尚不清楚。
此外,这些线粒体rRNA修饰酶除了发挥催化修饰RNA 的功能,还参与其他过程。例如,TFB1M 能够参与转录的激活,但并不依赖其甲基转移酶活力[85]。NSUN4 会与MTERF4形成复合物,与核糖体大亚基相互作用,促进核糖体的组装[86-87]。但MTERF4 并不参与NSUN4 对核糖体小亚基中12 rRNA 的催化过程[88]。MRM3 还是线粒体小亚基中的成员之一,同时还是一个RNA伴侣[89]。
线粒体rRNA被修饰后,许多蛋白质因子会将这些成熟的rRNA与核糖体蛋白质组装起来,形成核糖体亚基[90]。
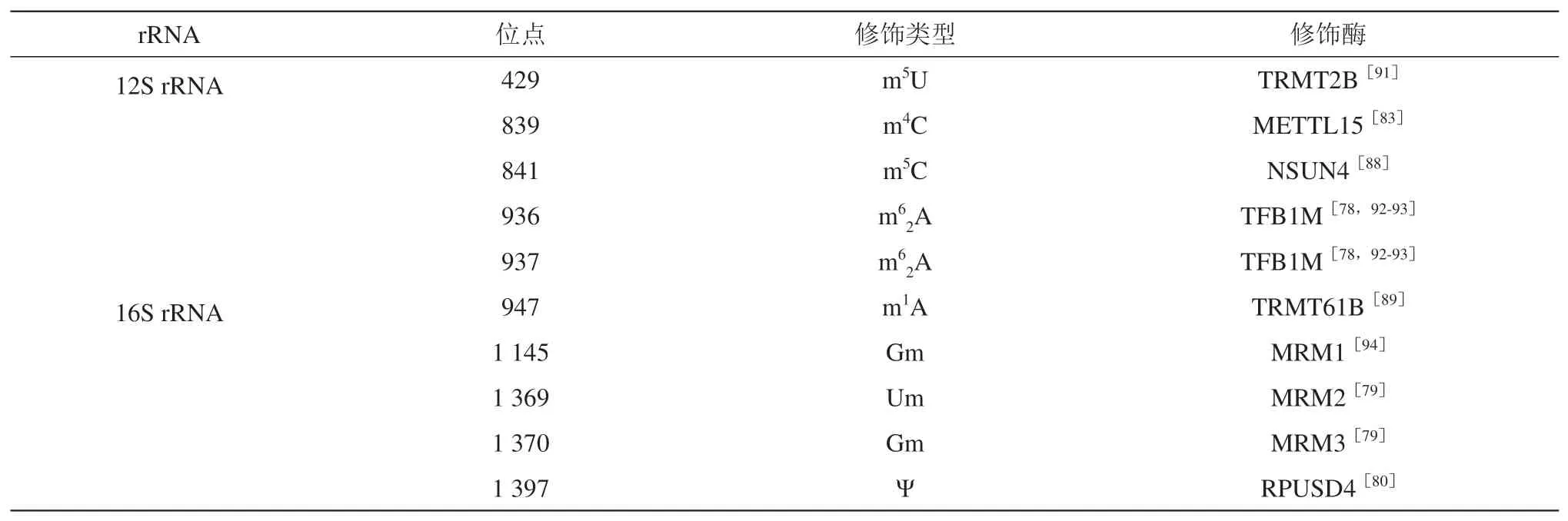
Table 1 Post-transcriptional modifications of mitochondrial rRNA表1 线粒体rRNA的转录后修饰
3 影响线粒体RNA加工的因素
线粒体RNA的正确加工对线粒体内RNA与蛋白质的生成至关重要,是线粒体发挥正常生理功能不可或缺的部分。线粒体RNA 的加工异常不仅影响线粒体的正常功能,甚至还会引发各种各样的疾病。根据目前的研究,从以下3个方面来阐述影响线粒体RNA加工的因素。
3.1 线粒体基因组DNA的突变
与核基因组DNA相比,线粒体基因组DNA的突变率更高[95]。线粒体DNA突变的诱因可能是线粒体基因组DNA 容易被活性氧自由基损伤,并且由于缺少组蛋白的保护而容易发生突变[96-97],此外,氧化应激也能影响线粒体复制酶的活性,导致突变率增加[98]。其次,早期研究认为线粒体中缺乏重要的核酸修复机制也是引起线粒体DNA 突变率高的因素[99]。线粒体DNA突变率高可能是由多方面的共同影响造成的。线粒体基因组DNA 上有部分突变会导致其转录的长顺反子上的前体tRNA不能被RNase P 或RNase Z 正确识别并切割,从而影响线粒体RNA 的正常加工过程,继而引发各种疾病。
与耳聋相关的线粒体7516delA 突变的研究显示,7516delA 突变会使由轻链转录而来的mt-tRNAser(UCN)前体的5'端缺失一个“U”,同时,使由重链转录而来的mt-tRNAAsp前体的5'端缺失一个“A”。这两个前体tRNA的5'端核苷酸的缺失使得RNase P 对其5'端的切割效率下降,还使下游其他成熟的tRNA和mRNA水平降低,以及导致线粒体翻译受损,膜电位降低和活性氧增加等[100]。此外,与高血压相关的线粒体4401A→G突变位于编码mt-tRNAGln和mt-tRNAMet基因的间隔区,导致RNase P 催化mt-tRNAGln和mt-tRNAMet前体5'端加工效率降低。同时,4401A→G 突变还导致多种mt-tRNA 和ND6 mRNA 水平的降低,以及轻链转录本中较长的未切割前体RNA 的增加[101]。影响RNase P 切割效率的线粒体突变还有12207G→A[102],3249G→A和4269A→G[103]等。
此外,据报道称,线粒体5587A→G突变能够造成莱伯氏遗传性视神经病变。这种突变使mt-tRNAAla上第73位的“A”突变为“G”,体外实验 证 明5587A→G突变影响了RNase Z 对mt-tRNAAla前体3'端的加工,使得mt-tRNAAla前体积累,成熟形式mt-tRNAAla减少。同时,抑制了TRNT1 对mt-tRNAAla的“CCA”加尾过程。此外,还影响了线粒体翻译和氧化磷酸化复合物的组装等[104]。影响mt-tRNAAla前体的加工可能是造成莱伯氏遗传性视神经病变的原因。同样,人线粒体3302A→G 突变可导致肌无力、乳酸性酸中毒和二型糖尿病等。小鼠线粒体2748A→G突变与人线粒体3302A→G突变同源。以小鼠为动物研究模型的实验发现,线粒体2748A→G 突变使mt-tRNALeu(UUR)上第71位的“A”突变为“G”,造成线粒体RNA 加 工异常,mt-tRNALeu(UUR) 和ND1 mRNA 前体积累,成熟的mt-tRNALeu(UUR)和ND1 mRNA 减少。同时,引起代谢缺陷、高血糖和胰岛素不敏感等病理性特征[105]。
3.2 线粒体RNA加工相关酶的突变
RNase P 和RNase Z 分别参与线粒体多顺反子转录产物中mt-tRNA前体5'端和3'端的切割加工过程[106]。 RNase P 是 由TMRT10C、 SDR5C1 和PRORP 组成的异源三聚体[18,21]。RNase P 复合物和RNase Z中的突变会影响两者对mt-tRNA前体的切割效率,导致线粒体多顺反子转录产物的加工异常。
据报道称,TRMT10C 编码基因的突变会导致婴儿在出生时表现为乳酸性酸中毒、肌张力减退和耳聋等症状,影响婴儿的正常发育。来自携带TRMT10C 错义突变基因的个体的成纤维细胞显示mt-tRNA 前体的稳态水平下降,线粒体RNA 加工受损以及线粒体蛋白质翻译效率降低[107-108]。此外,SDR5C1编码基因的一种新的突变可以导致顽固性癫痫和全局性发育迟缓。经研究发现,这种突变的致病性是由于成熟形式的mt-tRNA 减少,从而引发一系列线粒体功能障碍所导致的[109]。PRORP基因突变的个体表现为神经性听力损失、发育迟缓和脑白质改变等。经实验研究发现,来自基因突变的患者的成纤维细胞中的PRORP 表达量下降,线粒体转录本前体累积以及线粒体编码的蛋白质稳态水平下降,这些现象都可以通过表达野生型的PRORP而得到回补[110]。
之前研究表明,ELAC2 基因突变可以导致婴儿肥厚性心肌病。经实验发现,ELAC2 基因突变会使mt-tRNA前体积累,线粒体复合物I的表达量减少以及线粒体翻译受损[111]。
除RNase P 与RNase Z 以外,其他与线粒体RNA 加工相关的酶的突变也会引起线粒体RNA加工紊乱。GRSF1(G-rich sequence factor 1)是一种RNA 结合蛋白,能结合新合成的线粒体RNA,并且与RNase P 相互作用[112]。GRSF1基因敲除使线粒体RNA 的稳定性发生改变,导致线粒体编码的蛋白质的表达量减少和线粒体功能障碍[112-113]。此外,PTCD1 作为一种线粒体基质蛋白质,与ELAC2相互作用,对线粒体多顺反子转录产物3'端的加工发挥重要作用[106]。敲除PTCD1后,mt-tRNA 前体增加;过表达PTCD1时,mt-tRNA前体减少。且当PTCD1 的表达量减少时,几种线粒体编码蛋白质的水平和复合物IV 的活性增加[112]。在斑马鱼模型中,线粒体tRNA 修饰酶 MTO1 与 MTPAP (mitochondrial poly (A)polymerase)相互作用,MTO1基因敲除使MTPAP的表达量降低,导致线粒体mRNA 的多聚腺苷化下降,影响线粒体编码的相关蛋白质的表达水平和线粒体氧化磷酸化水平[114]。
3.3 线粒体RNA修饰的改变
线粒体RNA 上存在众多的修饰,这些修饰对线粒体RNA 的加工也至关重要。据报道称,ALKBH7 能够对线粒体新生的线粒体多顺反子RNA 中的mt-tRNAIle和mt-tRNALeu(CUN)去甲基化m2
2G26 和m1A58。ALKBH7 的去甲基化作用能够调节线粒体多顺反子RNA 的结构动力学和加工过程。敲低ALKBH7基因,导致线粒体多顺反子RNA加工异常,线粒体编码的tRNA稳态水平和蛋白质翻译水平都降低,线粒体活性也显著下降。ALKBH7 作为一种线粒体RNA 的去修饰酶,通过改变线粒体RNA 的修饰水平来调节线粒体新生RNA的加工和线粒体活性[115]。
与耳聋相关的线粒体4295A→G突变的研究显示,4295A→G 突变导致mt-tRNAIle上的t6A37 修饰变成m1G37 修饰。体外实验数据表明,4295A→G突变使RNase P 对mt-tRNAIle前体的5'端的催化效率降低,tRNA 代谢异常,线粒体翻译受损等,这些影响可能是源于tRNA上37位修饰的改变[116]。
此外,有文献报道称,线粒体tRNA 中第9 位的m1A和m1G修饰能够影响线粒体的tRNA正确折叠,从而影响线粒体多顺反子的切割和下游蛋白质的翻译[117-119]。同时,通过分析大量RNA 测序数据,发现线粒体tRNA 中第9 位的甲基化水平与tRNA 的5'端的加工速率存在正相关性,这表明线粒体多顺反子转录本和转录后修饰之间存在联系,以及第9 位的甲基化水平与多顺反子RNA 的切割是耦合的[120]。
除了线粒体tRNA上的修饰影响线粒体RNA加工以外,线粒体rRNA 修饰作为线粒体rRNA 加工的重要环节,rRNA 修饰的缺陷也会影响rRNA 的加 工[121]。例 如: 12S rRNA 上 的m26A936 和m26A937 修饰减少,会导致12S rRNA 加快降解[121];16S rRNA 上的Ψ 修饰减少,会导致16S rRNA的表达量下降[80]。
4 总结与展望
与核基因组相比,人线粒体基因组非常小,但其基因组上每个基因的精确转录和翻译对细胞的正常生长至关重要。线粒体基因组的重链和轻链被转录成多顺反子RNA,经过酶切处理后释放出3种不同类型的RNA:mt-tRNA、mt-rRNA和mt-mRNA,这些RNA被进一步加工成为成熟形式的RNA分子并发挥作用。在线粒体RNA 加工过程中,某些因素会造成RNA 加工异常,影响线粒体正常生理功能,继而引发线粒体相关疾病(图1)。此外,线粒体RNA 中除了这3 种主要的RNA 以外,还有其他非编码RNA 的存在,如lncRNA、miRNA、piRNA 以及circRNA。这些线粒体非编码RNA 可能是由核基因编码的,也可能是由线粒体基因编码的,参与线粒体的基因表达、氧化还原调节和蛋白质运送等过程。但是目前对线粒体非编码RNA 的了解还不够深入,如线粒体非编码RNA 的鉴定、来源于线粒体基因组的非编码RNA 的生成过程以及线粒体非编码RNA 的转运机制等,都亟待深入地研究。
在过去几十年,研究者们对线粒体RNA 的加工进行了深入的研究并有了一定的了解,但在线粒体RNA 加工过程中仍有些悬而未决的问题亟待解决。线粒体RNA 加工是一个复杂且广受调控的过程,尽管随着研究的不断深入,影响线粒体RNA加工的因素不断被发现和报道,但是关于线粒体中RNA 加工的分子机制以及影响因素还有待未来更深入的研究。
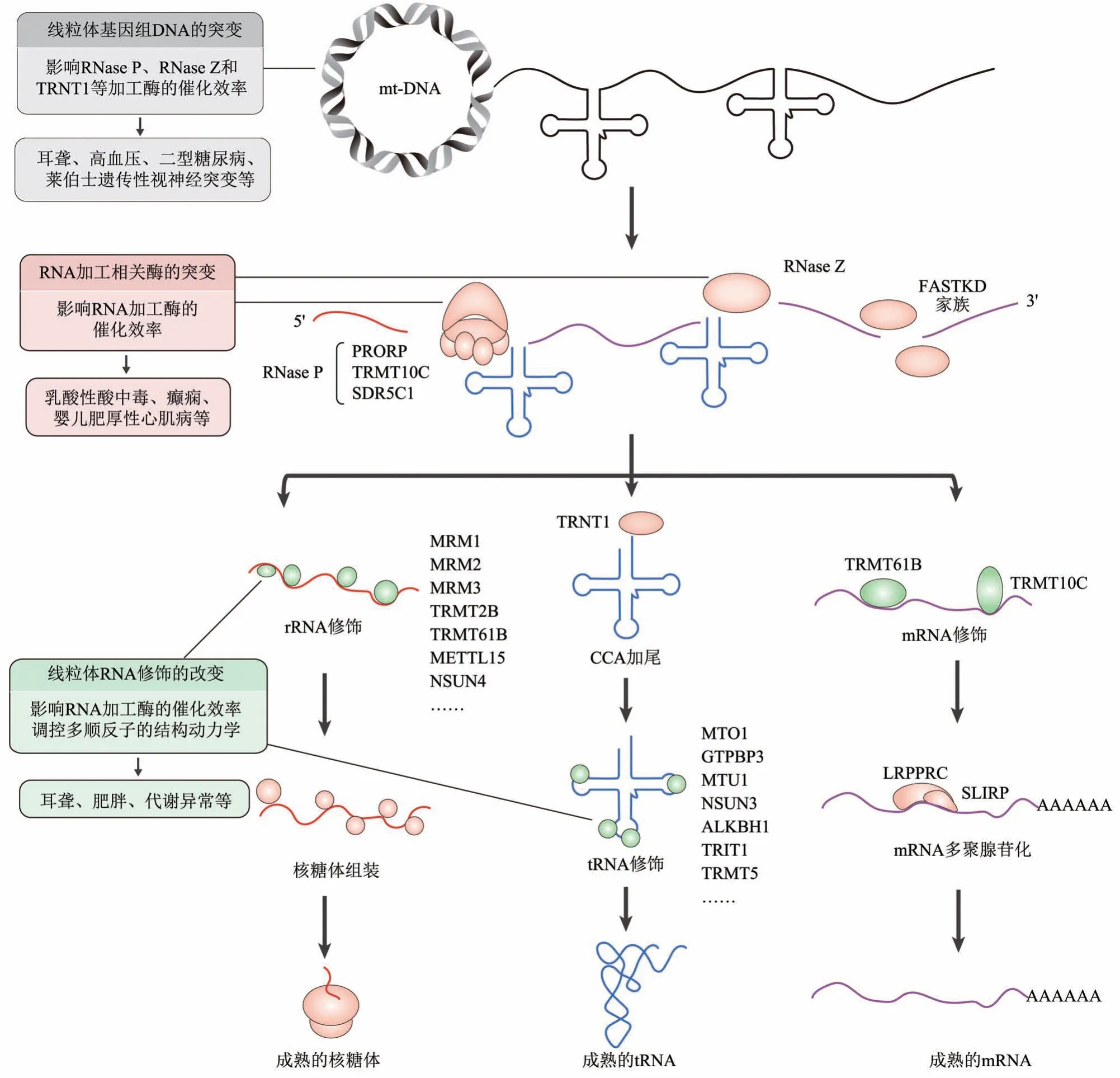
Fig. 1 Overview of human mitochondrial DNA transcription,RNA processing and loss-of-function mutation图1 人线粒体DNA转录、RNA加工及功能突变的全局图
