缓步动物热溶性蛋白的独有特性及其在极端环境适应中的功能*
2023-05-16王泽峰
王泽峰
(中国科学院上海营养与健康研究所,上海 200031)
水是生命之源,在细胞生命活动与新陈代谢反应中必不可少。但在低温下,水结成的冰晶会破坏细胞结构并造成生物大分子不可逆的损伤,也是生命体脆弱的根本原因[1]。而某些生物的细胞在大幅度脱水后, 可以进入一种叫做隐生(cryptobiosis)的特殊状态[2-3],使细胞脱水萎缩并停止新陈代谢,从而可以允许其在极端条件下生存多年。这类生物对极端环境的适应,依赖于其细胞在脱水后进入隐生保护状态并在遇水补液后进行复苏的能力[3]。通过隐生状态来适应极端环境,目前只发现于细菌、真菌、原生生物、植物和一些低等动物中,而人类等高等动物缺乏类似的适应能力。然而,实现对人体细胞、器官或个体的隐生保护和极端条件适应,在生物医学等领域有着重要用途。
大多数耐干燥的生物是通过在体内积累非还原糖类(主要为双糖)的方法来保护细胞,以免其受到干燥脱水所引起的损伤[4]。这类非还原双糖主要包括蔗糖(sucrose)与海藻糖(trehalose)[5-6]。海藻糖在许多耐干燥植物、真菌或一些节肢动物中的含量非常高,可达干重的20%[7],并且已经被证明对这类生物的极端条件耐受能力有着重要作用[8]。双糖保护长期被认为是可脱水生物的普遍特性,尤其是在植物种子和微生物的脱水冷冻中发挥重要作用,其原理也被用于高等动物细胞的冻存技术。然而,动物细胞本身无法合成此类双糖。
近年来,在一些适应极端条件的动物(如缓步动物与轮虫)研究中发现,这些动物在脱水过程中并不存在双糖的高浓度积累,而是以表达抗冻蛋白的形式提供脱水保护。这类生物所表达的抗冻蛋白是一类含有大量重复序列的内在无序蛋白(intrinsically disordered proteins,IDP,也称内在紊乱蛋白),可通过不同途径高效地结合并固定水分子,从而保护蛋白质复合体和细胞膜等关键生物大分子结构,对极端条件带来的细胞损伤起到脱水保护效果[9-10]。这类生物中,缓步动物以其在极端环境中生存的能力而闻名,其可以适应干燥[9]、冰冻[11]、强辐射[12]、极端压力[13]和151°C 的高温[14]等极端环境。近年来,研究人员在其基因组中发现了3 个特有的IDP 蛋白新家族。这3 个蛋白质新家族包括细胞质丰富热溶蛋白(cytosolicabundant heat-soluble proteins,CAHS)、分泌型丰富热溶蛋白 (secretory-abundant heat-soluble proteins, SAHS)和线粒体丰富热 溶 蛋 白(mitochondrial-abundant heat-soluble proteins,MAHS),统称缓步动物紊乱蛋白(tardigrade disordered proteins,TDP),在缓步动物的极端环境适应中起到了脱水保护作用[15]。TDPs是缓步动物所独有的,除了高度无序的特征之外,其内部3个家族彼此并不相似。这些缓步动物的热溶蛋白可以说是广义上的抗冻蛋白中的一类。尽管有研究初步证明,热溶蛋白可以帮助细胞适应高渗透压等极端环境,但是对这类蛋白质的性质和功能研究尚处于初期阶段。其在极端条件下对细胞的脱水保护作用机理有很多未知的问题,尤其是一些关键的基本问题,例如这些热溶性蛋白特有的内在序列怎样决定了其结构?其三维结构在脱水和复苏过程中怎样变化?尚待进一步解答。而这些问题的研究,将促进热溶蛋白在生物医学上的广泛应用。
1 热溶性蛋白基本特征
通常情况下,水溶液中多数蛋白质在超过50°C的温度下会发生变性,形成蛋白质聚集沉淀。多数情况下蛋白质的变性伴随着一个不可逆的蛋白质失活过程,而酶蛋白的活性中心与其他区域相比通常对变性更为敏感[16-17]。不同蛋白质发生热变性温度也大有差别,而一些蛋白质在高温下仍然可以保持稳定的结构并具有活性。其中一个著名的例子就是嗜热细菌中发现的Taq DNA 聚合酶,在70~80°C 可以发挥最优的活性[18],被广泛应用于聚合酶链反应(PCR)反应中。而有一类特殊的热溶性蛋白(heat-soluble proteins)是分子质量较小的内在无序蛋白,它们的序列中富含大量的亲水氨基酸,形成无结构区域,具有很高的亲水性和热稳定性,可在超过90°C 的高温水溶液甚至煮沸条件下保持水溶状态而不发生聚集沉淀。含有大量内在无序序列的抗冻蛋白也具有热溶性质,因此也可归于这一类热溶性蛋白。
在植物基因组中大量存在的胚胎发生晚期丰富蛋白(late embryogenesis abundant protein,LEA)就是这类热溶性蛋白的代表。LEA 蛋白的编码基因在植物种子胚胎发育晚期表达升高,而在干旱、低温、盐胁迫、紫外辐射等极端应激条件下其mRNA 也会大量累积[19]。LEA 蛋白在细胞中可以稳定细胞膜结构,作为水分子伴侣具有结合不同离子和防止氧化等作用,也被认为是在极端环境中对植物起保护作用的关键分子,并在植物脱水抗旱抗冻中起到重要作用[19]。为了研究缓步动物中是否存在类似的热溶性蛋白,东京大学的Kunieda 团队[20]将具有耐脱水性质的缓步动物Ramazzottius varieornatus碾碎经高温处理后(92°C,15 min),进行全蛋白质组的测定,发现了两类新型的含量丰富的热溶性蛋白,分别存在于细胞质中或被分泌到细胞外,因此称为CAHS 和SAHS。之后又发现了富集于线粒体的MAHS[21]。之后通过序列分析,在其他的缓步动物种类中也发现了类似的热溶性蛋白家族并发现了它们在脱水保护中有着重要作用[9]。
这些热溶性蛋白为缓步动物独有,除了热溶性外每个蛋白质家族彼此间并不具有序列保守性或结构相似性。在同一个家族中的成员间有较好的结构相似性(或者说具有共有的结构特征),而序列相似性并不高,但都包含有一些在本家族中保守的蛋白质结构域(conservative domain)(图1)。由于缓步动物基因组的标注尚不完备,目前每个热溶性蛋白家族中包含的蛋白质成员数目尚不清楚。以模型动物Ramazzottius varieornatus为例,至少发现了16种CAHS 蛋白、13 种SAHS 蛋白和两种MAHS 蛋白,同时还有多个基于保守序列预测的LEA 蛋白家族的成员[22]。这些蛋白质的功能和机制研究才刚开始,目前的分析结果都表明,它们在脱水等极端条件下的生存中可能起到极为重要的作用。
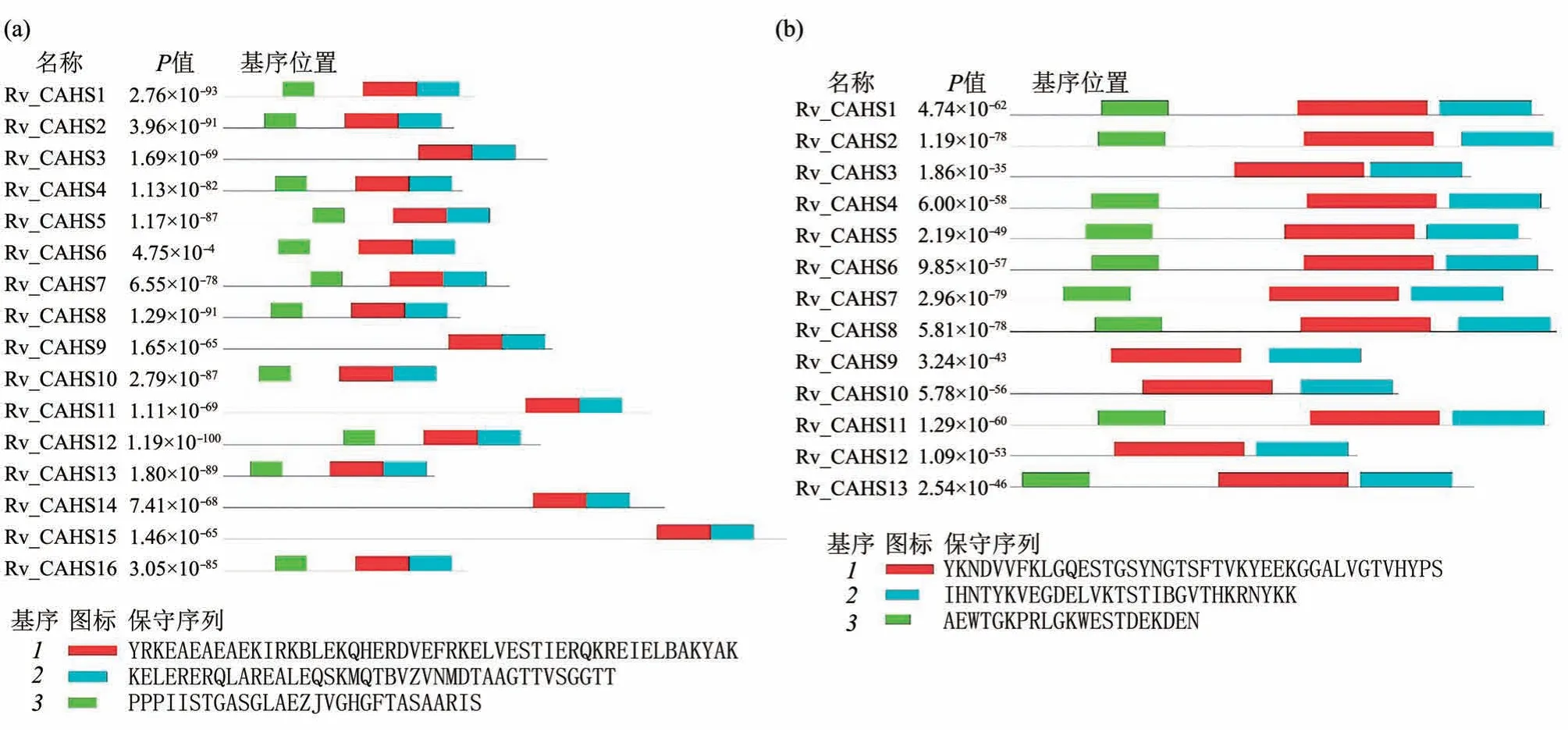
Fig. 1 The sequence features and conserved motifs of the CAHS and SAHS proteins in Ramazzottius varieornatus图1 缓步动物Ramazzottius varieornatus中的CAHS家族(a)和SAHS家族(b)的蛋白质成员序列特征
2 细胞质丰富热溶蛋白(CAHS)
CAHS蛋白是最早发现的两种TDP之一,长度通常在200~300个氨基酸之间。其在脱水时表达量升高,CAHS蛋白被发现可以保护其他蛋白质免受脱水所引起的损伤。这表明CAHS蛋白可能在缓步动物中发挥着维持蛋白质稳定性的重要作用[9]。在酵母中人工表达CAHS蛋白后也可以提高细胞的脱水耐受[9]。其主要序列特征是在N端和C端有两个内在无序区域,而中间是一个较长的coil-coil区域可形成一个α 螺旋(根据Alphafold 预测,图2a)。此外在N 端有着相对保守的ASAAR(I/VI)S 的序列,而其他区域的序列为此类蛋白质特有。富含α螺旋和无序结构的蛋白质构架,也在LEA蛋白等已知的脱水保护蛋白中大量存在。根据结构可以推测,CAHS 蛋白两边的无序区域可以相互结合,而中间的α螺旋可以在脱水时变得更稳定,形成纤维样的超级网格结构(类似于无规蛋白的“相分离”)。这样的结构有利于将水分子吸附固定,防止其在低温时形成较大的冰晶。
CAHS蛋白在脱水过程中,可以通过多种互不排斥的潜在机理发挥对细胞内蛋白质和核酸等生物大分子的保护作用。简言之,CAHS蛋白可以在脱水过程中通过特定的结构变化,来介导细胞质的玻璃化(vitrification)过程。在此过程中,缓慢脱水导致剩余的水分子被相对均匀地固定限制在细胞质不同区域中,使得细胞黏度平稳增加,成为介于经典液态和固态间的非晶玻璃态,同时蛋白质、核酸等大分子被可逆地“冰冻保护”在一种活性结构状态,而不是因为脱水造成结构坍塌变性。细胞的玻璃化是其在脱水冰冻条件生存的主要机理,在玻璃化过程中通常需要一种分子介质作为“分子伴侣”来缓冲失水导致的氢键丧失以及细胞质内的黏度变化。植物中的双糖(蔗糖或海藻糖)是已知的很好的玻璃化介质,在不同系统中可以起到脱水冰冻保护作用[23]。而广泛存在于细胞质中的CAHS蛋白,也可以起到类似作用。近期的研究表明,缓步动物的脱水过程中可以发生玻璃化,而这种玻璃化是其在极端条件下生存的必要条件[24]。然而此方向的研究刚刚开始,有大量未知问题需要解答。
失水过程可以造成的水分子和蛋白质间的氢键丧失,而产生的游离亲水基团间可能发生氢键重构,从而破环蛋白质结构。在细胞质玻璃化过程中,CAHS蛋白可能通过介导蛋白质大分子的水取代(water replacement)和优先水化(preferential hydration)来进行脱水保护。水取代假说提出,在细胞中广泛表达的CAHS蛋白中含有大量的亲水集团,它们可以和其他蛋白质形成氢键来取代水分子,从而保障脱水时维持蛋白质的基本结构;而优先水化假说提出,在细胞脱水时尽管水分子大量流失,许多关键蛋白质分子的表面亲水区域仍保留一个水化层来锁定部分水分子,从而维持其结构与功能。作为脱水保护蛋白,CAHS蛋白可以锁定一部分水分子,在它和其他蛋白质间造成一个优先水化层,从而协助其他蛋白质保持稳定结构。
最新研究表明,CAHS蛋白在体外可在高渗胁迫下可逆聚合成许多细胞骨架样纤维,并可进行可逆凝胶转化,同时还增加细胞硬度来抵消因脱水的渗透压改变引起的细胞收缩,从而提高了高渗胁迫下的存活率[15]。缓步动物细胞内存在大量的CAHS 蛋白,但目前还不知道是否不同的CAHS蛋白间在功能上是否可以互相替代。不同CAHS蛋白有可能在不同细胞类型中起作用,或者对不同种类的蛋白质进行脱水保护。此外,在脱水过程中不同的CAHS蛋白也许可以在不同阶段发挥作用。这些都是未来需要进行研究的问题。
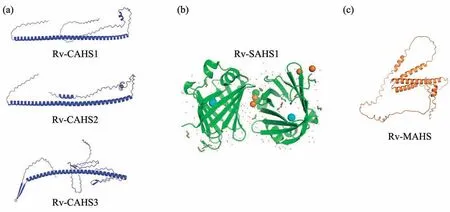
Fig. 2 Common structure of different types of TDP using the CAHS,SAHS and MAHS in Ramazzottius varieornatus as examples图2 以Ramazzottius varieornatus 中的三个TDP家族为代表,简示CAHS、SAHS和MAHS蛋白的典型结构特征
3 分泌型丰富热溶蛋白(SAHS)
与 CAHS蛋白相比,SAHS蛋白中的无序序列较少,因此是目前唯一可以通过晶体衍射来研究其结构的TDP[25-26]。SAHS蛋白家族和哺乳动物中的脂肪酸结合蛋白(fatty acid binding proteins,FABPs)有一定的序列保守性和较高的结构保守性。以RvSAHS1 的晶体结构为例,SAHS 蛋白主要是由大量β 折叠组成了β 桶状结构,并在β 桶的顶端有个由2 个α 螺旋和1 个转角结构(helix-turnhelix)形成的“盖子”结构域(图2b)。SAHS 蛋白在水化条件下的结构通常是富含β折叠,但在失水时转为更富含α 螺旋的状态[20],这种结构转化对脱水保护的作用尚不清楚。SAHS蛋白的N端有着介导细胞外分泌的信号肽序列,因此SAHS主要富集在细胞膜外和细胞间质中,此外定位在各类细胞内膜中(如内质网、高尔基体),但不清楚这种内膜定位是否只体现了蛋白质分泌路径的中间步骤。SAHS蛋白这种特有的定位方式,让人容易假设它们在脱水过程中发挥着保护细胞膜的作用。
类似于脂肪酸结合蛋白FABP,SAHS也有2个富含极性氨基酸的配体结合位点(ligand binding site,LBS)。这些LBS通常被认为是蛋白质结合脂肪酸的位点,但对FABP的研究表明,此类配体结合位点有较灵活的结合特异性,可以结合脂肪酸之外的多种分子[27]。因此SAHS 很可能通过这类位点来结合细胞膜和细胞间质中的多种分子,从而在脱水过程中固定这些分子的相对位置,从而达到保护细胞间结构的作用。此外,SAHS蛋白倾向于形成多聚体,而晶体结构中SAHS也是以二聚体的形式存在[25-26]。因此,一种可能的机理是SAHS 蛋白在细胞膜外通过多聚化形成纤维状骨架,这种蛋白质纤维骨架在脱水时可能起到类似于细胞壁的作用,从而保护多细胞结构的稳定性。
4 线粒体丰富热溶蛋白(MAHS)
在3 种TDP 家族中,MAHS 蛋白在自然界中最为特别,目前在其他生物中尚未发现有类似的蛋白质序列,只是和某些LEA 蛋白有些较远的相似度。比起CAHS和SAHS来,MAHS 蛋白家族的成员较少,但是很可能在脱水过程中起到一个极为关键的作用——保护线粒体的完整性。作为细胞内重要的能量工厂,线粒体双层膜的完整性是氧化呼吸链反应的必要条件,也是细胞存活的关键因素。高等动物中线粒体双层膜遭到破坏后会使细胞发生凋亡或焦亡。在极端条件下的隐生状态需要将氧化呼吸链反应暂停,在此过程中线粒体由于脱水而缩小,而在复苏恢复期需要重启此反应,也需要线粒体恢复正常状态。而线粒体损伤不仅会影响代谢反应,而且会释放活性氧(reactive oxygen species,ROS)来导致细胞内其他分子的损伤。因此,保护线粒体双层膜的完整性对脱水保护至关重要。
MAHS 蛋白的结构中具有大量的无规序列区域和α 螺旋。结构预测表明,MAHS 蛋白由5 个α螺旋组成一个较松散的结构核心,而α螺旋间有大量的无规区域组成蛋白质外围(图2c)。这种结构可以让人们假想MAHS 蛋白像一个具有较大弹性的球,而α 螺旋可以在两边具有疏水面和亲水面,从而分散嵌入线粒体膜中。在线粒体脱水过程中,线粒体膜表面面积变小可以发生收缩,使膜脂的极性头部紧密堆聚(pack)在一起形成胶状状态[28]。由于失去水分子过程的随机性,这种收缩将会在局部导致线粒体膜产生不均一的孔洞。而吸水过程正好相反,线粒体膜的吸水扩展形成流动性较高的液晶状态[29],而从胶状到液晶状态的转变如果发生不均匀的变化,也会造成线粒体膜的局部孔洞[29]。因此,一个可能的机理就是,MAHS 蛋白的嵌入,可以作为缓冲介质有效地平衡线粒体膜的收缩和扩展过程中的局部不均一性,使得线粒体膜在失水变为胶状过程中仍保有较好的流动性。当然,MAHS蛋白也很可能同时与线粒体膜上的蛋白质相结合,从而保护这些膜蛋白在脱水过程中的结构稳定性,从而减少由于线粒体膜蛋白的结构变化导致的线粒体损伤。这些假想的机理并不互斥,反而有可能同时起作用。
5 TDP在极端环境适应中的潜在应用
作为缓步动物特有的内在无序蛋白,TDP 的功能和机理研究尚不深入。一系列重要的问题尚待回答,包括其进化历史是什么?为什么不同家族中的成员数目相差很多?TDP 表达是否受到极端环境诱导?同一家族的不同成员间是否有功能的冗余和互补性?不同TDP 是否可以相互结合形成异质性纤维骨架?不同种缓步动物间它们的TDP 是否可以跨种发挥作用?缓步动物TDP 是否可以在其他动物中发挥类似作用?这些问题的解答将有助于理解它们超强的对极端环境能力,并可能带来一系列潜在的创新性应用。
首先,这些TDP 在干燥条件下可以对细胞进行脱水保护,使其可以作为细胞冷冻保存介质来发挥作用。目前,细胞的常规保存方法主要有液体保存法(4℃)和超低温保存法(-80℃或-196℃)。液体保存法(4℃)保存时间短,且易受到细菌污染;超低温保存可长期保存,但需要昂贵、笨重的低温设备,而且由于保护液中含有渗透性保护剂,解冻后需要反复洗涤,对细胞状态产生影响。冷冻干燥法(冻干法)是目前很有潜力的一种新型保存细胞的方法。其是将含水物质在低温下冻结,然后在真空条件下通过对冻结物质加热,使其中的水分直接升华而获得干燥物质的技术,为细胞的长期保存提供了一种新的选择。经冷冻干燥的细胞将能够在常温下长时间保存,并且容易重新复水而恢复活性,大大减少了运输与保存的不便,优点显著。然而,绝大多数细胞对低温、干燥这类极端条件非常敏感。在这些极端条件的发生过程中,细胞的物理与生理状态均会发生变化,细胞内各亚细胞器的功能活性也会受到影响(主要是水的形态变化和失水造成损伤)。同时,细胞活力也会明显下降。如何能够减少细胞组分变性、保持细胞活性,是当前细胞冻干保存研究的重点与难点。目前冷冻干燥技术多见于对血小板、红细胞等特殊的无核细胞保存研究上,而几乎没有对其他有核细胞的研究。而TDP 有可能作为冷冻干燥的保护性介质,在细胞保存中发挥重要作用。
类似的潜在应用,可以进一步在高等动物细胞内通过外源表达TDP,建立并改造此类细胞保护系统,从而赋予动物细胞超常的极端环境下生存能力,实现在干燥条件下对不同温度的适应,实现长期保存与复苏。内在无序蛋白在高等动物的基因组中也是大量存在,并通过介导细胞中液相分离来发挥重要生理作用。同时一些无序蛋白也是受细胞应激状态调控的,有潜在的脱水保护作用。利用TDP对哺乳动物细胞进行改造,有望获得适应极端条件的具有不同功能的工程化细胞,甚至可以赋予整个器官更好的极端环境适应能力,在器官移植中实现供体器官的脱水保存和复苏。
最后,对完整人体进行休眠和复苏是很久以来的理想,在一些古代传说中,就认为人死后进行脱水干燥可以保护躯体让其复活。而在现代冷藏技术发明以来, 也开始了对尸体的冷冻保存(cryonics),以期未来有技术将其复活。自1967 年James Bedford 作为第一个尝试者将自己的尸体进行冷冻保存之后,至2015年已有超过1 500人立下遗嘱进行尸体冷冻。然而,对于刚死去的人进行冷冻时,细胞已经有了不可逆的损伤。所以尸体冷冻保存复苏的技术目前看来可能只是一种幻想。而对于健康人在低温条件下的休眠和复苏,却是一个有望实现的未来技术,或将在医学领域和未来宇宙探索与星际移民中发挥极其重要的作用。而对缓步动物的极端条件耐受机理研究和工程改造,为此类技术的实现提供了一个潜在的路径。
