补肺益肾组分方Ⅲ对大鼠实验性肺动脉高压的改善作用
2023-05-06任周新余海滨梅晓峰董浩然沈俊岭李建生
任周新, 余海滨, 梅晓峰, 董浩然, 沈俊岭, 李建生
(1.河南中医药大学呼吸疾病中医药防治省部共建协同创新中心药理平台,河南 郑州 450046;2.河南中医药大学中医药科学院,河南 郑州 450046;3.河南中医药大学第一附属医院河南省病毒性疾病中医药防治重点实验室,河南 郑州 450000)
肺动脉高压(pulmonary hypertension,PH)是肺血管阻力和肺动脉压力异常升高的病理生理综合征,可继发成为右心衰竭(right heart failure,RHF)。肺部疾病和(或)低氧所致的PH 是临床最常见的PH 类型之一,其中慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是最常见的病因[1-3]。COPD 并发PH 的患者预后更为凶险,死亡率更高。但目前临床指南推荐的治疗方法仅有针对COPD 的长程氧疗[1]。理论上,干预肺血管的异常病变或扩张肺血管有益于患者的治疗,但临床上由于该类疾病的复杂性,针对肺血管重构或降低肺动脉压的药物应用存在争议[4-5]。补肺益肾组分方Ⅲ(effective-compound compatibilityⅢ of Bufei Yishen prescription,ECC-BYP Ⅲ;专利申请号:201811115372.3),由人参皂苷 Rh1 和黄芪甲苷等成分组成,具有改善COPD 大鼠肺功能、减轻肺组织损伤和抑制炎症反应、氧化应激及黏 液 高 分 泌 等 效 应[6-7]。近 期 研 究[8]显 示:ECC-BYP Ⅲ能够减少COPD 大鼠肺血管管壁厚度,增加管腔口径。但ECC-BYP Ⅲ是否具有改善COPD 相关PH 的效应尚未见报道,ECC-BYP Ⅲ对肺血管异常重构的影响仍不清楚。本研究以烟雾暴露复合克雷伯杆菌(Klebsiellapneumoniae,Kp)诱导的大鼠PH 模型为研究对象,观察ECC-BYPⅢ对PH 的影响,从肺小血管炎症和肺小动脉肌化等方面,进一步探讨该方对肺血管重构的影响,为ECC-BYP Ⅲ干预COPD 相关PH 的临床应用提供依据。
1 材料与方法
1.1 实验动物、细菌和香烟149 只SPF 级SD 大鼠,雌性,体质量150~180 g,购自南京市江宁区青龙山动物繁殖场,动物生产许可证号:SCXK(苏)2017-0001。本实验经河南中医药大学实验动物 伦 理 委 员 会 审 核 批 准,批 准 编 号:DWLL2018030063。Kp购自中国食品药品检定研究院,编号:CMCC (B)46117,使用前配成6×108CFU·mL-1的混悬液。红旗渠牌过滤嘴香烟(烤烟型,焦油量10 mg,烟气烟碱量0.8 mg,烟气一氧化碳量12 mg)由河南中烟工业有限责任公司提供。
1.2 药物、主要试剂和仪器ECC-BYP Ⅲ按20(S)-人参皂苷Rh1∶丹皮酚∶淫羊藿苷∶川陈皮素∶黄芪甲苷=12.5∶3.125∶50∶2∶2.5 比例组成。20(S)-人参皂苷Rh1、丹皮酚、淫羊藿苷和黄芪甲苷均为成都克洛玛生物科技有限公司产品,川陈皮素为西安汇林生物科技有限公司产品。大鼠白细胞介素6(interleukin 6,IL-6)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(E-EL R0015-c)、大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒(E-EL-R2856c)、大鼠内皮素-1(endothelin-1,ET-1)试剂盒(E-EL-R1458c)和前列环素2(prostacyclin 2,PGI2)ELISA 试 剂 盒(E-EL-0022c)均为武汉Elabscience 公司产品。万分之一分析天平为梅特勒-托利多仪器(上海)有限公司产品,Multiskan Go 型全波长酶标仪为美国Thermo Scientific 公司产品,BL-420S 生物机能实验系统购自成都泰盟软件有限公司,YH-4 型生理压力传感器购自北京航天医学工程研究所,聚乙烯导管购自美国史密斯医疗器械有限公司。
1.3 模型制备、分组及给药大鼠适应环境7 d,随机分为对照组(n=9)和造模组(n=140),对照组大鼠正常饲养;其余大鼠采用香烟烟雾暴露联合细菌感染的方法制备模型[8-9]:在大鼠吸气时,经鼻腔滴入Kp 液6×108CFU·mL-1,0.1 mL,每5 d 1 次,持续8 周;点燃香烟并使烟熏箱烟雾浓度达到(3 000±500)ppm,每次40 min,每天2 次,2 次烟熏间隔至少3 h,持续8 周。造模期间大鼠死亡21 只。
造模结束后,按照肺功能均匀的原则将造模大鼠分为模型组(n=10)和低剂量(n=9)、中剂量(n=10)及高剂量(n=10)ECC-BYP Ⅲ组。用无菌生理盐水制备药物混悬液,每只大鼠每日按照组 别 分 别 灌 胃3.24、6.48 和12.96 mg·kg-1ECC-BYP Ⅲ。对照组和模型组大鼠给予等量生理盐水。共给药4 周。
1.4 实验动物麻醉采用戊巴比妥钠(9 g·L-1生理盐水溶液)腹腔注射的方式麻醉大鼠。部分大鼠进行肺动脉压检测。
1.5 各组大鼠肺动脉压测定参照文献方法[9-10]检测各组大鼠肺动脉压,每组随机选择5 只。大鼠腹腔麻醉后,分离颈动脉及右颈外静脉。将与压力换能器连接并充满肝素盐水(1 g·L-1)的 PE 管连接BL-420S 生物机能实验系统,将PE 管经右颈外静脉插入肺动脉后,固定插管,静止5 min 后开始描记肺动脉压,包括肺动脉平均压(mean pulmonary artery pressure,mPAP)、肺动脉收缩压(pulmonary artery systolic pressure,PASP)和肺动脉舒张压(pulmonary artery diastolic pressure,PADP)。麻醉致死大鼠,剪断腹主动脉和静脉,经PE 管先后灌注1×PBS 缓冲液和4%多聚甲醛,至腹主动脉流出液无色。其余大鼠不检测肺动脉压,按上述方法麻醉插管进行PBS 缓冲液和多聚甲醛灌注。
1.6 各组大鼠右心室肥大指数(right ventricularhypertrophy index,RVHI)测定各组大鼠开胸取心脏和肺脏,4%多聚甲醛固定左肺和心脏。24 h取出浸泡的心脏,在通风橱中,沿冠状沟去除心房、主动脉和肺动脉,沿前后室间沟分离右心室游离壁,卫生纸吸干组织表面液体。称量右心室游离壁及室间隔+左室壁。RVHI=右心室游离壁质量/(室间隔质量+左室壁质量)。
1.7 ELISA 法检测各组大鼠肺组织中IL-6、TNF-α、ET-1和PGI2水平取大鼠右肺称质量,加入4 ℃生理盐水,冰浴条件下用匀浆器制备10%肺组织匀浆。按照试剂盒说明书,采用双抗体夹心ELISA 法 检 测IL-6、TNF-α 和ET-1 水 平,竞 争ELISA 法 检 测PGI2 水 平。
1.8 各组大鼠肺组织HE 染色和维多利亚蓝染色
取大鼠左肺,切片、乙醇脱水、石蜡包埋和制片,切片厚度4 μm。采用碧云天公司的苏木素-伊红 (hematoxylin-eosin,HE)染 色 试 剂 盒 和Solarbio 公司的维多利亚蓝弹力纤维染色液,按照说明书分别进行肺组织的HE 染色和维多利亚蓝染色。
1.9 各组大鼠肺小动脉血管分型百分比的计算显微镜下观察维多利亚蓝染色切片。汇总长径<100 μm 肌性动脉(具有内层和外层完整弹力板)、部分肌性动脉(内层弹力板不完整,外层弹力板完整)和非肌性动脉(单层弹力板)的数量及动脉总数量,按照如下公式计算每个样本3 种类型动脉的百分比,某种类型动脉百分比=该类型动脉总数/动脉总数×100%[11-12]。
1.10 各组大鼠肺肌性小动脉厚度和管腔面积的检测参照参考文献[11-12]中的方法,选择维多利亚蓝染色的病理切片,显微镜下观察,选择<200 μm 直径的肺小动脉(排除非肌性动脉和部分肌性动脉)进行检测,每张切片随机选择5 支血管,采用ipp6.0 图像分析软件检测血管壁厚度(wall thickness,WT)、血 管 管 径 (external diameter,ED)、血管总面积(total area,TA)和血管腔面积(luminal area,LA)。根据上述数据计算如下指标:肺小动脉管壁厚度占管径的百分比(WT%)=2×WT/ED×100%,血管腔面积占血管总面积百分比(LA%)= LA/TA×100%。
1.11统计学分析采用SPSS 16.0 软件进行统计学 分 析。各 组 大 鼠mPAP、PASP、PADP 和RVHI,肺 组 织 中IL-6、TNF-α、ET-1 和PGI2 水平及ET-1/PGI2 比值,各型肺小动脉百分比、WT%和LA%均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠mPAP、PASP、PSDP 和RVHI与对照组比较,模型组大鼠mPAP、PASP 和PADP升高(P<0.05 或P<0.01);与模型组比较,高剂量ECC-BYP Ⅲ组大鼠mPAP 和PADP 降低(P<0.05)。见表1。与对照组比较,模型组大鼠RVHI升高(P<0.01);与模型组比较,低、中和高剂量ECC-BYP Ⅲ组大鼠RVHI 差异无统计学意义(P>0.05)。见表2。
表1 各组大鼠mPAP、PASP 和PADPTab.1 mPAP,PASP,and PADP of rats in various groups(n=5,±s,P/mmHg)
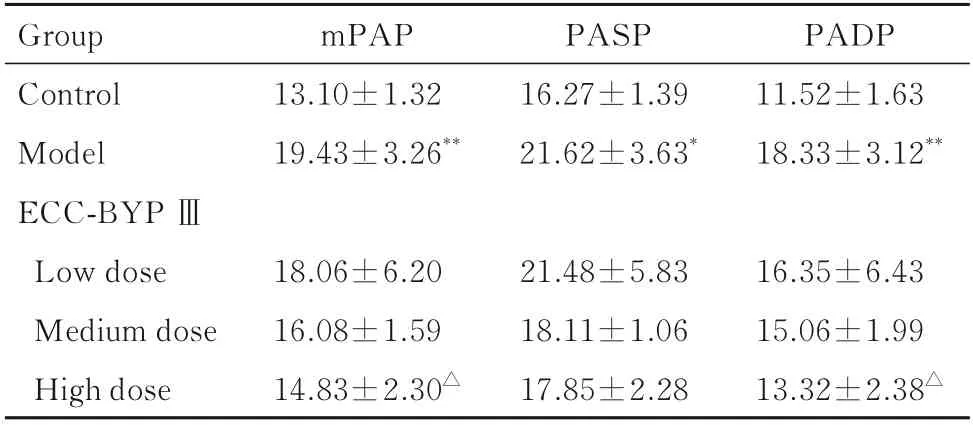
表1 各组大鼠mPAP、PASP 和PADPTab.1 mPAP,PASP,and PADP of rats in various groups(n=5,±s,P/mmHg)
*P<0.05,**P<0.01vscontrol group;△P<0.05vsmodel group.
Group Control Model ECC-BYP ⅢmPAP 13.10±1.32 19.43±3.26**PASP 16.27±1.39 21.62±3.63*PADP 11.52±1.63 18.33±3.12**Low dose Medium dose High dose 16.35±6.43 15.06±1.99 13.32±2.38△18.06±6.20 16.08±1.59 14.83±2.30△21.48±5.83 18.11±1.06 17.85±2.28
表2 各组大鼠RVHI 值Tab.2 Values of RVHI of rats in various groups (±s)
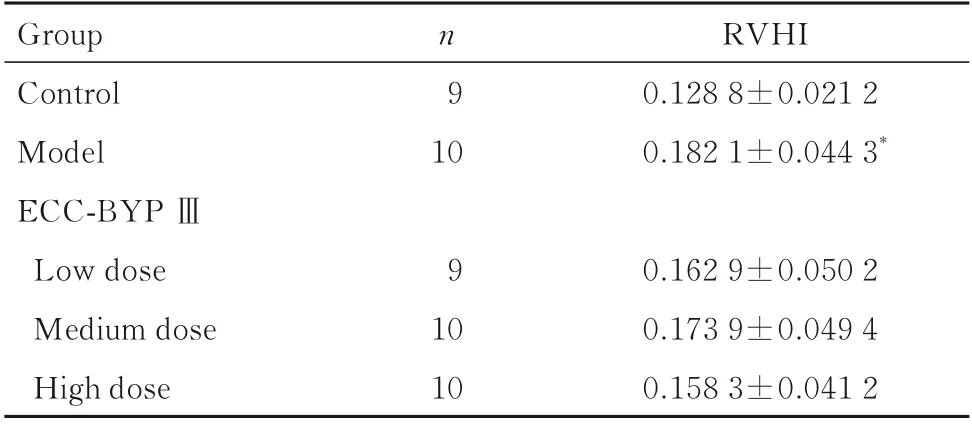
表2 各组大鼠RVHI 值Tab.2 Values of RVHI of rats in various groups (±s)
*P<0.01vscontrol group.
Group Control Model ECC-BYP Ⅲn 9 10 RVHI 0.128 8±0.021 2 0.182 1±0.044 3*Low dose 0.162 9±0.050 2 0.173 9±0.049 4 0.158 3±0.041 2 9 Medium dose High dose 10 10
2.2 各组大鼠肺小动脉周围炎症细胞浸润和肺组织炎症因子水平对照组大鼠肺小动脉管壁结构清晰,小动脉周围、肺间质及肺泡无明显炎症细胞浸润;模型组大鼠肺小动脉周围、肺间质及肺泡淋巴细胞和巨噬细胞浸润明显;中和高剂量ECC-BYPⅢ组大鼠肺小血管周围、肺间质及肺泡炎症细胞浸润较轻。见图1。与对照组比较,模型组大鼠肺组织TNF-α 和IL-6 水平升高(P<0.01);与模型组比较,中和高剂量ECC-BYP Ⅲ组大鼠肺组织中TNF-α 和IL-6 水 平 降 低(P<0.01);与 低 剂 量ECC-BYP Ⅲ组比较,中剂量ECC Ⅲ组大鼠肺组织 中TNF- α 水 平 降 低(P<0.05),高 剂 量ECC-BYP Ⅲ组大鼠肺组织中IL-6 水平降低(P<0.05)。见表3。
表3 各组大鼠肺组织中TNF-α 和IL-6 水平Tab.3 Levels of TNF-α and IL-6 in lung tissue of rats in various groups [-±s,ρB/(ng·L-1)]

表3 各组大鼠肺组织中TNF-α 和IL-6 水平Tab.3 Levels of TNF-α and IL-6 in lung tissue of rats in various groups [-±s,ρB/(ng·L-1)]
*P<0.01vscontrol group;△P<0.01vsmodel group;#P<0.05vslow dose of ECC-BYP Ⅲ group.
Group Control Model ECC-BYP Ⅲn 9 10 TNF-α 42.49±3.39 72.04±4.97*IL-6 32.25±5.14 47.47±6.70*Low dose 9 Medium dose High dose 10 10 68.03±5.11 63.02±4.48△#64.30±4.45△45.43±5.77 40.28±6.00△38.38±5.79△#
2.3 各组大鼠肺小动脉血管分型百分比按维多利亚蓝染色大鼠肺动脉壁弹力纤维将肺小动脉区分为非肌性血管、部分肌性血管和肌性血管。见图2。与对照组比较,模型组大鼠肌性血管百分比增加(P<0.01),非肌性血管百分比减少(P<0.01),部分肌性血管百分比差异无统计学意义(P>0.05);与模型组比较,中和高剂量ECC-BYP Ⅲ组大鼠肌性血管百分比减少(P<0.01),低、中和高剂量ECC-BYP Ⅲ组大鼠部分肌性血管百分比差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠肺组织中非肌性、部分肌性和肌性肺小动脉百分率Tab.4 Percentages of non-muscular, partial muscular,and muscular pulmonary arterioles in lung tissue of rats in various groups(±s,η/%)
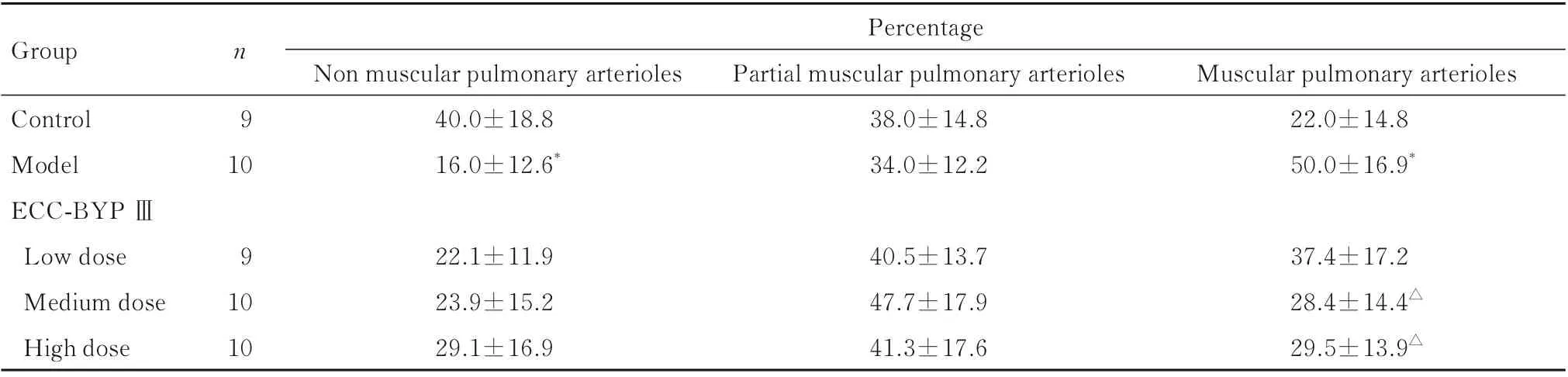
表4 各组大鼠肺组织中非肌性、部分肌性和肌性肺小动脉百分率Tab.4 Percentages of non-muscular, partial muscular,and muscular pulmonary arterioles in lung tissue of rats in various groups(±s,η/%)
*P<0.01vscontrol group;△P<0.01vsmodel group.
Group n Percentage Control Model ECC-BYP Ⅲ9 10 Non muscular pulmonary arterioles 40.0±18.8 16.0±12.6*Partial muscular pulmonary arterioles 38.0±14.8 34.0±12.2 Muscular pulmonary arterioles 22.0±14.8 50.0±16.9*Low dose 9 Medium dose High dose1029.1±16.9 37.4±17.2 28.4±14.4△29.5±13.9△10 22.1±11.9 23.9±15.2 40.5±13.7 47.7±17.9 41.3±17.6
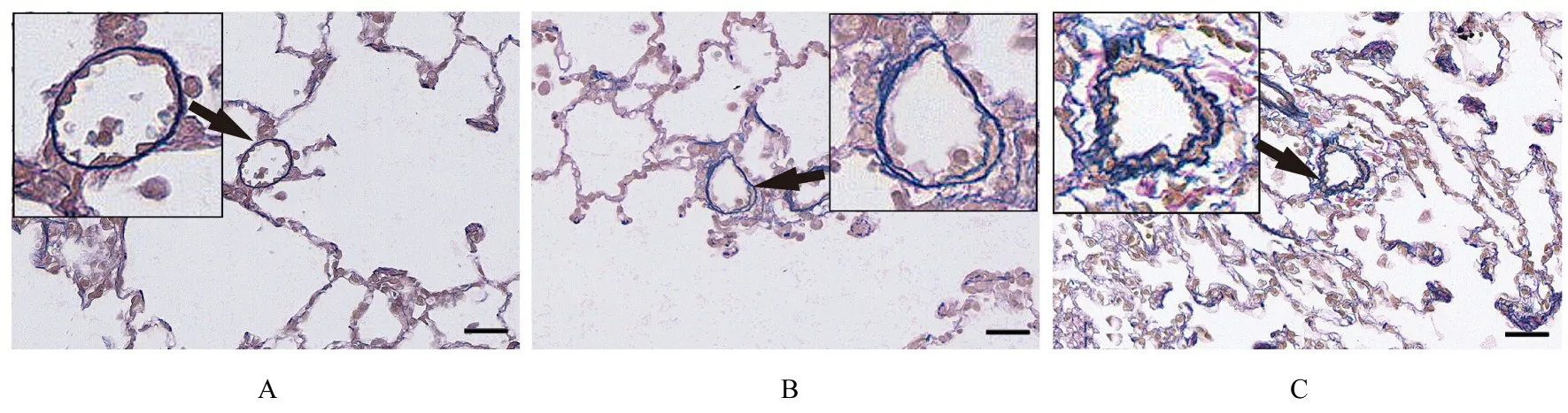
图2 各组大鼠肺组织中非肌性、部分肌性和肌性肺小动脉形态表现(维多利亚蓝,Bar=50 μm)Fig.2 Morphology of non-muscular, partial muscular, and muscular pulmonary arterioles in lung tissue of rats in various groups (Victorian blue, Bar=50 μm)
2.4 各组大鼠肺组织中肌性小动脉壁厚度和管腔面积对照组大鼠肺组织中肌性小动脉壁薄,周围少见炎症细胞,管腔面积大;模型组大鼠肺组织中肌性小动脉管壁增厚,周围炎症细胞浸润明显,管腔狭窄变形;中和高剂量ECC-BYP Ⅲ组大鼠肺组织中肌性小动脉管壁较薄,周围炎症细胞浸润较轻,管腔面积较大。见图3。与对照组比较,模型组大鼠肺组织中肌性肺小动脉WT%升高(P<0.01),LA%降低(P<0.01);与模型组比较,中和高剂量ECC-BYP Ⅲ组大鼠肺组织中WT%降低(P<0.01),LA%升高(P<0.01);与低剂量ECC-BYP Ⅲ组比较,中和高剂量ECC-BYP Ⅲ组大鼠肺组织中WT%降低(P<0.01),LA%升高(P<0.01)。见表5。
表5 各组大鼠肌性肺小动脉WT%和LA%Tab.5 WT% and LA% of pulmonary muscular arterioles of rats in various groups (±s,η/%)
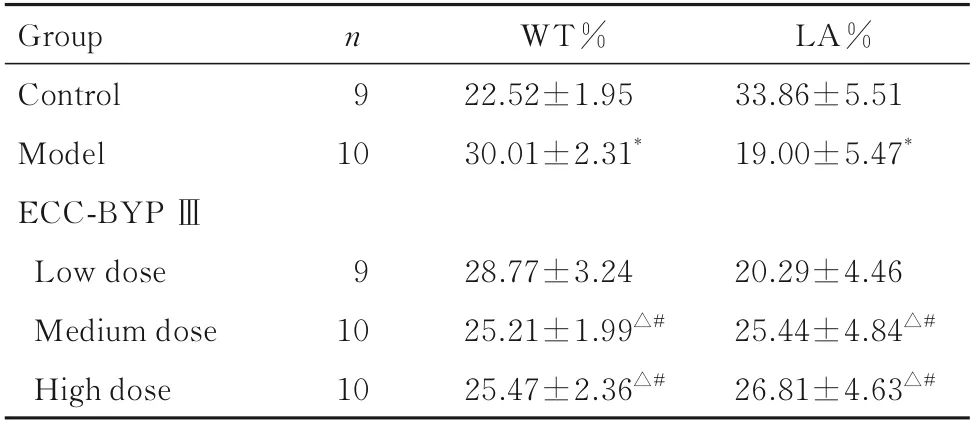
表5 各组大鼠肌性肺小动脉WT%和LA%Tab.5 WT% and LA% of pulmonary muscular arterioles of rats in various groups (±s,η/%)
*P<0.01vscontrol group;△P<0.01vsmodel group;#P<0.01vslow dose of ECC-BYP Ⅲ group.
Group Control Model ECC-BYP Ⅲn 9 10 WT%22.52±1.95 30.01±2.31*LA%33.86±5.51 19.00±5.47*20.29±4.46 25.44±4.84△#26.81±4.63△#Low dose 9 Medium dose High dose 10 10 28.77±3.24 25.21±1.99△#25.47±2.36△#
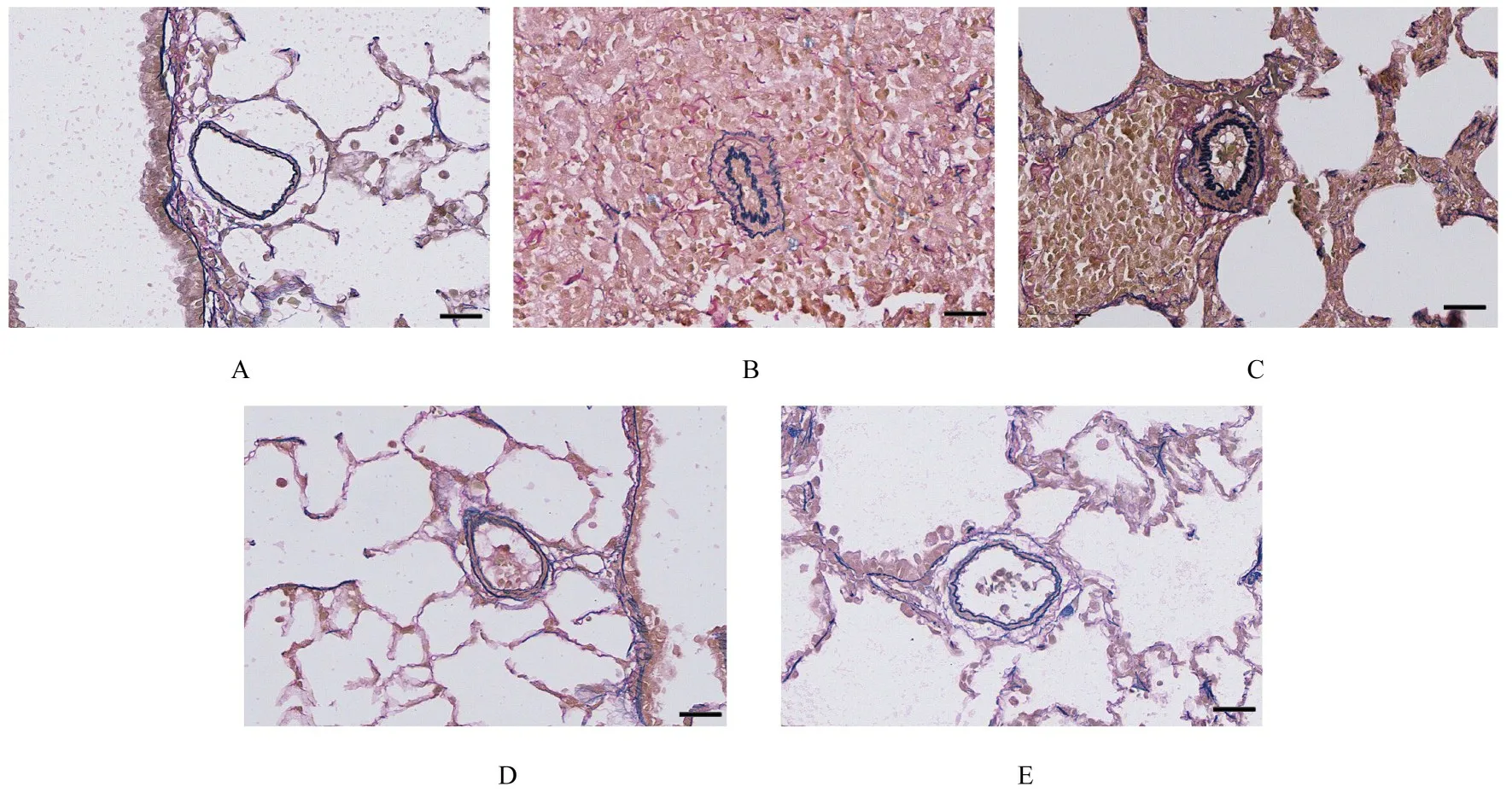
图3 各组大鼠肺组织中肌性小动脉形态表现(维多利亚蓝,Bar=50 μm)Fig.3 Morphology of muscular pulmonary arterioles in lung tissue of rats in various groups(Victorian blue,Bar=50 μm)
2.5 各组大鼠肺组织中ET-1 和PGI2 水平及ET-1/PGI2 比值与对照组比较,模型组大鼠肺组织ET-1水平和ET-1/PGI2 比值升高(P<0.05或P<0.01),PGI2 水平差异无统计学意义(P>0.05);与模型组比较,中和高剂量ECC-BYP Ⅲ组大鼠肺组织中ET-1 水平降低(P<0.05 或P<0.01),高剂量ECC-BYP Ⅲ组大鼠肺组织中ET-1/PGI2 比值降低(P<0.05),低、中和高剂量ECC-BYP Ⅲ组大鼠肺组织中PGI2 水平差异无统计学意义(P>0.05);与低剂量ECC-BYP Ⅲ组比较,中和高剂量ECC-BYP Ⅲ组大鼠肺组织中ET-1 水 平 降 低(P<0.05 或P<0.01),高 剂 量ECC-BYP Ⅲ组大鼠肺组织中ET-1/PGI2 比值降低(P<0.05)。见表6。
表6 各组大鼠肺组织中ET-1 和PGI2 水平及ET-1/PGI2 比值Tab.6 Levels of ET-1 and PGI2 and ratios of ET-1/PGI2 in lung tissue of rats in various groups (±s)

表6 各组大鼠肺组织中ET-1 和PGI2 水平及ET-1/PGI2 比值Tab.6 Levels of ET-1 and PGI2 and ratios of ET-1/PGI2 in lung tissue of rats in various groups (±s)
*P<0.05,**P<0.01vscontrol group;△P<0.05,△△P<0.01vsmodel group;#P<0.05,##P<0.01vslow dose of ECC-BYP Ⅲ group.
Group Control Model ECC-BYP Ⅲn 9 10 ET-1[ρB/(ng·L-1)]41.99±14.36 84.49±33.09**PGI2[ρB/(ng·L-1)]42.99±5.67 40.40±2.97 Ratio of ET-1/PGI2 0.983 1±0.352 2 2.197 0±0.905 7*Low dose 9 Medium dose High dose 2.198 0±0.736 3 1.438 1±0.687 8 1.102 5±0.371 1△#10 10 84.71±30.91 58.49±24.35△#44.81±13.74△△##40.39±1.84 41.49±3.92 41.57±6.65
3 讨 论
吸烟诱导PH 发病机制复杂,与炎症反应、肺动脉内皮功能紊乱、肺动脉平滑肌异常增殖和细胞外基质沉积等有关[13-14]。肺部的细菌感染引起炎性细胞的扩散,加重了肺血管周围炎症反应,进一步恶化PH。本研究采用烟草烟雾暴露复合Kp 感染的方法建立PH 大鼠模型,结果显示:大鼠模型出现肺小动脉肌化、肺动脉壁增厚和肺小动脉腔狭窄等典型肺血管异常重构的病理变化及mPAP、PASP和PADP 明显升高,表明PH 模型建立成功。前期研究[8]显示:ECC-BYP Ⅲ可降低COPD 大鼠肺小血管壁厚度,减轻管腔狭窄,改善肺血管重构。本研究结果显示:ECC-BYP Ⅲ能够降低模型大鼠的PH,在3.24~12.96 mg·kg-1范围内抑制效应显示出剂量依赖性。另外,在本研究中,模型大鼠的肺动脉血管阻力增高引起右心室代偿性肥厚,而ECC-BYP Ⅲ未能明显改善右心肥大,可能与给药时间短和剂量低等有关。
COPD 肺小动脉血管重塑主要有无肌性正常动脉周围肌化、平滑肌细胞增殖导致的肌型动脉管壁增厚以及细胞外基质蛋白的大量沉积等病理变化[15]。无肌性小动脉周围肌化是肺小血管重塑常见的表现,是PH 形成和发展的重要病理基础[15-16]。尽管前期的研究[8]显示:COPD 大鼠血管内皮生长 因 子 (vascular endothelial growth factor,VEGF)和ET-1 的表达明显增加,ECC-BYP Ⅲ降低这2 种指标的表达水平,但其结果仍不能明确ECC-BYP Ⅲ对肺小动脉肌化的影响。本研究结果显示:模型大鼠肌性肺小血管百分比升高和非肌性百分比降低,反映了肺小血管肌化的病理变化;ECC-BYP Ⅲ对肺血管肌性血管百分比异常变化的抑制,显示出ECC-BYP Ⅲ改善肺小动脉肌化的作用,提示减轻肺小动脉肌化是ECC-BYP Ⅲ抑制COPD 肺小动脉血管重塑和降低PH 的机制之一。
既 往 的 研 究[6-7]显 示:ECC-BYP Ⅲ减 轻COPD 大鼠肺支气管和肺组织的炎症反应,通过多条信号通路的干预,降低多种炎症因子的水平。本研究结果显示:模型组大鼠肺肌性动脉外膜周围有大量单个核炎症细胞浸润,主要由淋巴细胞和巨噬细胞组成,上述炎症细胞分泌大量的炎性蛋白,如趋化因子和细胞因子等,维持炎症反应的持续,导致血管壁的破坏和功能异常,恶化肺血管异常重构,其中细胞因子IL-6 和TNF-α 产生了重要作用。IL-6 促进血管周围炎症细胞的浸润和肺动脉平滑肌增殖,过表达IL-6 转基因小鼠出现严重肺血管重塑,如远端小动脉肌化和特征性的丛样病变[17]。敲除IL-6 基因表达的小鼠,肺血管重构和PH 得到改善[18]。TNF-α 主要由活化的 巨噬细胞分泌,刺激其他炎性因子的合成,与其他炎性因子协同产生炎症瀑布反应。应用TNF-α 拮抗剂Infliximab 可有效减少PH 大鼠腺泡内肌性肺动脉的数量和肺动脉中膜的厚度[19]。ECC-BYP Ⅲ减少肺动脉血管周围的炎症细胞浸润,抑制肺组织IL-6 和TNF-α 的升高,提示其降低肺动脉压和抑制肺血管重构的效应与改善肺动脉血管周围的炎症反应有关。
肺动脉周围的收缩血管因子水平和舒张血管因子水平之间平衡被破坏,是导致肺血管管腔狭窄和PH 的重要原因。ET-1 是强效的血管收缩因子,在肺组织中主要由血管内皮细胞和肺上皮细胞等分泌。PGI2 具有高效的肺血管舒张作用。肺部疾病和(或)低氧所致PH 患者肺组织中存在PGI2 水平 不 足[20]和ET-1 水 平 升 高[21]的 表 现,而 在COPD 小鼠或大鼠肺组织中ET-1 水平也明显升高[22-23]。本 研 究 中,PH 大 鼠 肺 组 织 中ET-1 水 平 明显升高,尽管PGI2 含量无明显变化,但ET-1/PGI2 比值明显增加,表明肺血管周围可能存在缩血管因子水平/舒张血管因子水平失衡。ECC-BYP Ⅲ可降低肺组织中ET-1 水平,改善ET-1/PGI2失衡,通过减轻肺动脉血管狭窄降低PH。综上所述,ECC-BYP Ⅲ减轻肺小动脉肌化和肺血管周围炎症,改善肺血管的异常重构,改善肺血管周围血管因子水平/舒张血管因子水平失衡,减轻肺血管管腔狭窄和降低肺动脉压。本研究阐明ECC-BYP Ⅲ通过多个环节改善PH 和肺血管异常重构,为COPD 相关PH 的临床治疗提供了参考,为进一步的机制研究指明了方向。
