茯苓酸对人胰腺癌PANC-1 细胞迁移、侵袭和上皮间质转化的抑制作用
2023-05-06谭晓冬胡耀元
李 锐, 谭晓冬, 胡耀元
(1.中国医科大学附属盛京医院第十二普通外科病房,辽宁 沈阳 110004;2.中国医科大学附属盛京医院胰腺甲状腺外科病房,辽宁 沈阳 110004)
胰腺癌是消化道恶性肿瘤中最具破坏性、预后最差的一种高度致命的癌症,是男性和女性癌症死亡的第四大原因,其发病率呈逐年上升趋势[1]。完全手术切除可明显延长胰腺癌患者的生存期,但胰腺癌通常为晚期确诊,因此适合手术的患者较少,且手术后复发率仍较高,患者5 年生存率低于10%[2]。此外,胰腺癌具有侵袭性,50%的胰腺癌患者就诊时发生转移,多数接受手术治疗的患者在术后4 年内发生转移[3]。因此,了解胰腺癌发生发展的分子机制对制定胰腺癌诊断及治疗的新方案是必要的。中药是多成分、多靶点和多阶段的药物,其作为癌症预防和治疗的药物被广泛接受[4]。萜类化合物是最大的一类植物特化次生代谢产物,具有抗高血压、降低胆固醇和抗组胺保护作用以及抗肿瘤和抗血管生成活性[5]。茯苓酸(pachymic acid,PA)是一种来自茯苓的羊毛甾烷型三萜类化合物,具有抗肿瘤、抗炎、抗氧化、降血糖、镇静和催眠活性等多种药理作用[6]。关于PA 在胰腺癌中发挥作用的相关研究较少,CHENG 等[7]发现:PA 通过激活内质网应激诱导吉西他滨耐药的胰腺癌细胞凋亡,从而发挥抗癌作用。PA 对胰腺癌细胞迁移和细胞侵袭的作用及发挥作用的机制尚未见报道,有待进一步研究。本研究应用PA 处理胰腺癌PANC-1 细胞及细胞的裸鼠移植瘤模型,探究其对胰腺癌细胞增殖、迁移、侵袭和上皮间质转化(epithelial-mesenchymal transition,EMT)的影响,同时采用GSE64111 数据集中PA 处理及未处理胰腺癌细胞的差异表达基因,验证差异表达基因作为PA 治疗胰腺癌的靶点的潜力。
1 材料与方法
1.1 实验动物、细胞、试剂和主要仪器10 只6 周龄雌性SPF 级BALB/c nude 裸鼠购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2021-0011。PANC-1 细胞购于武汉普诺赛生命科技有限公司。PA 购自美国MCE 公司,si-NC 和si-ATF3 购自上海吉玛基因公司,DMEM培养基和胎牛血清购自美国Gibco 公司,Lipofectamine 3000 转染试剂购自美国Thermo 公司,CCK-8 检测试剂盒、BCA 蛋白定量试剂盒、RIPA 裂解液和ECL 化学发光试剂盒均购自上海碧云天生物技术有限公司,上皮钙黏素、神经钙黏素、波形蛋白、热休克蛋白家族A 成员6 (heat shock protein family A member 6,HSPA6)、转录激 活 因 子 3 (activating transcription factor 3,ATF3)和GAPDH 抗体均购自美国Abcam 公司。5424 低温高速离心机购自德国艾本德公司,EG1150 石蜡包埋机和RM2135 石蜡切片机购自德国Leica 公司,CKX53 倒置显微镜购自日本Olympus 公 司,ELx800 酶 标 仪 购 自 美 国Bio-Tek 公司,5200 全自动化学发光分析系统购自上海天能科技有限公司。
1.2 细胞培养及转染胰腺癌PANC-1 细胞用含10%胎牛血清和1%青链霉素的DMEM 高糖培养基在37 ℃含5%二氧化碳的恒温细胞培养箱中长期培养。将细胞分为si-NC 组和si-ATF3 组,根据实验方案严格按照Lipofectamine 3000 转染试剂说明书将对照siRNA 和ATF3 siRNA 转染PANC-1 细胞,转染结束后用含终浓度为30 μmol·L-1PA 的完全培养基继续培养细胞24 h。
1.3 CCK-8 法检测各组细胞活性取对数生长期的PANC-1 细胞,均匀接种于96 孔细胞培养板中,每孔3 000 个细胞,培养过夜后,分别用含终浓度为0、2、5、10、20、30、40和50 μmol·L-1PA 的 完全培养基继续培养细胞24 h,弃培养基,加入110 μL 含10 μL CCK-8 法检测试剂的无血清培养基,37 ℃孵育1 h,酶标仪检测450 nm 处吸光度(A)值,计算细胞活性。细胞活性=(实验组A值-空白组A 值)/(对照组A 值-空白组A 值)×100%。
1.4 Transwell 小室实验检测各组细胞迁移能力和细胞侵袭能力取对数生长期的PANC-1 细胞,用不含血清的DMEM 培养基重悬细胞,取50 000 个细胞加入无基质胶包被(迁移实验)及包被基质胶(侵袭实验)的Transwell 小室上室中,小室下室中加入含20%胎牛血清的DMEM 培养基,待细胞贴壁,分 别用含终浓度为0、10、30 和50 μmol·L-1PA 的无血清培养基继续培养细胞24 h。取出小室,弃培养基,PBS 缓冲液洗涤3 次,加入4%多聚甲醛室温固定30 min,PBS 缓冲液洗涤3 次,加入0.5%结晶紫染色液,室温染色1 h,PBS 缓冲液洗涤3 次,棉签擦去小室内侧细胞,倒置显微镜下观察并拍照,采用Image J 软件进行细胞计数。
1.5 Western blotting 法检测各组细胞中EMT 相关蛋白、HSPA6 和ATF3 蛋白表达水平收集处理后的细胞,加入含蛋白酶抑制剂的RIPA 裂解液,冰上孵育30 min 后超声破碎3 次,4 ℃、12 000 g 离心20 min,收集上清液。BCA 法检测蛋白浓度并根据蛋白浓度配置上样量为30 μg 的蛋白样品,煮样5 min 使蛋白样品变性并将样品上样于聚丙烯酰胺凝胶上样孔中,电泳分离蛋白,将蛋白转移到PVDF 膜上,5%脱脂奶粉室温封闭1 h 后,加入一抗4 ℃孵育过夜,PBST 洗膜3 次,每次10 min,二抗室温孵育1 h,PBST 洗膜3 次,每次10 min,ECL 化学发光法显影,使用Image J 软件进行灰度分析。目的蛋白相对表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.6 基于高通量基因表达汇编(gene expression omnibus,GEO)分析胰腺癌细胞中差异表达基因
通过GEO2R 软件分析GSE64111 数据集中的差异表达基因,该数据集中包含4 个30 μmol·L-1PA 处理的胰腺癌细胞样本和4 个二甲基亚砜(dimethyl sulfoxide,DMSO)处理的胰腺癌细胞样本,以 log 差 异 倍 数 (fold change,FC)>1或<-1 及调整后的P<0.05 作为筛选标准筛选差异表达基因。
1.7 裸鼠胰腺癌皮下移植瘤模型的建立及处理将10 只裸鼠随机分为对照组和PA 处理组,每组5 只。收集胰腺癌PANC-1 细胞,将2.5×106个细胞皮下注射于裸鼠左腋下,每日用游标卡尺测量肿瘤长径(mm)和短径(mm),计算肿瘤体积,肿瘤体积=(长径×短径)2/2。待肿瘤体积达到60 mm3时,PA 处 理 组 裸 鼠 腹 腔 注 射25 mg·kg-1PA,对照组裸鼠注射等量生理盐水,每周注射3 次,持续5 周[7]。实验结束后处死裸鼠,取移植瘤组织。游标卡尺测量肿瘤长径和短径,计算肿瘤体积,电子秤称量瘤质量。将移植瘤组织置于4%多聚甲醛中,采用免疫组织化学检测肿瘤组织Ki-67 蛋白表达情况。
1.8 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组细胞活性,细胞迁移和侵袭能力,EMT 相关蛋白、HSPA6 和ATF3 蛋白表达水平,肿瘤体积及瘤质量均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用Tukey 检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组PANC-1 细胞的细胞活性CCK-8 法检测结果显示:与空白对照(0 μmol·L-1PA)组比较,不同浓度(5、10、20、30、40 和50 μmol·L-1)PA 处理组的PANC-1 细胞活性呈浓度依赖性降低(P<0.05)。见表1。
表1 CCK-8 法检测各组PANC-1 细胞的细胞活性Tab.1 Activities of PANC-1 cells in various groups detected by CCK-8 assay (n=3,±s,η/%)
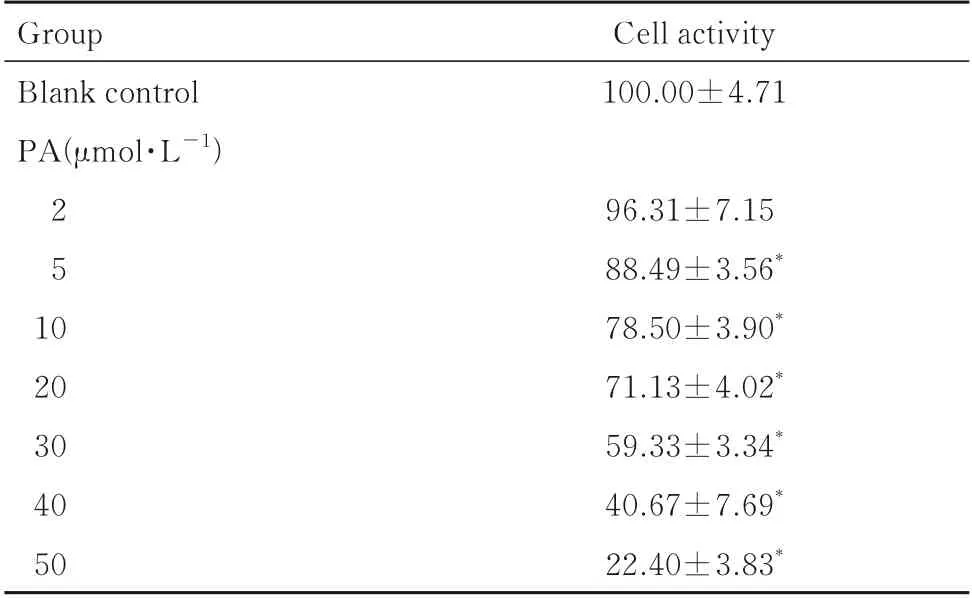
表1 CCK-8 法检测各组PANC-1 细胞的细胞活性Tab.1 Activities of PANC-1 cells in various groups detected by CCK-8 assay (n=3,±s,η/%)
*P<0.05 compared with blank control(0 μmol·L-1PA)group.
Group Blank control PA(μmol·L-1)Cell activity 100.00±4.71 2 5 10 20 30 40 50 96.31±7.15 88.49±3.56*78.50±3.90*71.13±4.02*59.33±3.34*40.67±7.69*22.40±3.83*
2.2 各组细胞迁移和侵袭能力及EMT 相关蛋白表达水平Transwell 小室实验检测结果显示:与空 白 对 照(0 μmol·L-1PA)组 比 较,不 同 浓 度(10、30 和50 μmol·L-1)PA 处 理组PANC-1 细胞迁移和细胞侵袭能力呈浓度依赖性降低(P<0.05)。见图1 和图2。Western blotting 法检测结果显示:与空白对照(0 μmol·L-1PA)组比较,不同 浓 度(10、30 和50 μmol·L-1)PA 处 理 组PANC-1 细胞中上皮钙黏素蛋白表达水平呈浓度依赖性升高(P<0.05),神经钙黏素和波形蛋白表达水平呈浓度依赖性降低(P<0.05)。见图3。
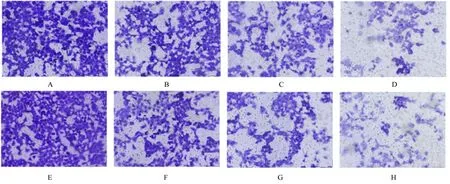
图1 Transwell 小室实验检测各组PANC-1 细胞迁移和侵袭能力(结晶紫,×200)Fig.1 Migration and invasion abilities of PANC-1 cells in various groups detected by Transwell chamber experiment(Crystal violet,×200)
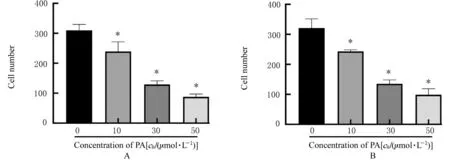
图2 各组PANC-1 细胞中迁移细胞数(A)和侵袭细胞数(B)直条图Fig.2 Histograms of numbers of migration (A) and invasion (B) cells in PANC-1 cells in various groups
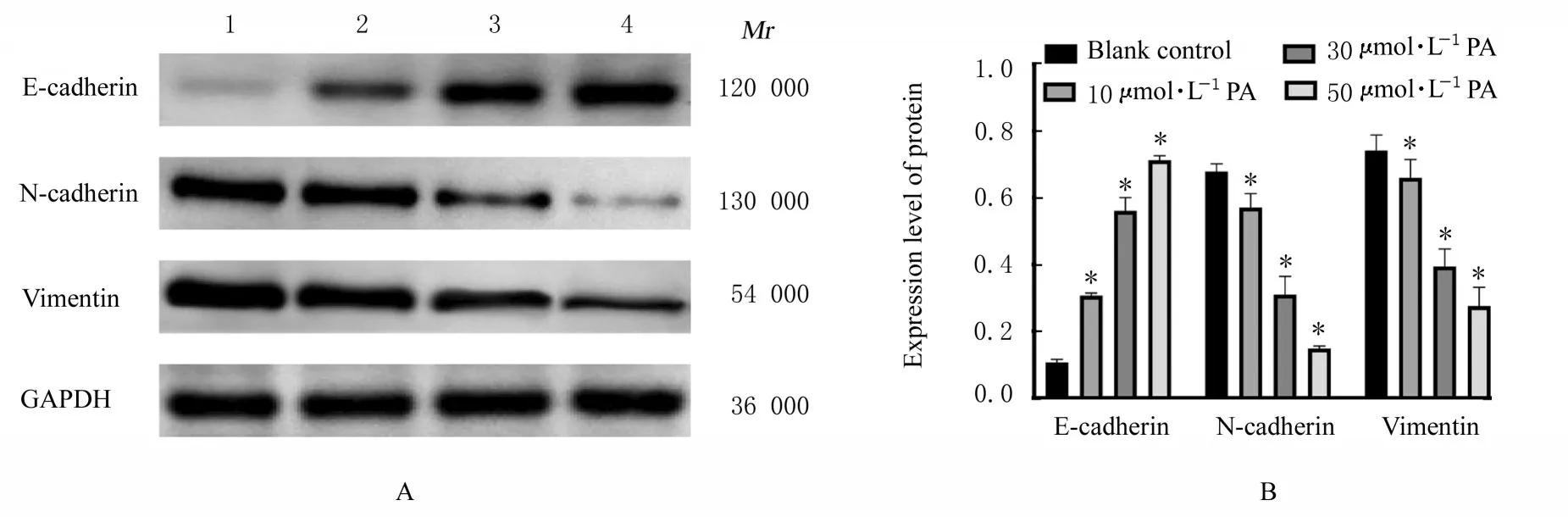
图3 各组PANC-1 细胞中EMT 相关蛋白表达电泳图(A)和直条图(B)Fig.3 Electrophoregram (A) and histogram (B) of expressions of EMT-related proteins in PANC-1 cells in various groups
2.3 各组裸鼠移植瘤生长和Ki-67 蛋白表达情况
对照组裸鼠移植瘤体积为(1 173.19±171.00)mm3,瘤 质 量 为(0.676±0.080)g;PA 组裸鼠移植瘤体积为(354.3±86.66)mm3,瘤质量为(0.234±0.023)g。与对照组比较,PA 组裸鼠移植瘤体积和瘤质量均明显降低(P<0.05),见图4。免疫组织化学检测结果显示:与对照组比较,PA 组裸鼠移植瘤组织中Ki-67 蛋白棕色阳性染色减少。见图5。
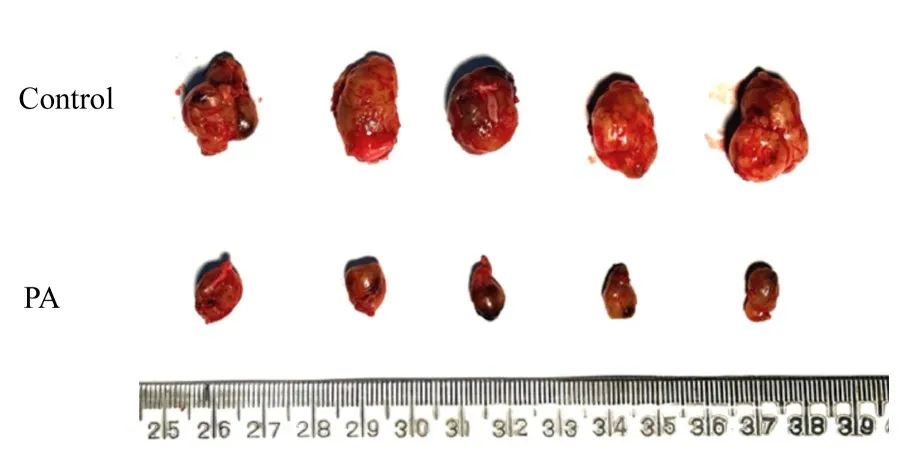
图4 各组裸鼠移植瘤照片大体表现Fig.4 General morphology of xenografted of nude mice in various groups
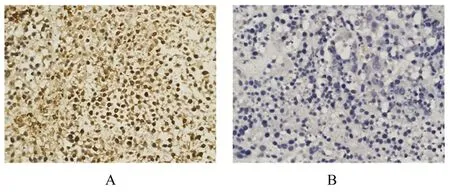
图5 对照组(A)和PA 组(B)裸鼠移植瘤组织中Ki-67 蛋白表达情况(免疫组织化学,×200)Fig.5 Expressions of Ki-67 protein in xenografted tissue of nude mice in control group (A) and PA group (B)(Immunohistochemistry,×200)
2.4 PA 处理后胰腺癌细胞中差异表达基因的数据库分析通过GEO2R 软件分析GSE64111 数据集中的差异表达基因,该数据集中包含4 个30 μmol·L-1PA 处 理 的 胰 腺 癌 细 胞 样 本 和4 个DMSO 处理的胰腺癌细胞样本,分析结果显示:共23 个差异表达基因,其中16 个基因表达上调,7 个基因表达下调,其中差异表达倍数最高的基因为HSPA6 和ATF3。见图6。
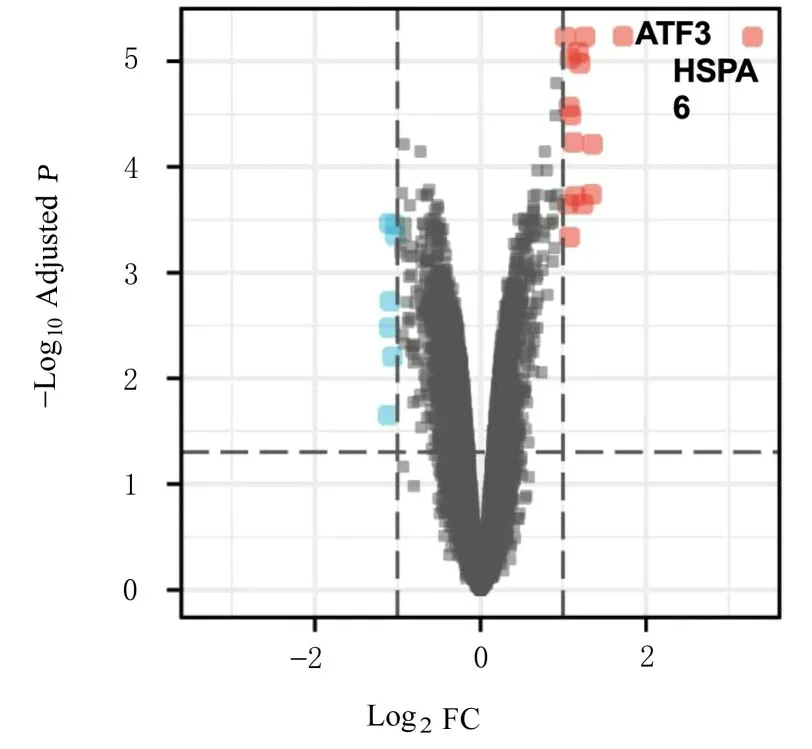
图6 PA 处理后胰腺癌细胞中差异表达基因Fig.6 Differentially expression genes in pancreatic cancer cells after treated with PA
2.5 各组PANC-1 细胞中HSPA6 和ATF3 蛋白表达水平Western blotting 法检测结果显示:与空白对照组比较,PA 组PANC-1 细胞中HSPA6 和ATF3 蛋白表达水平明显升高(P<0.05)。见图7。
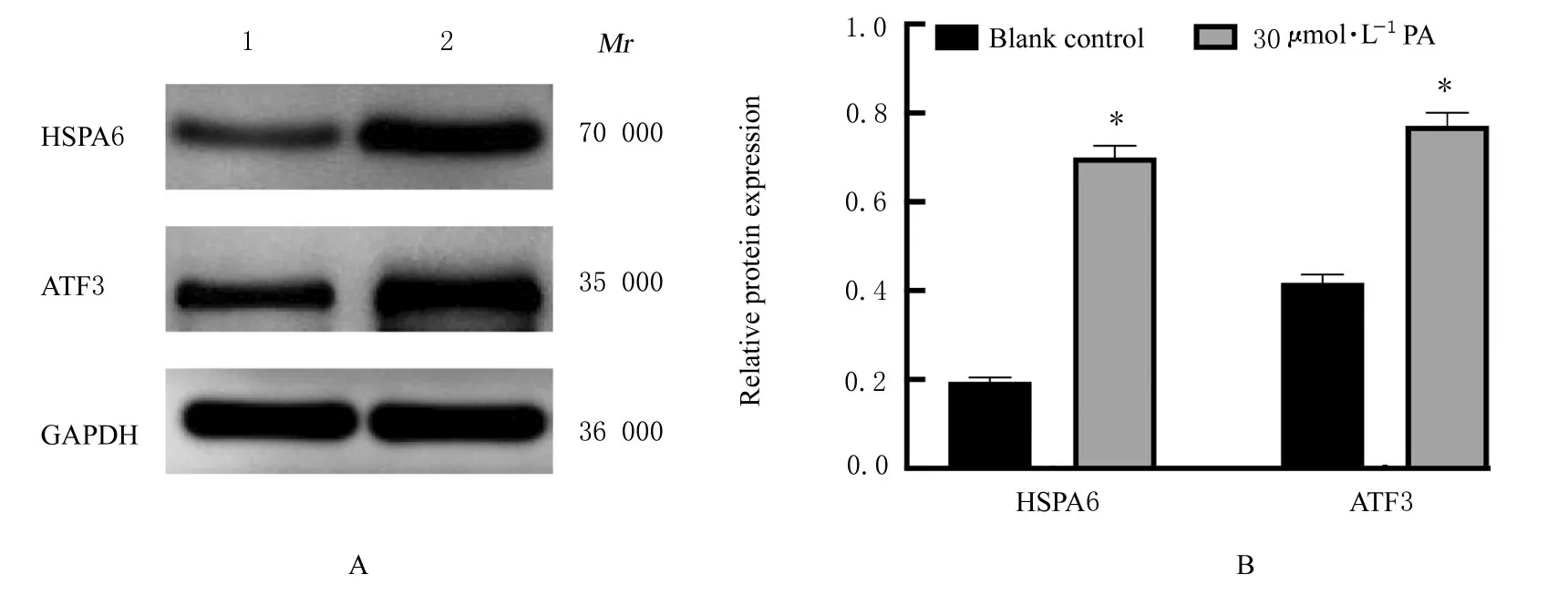
图7 Western blotting 法检测各组PANC-1 细胞中HSPA6 和ATF3 蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram (A) and histogram (B) of expressions of HSPA6 and ATF3 proteins in PANC-1 cells in various groups detected by Western blotting method
2.6 沉 默ATF3 后PANC-1 细 胞中HSPA6 和ATF3 蛋白表达水平Western blotting 法检测结果显示:与si-NC 组比较,si-ATF3 组PANC-1 细胞中HSPA6 和ATF3 蛋白表达水平明显降低(P<0.05)。见图8。
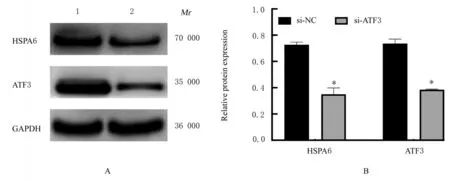
图8 Western blotting 法检测沉默ATF3 后PANC-1 细胞中HSPA6 蛋白表达电泳图(A)和直条图(B)Fig.8 Electrophoregram (A) and histogram (B) of expressions of HSPA6 protein in PANC-1 cells after silencing of ATF3 detected by Western blotting method
2.7 沉默ATF3 后PANC-1 细胞迁移能力和细胞侵袭能力及EMT 相关蛋白表达水平Transwell 小室实验检测结果见图9,si-NC 组侵袭细胞数为(172.20±11.44)个,si-ATF3 组侵袭细胞数为(264.80±9.36)个,2 组间比较差异有统计学意义(P<0.05);si-NC 组迁移 细胞数(132.80±7.36)个,si-ATF3 组 迁 移 细 胞 数(239.80±6.64)个,2 组间比较差异有统计学意义(P<0.05)。进一步通过Western blotting 法检测EMT相 关 蛋 白 表 达,结 果 显 示:与si-NC 组 比 较,si-ATF3 组PANC-1 细胞中上皮钙黏素蛋白表达水平明显降低(P<0.05),神经钙黏素和波形蛋白表达水平明显升高(P<0.05)。见图10。
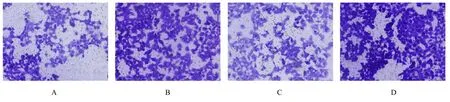
图9 各组PANC-1 细胞迁移和侵袭形态表现(结晶紫,×200)Fig.9 Morphology of migration and invasion of PANC-1 cells in various groups(Crystal violet,×200)
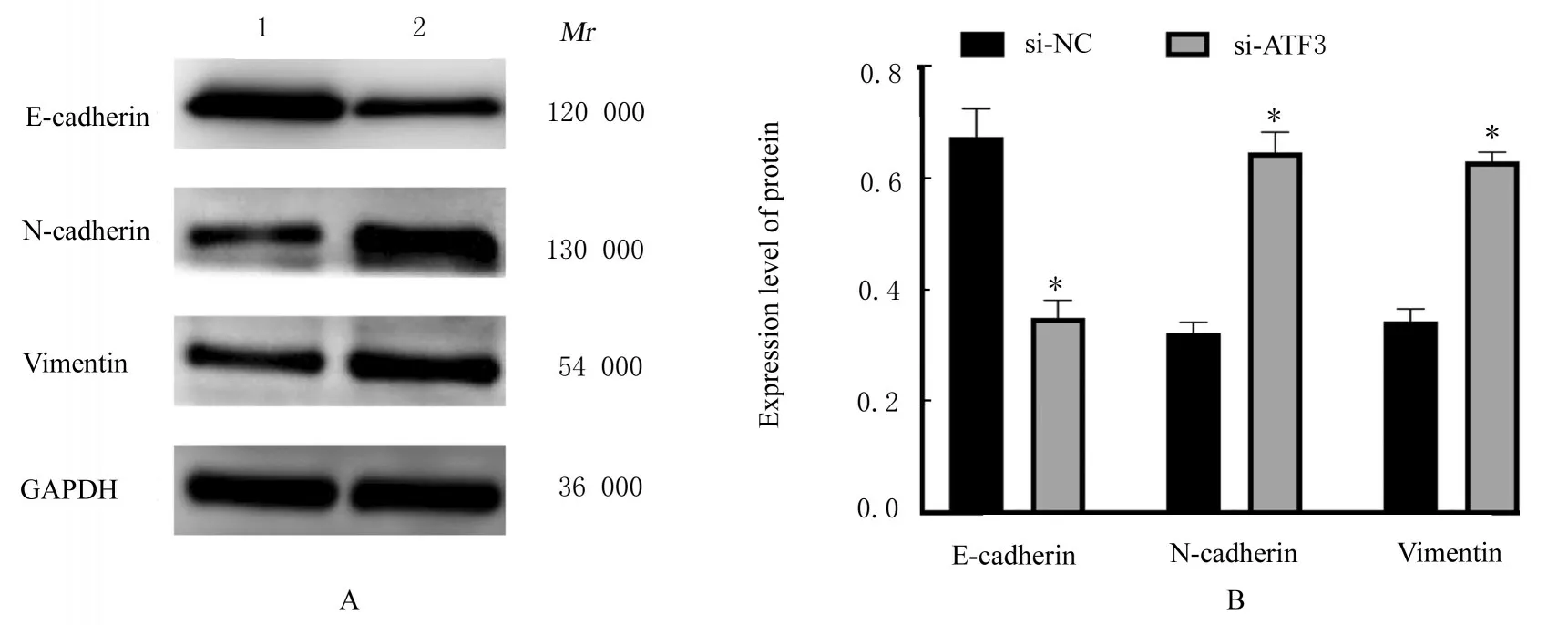
图10 各组PANC-1 细胞中EMT 相关蛋白表达电泳图(A)和直条图(B)Fig.10 Electrophoregram (A) and histogram (B) of expressions of EMT-related proteins in PANC-1 cells in various groups
3 讨 论
由于胰腺癌的高转移性和侵袭能力,传统的手术治疗及化疗药物治疗效果并不明显[8]。PA 对多种癌症的侵袭和转移具有抑制作用,研究[8]发现PA 以时间和剂量依赖性方式明显降低胆囊癌细胞生长、迁移和侵袭。GAO 等[9]发现:PA 剂量依赖地抑制卵巢癌细胞体外生长、迁移和侵袭,并上调上皮钙黏素表达。CHENG 等[10]发现:PA 抑制胰腺癌细胞侵袭。本研究结果显示:PA 处理可以抑制胰腺癌PANC-1 细胞体外生长、迁移和侵袭及体内移植瘤生长。
EMT 是导致胰腺癌肿瘤细胞侵袭、转移和化学抗性等高度恶性潜能的主要原因[11]。EMT 是指上皮-间质状态转变,上皮细胞经历表型和基因型转化以获得间充质表型,上皮表型是可定植和稳定的,而间充质表型能够抵抗细胞凋亡,具有侵袭性和迁移能力[12]。上皮钙黏素是细胞表面的上皮钙黏蛋白分子,有助于顶端-基底极性的上皮细胞之间的外侧连接,可作为上皮细胞标志蛋白[13]。神经钙黏素和波形蛋白是间充质细胞标志蛋白,EMT 中间充质标记物的表达和上皮标记物的抑制同时发生,一旦EMT 程序被激活,癌细胞就会获得迁移和侵袭能力,进而促进癌症的侵袭和转移[14-15]。在本研究中,PA 处理可明显上调胰腺癌PANC-1 细胞上皮钙黏素表达,下调神经钙黏素和波形蛋白表达,表明PA 抑制PANC-1 细胞EMT。
为了进一步探究PA 抑制胰腺癌细胞迁移、侵袭和EMT 的机制,本研究分析了GEO 数据库GSE64111 数据集中的差异表达基因,该数据集包括4 个30 μmol·L-1PA 处 理 的 胰 腺 癌 细 胞 样 本 和4 个DMSO 处理的胰腺癌细胞样本,结果显示:HSPA6 和ATF3 在PA 处理的胰腺癌细胞中表达上调。HSPA6 位于人类染色体1q23.3,编码一种相对 分 子 质 量 为70 000 的 蛋 白[16]。SHEN 等[17]发现:百里香醌通过上调HSPA6 表达抑制三阴性乳腺癌细胞生长、迁移和侵袭,且HSPA6 高表达与乳腺癌患者的长总生存期呈正相关关系。COTO-LLERENA 等[18]发 现:HSPA6 表 达 上 调促进肝细胞肝癌细胞体外增殖和迁移以及体内肿瘤生长。ZHOU 等[19]发现:HSPA6 在胶质母细胞瘤患者中呈高水平表达,且HSPA6 通过促进增殖、侵袭和抗凋亡促进胶质瘤细胞的恶性进展。总之,HSPA6 在不同癌症中发挥致癌或抑癌作用。ATF3是活化转录因子(activating transcription factor,ATF)/环 磷 酸 腺 苷 (cyclic adenosine monophosphate,cAMP)反应元件结合家族的成员,在调节代谢、免疫和肿瘤发生中起重要作用,且可能作为癌基因和肿瘤抑制因子发挥双重作用[20]。YOUNS 等[21]研究显示:雷公藤红素通过上调ATF3 表达抑制胰腺癌细胞生长并诱导细胞凋亡。DUNCAN 等[22]发现:组蛋白去乙酰化酶抑制剂和蛋白质二硫键异构酶抑制剂联合处理诱导胶质母细胞瘤和胰腺癌细胞ATF3 表达,ATF3 表达上调诱导HSPA6 上调,从而发挥抗肿瘤协同作用。本研究结果显示:PA 诱导HSPA6 和ATF3 蛋白表达,沉默ATF3 降低了PA 诱导的HSPA6 蛋白表达,此外,沉默ATF3 逆转了PA 对胰腺癌细胞生长、迁移和侵袭的抑制作用。
综上所述,鉴于PA 抑制胰腺癌细胞体外增殖、迁移、侵袭和EMT 且在体内抑制胰腺癌细胞移植瘤生长,PA 有望成为抗胰腺癌转移的有效药物。PA 通过上调ATF3 和HSPA6 蛋白表达发挥抗肿瘤作用,ATF3 和HSPA6 有望成为抗胰腺癌治疗的靶点。本研究结果为抗胰腺癌治疗提供理论依据。
