卡氏棘阿米巴肌动蛋白1 的免疫学特性和细胞黏附功能
2023-05-06杨舒越赵佳欣孔繁利郭思瑶冯宪敏
李 晶, 杨舒越, 赵佳欣, 孔繁利, 郭思瑶, 冯宪敏
(1.北华大学基础医学院病理生理教研室,吉林 吉林 132013;2.吉林医药学院基础医学院病原生物学教研室,吉林 吉林 132013)
在自然界中存在着多种自由生活阿米巴原虫,其中一部分具有潜在致病作用,可引起诸如人体急慢性炎症等。棘阿米巴属(Acanthamoeba)是阿米巴原虫的一种,其广泛分布在自然界的水、泥土和腐烂的植物中,可经受损的皮肤、眼角膜、呼吸道或生殖道等侵入人体,并能寄生在眼部或脑部,从而引起致盲性阿米巴性角膜炎(AcanthamoebaKeratitis,AK)、肉芽肿性阿米巴性脑炎和阿米巴性皮肤损害[1-4]。卡氏棘阿米巴(Acanthamoeba castellanii,Ac)是最具代表性的致病虫株,为AK的主要病原体[5]。Ac 的生活史包括滋养体和包囊2 个阶段,黏附是虫体入侵人体的首要环节。入侵角膜基质的滋养体很快形成包囊,包囊对药物具有很强的抵抗作用,不易被清除,常常造成感染的慢性化。对于严重的AK 患者,主要以手术治疗为主,包括眼角膜病灶清创术、眼角膜移植术和病灶冷冻治疗等,预后差,严重影响患者的生活质量[6-7]。因此阻断棘阿米巴的入侵是预防感染的关键。本课题组在前期工作中构建了棘阿米巴cDNA文库,经噬菌体展示技术筛选出包含肌动蛋白1(Actin 1)的多种抗原分子[8-9]。Actin 1 是真核细胞骨架的核心组成部分,参与虫体的运动、形状维持、囊泡运输、基因调控和细胞分裂等[10]。研究[11-14]表明:Actin 1 在多种寄生原虫的入侵和致病过程中发挥作用。在前期工作基础上,本研究进一步探讨Ac-Actin 1 的免疫学特性,初步阐明Ac-Actin 1 介导虫体黏附宿主细胞,参与虫体入侵的作用,为进一步研究Ac-Actin 1 的功能和以Ac-Actin 1 为分子靶点的预防策略奠定基础。
1 材料与方法
1.1 棘阿米巴原虫、细胞系、细菌菌株及实验动物棘阿米巴原虫(ATCC®50514TM)购于美国菌种保藏中心(American Type Culture Collection,ATCC)。Vero 细胞系由普诺赛生命科技有限公司提供。大肠杆菌(ATCC®29552TM)由实验室甘油菌种保存于-80 ℃冰箱中。3 只新西兰白兔购于吉林大学白求恩医学部动物实验中心,实验方案获得了吉林医药学院动物保护与利用委员会的批准(批准号:190001)。
1.2 主要试剂和仪器蛋白胨和酵母浸膏琼脂购自英国OXOID 公司,麦芽浸出液琼脂、弗氏完全佐剂和不完全佐剂购自美国Sigma 公司,蛋白分子量标准(14 400~97 400)购自北京天恩泽科技有限公司,HRP 标记羊抗兔IgG(H+L)购自中国Proteintech 公司,ECL 化学发光试剂盒购自上海碧云天生物技术有限公司,兔IgG 抗体分析试剂盒购自上海酶联生物科技有限公司。SpectraMax iD5 多功能酶标仪购自上海美谷公司,CX33 倒置显微镜购自日本Olympus 公司,Clear first-2000 蛋白纯化仪购自上海闪谱公司,全自动凝胶/化学发光成像分析仪购自上海天能公司,超净工作台购自苏州安泰空气技术公司。
1.3 Ac 的培养从液氮中取出棘阿米巴虫株冻存管,迅速放置于提早预热至35 ℃水浴锅中,使其迅速解冻融化;向冻存管中加入100 μL 庆大霉素硫酸盐,吹打混匀,用一次性无菌吸管吸出虫体悬液300 μL,涂布于997 固体培养基(麦芽膏 0.1 g、酵母膏 0.1 g 和琼脂10 g,加1 L 蒸馏水溶解,121 ℃高压蒸汽灭菌,倒入一次性90 mm 培养皿中,待凝固后,4 ℃保存);待凝固后封口,倒置于25 ℃恒温培养箱中静置培养,3~5 d 后通过倒置显微镜(×100)观察虫体形态。
1.4 重组Ac-Actin1(recombinantAc-Actin1,rAc-Actin 1)蛋白的小量诱导表达及可溶性分析在超净工作台中,将含有pET22b(+)-Actin 1(His 标签)重组质粒的大肠杆菌BL21(DE3)表达株,以1∶200 比例接种于5 mL 含有氨苄青霉素(ampicillin)抗性(终浓度50 mg·L-1)的LB 肉汤液体培养基中,37 ℃、180 r·min-1条件下摇床中振摇过夜培养;次日将过夜菌液以1∶100比例接种于5 mL 含有Amp 抗体(终浓度50 mg·L-1)的新鲜LB 肉汤液体培养基中,以37 ℃、180 r·min-1条件下振摇培养至吸光度[A(600)]值为0.6~0.8;留取1 mL 菌液至1.5 mL Ep 管中,作为诱导前菌液阴性对照;剩余菌液中加入终浓度为1 mmol·L-1的异丙基硫代半乳糖苷(isopropyl thiogalactoside,IPTG),37 ℃、180 r·min-1条件下振摇诱导4 h;留取40 μL 全菌,剩余菌液于4 ℃、12 000 r·min-1离心10 min,弃上清,收集诱导前后菌体沉淀重悬于40 μL PBS 缓 冲 液(pH 7.2),加 入10 μL 5×SDS-PAGE 上样缓冲液,100 ℃金属浴煮沸10 min,取10 μL 进行SDS-PAGE 分析重组蛋白的表达情况。收集诱导后4 h菌液50 mL,于4 ℃、12 000 r·min-1离心10 min,弃上清;加入20 mmol·L-1Tris-HCl(pH 8.0)裂解液充分混匀菌体沉淀进行超声破碎,将超声后的菌体12 000 r·min-1离心10 min,取等体积上清和沉淀经处理后,进行SDS-PAGE 电泳分析重组蛋白的可溶性。
1.5 rAc-Actin 1 蛋白的纯化及鉴定将表达体系扩增至3 L,于 4 ℃、12 000 r·min-1离心25 min,收 集 菌 体 沉 淀,加 入50 mL 的20 mmol·L-1Tris-HCl(pH 8.0)溶液重悬沉淀,进行超声破碎,留取超声破菌后的沉淀即为包涵体蛋白;对包涵体进行洗涤、变性和复性;复性液通过His Trap FF 预装纯化柱,采用亲和层析方法,使用Clear First-2000 型蛋白纯化系统进行纯化,分别用含100 和200 mmol·L-1Tris-HCl(pH 8.0)溶液洗柱,收集蛋白峰;通过SDS-PAGE 电泳分析重组蛋白的纯化情况。
1.6 rAc-Actin 1 蛋白的多克隆抗体制备3 只体质量约为2.0 kg 的新西兰白兔,免疫前于耳缘静脉取阴性血清;首次免疫以800 μ g 纯化后的rAc-Actin 1 蛋白,加入等体积弗氏完全佐剂,混匀至完全乳化,行背部皮下多点注射;首次免疫后,每间隔2 周进行1 次共3 次的加强免疫,用800 μg免疫原和等体积弗氏不完全佐剂混匀,行背部皮下多点注射;于第4 次免疫后1 周,收集血液,37 ℃静置凝固后,4 500 r·min-1离心10 min,分离血清。
1.7 间接酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)法检测新西兰白兔多克隆抗体效价和抗体亚型纯化后的rAc-Actin 1蛋白(5 mg·L-1),包被96 孔细胞培养板,每孔100 μL,4 ℃过夜;次日弃液,甩干,PBS 缓冲液洗涤3 次;各孔加200 μL 5%脱脂牛奶37 ℃静置封闭1 h;PBS 缓冲液洗涤后,孵育一抗(兔多克隆抗体用PBS 缓冲液进行倍比稀释,稀释梯度分别为1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600、1∶51 200 和1∶102 400);阴性对照孔为100 μL(1∶200)兔阴性血清,空白对照孔为100 μL PBS 缓冲液,37 ℃静置孵育1 h;PBS 缓冲液洗涤后,加入二抗(1∶2 000 稀释的HRP 标记的羊抗兔IgG),每孔100 μL,37 ℃孵育1 h;PBS 缓冲液洗涤后,显色并在450 nm 波长下测量各孔A 值,计算兔多克隆抗体效价(最大A 值的二分之一所对应的稀释梯度)。采用ELISA 试剂盒按照说明书操作,检测抗Ac-Actin 1 IgG 抗体亚型。
1.8 Western blotting 法检测rAc-Actin1 蛋白与兔多克隆抗体的免疫反应性将0.25、0.50和1.00 μg的纯化蛋白分别进行12%的SDS-PAGE 电泳后,按照100 V、1 h 条件进行转膜,将目的蛋白充分转到PVDF 膜上,用含5%脱脂牛奶的PBST 封闭1 h,按照1∶1 000 比例加入兔多抗阳性血清(一抗)过夜孵育,加入适量PBST 洗膜3 次,每次10 min,按照1∶3 000 比例加入带辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔(二抗)室温作用1 h,充分洗膜后加入ECL 显色液,经成像系统分析重组蛋白与兔多克隆抗体的免疫反应性。
1.9 免疫荧光法检测Ac-Actin1 的定位取对数期虫体接种于6 孔细胞培养板中,25 ℃过夜孵育,次日显微镜下观察棘阿米巴滋养体比例达到95%以上进行实验;弃去培养基,用PBS 缓冲液洗涤3 次,去 除 杂 质 及 死 虫 体;4% 多 聚 甲 醛(polyformaldehyde macromolecule,PFA)溶 液 室温固定30 min;PBS 缓冲液洗涤后,加入1 mL Triton X-100,室温孵育30 min;去除孔内液体,充分冲洗,加入800 μL 5% BSA 室温封闭 1 h;分别进行一抗(兔多克隆抗体血清,1∶50)和二抗(Alexa Fluor 488 荧光标记的羊抗兔 IgG,1∶500)孵育;洗涤后,加入800 μL DAPI 染色液;洗涤后,激光共聚焦显微镜(×1 200)观察成像并拍照。
1.10 棘阿米巴滋养体细胞黏附实验检测虫体对细胞的黏附性设置对照组(细胞+虫体)和实验组(细胞+虫体+抗体)。取对数期虫体接种于6 孔细胞培养板中,25 ℃孵育过夜,次日,吹打虫体悬液转 移 至15 mL 离 心 管 中,2 000 r·min-1离心10 min,弃上清,PYG 重悬沉淀。取对数期Vero 细胞,接种于12 孔细胞培养板中,每孔为2.2×104个细胞,于37 ℃、5% CO2培养箱中过夜培养。对照组中细胞加入等数量的滋养体,实验组中加入预先兔多克隆抗体血清孵育(1∶40,37 ℃培养2.5 h)的等数量滋养体,置于37 ℃、5% CO2培养箱中培养。分别于2、4 和6 h 吸去游离虫体,倒置显微镜观察并拍照,计算黏附率,黏附率=虫体黏附Vero 细胞上的数量/细胞的数量×100%。
1.11 统计学分析采用GraphPad Prism 8 软件进行统计学分析。对照组不同时期棘阿米巴滋养体和Vero 细胞共孵育黏附率,实验组不同时期棘阿米巴滋养体、多抗和Vero 共孵育黏附率经正态性检验均符合正态分布,以±s表示,2 组间样本均数比较采用两独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 rAc-Actin 1 蛋白的表达和可溶性分析将重组质粒pET22b(+)-Actin 1(His 标签)转化入大 肠 杆 菌BL21 (DE3)菌 株,经 1 mmol·L-1IPTG、37 ℃诱导表达4 h,进行15% SDS-PAGE电泳。结果表明:在相对分子质量约为28 000 处有一明显的蛋白条带(图1)。收集诱导后4 h 菌体沉淀,经 超 声 破 碎 后,12 000 r·min-1离 心10 min,取等体积上清和沉淀经处理后,行SDS-PAGE 电泳分析重组蛋白可溶性,结果显示:rAc-Actin 1 主要以包涵体形式表达(图2)。
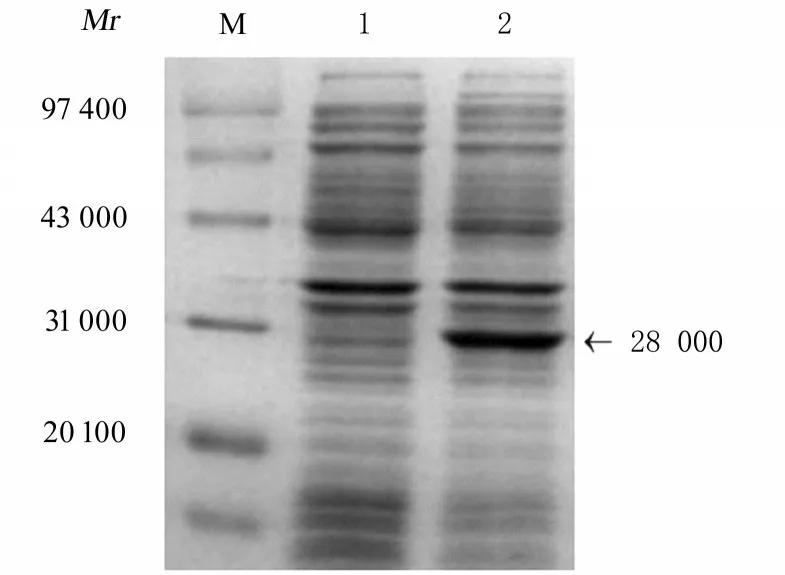
图1 rAc-Actin 1 蛋白的原核表达Fig.1 Prokaryotic expression of rAc-Actin 1 protein
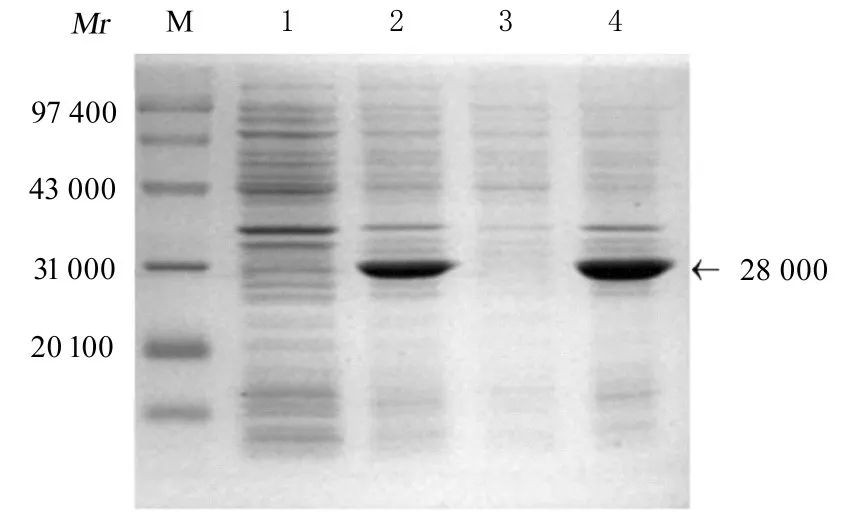
图2 rAc-Actin 1 蛋白的可溶性分析Fig.2 Soluble analysis on rAc-Actin 1 protein
2.2 rAc-Actin 1 的纯化经镍柱纯化后的蛋白,分别取不同浓度的咪唑洗脱峰留样进行SDSPAGE 电泳鉴定重组蛋白的纯化效果,结果表明:100 mmol·L-1咪唑浓度时,蛋白纯度较高(图3)。
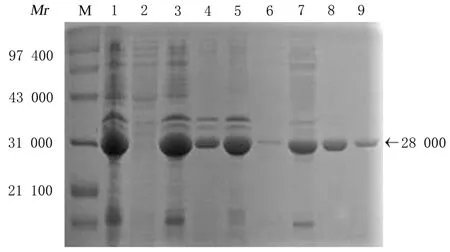
图3 rAc-Actin 1 蛋白的纯化Fig.3 Purification of rAc-Actin 1 protein
2.3 rAc-Actin 1 蛋白免疫兔多克隆抗体效价随着稀释度的增加,A (450)值逐渐下降,最大A 值1/2 处所对应的稀释倍数为抗体的效价,为1∶6 400 (图4)。
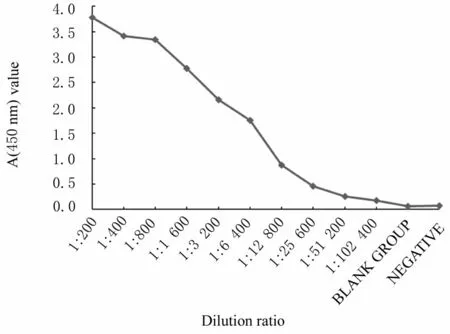
图4 间接ELISA 法检测重组蛋白免疫兔多克隆抗体效价Fig.4 Titers of recombinant protein immunized rabbit polyclonal antibodies detected by indirect ELISA method
2.4 兔多克隆抗体亚型IgG1 和IgG2a采用ELISA 抗体分型试剂盒测定兔血清中的抗Ac-Actin1 IgG1 和IgG2a 浓度,绘制标准曲线,计算IgG1 和IgG2a 平均浓度,分别为116.76(图5)和1 136.15 mg·L-1(图6)。
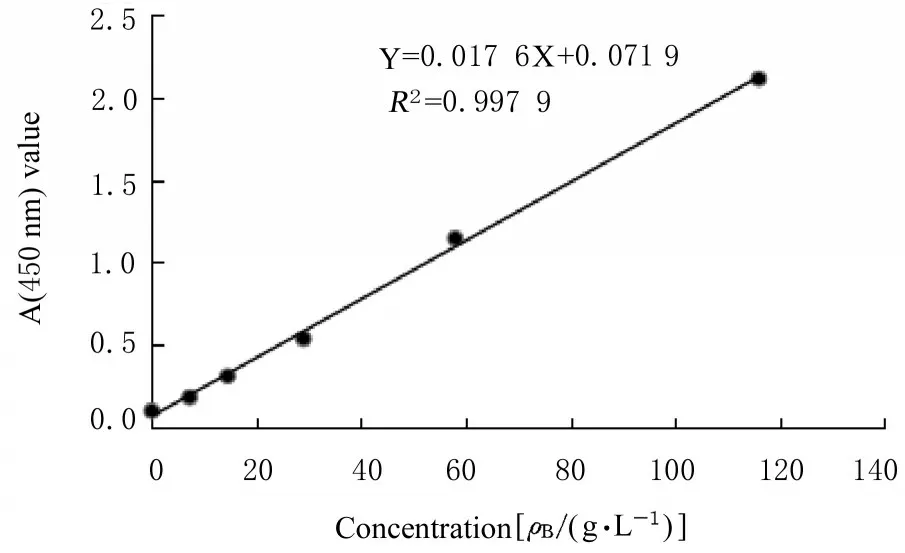
图5 兔血清IgG1 标准曲线Fig.5 Standard curve of serum IgG1 of rabbits
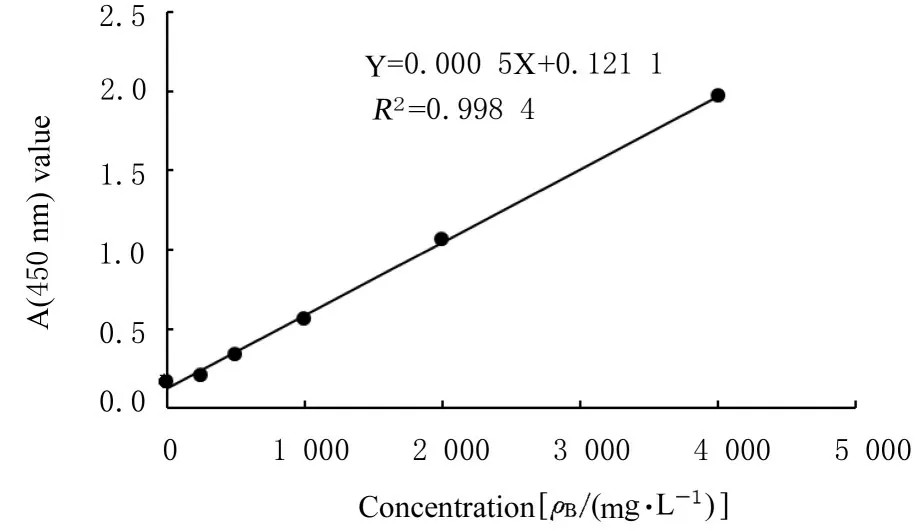
图6 兔血清IgG2a 标准曲线Fig.6 Standard curve of serum IgG2a of rabbits
2.5 rAc-Actin 1 蛋白与兔多克隆抗体的免疫反应性经Western blotting 法检测后,成像系统显示目标条带清晰可见,且背景干净无杂带出现,表明rAc-Actin 1 与兔多克隆抗体具有较好的免疫反应性(图7)。
2.6 rAc-Actin 1 蛋白的免疫荧光定位采用间接免疫荧光定位实验,通过激光扫描共聚焦显微镜放大1 200 倍,可以观察到Ac-Actin 1 主要定位于滋养体的细胞膜上,内外膜均有分布(图8)。
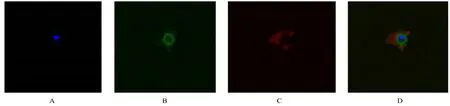
图8 rAc-Actin 1 在滋养体中的免疫荧光定位(Bar=10 μm)Fig.8 Immunofluorescence localization of rAc-Actin 1 in trophozoites(Bar=10 μm)
2.7 Ac-Actin 1、棘阿米巴原虫和Vero 细胞共孵育的黏附作用采用1∶40 的兔抗rAc-Actin 1 多克隆抗体孵育滋养体后,进行细胞黏附实验,结果显示:对照组黏附率为(66.11%±0.11%),抗体与虫体孵育时间2 h时,黏附率为(42.88%±0.04%);4 h 时,黏附率为(29.34%±0.01%);6 h 时,黏附率为(26.63%±0.02%)。虫体和细胞孵育对照组2 h 时,黏附率为78.79%±0.01%;4 h 时,黏附 率 为60.53%±0.03%;6 h 时,黏 附 率 为66.11%±0.02%。随着抗体与虫体孵育时间的延长,实验组棘阿米巴原虫对Vero 细胞的黏附率明显降低,与对照组比较差异有统计学意义(P<0.01),表明抗rAc-Actin 1多克隆抗体可有效阻断虫体的黏附作用。
3 讨 论
AK 的感染和致病涉及一系列过程,包括棘阿米巴滋养体与角膜上皮细胞黏附、分泌蛋白质水解酶促进滋养体通过基底膜和基质对角膜的入侵和渗透、破坏角膜上皮细胞和基质细胞等[15-19]。研究[19-20]表明:甘露糖结合蛋白可介导滋养体黏附到角膜上皮细胞,同时通过诱导MIP-133 对角膜上皮细胞产生细胞病变作用。若以MIP-133 免疫中国仓鼠,其泪液中可产生出抗MIP-133 的SIgA 型抗体,该抗体在一定程度上可以抵御滋养体的感染[21]。但当滋养体大量黏附后,其抗感染的作用也被大大削弱[22]。因此,切断虫体的黏附是抵御虫体致病的关键。
为进一步探讨Ac-Actin 1 在棘阿米巴滋养体黏附入侵过程中的作用,本研究以纯化的rAc-Actin 1免疫新西兰白兔,制备兔多克隆抗体,检测抗体效价(1∶6 400),证明rAc-Actin 1 具有良好的免疫原性,同时rAc-Actin 1 与兔抗rAc-Actin 1 多克隆抗体具有良好的免疫反应性;为了确定rAc-Actin 1所触发的免疫类型,检测多克隆抗体亚型(IgG1 和IgG2a)浓 度,分 别 为 116.76 g·L-1和1 136.15 mg·L-1,且IgG1 浓 度 明 显 大 于IgG2a,表明rAc-Actin 1 同时刺激机体产生体液免疫应答和细胞免疫应答,但以Th2 免疫反应为主;Ac-Actin 1 主要定位于棘阿米巴原虫的细胞膜上;共孵育实验结果显示:Ac-Actin 1 对Vero 细胞具有黏附作用。当虫体与兔抗rAc-Actin 1 多克隆抗体共孵育后,虫体对细胞的黏附率明显下降,表明Ac-Actin 1 可能参与虫体入侵的黏附过程,兔抗rAc-Actin 1多克隆抗体可有效阻断虫体的黏附,具有一定的保护作用。
综上所述,环境中普遍存在的棘阿米巴成囊是导致棘阿米巴耐药及感染难以治愈的主要原因[23-24]。由于棘阿米巴角膜炎诊断技术的滞后[25],感染的预防对于棘阿米巴感染的防治至关重要。然而目前尚无抗棘阿米巴疫苗。本研究以Ac-Actin 1为候选分子,探讨Ac-Actin 1 免疫学特性及其在棘阿米巴入侵过程中对宿主细胞的黏附作用,为棘阿米巴感染分子机制和免疫预防策略的研究提供新思路。
