姜黄素通过下调PI3K/Akt/mTOR 信号通路蛋白表达对胃癌MGC-803 细胞增殖和侵袭的抑制作用
2023-05-06孙逸飞李迪诺王玉彬
孙逸飞, 李迪诺, 王玉彬
(1.锦州医科大学研究生院,辽宁 锦州 121000;2.锦州医科大学附属第一医院普外胃肠科,辽宁 锦州 121000)
1 材料与方法
1.1 实验动物、细胞株、主要试剂和仪器32 只SPF 级雄性BALB/c 小鼠(5~6 周龄),购自辽宁长生生物有限公司,动物生产许可证号:SCXK(辽)2012-0001。胃癌细胞株MGC-803 购于中国科学院细胞库。姜黄素购于美国Sigma 公司,溶解于1% 羧甲基纤维素钠分别配成含10、20 和40 μmol·L-1的混悬液备用。一步法TUNEL 细胞凋亡检测试剂盒、增强型CCK-8 试剂盒、磷酸化PI3K(phosphorylated PI3K,p-PI3K)、磷酸化Akt(phosphorylated Akt,p-Akt)和 磷 酸 化mTOR(phosphorylated mTOR,p-mTOR)一抗及酶标二抗均购自上海碧云天生物技术有限公司,蛋白质定量试剂盒(BCA 法)购自北京普利莱基因技术有限公司,ECL-Plus 荧光检测试剂购自北京索莱宝科技有限公司。石蜡包埋机(型号:TKY-BMB)购自上海寰熙医疗器械有限公司,切片机(型号:DK-2268-Ⅵ)和荧光显微镜(型号:PLJ-131)购自北京世纪科信科学仪器有限公司),酶标仪(型号:EXL808)购自美国Bio-RAD 公司,CO2培养箱(型号:371 型)购自美国Thermo Fisher Scientific公司。
1.2 细胞实验分组胃癌MGC-803 细胞接种于RPMI 1640培养基(含10%胎牛血清、100 U·mL-1青霉素和链霉素)中,置于恒温37 ℃、5% CO2的细胞培养箱中培养。当细胞融合度达到85%以上进行传代培养,取对数生长期细胞用于实验。细胞实验分为对照组、低剂量(10 μmol·L-1)姜黄素组、中 剂 量(20 μmol·L-1)姜 黄 素 组 和 高 剂 量(40 μmol·L-1)姜黄素组。
1.3 小鼠皮下移植瘤的制备及给药处理将32 只小鼠随机分为对照组、低剂量姜黄素组(0.5 mg·kg-1姜黄素)、中剂量姜黄素组(1 mg·kg-1姜黄素)和高剂量姜黄素组(2 mg·kg-1姜黄素),每组8 只。各组小鼠皮下注射5×105个胃癌MGC-803 细胞,待肿瘤体积达到100 mm3时视为造模成功,进行下一步实验。不同剂量姜黄素组小鼠灌胃对应浓度的姜黄素,对照组小鼠灌胃等量生理盐水。每天观察并记录小鼠存活情况,每3 d 测量1 次肿瘤体积,于第30 天摘取肿瘤组织保存备用。肿瘤体积(mm3)=长×宽2/2。
1.4 CCK-8 法检测各组MGC-803 细胞增殖能力
将MGC-803 细胞接种于96 孔细胞培养板内,每孔1×106个,分别经0、10、20 和40 μmol·L-1的姜黄素处理24、48 和72 h 后,向各孔中加入20 μL 增强型CCK-8 溶液,放置于细胞培养箱中继续培养1 h。提前预热酶标仪,在450 nm 测定吸光度(A)值,测量数据用以评估各组细胞的增殖能力,每组设置3 个复孔,以A 值表示相应时间点的细胞增殖能力,A 比值=A48h值/A0h值。
1.5 Transwell 法检测各组MGC-803 细胞侵袭能力将细胞接种于12 孔细胞培养板,每孔1×105个细胞,加入0、10、20 和40 μmol·L-1的姜黄素处理24 h 后,将细胞消化并转移到基质胶包被的Transwell 小室上室,下室加入含20%胎牛血清的培养基,继续培养24 h,弃培养基,4%多聚甲醛室温固定15 min,0.1%结晶紫室温染色30 min,PBS 缓冲液冲洗3 遍,棉签擦净未穿膜细胞,光学显微镜下低倍镜观察,随机选取5 个视野计数穿膜细胞数,高倍镜(×200)下分别计数5 个视野的穿膜细胞数,计算每个视野的平均细胞数,以侵袭细胞数代表细胞侵袭能力。
1.6 流式细胞术检测各组MGC-803 细胞凋亡率按照每孔2×106个细胞接种于6 孔细胞培养板内,培养过夜后,加入10、20 和40 mol·L-1姜黄素处理24 h,PBS 缓冲液洗涤细胞,胰酶消化,1 000 g 离心5 min,弃上清,收集细胞,PBS 缓冲液重悬并计数,取5×104个重悬细胞,1 000 g 离心5 min,弃上清,加入195 μL Annexin Ⅴ-FITC 结合液重悬细胞,加入5 μL Annexin Ⅴ-FITC,轻轻混匀,加入10 μL 碘化丙啶(propidium iodide,PI)染色液,轻轻混匀,室温避光孵育20 min,流式细胞仪上机检测。Annexin Ⅴ-FITC/PI 双染细胞凋亡检测方法,用标记FITC 的AnnexinⅤ作为荧光探针,利用流式细胞仪检测细胞凋亡率。随机选取5 个不同视野,计算每个视野细胞凋亡率。细胞凋亡率=凋亡细胞数/ (凋亡细胞数+正常细胞数)×100%。
1.7 TUNEL 法检测小鼠移植瘤组织中细胞凋亡率无菌取出肿瘤组织,固定于4%的多聚甲醛中,制成4 μm 厚度的石蜡切片。依次放入二甲苯中浸泡10 min、无水乙醇浸泡5 min、90%乙醇浸泡2 min、70%乙醇浸泡2 min,蒸馏水浸泡2 min。滴 加20 mg·L-1不 含DNase 的 蛋 白 酶K,放 置 于37 ℃中作用15~30 min。PBS 缓冲液洗涤3 次,每次10 min。向切片上滴加配置好的TUNEL 检测液使其均匀覆盖切片,37 ℃避光孵育60 min。PBS 缓冲液洗涤3 次,每次10 min。用抗荧光淬灭剂封片,荧光显微镜下观察。在荧光显微镜(激发光存在下)计数阳性细胞数,然后在相同视野下,调节激发光至关闭,并开启正常透射光,即可计数总细胞数。随机选取5 个不同视野,计算每个视野细胞凋亡率。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.8 各组小鼠移植瘤组织中PI3K、Akt 和mTOR蛋白表达水平小鼠胃部移植瘤组织提取:无菌分离小鼠移植瘤组织并提取各组小鼠肿瘤组织总蛋白。应用BCA 蛋白定量试剂盒检测以上各样本蛋白浓度,取20 μg 样品进行SDS-PAGE 电泳,转至PVDF 膜上,5%脱脂奶粉室温封闭1 h,TBST 缓冲液清洗3 次,每次5 min;加入稀释好的一抗,4 ℃过夜孵育。次日用TBST 缓冲液洗膜3 次,每次5 min;再加入稀释好的二抗,室温孵育2 h,TBST 缓冲液洗膜3 次,每次10 min;避光滴加ECL 液曝光显影,采用Image J 软件计算蛋白条带灰度值。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值,磷酸化目的蛋白表达水平=磷酸化蛋白条带灰度值/总蛋白条带灰度值。
区内岩浆活动强烈,岩体极为发育,有大小岩体十几个,呈岩基、岩株产出,参照《中国矿产地质志(江西卷)》(2015),区内主要出露岩体为早志留世的万洋山序列及晚侏罗世的葛仙山序列。
1.9 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组MGC-803 细胞增殖能力、侵袭能力、细胞凋亡率和小鼠移植瘤体积、移植瘤组织中细胞凋亡率及PI3K、Akt 和mTOR 蛋白表达水平,均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 CCK-8 法检测各组MGC-803 细胞增殖能力与对照组比较,不同剂量姜黄素组中MGC-803细胞增殖能力明显降低(P<0.05)。低剂量姜黄素组中的细胞增殖能力明显高于高剂量姜黄素组(P<0.05),而中剂量姜黄素组细胞增殖能力则介于低剂量和高剂量姜黄素组之间。见表1。
表1 CCK-8 法检测各组MGC-803 细胞增殖能力Tab.1 Proliferation abilities of MGC-803 cells in various groups detected by CCK-8 method (n=3,±s)
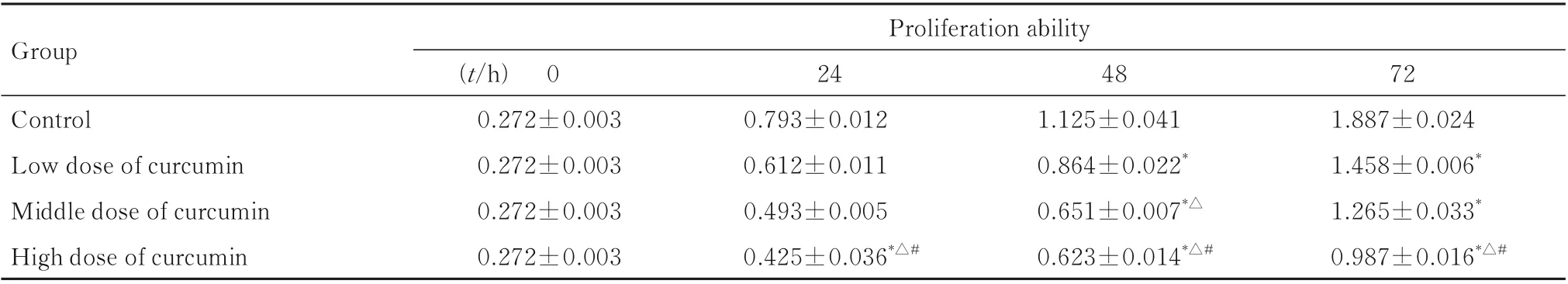
表1 CCK-8 法检测各组MGC-803 细胞增殖能力Tab.1 Proliferation abilities of MGC-803 cells in various groups detected by CCK-8 method (n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with low dose of curcumin group;#P<0.05 compared with middle dose of curcumin group.
Group Proliferation ability 24 48 72 Control Low dose of curcumin Middle dose of curcumin High dose of curcumin(t/h) 0 0.272±0.003 0.272±0.003 0.272±0.003 0.272±0.003 0.793±0.012 0.612±0.011 0.493±0.005 0.425±0.036*△#1.125±0.041 0.864±0.022*0.651±0.007*△0.623±0.014*△#1.887±0.024 1.458±0.006*1.265±0.033*0.987±0.016*△#
2.2 各组MGC-803 细胞中侵袭细胞数与对照组比较,不同剂量姜黄素组MGC-803 细胞中侵袭细胞数降低(P<0.05);低剂量姜黄素组细胞中侵袭细胞数明显高于高剂量姜黄素组(P<0.05);而中剂量姜黄素组MGC-803 细胞中侵袭细胞数介于低剂量姜黄素组和高剂量姜黄素组之间(P<0.05)。见图1 和2。
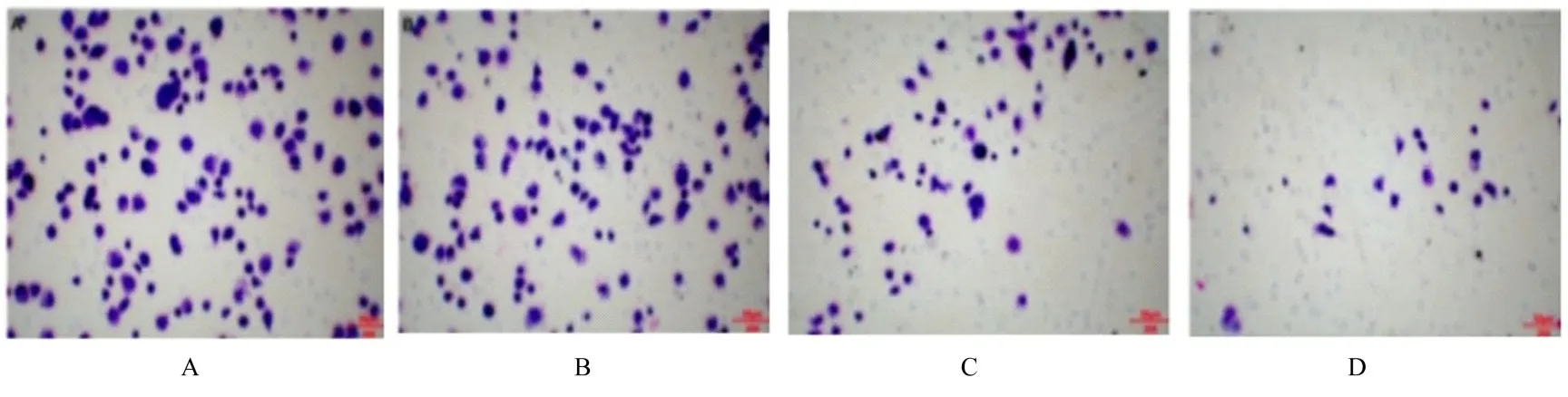
图1 各组MGC-803 细胞侵袭形态表现(结晶紫,×200)Fig.1 Invasive morphology of gastric cancer MGC-803 cells in various groups(Crystal violet,×200)
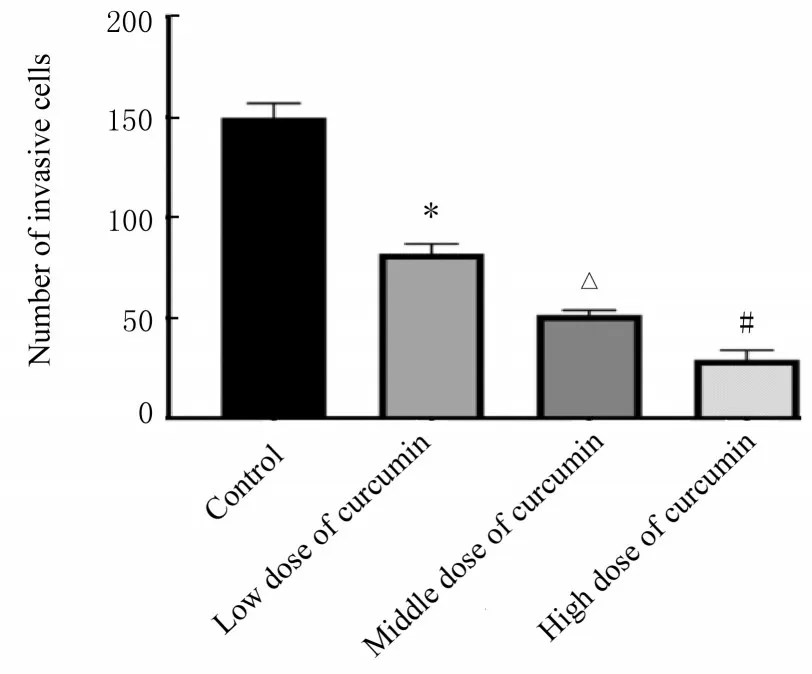
图2 Transwell 法检测各组MGC-803 细胞侵袭数Fig.2 Number of invasion MGC-803 cells in various groups detected by Transwell method
2.3 各组MGC-803 细胞凋亡率与对照组比较,不同剂量姜黄素组MGC-803 细胞凋亡率明显升高(P<0.05)。低剂量姜黄素组MGC-803 细胞凋亡率明显低于高剂量姜黄素组(P<0.05),而中剂量姜黄素组MGC-803 细胞凋亡率则介于低剂量姜黄素组和高剂量姜黄素组之间(P<0.05)。见图3 和4。
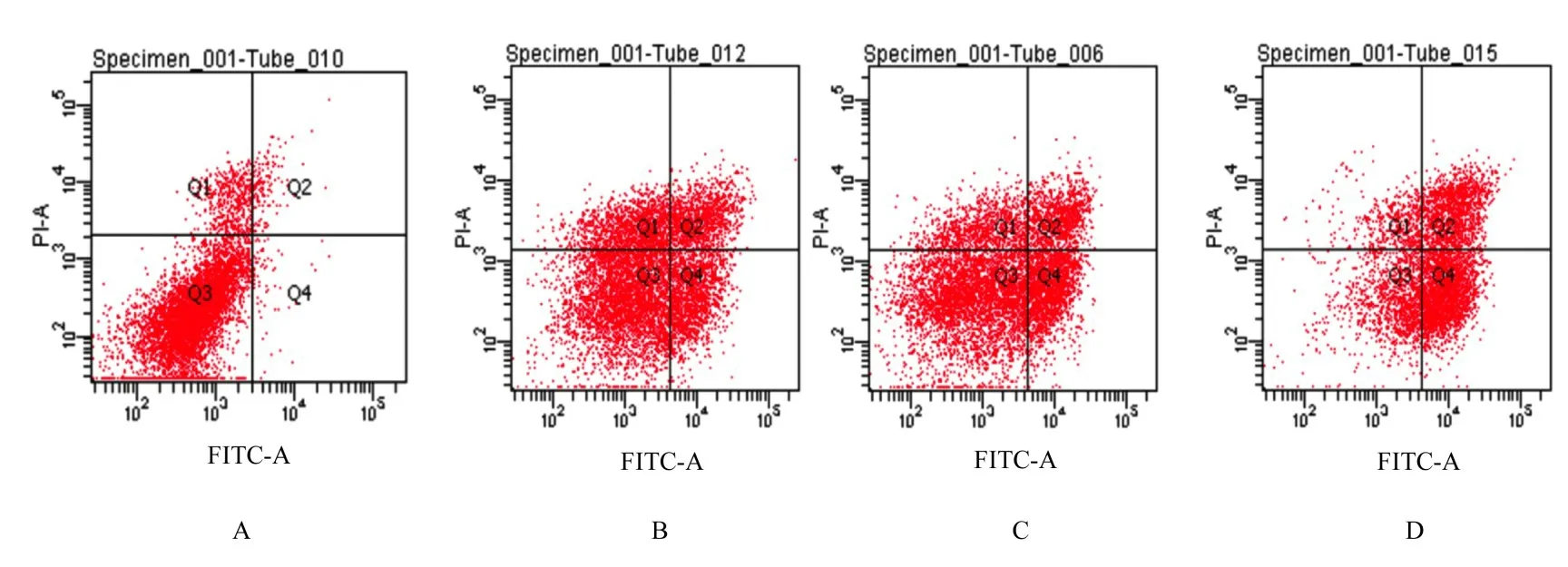
图3 流式细胞术检测各组MGC-803 细胞凋亡率Fig.3 Apoptotic rates of MGC-803 cells in various groups detected by flow cytometry
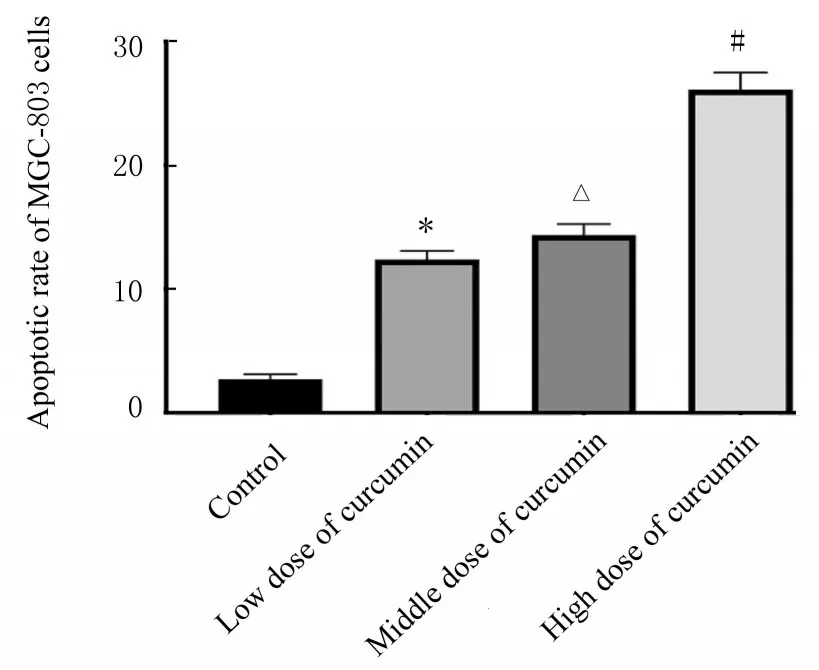
图4 各组MGC-803 细胞凋亡率Fig.4 Apoptotic rates of MGC-803 cells in various groups detected by flow cytometry
2.4 各组小鼠移植瘤体积连续监测各组小鼠移植瘤体积,对照组小鼠移植瘤体积为(425.4±17.6)mm3,低剂量姜黄素组小鼠移植瘤体积为(187.6±15.9)mm3、中剂量姜黄素组小鼠移植瘤体积为(47.5±8.4)mm3,高剂量姜黄素组小鼠移植瘤体积为(19.7±5.2)mm3,与对照组比较,不同剂量姜黄素组小鼠移植瘤体积明显缩小(P<0.05)。见图5。

图5 各组小鼠移植瘤大体形态表现Fig.5 General morphologly of transplanted tumors of mice in various groups
2.5 各组小鼠移植瘤组织的细胞凋亡率TUNEL 染色观察各组小鼠移植瘤组织的细胞凋亡率,结果显示:对照组小鼠移植瘤的细胞凋亡率较低,与对照组比较,不同剂量姜黄素组小鼠移植瘤的细胞凋亡率升高(P<0.05);中剂量姜黄素组小鼠移植瘤的细胞凋亡率明显高于低剂量姜黄素组(P<0.05),高剂量姜黄素组小鼠移植瘤的细胞凋亡率明显高于中剂量姜黄素组(P<0.05)。见图6 和7。
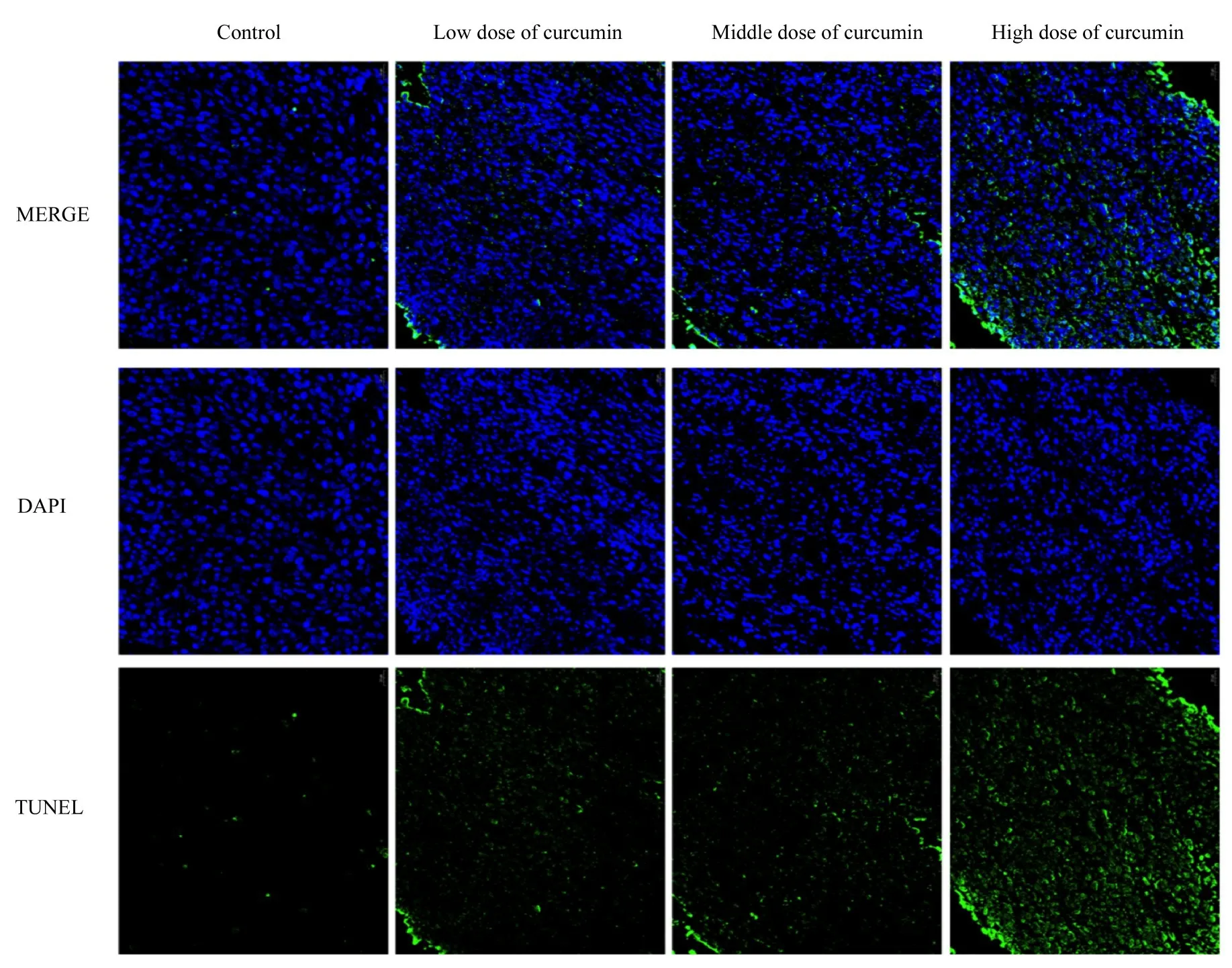
图6 TUNEL 法检测各组小鼠移植瘤组织的细胞凋亡情况 (×200)Fig.6 Apoptosis of cells of transplanted tumor tissue of mice in various groups detected by TUNEL method(×200)
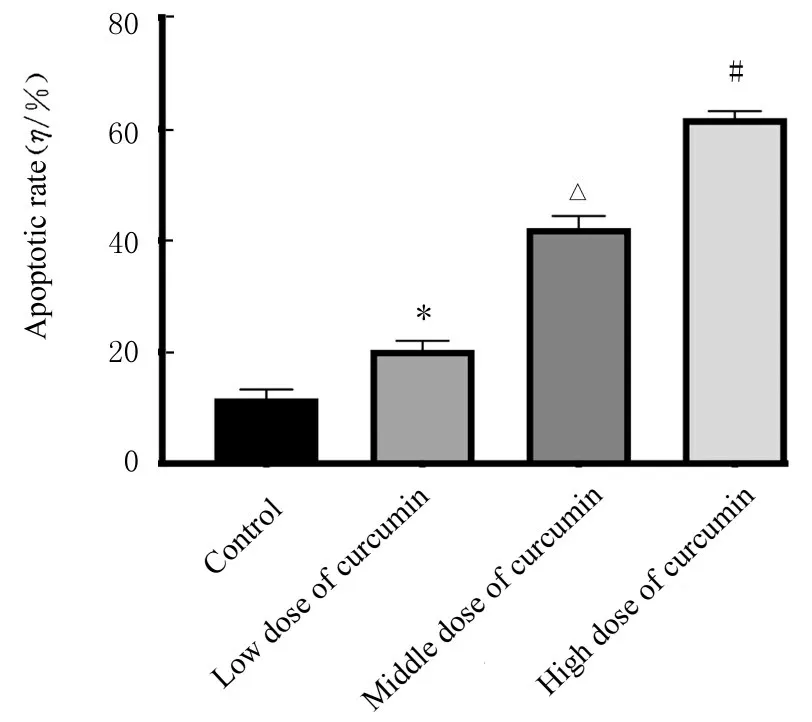
图7 各组小鼠移植瘤组织的细胞凋亡率 (×200)Fig.7 Apoptotic rates of cells of transplanted tumor tissue of mice in various groups(×200)
2.6 各组小鼠移植瘤组织中PI3K、p-AKT 和p-mTOR 蛋白表达水平与对照组比较,不同剂量姜黄素组 小 鼠 移 植 瘤 组 织 中PI3K、p-Akt 和p-mTOR 蛋白表达水平随剂量升高而明显降低(P<0.05)。低剂量姜黄素组小鼠移植瘤组织中PI3K、p-Akt 和p-mTOR 蛋白表达水平明显高于中剂量姜黄素组(P<0.05),而高剂量姜黄素组小鼠移植瘤组织中PI3K、p-Akt 和p-mTOR 蛋白表达水平明显低于中剂量姜黄素组(P<0.05)。见图8。
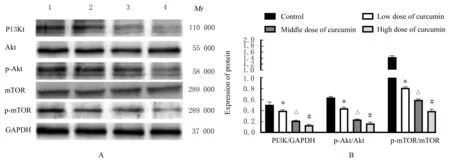
图8 Western blotting 法检测各组小鼠移植瘤组织中PI3K/AKT/mTOR 信号通路蛋白表达电泳图(A)和直条图(B)Fig.8 Electrophoregram (A) and histogram (B) of expressions of PI3K/AKT/mTOR signaling pathway proteins in transplanted tumor tissue of mice in various groups detected by Western blotting method
3 讨 论
胃癌是世界上最常见的癌症之一,近年来胃癌在亚洲地区发病率呈上升趋势[7-8]。常见的胃癌治疗方法包括化疗、放疗、胃切除和靶向治疗[9-11],其中化疗是胃癌的主要治疗方法,但其具有严重的不良反应和化疗耐药性[12]。姜黄素是从姜黄中提取的一种多酚化合物,具有很强的抗氧化、抗炎和抗肿瘤作用[13],可能通过调节致癌途径来抑制癌症的发生[14],对胃癌的作用包括直接抑制增殖和侵袭、诱导凋亡、化学治疗增敏及逆转耐药、抗化学物质诱导胃癌和抗幽门螺旋杆菌等作用,其机制主要是通过调节癌基因和抑癌基因及多种信号通路从而抑制多种肿瘤细胞的生长、侵袭和转移[15]。本研究以人胃癌MGC-803 细胞为研究对象,研究姜黄素对MGC-803 细胞体内外增殖、迁移、侵袭和凋亡的影响及其可能机制。
胃癌的进展与一系列分子水平变化有关,包括相关基因的突变以及异常表达、信号通路的激活等,分子靶向治疗在抗肿瘤治疗中已显现出良好的应用前景。研究[16]显示:细胞信号转导通路的异常与胃癌的发生发展有密切关联。肿瘤细胞可以通过EMT 获得更强的迁移和侵袭能力[17],此过程通常是在多种生长因子的诱导下,活化有关信号通路,通过一系列表观遗传调控反应,促进相关转录调控因子Snail 和Slug 的表达,下调上皮标记物的表达,引起肿瘤起始细胞的抗凋亡和浸润侵袭等能力增强,进而促进肿瘤发生发展[18]。因此,降低肿瘤细胞的增殖、迁移和侵袭能力,促进其凋亡是抑制肿瘤扩散和转移的关键。既往研究[19]表明:姜黄素可以抑制肿瘤干细胞的自我更新和分化能力,降低肿瘤干细胞在癌细胞中的数量。姜黄素还可以下调P21 蛋白激活激酶1 (P21 protein activated kinase 1,PAK1)活性及细胞周期蛋白D1(cyclinD1)的表达,阻断胃癌细胞周期从G1期到S 期的转换,抑制胃癌细胞的增殖[20-22]。本研究结果显示:不同剂量的姜黄素治疗均能有效抑制MGC-803 细胞的增殖、迁移和侵袭能力,并促进其凋亡。体内实验结果表明:口服姜黄素能够明显抑制肿瘤的形成,促进肿瘤细胞的凋亡,有效延缓小鼠死亡。
PI3K/Akt 信号通路是经典的细胞内信号通路[23],该通路在功能上与细胞增殖、细胞存活、新陈代谢和静止有关[24]。PI3K/Akt 信号通路还可以通过参与EMT 促进胃癌的发生和发展[25]。Akt是PI3K 下游的关键信号节点,其是一种丝氨酸/苏氨酸蛋白激酶,在促进细胞存活及调节多种功能中起重要作用。Akt 活性异常能够导致正常细胞向恶性细胞的转化,其磷酸化后能够促进肿瘤细胞的生长、侵袭和转移,并抑制肿瘤细胞的凋亡[26]。mTOR 为Akt 下游基因,能够被p-Akt 直接或间接诱导磷酸化而激活,p-mTOR 是自噬过程主要调节蛋白,p-mTOR 能够调控细胞周期而促进细胞增殖[27]。研 究[28]表 明:药 物UFM1 可 以 通 过 抑 制PI3K/Akt 分子信号通路降低胃癌细胞的迁移。应用药物治疗也可以通过调节PI3K/Akt/mTOR 信号通路诱导胃癌细胞自噬依赖性凋亡[29]。本研究结果显示:不同剂量的姜黄素组小鼠移植瘤组织中p-PI3K、p-Akt 和p-mTOR 蛋白表达水平均明显低于对照组,验证了姜黄素可以通过抑制PI3K/Akt/mTOR 表达在胃癌中发挥保护作用。PI3K-AktmTOR 通路作为细胞内非常重要的信号转导途径,在细胞的生长、存活、增殖、凋亡、血管生成和自噬等过程中发挥极其重要的生物学功能[30],关于该通路在胃癌细胞的增殖调控中发挥重要作用已有很多报道,近年来,姜黄素的抗癌作用一直都是研究热点,因此本研究基于PI3K/Akt/mTOR 信号通路探讨中药姜黄素的作用机制,同时观察不同剂量的姜黄素对小鼠移植瘤细胞的影响,为开展癌症的靶向药物开展临床试验提供理论依据。
综上所述,姜黄素通过下调PI3K/Akt/mTOR信号通路相关蛋白的表达,在体外有效地抑制胃癌细胞增殖、迁移和侵袭,并促进其凋亡,而在体内可以抑制肿瘤的生长。本研究为胃癌的治疗提供了新的理论依据,但其应用于临床治疗效果还有待进一步研究。
