AI+化学:从自动化迈向智能化探索
2023-04-29韩英锋鲁欣月张乐
韩英锋 鲁欣月 张乐
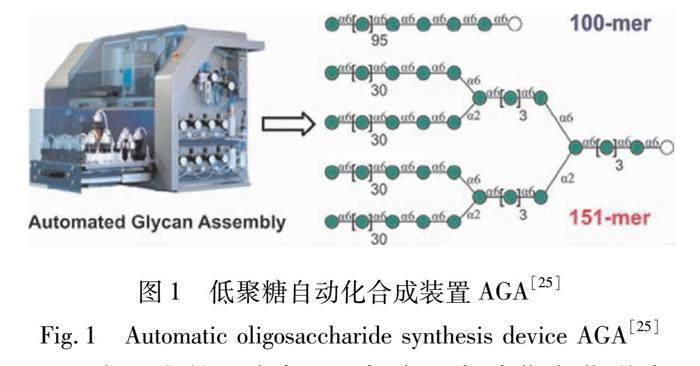

摘要 当前, 多学科交叉范式的逐渐深入发展对传统化学合成提出了更精确、 更高效的新要求。 近年来,随着以机器学习为代表的人工智能技术快速发展, “AI+化学”模式使自动化合成逐渐迈向智能化。 人工智能通过挖掘海量化学实验数据, 不但可以帮助研究者做出合理分析预测, 而且可以将研究者从繁琐复杂的日常实验中解放出来, 大大加速相关研发过程。 梳理了化学研究领域由自动化合成迈向智能化的发展历程, 介绍了实验室自动化平台的发展历程, 随后系统讨论了实验室自动化平台构建范式, 强调自动化合成技术与人工智能结合以期实现化学合成的智能化闭环策略,最后展望了该领域的未来发展前景。
关键词 实验室自动化;自动化合成;人工智能化学;机器学习;学科交叉
中图分类号:O6-05 DOI:10.16152/j.cnki.xdxbzr.2023-01-001
AI & Chem: From automation to intelligence
HAN Yingfeng, LU Xinyue, ZHANG Le
(College of Chemistry and Materials Science, Northwest University, Xian 710127, China)
Abstract At present, the gradual and in-depth development of multidisciplinary paradigm has put forward new requirements to traditional chemical synthesis. Recently, with the rapid development of artificial intelligence technology represented by machine learning, the "AI+Chem" model has gradually made automatic synthesis intelligent. By mining massive chemical experiment data, AI can not only help researchers make reasonable analysis and prediction, but also liberate researchers from tedious and complex daily experiments, which can greatly accelerate the related research and development process. This review combs the recent development of chemical research field from automatic synthesis to intelligence. We started with the description of the development of laboratory automation platform. Then, we systematically summarized recent progress on the construction paradigm of laboratory automation platform, emphasized the combination of automatic synthesis technology and artificial intelligence to achieve intelligent closed-loop strategy of chemical synthesis. Finally, we discussed the future development prospects of this field.
Keywords laboratory automation; automated synthesis; artificial chemistry intelligence; machine learning; interdisciplinarity
合成化學是化学学科的基础和核心[1-2]。化学合成不仅可以制造自然界中存在较少或原本不存在的物质,还可以精准创制具有特定性能和不同功能的新物质。所以,化学合成对科学发展和人类进步起着非常重要的作用。
化学合成的主要目标之一是改进现有的研究模式,利用新的合成方法和技术来制备新的化合物。传统有机合成模式下的反应过程与现象往往依靠化学家的经验进行判断,这要求化学家必须积累丰富的化学知识[3]。如今,在科研人员的不断努力之下,化学研究体系和研究方法已日趋成熟,通过人工总结经验,实验操作也得以规范化、标准化,但多学科交叉研究范式的发展对化学合成提出了更为精确化、高效化的要求。
对于化学这个相对开放的学科来说,目前知识共享仍非常分散,科研人员往往通过阅读文献来相互交流,但这种方式具有很大的局限性[4]。文献报道的合成方法常因个人表达习惯的差异,导致一些重要参数被忽略,而化学反应空间的多维性会使完全相同的实验产生明显不同的结果,从而造成同一化学反应的重现性不高[5]。
在有机合成路线的设计中,逆合成分析是最基本、最常用的方法,但其准确性仍然依靠手动试错来进行验证。这一过程需要耗费大量时间,当化学家必须连续检测几小时的反应,进行一些重复的实验操作时,独立思考的时间将大大减少,长此以往不利于科研人才的培养和科研的创新[6]。
一路走来,尽管我们在化学领域中取得了很大的成就,但是原有的科研模式似乎已跟不上当下的科研发展趋势。在科学技术发展突飞猛进、日新月异的21世纪,对于上述化学领域中存在的问题,我们需要联用各种创新方案解决问题,尤其是在目前学科交叉的大研究氛围之中,各学术团体都应积极参与进来,在思维方式和战略方法上,针对新的技术和发现进行深刻的演变。
1 实验室自动化平台发展
实验室自动化是一种减少实验室人工干预的方法,具有提高实验效率的潜能,如减少重复和提高通量、通过机器高精度的系统来提高实验的重现性以及减少人类接触有害化学物质的机会来提高实验的安全性等优点,一直以来被广泛关注[7-15]。
实验室自动化率先在生命科学领域取得进展。在20世纪60年代,Merrifield和Stewart提出了第一个固相肽合成自动化系统,成功地减少了逐步添加和纯化样品所需的时间,并降低了材料的损失[16-18]。从此,自动化系统逐步进入实验室。早期的自动化系统主要是以机械系统的设计形式来执行可重复性的实验操作任务,这些系统的出现为自动化合成化学和现代化高通量实验平台的发展奠定了基础。
20世纪80年代,生命科学领域的工作者为了高效分离和稀释生物样品,开发出自动化液体处理程序,该程序可以在极少的人工干预下生成一致的样品阵列,被广泛应用于临床样品和药物研发的高通量筛选分析。
20世纪90年代,科学家们基于组合化学(CombiChem)和多样性导向合成(DOS)的平行化学研究促使自动化和高通量筛选系统的发展趋向成熟,并成为一个重要的药物发现辅助工具,从而用于合成路线先导物的选择,以及针对多种生物分子属性进行优化[19-20]。
随后,生命科学领域中基于肽[21-22]、寡核苷酸[23]以及寡聚糖[24-25]的自动化合成仪器被大量开发(见图1),实现了自动合成蛋白质[26-27]、基因[28-29],甚至完整的基因序列[30],极大地推动了生物科学的发展;肽和寡核苷酸候选药物的易得性[31-32],以及低聚糖自动化合成对疫苗开发也产生了重要影响[33]。在制药领域中,从新分子的发现、纯化到产量化,自动化的平行实验起着越来越重要的作用[34]。例如,自动化和高通量筛选系统常应用于生物分析和药物分子筛选[35-36]。
在过去的几十年里,实验室自动化在化学实验室配置方面也取得了稳步的进展,包括对学术领域和工业领域中的催化转化识别、反应筛选,以及快速检测药物晶体的形式都产生了巨大影响(见图2、图3)[37-49]。
1985年,Bolla实验室引入了一种能够进行多种化学反应的自动化合成装置[50]。该装置具有特定的编程语言,并配有计算机接口功能,主要用来将实验室规模的反应参数优化到工业规模。由Deuchi和Okamota设计的自动化合成平台已被全面开发,这些自动化合成仪器可以24 h运转,进行常见的克级有机反应[51-52]。2000年,Otera课题组开发的自动化一锅合成器MEDLEY(见图4)可完成反应条件为-78 ℃到室温的惰性气氛反应[53]。Otera课题组利用MEDLEY进行各种化学转化(见图5),包括对空气敏感的有机锂反应、格氏反应以及过渡金属催化的交叉偶联反应[54]。
2010年,Takahashi课题组同样开发了一种空气敏感化学反应自动化合成平台ChemKonzert(见图6),该平台包含一个额外的离心分离器,既可以进行液-液萃取,也可进行各种不同反應[55-59],ChemKonzert完成了自动化三步合成α-氨基醛的反应[60]。
2017年,随着AlphaGO打败人类顶级围棋棋手,深度学习这一概念被人们所熟知[61-62]。最近,AlphaFold2的报道又令蛋白质结构预测走向一个新的阶段[63-66]。在化学领域中,深度学习最先被应用于预测小分子的活性结合位点[67]、人工智能合成路线设计[68]以及逆向分子设计[69-71],研究人员利用蒙特卡罗等算法,开发出具有学习能力的化学辅助软件[72-73],大量化合物得以被快速设计和评估。
人工智能算法和机械自动化的结合发展大力推动了“自主发现系统”的诞生。2018年至今,已成功开发多种基于机器学习和人工智能的数字化自动合成装置,这在很大程度上冲击了传统模式下的化学合成[74]。自动化与自然科学的结合对科研工作产生了革命性的影响,未来化学合成领域的自动化一定朝着更加协同化、集成化、通用化和智能化的趋势发展。在日常科研中,我们已切身感受到实验室自动化带来的便利,顺应这个智能时代的发展趋势,我们认为现在是时候加速转向一种智能自动化的化学研究模式,能极大程度地改进我们实验工作的方式。
本综述中,我们根据实验室自动化的程度对自动化合成平台进行分类,并对不同程度下自动化平台的构建措施进行举例讨论,分析如何实现从自动化合成平台的通用化发展到自动化平台的智能化,以及最终实现实验室无人化。我们也强调自动化合成技术与机器学习和人工智能的结合,以期实现化学合成的智能化闭环。
2 实验室自动化平台构建
2.1 连续流动化学技术照亮自动化合成前行之路
在讨论实验室自动化平台之前,先从连续流动化学技术说起,因为在过去的十几年间,流动化学技术平台的开发让我们看到了实验室规模的自动化合成反应的希望[75-77]。与传统处理模式相比,连续流动的工作模式可以显著减少人工干预,因此受到广泛关注,如最近报道的连续流动化学技术在环加成反应[78]、聚合物有机电子[79]、生物活性药物[80-81]以及多肽[82-85]合成方面取得了新的进展,如图7所示,利用连续流动化学技术实现了乙烯与柠檬酸酐的[2+2]光环加成反应。
连续流动化学技术平台如同将工业上使用的合成仪器缩小化,这为实验室搭建自动化合成平台提供了很好的思路。近几年,通过将流动化学技术与自动化技术和计算机控制技术结合发展,开发出的自动化合成反应系统极大地降低了人工实验操作的重复性,这为科研人员争取了更多进行创造和创新的时间。
通常,流动化学平台将多个反应器单元串联以进行多步合成,但面对每个新的目标分子,必须对流动化学反应器进行重新配置,这使流动化学自动化合成平台产生了很大的局限性[86]。
Gilmore课题组的自动化径向合成设备则能很好地解决这一问题[87]。自动化径向合成设备主要由溶剂和试剂输送系统(RDS)、中央交换站(CSS)、备用模块(SM)和收集容器(CV)4个部分组成(见图8)。其中,中央交换站的主控制器通过16通阀调整试剂流向,将试剂导向不同反应器模块,这些反应器模块在中央交换站周围呈放射状排列,如此可确保每个合成反应都可以在最佳条件下独立进行。整个系统使用氮气加压,溶液流量由RDS的2个流量控制器或由合成器(RDS和SM)的3个质量流量控制器控制,该系统可在很大程度上确保反应的可重复性。由于该设备同时具备循环合成和线性合成的功能,不需要在不同合成方式之间重新配置,只要输入物料的质量相同,给定的合成指令将在另一个系统上以完全相同的方式执行。作者利用此设备实现了抗惊厥药物芦丁酰胺的自动化合成(见图8)。
自动化径向合成设备能很好地解决化学反应重现性的问题,但同时该平台也存在一些局限,如不能将纯化、分离和分析的步骤进行整合。通常,多步反应过程中也存在试剂不统一、未完全溶解的固体试剂导致管道堵塞、反应试剂的兼容性等问题。上述困难是连续流动化学技术中常见的阻碍,在接下来的研究中应该从设备设计方面进行完善。
吴杰课题组将连续流动合成技术与固相合成技术相结合,使得上述反应试剂兼容性问题得以很好解决[88]。研究人员将初始底物经树脂固定后置于柱式反应器中,再将每一步的反应液依次通过反应器进行流动反应,等待反应完成后利用溶剂洗涤和置换,随后进行下一步反应。该自动化流动合成系统经过32 h的运转后,得到总产率为65 %的Prexasertib(见图9)。这种基于固相合成中的假稀释效应策略,可以有效避免分子间反应,在一定程度上有利于构建大环分子。该平台采用各步反应既连续又互不干扰的运行方式,可以确保对每一步反应进行独立的设计和优化,从根本上避免试剂不兼容的问题,该策略的提出为自动化多步合成开拓了更为广阔的应用前景。
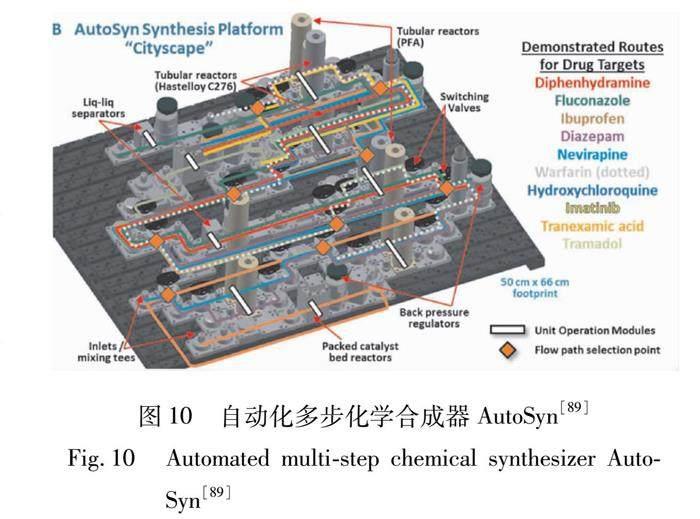
2020年,Collins课题组报道了一种自动化多步化学合成器AutoSyn(见图10),它具有合成功能多样性的特点,除了进行加样和选择驱动目标分子自动合成的数字编码过程外,其他过程均不需要人工干预,利用该自动化连续流动多步化学合成器可以在几小时内合成多种毫克级到克级的药物小分子[89]。
通过以上实例,我们看到连续流动合成设备已经发展到自动化阶段。根据合成自动化程度,可将实验室合成平台划分为3类:模块化技术平台、机械臂集成技术平台、机器人技术平台。前两类技术平台基于连续流动化学技术发展起来,经过科研人员的不断努力已经朝着通用化、集成化、智能化的方向发展。相比而言,机器人技术平台则可以极大地减少人工干预,该技术平台目前也随着人工智能算法和物联网技术的发展,逐渐朝着实验室远程化和无人化的方向发展。下文将分别对3类技术举例分析讨论。
2.2 模块化技术开启自动化合成的多样性
为了解决自动化合成的通用性问题,研究人员针对如何将化学反应的实际操作流程化,引入模块化理念,对不同的流程设计相应的反应模块,实验室可通过搭建自动化模块来执行常见的实验操作。由不同的单个模块组合搭建是实现自动化合成最灵活的方法。对于多种成熟的实验流程,模块按需布局搭配,这些由不同模块组合的技术平台便于因需求变化而拓展升级。
例如,2018年,Jamison课题组将算法、流动化学技术和分析技术相结合,开发出一套小型的可重新配置的自动化合成平台(见图11),平台整体由合成部分、净化部分、在线监视反应进程的分析技术部分以及可视化软件控制部分组成[90-92]。
该平台能实现多种反应自动化合成的关键在于其合成部分。在整个合成过程中,研究人员设计了6种功能化模块,包括用于实现特殊反应的LED模块、加热模块(高温可达120 ℃)、冷却模块(低温可达-20 ℃)、填充床模块、萃取产物的液-液分离模块以及用于混合试剂的旁路模块(见图12)。研究人员根据不同的反应条件选择相应的模块,将其插入拥有5个接口的连续流动合成平台上,即可实现合成多样性。
对于不同类型的简单合成反应,连续流动设备只需一个反应模块。对于SNAr反应来说,仅需一个加热模块就可保证反应进行;对于非均相催化下的Suzuki-Miyaura偶联反应,仅需一个填充床模块即可实现;对于一些有中间体生成的多步合成反应,可根据每一步的反应条件为流动设备按序配备相应的功能模块。如将2~3个加热模块进行联用,通过该设备可实现反应条件的快速优化,包含缩合过程和还原过程的还原胺化反应、基于烯酮生成的[2+2]环加成反应以及基于鏻叶立德生成的HWE烯烃化反应。将LED光催化模块和加热模块进行组合,可以实現α-胺取代反应(见图13)。通过功能模块的重排,该设备可以进行超过15 000种反应,进行大量创造性的合成工作。
2018年,Cronin课题组开发出一种人工智能驱动的化学合成平台,使大量化学反应的流程达到自动化(见图14)。该平台主要由泵和反应器组成,可实现与质谱仪、核磁共振光谱仪以及红外光谱仪进行联用,对化学反应过程和产物进行实时探索[93]。
2019年,Cronin组设计和开发了Chemputer自动化合成平台,这是一个可编程的模块化系统,该平台最大的亮点就是作者设计了一种化学编程语言和相关的可视化开发环境,使用户能够对程序进行编码,并使用标准格式进行交换。
该平台的流程图如图15所示,研究人员通过化学描述语言(χDL)将合成过程表示为发生在抽象容器中的过程序列,并创建χDL文件,再进一步将χDL转换为化学汇编语言ChASM,同时,以GraphML格式为基础,来实现化学数字化。
该平台的硬件部分(见图16)包括一系列注射泵和六通阀, 骨架部分易于扩展,很容易对模块进行更改且不会影响系统的其他部分。 基于化学合成反应的常见步骤, 作者开发了反应、 过滤、 液-液分离、旋蒸和色谱分离等操作模块,实现了盐酸苯海拉明、卢菲酰胺以及西地那非的自动化合成[94]。
2021年1月,Cronin课题组提出模拟人工有机合成工作流程的新方法,该方法利用标准化的合成化学操作,开发出更多的功能化模块(见图17),如分离、过滤、蒸发、加热、冷却、搅拌等,以统一标准的方式实现自动化。
例如,对于Suzuki-Miyaura偶联反应的操作,该系统使用了加料、搅拌、加热、旋蒸模块;对于光交联剂NHS-diazirine的合成,因需要无水环境并且使用了对温度和光非常敏感的试剂,该课题组通过开发冷却、搅拌和保持惰性气氛的功能化模块,很好地解决了此问题,从而保证敏感试剂在使用之前可以储存在低温下。该自动化平台还可通过重复添加试剂、过滤、洗涤和干燥的过程实现固相多肽合成(见图18)[95]。
同年,Cronin课题组提出一种使用机器学习结合自动合成反应和反应性评估的闭环方法,该方法在未知化学空间发现新反应方面发挥着关键作用(见图19)。该系统在自动化反应平台搭建方面,与之前相比增添了光化学反应模块,通过在其中3个反应器中配备可见发光二极管,以促进光化学反应顺利进行。该自动化平台在1 018个反应、15个输入范围内进行验证,不仅发现1个新的光化学反应,而且还发现1个已知试剂(对甲苯磺酸基甲基异氰化物,TosMIC)的新反应模式[96]。
随着该平台功能不断拓展,Cronin课题组构建了包含103个分子的可自动化执行化学反应数据库,并使用Chemputer对其中的53个分子进行实验验证,产率和纯度与化学家合成结果相当。该数据库涉及当代有机合成中的多种常用反应,包括过渡金属催化的偶联反应、杂环形成、官能团相互转化和多组分反应,具体的反应合成操作步骤通过化学反应代码(chemical reaction codes)的形式存储在数据库中。此外,他们还使用能与平台无缝衔接的色谱模块(使用相同语言编程)自动纯化一系列化合物[97]。
在最新报道中,Cronin团队开发了一种只有手提箱大小尺寸的便携式化学合成平台,其中包含分子合成和纯化所需要的所有模块,该平台可以连续运行超过329 h。研究者通过5个有机分子、4个寡肽和4个寡核苷酸的合成,以高产率和高纯度证明了该系统的普适性和高效性(见图20)[98]。
从Cronin课题组近几年对于自动化反应合成器的搭建来看,在实验室中,自动化模块技术的优势越来越明显。通过总结所有常规的化学操作方法,并为其设计不同的功能性模块,可以不断地根据需求对自动化合成平台的功能进行扩展。如在接下来的工作中可根据实验室自身需求扩展低温冷却模块、固体试样添加模块以及电化学反应模塊等,未来可实现更多创造性的合成工作流程。该自动化平台除辅助科研人员进行合成外,还利用算法将以往文献报道过的分子合成路线和未来探索的新分子合成路线标准化,从而在很大程度上确保文献结果的复现性。
本段中所提到的模块化技术并不仅仅局限于自动化平台搭建的模块化,由于合成过程中所需要的一些小分子,它们在构筑成一个目标产物之前,本身也是模块化的。通过简单的模块化分子在共同的模块化合成平台中进行混合和匹配,可以形成不同的目标产物,该方法可以实现广泛的合成创新[99-100]。
Burke教授团队曾在2015年设计出一种自动化合成平台(见图21),该平台围绕核心分子N-甲基亚氨基二乙酸(N-methyliminodiacetic acid, MIDA)硼酸酯进行一系列合成。MIDA作为一种双功能化合物,当其与二氧化硅相结合时不会被甲醇/乙醚所洗脱,但四氢呋喃却很容易的将其从二氧化硅上解离。基于此,作者构建了“捕获-释放”中间体的方法,当进行一次偶联反应后,中间体被固定在硅胶上,待残余的反应物以及副产物被洗脱除去后,再将反应中间体释放出来进行下一步反应,直到合成目标分子[101-105]。
每一个反应循环都包括脱保护、偶联反应和纯化操作,作者根据此操作设计了一套自动化合成装置,由脱保护模块、耦合反应模块以及净化模块3个模块组成,通过自动化迭代偶联反应将模块化分子依次连接,可合成线性分子,也可将线性前体串联再让其连回自身,使得复杂的多环结构也可被自动合成,该平台实现了14类小分子毫克量级上的自动化合成。这项技术在设计创新方面是一项极大的突破,但也产生一些局限性,即仅使用于部分不饱和片段中的Csp2-Csp2偶联,却无法用于需求更大的立体和潜在手性Csp3分子的合成[106-110]。
近年来,化学家通过Suzuki-Miyaura偶联和1,2-金属化物反应在Csp3-C键的立体定向形成方面取得了许多突破,然而,由于MIDA具有碱性条件下易水解并且易与亲核试剂发生反应的特点,这些反应难以在MIDA硼酸酯迭代偶联技术中实现[111-113]。
最近,Burke教授课题组通过超共轭和空间位阻调节,开发出新型的四甲基N-甲基亚氨基二乙酸(TIDA)硼酸酯,该化合物在Dean-Stark条件下由硼酸制备或通过TIDA脱水成酸酐制备而成。TIDA硼酸酯电子密度的重新分布能够增强N-B键的共价性,可缓解TIDA硼酸酯的水解问题;羰基π-面的互补空间屏蔽能够降低TIDA硼酸酯与亲核试剂的反应性。因此,TIDA硼酸酯在各种常见的交叉偶联反应,如Stille、Suzuki、Sonogashira、Heck、光化学反应以及常见化学转化,如氧化、还原、硼化、烯化反应条件下都稳定,并且TIDA硼酸酯还保留了相对应的MIDA硼酸酯的所有关键特性,实现基于模块化的自动化合成,可用于自动迭代构建Csp3-C键,包括构建Csp3-Csp2和Csp3-Csp3键以制备立体特异性结构的天然产物[114]。
与之前相比,作者除了在分子模块的选择上进行了调整,在自动化合成装置的搭建上也进行了创新。如图22所示,整个合成器围绕一个带有8位阀门的注射泵设计而成,中央泵控制系统上所有液体的传输,NIR传感器用于检测不互溶的有机/水相边界,使得水相被吸入注射器,而倾析出的相则被分离。合成器的8个功能点上装有特定的容器,位置1和2进行干燥处理,位置3、4和5进行加热控制,位置3、5、6和7配有磁力搅拌器,对所用功能点进行集成处理,可用于进行MIDA或TIDA硼酸盐典型的脱保护-偶联纯化反应。
通过实验室自动模块化技术,研究人员开发了不同类型的自动化合成装置,这些自动化平台使得有机合成得到进一步发展,帮助很多实验室在很短的时间内获得了他们的目标分子。同时,基于标准化程序和实验参数的设置,使科研过程规范化,有效改善了传统模式下有机合成的重现性问题。
2.3 人工智能+机械臂引领合成智能化
上文提及的模块化技术已经可以实现化学合成的自动化,但还尚未达到科研思维自动化的水平。模块化技术无法实现反应路线自动规划和反应器件自动组装,整个过程仍需要很大程度的人工参与。因此,研究人员在实验室中引入了机械臂,整个自动化平台通过智能中控系统控制,以机械臂为中心来整合第三方设备,让设备运行更加灵活。
其实早在十几年前,机器人科学家“Adam”就被设计出来,它不是严格意义上的机器人,而是一个复杂的实验室,包括1台计算机、3个自动化液体处理器、3个培养箱、3个机械臂以及1台离心机,通过控制机械臂可将所有自动化设备整合起来。Adam可以自己设计、筛选实验,自动生成关于酵母中基因功能关系的假设,并通过实验室自动化同时验证多个假说[115-117]。
随后,一种自动化早期药物测试设备“Eve”也被开发(见图23),该机器人科学家能够自行设计实验、做实验、分析样本数据、得出实验结论,并能根据这些结果自行设计下一轮实验,独立完成整个实验流程,从而形成一个完整的实验闭环[118]。
近几年,小分子合成领域从自动化合成到自动优化实现闭环方面也得到了发展。在实验室自动化概念出现之前,计算机辅助合成路线设计(CASP)作为一种帮化学家确定反应路线的工具已被熟知[68,119]。从Reaxys和SciFinder等反应数据库中可搜索已知化合物的反应路线,但对于新化合物的合成路线设计除Chematica程序外无较大实质性进展[120-122],2018年,Segler等人的蒙特卡洛树算法提出后加速了CASP的发展[73]。
2019年,麻省理工学院Coley课题组,开发出一种利用AI设计合成路线和机器人执行的自动化合成平台(见图24)[123]。利用此平台,作者成功进行了15个小分子药物的合成路线设计和自动化合成。
该团队针对CASP开发了一个开源软件ASKCOS,该软件拥有独立的图形用户界面,研究人员可以轻松地与ASKCOS建议的路线和预测进行交互。此软件经过美国专利及商标局和Reaxys数据库中的反应训练,能夠利用神经网络(NN)模型预测反应,从而根据目标化合物的分子结构对合成路线和反应条件进行智能化设计和筛选。此外,系统硬件上配备了一个灵活的机械臂,在智能中枢的控制下可以执行化合物合成过程的所有操作流程。
该自动化平台各模块如图25所示,平台上的5个子模块固定在光学实验板上,机械臂根据系统所给路线将各模块化单元整合,从而形成一个连续流动路径。机械臂通过流体开关板将可编程的泵和软管连接至反应器入口,系统开始合成,待预设合成时间到达,系统冲洗管路,机械臂断开流体开关板,并将处理模块移到原来的存储位置。
此平台的成功开发意味着实验室自动化又登上了更高的阶梯,人工智能的引入让我们看见一个更加智能化平台的诞生。同时,该平台也给我们一些启发,ASKCOS基于公用的数据集进行机器学习,多步反应的优化常会因参数的传播而变得复杂,报道中的示例均基于单步反应或两步反应,若能依据实验室内部的数据集对ASKCOS进一步训练,则可以对多步反应路线的设计产生积极影响。
最近,莫凡洋课题组搭建机械臂平台,开发了TLC分析的自动化平台,通过该平台获得了大量标准化的TLC数据,进而应用机器学习对数据进行回归分析,得到一个能够进行精准预测的模型[124]。在实际应用中,此模型能够在秒级级别内预测化合物在任意指定溶剂组合条件下的Rf值,从而避免大量试错,提高实验室工作效率。
2.4 机器人技术实现实验室远程控制化
传统条件下的有机合成模式最大的特点就是劳动密集型,分子设计环节和实验操作合成部分密不可分,前文所述的自动化技术已经为合成提供了一个更便捷、更安全、更规范的过程,然而,化学家们对自动化的追求却远不止于此。
目前已有实验室采用中央集成控制台和友好的人机交互界面,实现整个系统无人化、协作化、智能化、远程操控化管理。同时,系统具备非常强的拓展能力,可实现直接与研发数据平台无缝对接。如图26所示,礼来公司开发的自动化合成实验室中均采用自动化设备,可以实现不同种类的化学反应,并且通过互联网可以进行全球访问,所有的合成步骤都可通过软件端进行控制[125]。
2015年,Ley课题组报道了一种新型的基于互联网的化学合成反应监测、控制和自主自优化平台LeyLab(见图27)。LeyLab在完成化学反应后,能自动进行多维度反应参数的优化,通过TCP/IP协议进行客户-服务器和服务器-仪器间的通讯,还能让全球研究人员通过互联网在世界上任何地方使用该设备来监测和控制化学反应[126]。
2020年,Cooper教授团队开发的一款机器人,与上文提到的机械臂最大不同之处在于它可以像真正的科研人员一样在实验室中进行科研工作,该机器人的目的是用来寻找水制氢反应的光催化剂。它可以独立完成整个科研流程,如固体称量、液体分配、运行催化反应等,与人类相比,它最大的特点就是可以在电量充足的情况下保证实验高效进行,每天可工作21.5 h。其在8 d时间内进行了43批共计688次实验,最终找到了一种高活性光催化剂[127]。
2020年,IBM公司发布了RoboRXN云端药物实验室的初级版本,该实验室集人工智能、云技术和实验机器人三大功能于一体,化学家可登陆平台网站,绘制目标分子的结构,而平台根据所提供的结构式反馈给科学家合成路线,并通过云端技术将生成的指令发送给远端实验室,实验室中的机器人就会自动完成所有操作。
无人化的远程实验室给化学研究人员提供了极大的便利,真正可以实现随时随地进行化学实验。但是,这也给研究人员带来巨大挑战,通过网络服务端进行实验操作需考虑网络信息加密管理,确保实验室信息安全。
最近,罗毅、江俊教授团队通过开发和集成移动机器人、化学工作站、智能操作系统以及科学数据库,研制出數据智能驱动的全流程机器化学家(见图28)[128]。
机器化学家平台实现了大数据与智能模型双驱动下的化学合成-表征-测试全流程开发,具有很强的化学智能和广泛的化学品开发能力,目前已涵盖光催化与电催化材料、发光分子、光学薄膜材料等,且适用范围将随平台升级和拓展继续扩大。该平台具有以下功能:①采用机器智能去查找和阅读文献,从海量研究数据中汲取专家经验,在前人知识与数据的基础上提出科学假说并制定实验方案;②调度2台移动机器人和15个自主开发的智能化学工作站,完成高通量合成、表征、测试的化学实验全流程,且预留标准接口,具备可扩展性;③通过配套的后台操作系统,实现了数据的自动采集、处理、分析和可视化,
并装载了云端数据库,可实时调用和更新数据库信息;④独有的计算大脑通过调用物理模型、理论计算、机器学习和贝叶斯优化,让智能模型融入底层的理论规律与复杂的化学实验演化,使得机器科学家更加理解化学,更加擅长化学创造。
3 总结和展望
在本综述中,我们回望了实验室自动化的发展历程,并从中看到实验室自动化技术在解决传统化学模式所面临的问题上取得的实质性进展。在工业领域常用的特定小分子自动化合成反应装置,通过科研人员的不断努力得到了性能的优化。对于研究领域所需的旨在加速发现新的功能分子或按需合成少量已知分子,能进行许多不同类型化学反应的自动化合成装置来说,研究人员通过引入模块化技术、机械臂整合技术、机器人技术以及人工智能和机器学习等先进手段,使得这类平台更加通用化、灵活化、智能化。
在这个智能化时代,我们对化学的理解应该融入21世纪的技术。算法的飞速发展加速推动了分子设计和合成反应路线设计的前进;自动化技术和机器学习的结合促使反应数据库变得越来越完善,反应预测模型准确度的大幅提高,反应各参数不断优化,使得合成反应的共性更加明显,从而对分子合成形成一种正向的反馈,加速了化学合成的智能化闭环;互联网远程控制技术极大地减少了人工干预,真正实现了实验室的无人化。
化学、数学、计算机科学和工程学之间的交叉融合,将使化学领域彻底发生改变。智能化时代,化学合成将变得越来越容易,人工智能可以轻易捕捉到我们易于忽视的众多特征。未来,我们将通过人工智能探索更多新物质,在其助力下合成远超自然界中可以寻找到的物质。
参考文献
[1] NANTERMET P G.Reaction: The art of synthetic chemistry [J].Chem,2016,1(3):335-336.
[2] NICOLAOU K C, CHEN J S. The art of total synthesis through cascade reactions [J]. Chem Soc Rev, 2009, 38(11): 2993-3009.
[3] GRAULICH N, HOPF H, SCHREINER P R. Heuristic thinking makes a chemist smart [J]. Chem Soc Rev, 2010, 39(5): 1503-1512.
[4] LEY S V, FITZPATRICK D E, INGHAM R J, et al. Organic synthesis: March of the machines [J]. Angew Chem Int Ed, 2015, 54(11): 3449-3464.
[5] BARAN P S. Natural product total synthesis: As exciting as ever and here to stay [J]. J Am Chem Soc, 2018, 140(14): 4751-4755.
[6] COLLINS K D, GENSCH T, GLORIUS F. Contemporary screening approaches to reaction discovery and development [J]. Nat Chem, 2014, 6(10): 859-871.
[7] BERGMAN R G, DANHEISER R L. Reproducibility in chemical research [J].Angew Chem Int Ed, 2016, 55(41): 12548-12549.
[8] DUROS V, GRIZOU J, XUAN W, et al. Human versus robots in the discovery and crystallization of gigantic polyoxometalates [J]. Angew Chem Int Ed, 2017, 56(36): 10815-10820.
[9] ROCH L M, HASE F, KREISBECK C, et al. ChemOS: Orchestrating autonomous experimentation [J]. Sci Robot, 2018, 3(19): eaat5559.
[10]SCHNEIDER G. Mind and machine in drug design [J]. Nat Mach Intell, 2019, 1(3): 128-130.
[11]WANG Y, SHAABANI S, AHMADIANMOGHADDAM M, et al. Acoustic droplet ejection enabled automated reaction scouting [J]. ACS Cent Sci, 2019, 5(3): 451-457.
[12]FITZPATRICK D E, BATTILOCCHIO C, LEY S V, et al. Enabling technologies for the future of chemical synthesis [J]. ACS Cent Sci, 2016, 2(3): 131-138.
[13]LEY S V, FITZPATRICK D E, MYERS R M, et al. Machine-assisted organic synthesis [J]. Angew Chem Int Ed, 2015, 54(35): 10122-10136.
[14]KOBAYASHI J, MORI Y, KOBAYASHI S. Multiphase organic synthesis in microchannel reactors[J].Chem Asian J, 2006, 1(1/2): 22-35.
[15]CHAPMAN T. Lab automation and robotics: Automation on the move [J]. Nature, 2003, 421(6923): 661-663.
[16]MERRIFIELD R B. Solid phase synthesis (Nobel Lecture) [J]. Angew Chem Int Ed, 1985, 24(10): 799-810.
[17]MERRIFIELD R B. Solid phase peptide synthesis. I. the synthesis of a tetrapeptide [J]. J Am Chem Soc, 1963, 85(14): 2149-2154.
[18]MERRIFIELD R B, STEWART J M, JERNBERG N. Instrument for automated synthesis of peptides[J].Anal Chem,1966,38(13):1905-1914.
[19]MULLIN R. As high-throughput screening draws fire, researchers leverage science to put automation into perspective [J]. Chem Eng News, 2004, 82(30): 23-32.
[20]PAUL S M, MYTELKA D S, DUNWIDDIE C T, et al. How to improve R&D productivity: The pharmaceutical industrys grand challenge [J]. Nat Rev Drug Disc, 2010, 9(3): 203-214.
[21]MERRIFIELD R B. Automated synthesis of peptides [J]. Science, 1965, 150(3693): 178-185.
[22]MIJALIS A J, THOMAS D A, SIMON M D, et al. A fully automated flow-based approach for accelerated peptide synthesis [J]. Nat Chem Biol, 2017, 13: 464-466.
[23]CARUTHERS M H. Gene synthesis machines: DNA chemistry and its uses [J]. Science, 1985, 230(4723): 281-285.
[24]PLANTE O J, PALMACCI E R, SEEBERGER P H. Automated solid-phase synthesis of oligosaccharides [J]. Science, 2001, 291(5508): 1523-1527.
[25]JOSEPH A A, PARDO-VARGAS A, SEEBERGER P H. Total synthesis of polysaccharides by automated glycan assembly [J]. J Am Chem Soc, 2020, 142(19): 8561-8564.
[26]KENT S B H. Novel protein science enabled by total chemical synthesis [J]. Protein Sci, 2019, 28(2): 313-328.
[27]MELNYK O, VICOGNE J. Total chemical synthesis of SUMO proteins [J]. Tetrahedron Lett, 2016, 57(39): 4319-4324.
[28]FERRETTI L, KARNIK S S, KHORANA H G, et al. Total synthesis of a gene for bovine rhodopsin [J]. Proc Natl Acad Sci U S A, 1986, 83(3): 599-603.
[29]KHORANA H G. Total synthesis of a gene [J]. Science, 1979, 203(4381): 614-625.
[30]GIBSON D G, GLASS J I, LARTIGUE C, et al. Creation of a bacterial cell controlled by a chemically synthesized genome [J]. Science, 2010, 329(5987): 52-56.
[31]FOSGERAU K, HOFFMANN T. Peptide therapeutics: Current status and future directions [J].Drug Discov Today, 2015, 20(1): 122-128.
[32]KHVOROVA A, WATTS J K. The chemical evolution of oligonucleotide therapies of clinical utility [J].Nat Biotechnol, 2017, 35(3): 238-248.
[33]SEEBERGER P H,WERZ D B. Automated synthesis of oligosaccharides as a basis for drug discovery [J]. Nat Rev Drug Disc, 2005, 4(9): 751-763.
[34]PARKER T D, WRIGHT D S, ROSSI D T. Design and evaluation of an automated solid-phase extraction method development system for use with biological fluids [J]. Anal Chem, 1996, 68(14): 2437-2441.
[35]GIOIELLO A, PICCINNO A, LOZZA A M, et al. The medicinal chemistry in the era of machines and automation: Recent advances in continuous flow technology[J].J Med Chem, 2020, 63(13): 6624-6647.
[36]NADIN A, HATTOTUWAGAMA C, CHURCHER I. Lead-oriented synthesis: A new opportunity for synthetic chemistry [J]. Angew Chem Int Ed, 2012, 51(5): 1114-1122.
[37]ALLEN C L, LEITCH D C, ANSON M S, et al. The power and accessibility of high-throughput methods for catalysis research[J].Nat Catal, 2019, 2 (1): 2-4.
[38]DIAGNE A B, LI S, PERKOWSKI G A, et al. Samdi mass spectrometry-enabled high-throughput optimization of a traceless petasis reaction [J].ACS Comb Sci, 2015, 17(11): 658-662.
[39]MONFETTE S, BLACQUIERE J M, FOGG D E. The future, faster: Roles for high-throughput experimentation in accelerating discovery in organometallic chemistry and catalysis [J]. Organometallics, 2011, 30(1): 36-42.
[40]MCNALLY A, PRIER C K, MACMILLAN D W C, et al. Discovery of an α-amino C-H arylation reaction using the strategy of accelerated serendipity [J]. Science, 2011, 334(6059): 1114-1117.
[41]REETZ M T, KHLING K M, DEEGE A, et al. Super-high-throughput screening of enantioselective catalysts by using capillary array electrophoresis [J]. Angew Chem Int Ed, 2000, 39(21): 3891-3893.
[42]REIZMAN B J, JENSEN K F. Simultaneous solvent screening and reaction optimization in microliter slugs [J]. Chem Commun, 2015, 51(68): 13290-13293.
[43]ROBBINS D W, HARTWIG J F. A simple multidimensional approach to high-throughput discovery of catalytic reactions [J]. Science, 2011, 333(6048): 1423-1427.
[44]TRAPP O, WEBER S K, BAUCH S, et al. High-throughput screening of catalysts by combining reaction and analysis [J]. Angew Chem Int Ed, 2007, 46(38): 7307-7310.
[45]SHEVLIN M, FRIEDFELD M R, SHENG H, et al. Nickel-catalyzed asymmetric alkene hydrogenation of α,β-unsaturated esters: High-throughput experimentation-enabled reaction discovery, optimization, and mechanistic elucidation [J].J Am Chem Soc, 2016, 138(10): 3562-3569.
[46]BELLOMO A, CELEBI-OLCUM N, BU X, et al. Rapid catalyst identification for the synthesis of the pyrimidinone core of HIV integrase inhibitors [J].Angew Chem Int Ed, 2012, 51(28): 6912-6915.
[47]MURRAY P M, TYLER S N G, MOSELEY J D. Beyond the numbers: Charting chemical reaction space [J].Org Process Res Dev, 2013, 17(1): 40-46.
[48]DAVIES I W, WELCH C J. Looking forward in pharmaceutical process chemistry [J]. Science, 2009, 325(5941): 701-704.
[49]MORISSETTE S L, ALMARSSON O, PETERSON M L, et al. High-throughput crystallization: Polymorphs, salts, co-crystals and solvates of pharmaceutical solids [J].Adv Drug Deliver Rev, 2004, 56(3): 275-300.
[50]LEGRAND M, BOLLA P. A fully automatic apparatus for chemical reactions on the laboratory scale [J]. J Autom Chem, 1985, 7(1): 31-37.
[51]SUGAWARA T, KATO S, OKAMOTO S. Development of fully-automated synthesis systems [J]. J Autom Chem, 1994, 16(1): 33-42.
[52]OKAMOTO H, DEUCHI K. Design of a robotic workstation for automated organic synthesis [J]. Lab Rob Automt, 2000, 12(1): 2-11.
[53]ORITA A, YASUI Y, OTERA J. Automated synthesis: Development of a new apparatus friendly to synthetic chemists (MEDLEY) [J]. Org Process Res Dev, 2000, 4(5): 333-336.
[54]ORITA A, YASUI Y, OTERA J. Automated synthesis: Utilization of medley in synthetic processes [J]. Org Process Res Dev, 2000, 4(5): 337-341.
[55]MACHIDA K, HIROSE Y, FUSE S, et al. Development and application of a solution-phase automated synthesizer, ′ChemKonzert′ [J]. Chem Pharm Bull, 2010, 58(1): 87-93.
[56]TANAKA Y, FUSE S, TANAKA H, et al. An efficient synthesis of a cyclic ether key intermediate for 9-membered masked enediyne using an automated synthesizer [J]. Org Process Res Dev, 2009, 13(6): 1111-1121.
[57]DOI T, FUSE S, MIYAMOTO S, et al. A formal total synthesis of taxol aided by an automated synthesizer [J]. Chem Asian J, 2006, 1(3): 370-383.
[58]MASUI H, NAITO K, MINOSHIMA M, et al. Efficient synthesis of 5-(hydroxymethyl)piperazin-2-ones using automatically prepared chiral bromocarboxylic acid and Garners aldehyde as versatile building blocks [J].Bioorg Med Chem Lett,2021,40:127961.
[59]FUSE S, OKADA K, IIJIMA Y, et al. Total synthesis of spiruchostatin B aided by an automated synthesizer [J]. Org Biomol Chem, 2011, 9(10): 3825-3833.
[60]MASUI H, YOSUGI S, FUSE S, et al. Solution-phase automated synthesis of an α-amino aldehyde as a versatile intermediate [J].Beilstein J Org Chem, 2017, 13(1): 106-110.
[61]SILVER D, HUANG A, MADDISON C J, et al. Mastering the game of go with deep neural networks and tree search [J]. Nature, 2016, 529(7587): 484-489.
[62]SILVER D, SCHRITTWIESER J, SIMONYAN K, et al. Mastering the game of go without human knowledge [J]. Nature, 2017, 550(7676): 354-359.
[63]TUNYASUVUNAKOOL K, ADLER J, WU Z, et al. Highly accurate protein structure prediction for the human proteome [J]. Nature, 2021, 596(7873): 590-596.
[64]SENIOR A W, EVANS R, JUMPER J, et al. Improved protein structure prediction using potentials from deep learning [J]. Nature, 2020, 577(7792): 706-710.
[65]JUMPER J, EVANS R, PRITZEL A, et al. Highly accurate protein structure prediction with AlphaFold [J]. Nature, 2021, 596(7873): 583-589.
[66]EISENSTEIN M. Artificial intelligence powers protein-folding predictions [J]. Nature, 2021, 599: 706-708.
[67]SCHWALLER P, LAINO T, GAUDIN T, et al. Molecular transformer: A model for uncertainty-calibrated chemical reaction prediction [J]. ACS Cent Sci, 2019, 5(9): 1572-1583.
[68]SZYMKUC S, GAJEWSKA E P, KLUCZNIK T, et al. Computer-assisted synthetic planning: The end of the beginning [J].Angew Chem Int Ed, 2016, 55(20): 5904-5937.
[69]GOTHARD C M, SOH S, GOTHARD N A, et al. Rewiring chemistry: Algorithmic discovery and experimental validation of one-pot reactions in the network of organic chemistry [J].Angew Chem Int Ed, 2012, 51(32): 7922-7927.
[70]KOWALIK M, GOTHARD C M, DREWS A M, et al. Parallel optimization of synthetic pathways within the network of organic chemistry [J]. Angew Chem Int Ed, 2012, 51(32): 7928-7932.
[71]FULLER P E, GOTHARD C M, GOTHARD N A, et al. Chemical network algorithms for the risk assessment and management of chemical threats [J]. Angew Chem Int Ed, 2012, 51(32): 7933-7937.
[72]SEGLER M H S, WALLER M P. Neural-symbolic machine learning for retrosynthesis and reaction prediction [J].Chem Eur J, 2017, 23(25): 5966-5971.
[73]SEGLER M H S, PREUSS M, WALLER M P. Planning chemical syntheses with deep neural networks and symbolic AI [J]. Nature, 2018, 555(7698): 604-610.
[74]WILBRAHAM L, MEHR S H M, CRONIN L. Digitizing chemistry using the chemical processing unit: From synthesis to discovery [J]. Acc Chem Res, 2021, 54(2): 253-262.
[75]POWER M, ALCOCK E, MCGLACKEN G P. Organolithium bases in flow chemistry: A review [J]. Org Process Res Dev, 2020, 24(10): 1814-1838.
[76]GUIDI M, SEEBERGER P H, GILMORE K. How to approach flow chemistry [J]. Chem Soc Rev, 2020, 49(24): 8910-8932.
[77]SAGMEISTER P, LEBL R, CASTILLO I, et al. Advanced real-time process analytics for multistep synthesis in continuous flow [J]. Angew Chem Int Ed, 2021, 60(15): 8139-8148.
[78]GARCA-LACUNA J, DOMNGUEZ G, PREZ-CATELLS J. Flow chemistry for cycloaddition reactions [J]. Chem Sus Chem, 2020, 13(19): 5138-5163.
[79]BECKERS O, SMEETS S, LUTSEN L, et al. Perspective on the application of continuous flow chemistry for polymer-based organic electronics [J]. J Mater Chem C, 2022, 10(5): 1606-1616.
[80]BURANGE A S, OSMAN S M, LUQUE R. Understanding flow chemistry for the production of active pharmaceutical ingredients [J].iScience, 2022, 25(3): 103892.
[81]LI C, CALLAHAN A J, SIMON M D, et al. Fully automated fast-flow synthesis of antisense phosphorodiamidate morpholino oligomers [J]. Nat Commun, 2021, 12(1): 4396.
[82]HARTRAMPF N, SAEBI A, POSKUS M, et al. Synthesis of proteins by automated flow chemistry [J]. Science, 2020, 368(6494): 980-987.
[83]TRUEX N L, HOLDEN R L, WANG B, et al. Automated flow synthesis of tumor neoantigen peptides for personalized immunotherapy [J]. Sci Rep, 2020, 10(1): 723.
[84]ZHANG G, LI C, QUARTARARO A J, et al. Automated affinity selection for rapid discovery of peptide binders [J]. Chem Sci, 2021, 12(32): 10817-10824.
[85]HARTRAMPF N, SAEBI A, POSKUS M, et al. Synthesis of proteins by automated flow chemistry [J]. Science, 2020, 368(6494): 980-987.
[86]JENSEN K F. Radial flow system decouples reactions in automated synthesis of organic molecules [J]. Nature, 2020, 579: 346-348.
[87]CHATTERJEE S, GULDL M, SEEBERGER P H, et al. Automated radial synthesis of organic molecules [J]. Nature, 2020, 579(7799): 379-384.
[88]LIU C, XIE J, WU W, et al. Automated synthesis of prexasertib and derivatives enabled by continuous-flow solid-phase synthesis [J]. Nat Chem, 2021, 13(5): 451-457.
[89]COLLINS N, STOUT D, LIM J P, et al. Fully automated chemical synthesis: Toward the universal synthesizer [J]. Org Process Res Dev, 2020, 24(10): 2064-2077.
[90]BEDARD A C, ADAMO A, AROH K C, et al. Reconfigurable system for automated optimization of diverse chemical reactions [J]. Science, 2018, 361(6408): 1220-1225.
[91]HARDWICK T, AHMED N. Digitising chemical synthesis in automated and robotic flow [J]. Chem Sci, 2020, 11(44):11973-11988.
[92]GODFREY A G, MICHAEL S G, SITTAMPALAM G S, et al. A perspective on innovating the chemistry lab bench [J]. Front Robot AI, 2020, 7: 24.
[93]GRANDA J M, DONINA L, DRAGONE V, et al. Controlling an organic synthesis robot with machine learning to search for new reactivity [J]. Nature, 2018, 559(774): 377-381.
[94]STEINER S, WOLF J, GLATZEL S, et al. Organic synthesis in a modular robotic system driven by a chemical programming language [J]. Science, 2019, 363(6423): eaav2211.
[95]ANGELONE D, HAMMER A J S, ROHRBACH S, et al. Convergence of multiple synthetic paradigms in a universally programmable chemical synthesis machine [J]. Nat Chem, 2021, 13(1): 63-69.
[96]CARAMELLI D, GRANDA J M, MEHR S H M, et al. Discovering new chemistry with an autonomous robotic platform driven by a reactivity-seeking neural network [J]. ACS Cent Sci, 2021, 7(11): 1821-1830.
[97]ROHRBACH S, SIAUCIULIS M, CHISHOLM G, et al. Digitization and validation of a chemical synthesis literature database in the ChemPU [J]. Science, 2022, 377(6602): 172-180.
[98]MANZANO J S, HOU W, ZALESSKIY S S, et al. An autonomous portable platform for universal chemical synthesis [J]. Nat Chem, 2022, 14: 1311-1318.
[99]LEHMANN J W, BLAIR D J, BURKE M D. Towards the generalized iterative synthesis of small molecules [J]. Nat Rev Chem, 2018, 2(2): 0115.
[100]WOERLY E M, ROY J, BURKE M D. Synthesis of most polyene natural product motifs using just 12 building blocks and one coupling reaction [J]. Nat Chem, 2014, 6(6): 484-491.
[101]LI J, BURKE M D. Pinene-derived iminodiacetic acid (PIDA): A powerful ligand for stereoselective synthesis and iterative cross-coupling of C(sp3) boronate building blocks [J]. J Am Chem Soc, 2011, 133(35): 13774-13777.
[102]GONZALEZ J A, OGBA O M, MOREHOUSE G F, et al. MIDA boronates are hydrolysed fast and slow by two different mechanisms [J]. Nat Chem, 2016, 8(11): 1067-1075.
[103]BALLMER S G, GILLIS E P, BURKE M D, et al. B-protected haloboronic acids for iterative cross-coupling [J]. Org Synth, 2009, 86: 344-359.
[104]LEE S J, ANDERSON T M, BURKE M D, et al. A simple and general platform for generating stereochemically complex polyene frameworks by iterative cross-coupling [J]. Angew Chem Int Ed, 2010, 49(47): 8860-8863.
[105]LI J, BALLMER S G, GILLIS E P, et al. Synthesis of many different types of organic small molecules using one automated process [J]. Science, 2015, 347(6227): 1221-1226.
[106]IMAO D, GLASSPOOLE B W, LABERGE V S, et al. Cross coupling reactions of chiral secondary organoboronic esters with retention of configuration [J]. J Am Chem Soc, 2009, 131(14): 5024-5025.
[107]LEHMANN J W, CROUCH I T, BLAIR D J, et al. Axial shielding of Pd(II) complexes enables perfect stereoretention in suzuki-miyaura cross-coupling of Csp3 boronic acids [J]. Nat Commun, 2019, 10(1): 1263.
[108]MLYNARSKI S N, SCHUSTER C H, MORKEN J P. Asymmetric synthesis from terminal alkenes by cascades of diboration and cross-coupling [J]. Nature, 2014, 505(7483): 386-390.
[109]MA X, MURRAY B, BISCOE M R. Stereoselectivity in Pd-catalysed cross-coupling reactions of enantioenriched nucleophiles [J]. Nat Rev Chem, 2020, 4(11): 584-599.
[110]CHERNEY A H, KADUNCE N T, REISMAN S E. Enantioselective and enantiospecific transition-metal-catalyzed cross-coupling reactions of organometallic reagents to construct C-C Bonds [J]. Chem Rev, 2015, 115(17): 9587-9652.
[111]LEONORI D, AGGARWAL V K. Lithiation-borylation methodology and its application in synthesis [J]. Acc Chem Res, 2014, 47(10): 3174-3183.
[112]SHARMA H A, ESSMAN J Z, JACOBSEN E N. Enantioselective catalytic 1,2-boronate rearrangements [J]. Science, 2021, 374(6568): 752-757.
[113]CASONI G, KUCUKDISLI M, FORDHAM J M, et al. α-Sulfinyl benzoates as precursors to Li and Mg carbenoids for the stereoselective iterative homologation of boronic esters [J]. J Am Chem Soc, 2017, 139(34): 11877-11886.
[114]BLAIR D J, CHITTI S, TROBE M, et al. Automated iterative Csp3-C bond formation [J]. Nature, 2022, 604(7904): 92-97.
[115]KING R D, WHELAN K E, JONES F M, et al. Functional genomic hypothesis generation and experimentation by a robot scientist [J]. Nature, 2004, 427(6971): 247-252.
[116]KING R D, ROWLAND J, OLIVER S G, et al. The automation of science [J]. Science, 2009, 324(5923): 85-89.
[117]KING R D, ROWLAND J, AUBREY W, et al. The robot scientist adam [J]. Computer, 2009, 42(8): 46-54.
[118]WILLIAMS K, BILSLAND E, SPARKES A, et al. Cheaper faster drug development validated by the repositioning of drugs against neglected tropical diseases [J]. J R Soc Interface, 2015, 12(104): 20141289.
[119]COREY E J, ORF H W, PENSAK D A. Computer-assisted synthetic analysis. The identification and protection of interfering functionality in machine-generated synthetic intermediates [J]. J Am Chem Soc, 1976, 98(1): 210-221.
[120]LIN Y, ZHANG Z, MAHJOUR B, et al. Reinforcing the supply chain of COVID-19 therapeutics with expert-coded retrosynthetic software [J]. ChemRxiv, 2020, DOI: 10.26434/chemrxiv.12765410.v1.
[121]MOLGA M, SZYMKUC S, GOLEBIOWSKA P, et al. A computer algorithm to discover iterative sequences of organic reactions [J].Nat Synth, 2022, 1(1): 49-58.
[122]MOLGA M, SZYMKUC S, GRZYBOWSKI B A. Chemist ex machina: Advanced synthesis planning by computers [J]. Acc Chem Res, 2021, 54(5): 1094-1106.
[123]COLEY C W, THOMAS D A, LUMMISS J A M, et al. A robotic platform for flow synthesis of organic compounds informed by AI planning [J]. Science, 2019, 365(6453): eaax1566.
[124]XU H, LIN J L, LIU Q Y, et al. High-throughput discovery of chemical structure-polarity relationships combining automation and machine-learning techniques [J]. Chem, 2022, DOI: 10.1016/j.chempr,2022.08.008.
[125]GODFREY A G, MASQUELIN T, HEMMERLE H. A remote-controlled adaptive medchem lab: An innovative approach to enable drug discovery in the 21st Century [J]. Drug Discov Today, 2013, 18(17/18): 795-802.
[126]FITZPATRICK D E, BATTILOCCHIO C, LEY S V. A novel internet-based reaction monitoring, control and autonomous self-optimization platform for chemical synthesis [J]. Org Process Res Dev, 2016, 20(2): 386-394.
[127]BURGER B, MAFFETTONE P M, GUSEV V V, et al. A mobile robotic chemist [J]. Nature, 2020, 583(7815): 237-241.
[128]ZHU Q, ZHANG F, HUANG Y, et al. An all-round AI-chemist with scientific mind [J].Natl Sci Rev, 2022, DOI: 10.1093/nsr/nwac190.
(編 辑 亢小玉)
