基于AMPKα/SREBP-1/ACCα信号通路调节糖脂代谢的山楂果叶配伍机制
2023-04-29周坤王静静李璐遥王鑫申雪寇瑶瑶马百平王梅郑晓晖赵晔
周坤 王静静 李璐遥 王鑫 申雪 寇瑶瑶 马百平 王梅 郑晓晖 赵晔

摘要 糖脂代謝病是由遗传、环境和精神状况引起的一种复杂性疾病,其特点是糖、脂代谢紊乱,中医学称之为“消渴症”,随着生活水平和社会压力的提高该疾病呈现多龄化趋势。中药的多组分协同增效使其在长期治疗消渴症方面具有明显优势。山楂果、叶富含有机酸和黄酮类成分,在降糖降脂方面具有显著效果。测定了山楂果、叶提取物中主要成分的含量,建立了T2DM大鼠模型,研究了山楂果叶提取物干预AMPKα/SREBP-1/ACCα信号通路进而调节糖脂代谢的作用和机制,结合网络药理学方法分析山楂果、叶治疗T2DM的有效成分、作用靶点和作用机制。结果表明,山楂果、叶配伍给药能更显著降低T2DM大鼠空腹血糖血脂水平,提高糖耐量水平,促进胰岛素分泌,降低脂肪堆积,缩小脂肪细胞,同时调节肝肾功能,增加肝脏AMPKα及其磷酸化水平,降低SREBP-1、ACCα的蛋白表达。网络药理学共筛选到14个山楂果、叶的有效成分,与疾病交集靶点共150个,参与调控PI3K-Akt信号通路、MAPK信号通路、胰岛素抵抗等与糖脂代谢相关的多个信号通路。研究表明,山楂的果、叶配伍能够通过干预AMPKα/SREBP-1/ACCα通路,协同调节糖脂代谢,并且对于PI3k-Akt信号通路、MAPK信号通路、胰岛素抵抗等也有调节作用,具有良好的临床应用前景。
关键词 山楂果;山楂叶;AMPKα/SREBP-1/ACCα;网络药理学;糖脂代谢
中图分类号:R28 DOI:10.16152/j.cnki.xdxbzr.2023-01-009
Compatibility mechanism of hawthorn fruit and leaf regulating
glycolipid metabolism based on AMPKα/SREBP-1/ACCα pathway
ZHOU Kun1, WANG Jingjing1, LI Luyao1, WANG Xin1, SHEN Xue1,
KOU Yaoyao1, MA Baiping2, WANG Mei1,3, ZHENG Xiaohui1, ZHAO Ye1
(1.Chemistry of Chinese Materia Medical Research Laboratory, National Administration of
Traditional Chinese Medicine(Third Grade), Northwest University, Xian 710069, China;
2.Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China;
3.Institute of Biology/SU Biomedicine, Leiden University-EuropeanCenter for Chinese Medicine and Natural Compounds, Leiden 2333BE, Netherlands)
Abstract Glucolipid metabolic disease is a complex disease characterized by disorder of glucose and lipid metabolism and caused by genetic, environmental and mental conditions. It is called "Xiaoke disease" in traditional Chinese medicine. With the improvement of living standards and social pressure, it shows a multi-aging trend. The multi-component synergy of traditional Chinese medicine has obvious advantages in the long-term treatment of diabetes. Hawthorn fruit and leaves are rich in organic acids and flavonoids, which have significant effect on lowering blood sugar and blood lipids. In this study, the contents of the main components in hawthorn fruit and leaf extracts were determined, and the T2DM rat model was established to study the effect and mechanism of hawthorn fruit and leaf extracts on AMPKα/SREBP-1/ACCα signaling pathway and regulation of glucose and lipid metabolism. Combined with the method of network pharmacology, the effective components, action targets and action mechanism of hawthorn fruit and leaf in the treatment of T2DM were analyzed. The results showed that the combined administration of hawthorn fruit and leaf could significantly reduce the fasting blood glucose and lipid level, improve the glucose tolerance level, promote insulin secretion, reduce fat accumulation, shrink adipocytes, regulate liver and kidney function and increase AMPKα phosphorylation, reduce protein expression of SREBP-1 and ACCα. A total of 14 active components of hawthorn fruit leaves were screened by network pharmacology, with a total of 150 disease intersection targets, which are involved in the regulation of PI3K/Akt signaling pathway, MAPK signaling pathway, insulin resistance and other signaling pathways related to glucose and lipid metabolism. This study shows that the compatibility of fruit and leaf of hawthorn can regulate glucose and lipid metabolism through AMPKα-SREBP-1-ACCα pathway, which has a good prospect of clinical application.
Keywords hawthorn fruit; hawthorn leaves; AMPKα/SREBP-1/ACCα; network pharmacology; glycolipid metabolism
糖脂代谢紊乱的主要特征是糖代谢紊乱与脂代谢紊乱,与II型糖尿病(T2DM)、高血脂、高血压、动脉粥样硬化等心脑血管疾病密切相关,对人类的健康威胁日益严重[1]。中药在治疗糖尿病和高脂血症等疾病上有着上千年的历史。山楂果为药食同源,入脾胃经,具有消食化积之力,在改善高血脂症[2]、动脉粥样硬化病变[3]等疾病上具有很好的效果。《中国药典》2020版中记载山楂叶具有“化浊降脂”的功效,可用于治疗心血管疾病[4-6]。现代研究表明山楂叶具有改善T2DM大鼠血糖血脂异常[7]、抑制胰岛组织凋亡[8]、促进胰岛β细胞分泌胰岛素[9]等作用。本研究通过高脂高糖饲料喂养联合注射链脲佐菌素诱导建立T2DM大鼠模型,研究山楂果、叶提取物基于AMPKα/SREBP-1/ACCα信号通路调节糖脂代谢的作用;基于中医整体观和辨证论治的特点,结合网络药理学所构建的基于疾病-表型-基因-药物的多层网络结构研究模式,分析山楂果、叶治療T2DM的有效成分、作用靶点和作用机制。该研究为阐明山楂果、叶协同调节糖脂代谢作用及机制提供理论依据,并为山楂果、叶的深入开发提供基础研究支撑。
1 实验材料和方法
1.1 仪器设备及试剂耗材
Velocity 12R型冷冻离心机(美国Dynamica);Tocan240化学发光仪(上海领成);DikMA C18色谱柱(汉邦科技);LC-20高效液相色谱仪(日本岛津)等。色谱级甲醇、醋酸、乙腈、四氢呋喃(天津科密欧);对照品牡荆素葡萄糖苷(111668)、牡荆素鼠李糖苷(MUST-16011113)、牡荆素(130522)、芦丁(100080)、金丝桃苷(111521),纯度均≥99%,购自中国食品药品检定研究所。本文中试剂制备均为体积分数。
1.2 药材采集及药物溶液的制备
山楂药材采自河北省承德市兴隆县,经鉴定为山里红(crataegus pinnatifida Var Major N.E.Br.)的干燥成熟果实和干燥叶。山楂果去核粉碎,75%乙醇加热回流2 h,得滤液,连续3次。合并3次滤液减压浓缩,取适量浓缩液于烧杯中,滴加1 mol/L NaOH溶液调节山楂果浓缩液的pH至10左右,抽滤得上清液。选择717型强碱阴离子交换树脂湿法装柱,纯水进行洗脱,洗脱液为无色后停止,再选用0.3 mol/L的盐酸溶液洗脱,洗脱液用水饱和乙酸乙酯等体积萃取6次,无水硫酸钠脱水后减压浓缩,真空干燥即得山楂果提取物(hawthorn fruit extract,HOA)。山楂叶采用25%甲醇作为溶剂,加热回流1.5 h,过滤得滤液,连续提取3次,合并滤液,减压浓缩至1 g/mL生药。使用D101型大孔树脂,3倍量10%甲醇洗脱后洗脱液弃去;再3倍量70%甲醇进行洗脱,收集洗脱液并减压浓缩,真空干燥即得山楂叶提取物(hawthorn leaves extract,HLF)。采用《中国药典》中山楂果、叶项下有机酸和总黄酮的含量测定方法进行测定[4],建立山楂叶HPLC方法,色谱条件为:DikMA C18色谱柱(柱长50 mm,柱径4.6 mm, 粒径5 μm),0.2%乙酸水-乙腈-甲醇-四氢呋喃(80∶12∶5∶3)为流动相,等度洗脱,流速为1.0 mL/min,柱温35 ℃,检测波长360 nm,测定山楂叶提取物中主要黄酮成分的含量。山楂果提取物中有机酸含量为60.3%。山楂叶提取物中总黄酮含量为90.5%,其中牡荆素葡萄糖苷含量为596.6 ng/g,牡荆素鼠李糖苷含量为119.6 ng/g,芦丁含量为12.0 ng/g,牡荆素含量为1.0 ng/g,金丝桃苷含量为49.2 ng/g。
1.3 实验动物模型的建立及给药方案
SPF级雄性SD大鼠,体质量(150 ± 30)g,购自西安交通大学医学部实验动物中心,许可证号:SCXK(陕西)2012-003。饲养于西北大学实验动物中心,许可证号:SYXK(陕)2021-004。温度(20±2)℃,湿度(50±10)%,明暗交替各12 h。将大鼠分为正常对照(Con.)组、模型(Mod.)组,Con.组给予标准饲料和纯净水,Mod.组给予高脂高糖饲料和葡萄糖溶液进行饮食诱导,4周后,禁食12 h,腹腔注射28 mg/kg STZ(溶于pH=4.4柠檬酸缓冲液中),3 d后测定血糖,血糖值≥11.1 mmol/L的大鼠,认为是造模成功的,同时Con.组按体质量腹腔注射柠檬酸缓冲液。筛选的模型鼠随机分成5组,每组8只,分别为Mod.组、HLF(100 mg/kg)组、HOA(100 mg/kg)组、山楂果、叶提取物混合(FA,100 mg/kg HLF+100 mg/kg HOA)组、阳性对照盐酸二甲双胍(MFM,266 mg/kg)组,Mod.组动物继续给予高脂高糖饲料,口服灌胃给药,1次/d,连续给药7周。
1.4 检测方法及指标
给药结束后,进行糖耐量实验。大鼠禁食12 h,尾静脉采血测定血糖,灌胃葡萄糖溶液(2 g/kg)后于0.5、1、2 h后测定血糖值并绘制糖耐量曲线。腹腔注射浓度为10 mL/kg的乌拉坦溶液麻醉大鼠,测量体质量,于颈总动脉插管取血,分离血浆检测总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、胰岛素(INS)、总胆红素(TNIL)、碱性磷酸酶(ALP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐(CREA)、尿酸(UA)、尿素(UREA);收集肾周脂肪及睾丸周围脂肪、肝组织,称其质量。取部分脂肪组织保存在4%多聚甲醛溶液中,HE切片观察脂肪形态学变化,其余样本置于-80 ℃的条件中。
1.5 肝脏组织蛋白测定
将大鼠肝组织加入预冷生理盐水研磨混匀,离心,去上清,沉淀加入含1%的PMSF和磷酸酶抑制剂的RIPA裂解液裂解30 min,12 kr/min离心10 min,用BCA蛋白测试盒测定蛋白提取液浓度。加入适量蛋白上样缓冲液,沸水变性。选择SDS-PAGE凝胶,80~120 V电泳,260 mA转膜,5%脱脂奶粉封闭2 h,4 ℃孵一抗过夜。抗体分别为AMPKα、磷酸化腺苷酸活化蛋白激酶(p-AMPKα)、SREBP-1、ACCα、β-actin,按照说明书进行稀释。37 ℃孵育二抗2 h,最后ELC发光液发光,凝胶成像拍照分析蛋白表达。
1.6 数据分析
使用SPSS 20软件进行数据统计学分析,采用单因素方差分析来比较各组间差异性,以GraphPad 8和Image J软件进行数据分析,数据均以±SD表示。
1.7 网络药理学
山楂果叶活性成分基于TCMSP数据库[10]挖掘并结合山楂果叶化学成分相关文献,对山楂果叶的活性成分进行筛选,通过SEA在线服务器、Swiss Target数据库预测相关靶点,去除重复靶点。PubChem数据库中收集这些成分的化学信息。Gene Cards数据库搜索T2DM相关靶标,并對活性成分预测靶点和疾病靶点取交集作为潜在靶点。最后,使用Cytoscape 3.7.2软件[11]建立药物-成分-靶点-疾病网络。String数据库绘制PPI网络,选择“Homo species”物种,选取得分大于0.9的高置信度目标蛋白质,得出PPI网络。将交集靶点基因导入DAVID数据库,对核心靶蛋白的GO功能和KEGG途径[12]进行富集分析。
2 实验结果
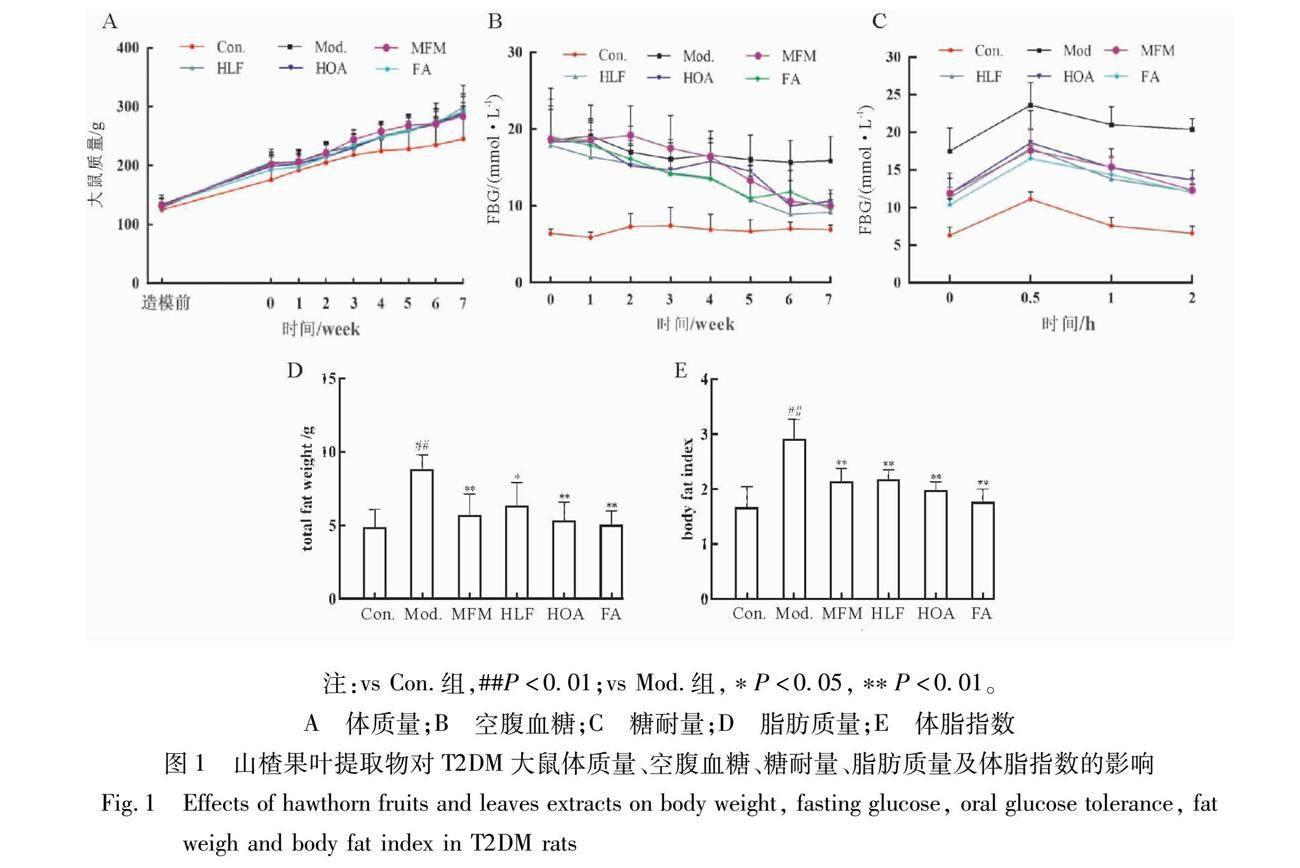
2.1 大鼠体质量、血糖、体脂测定结果
造模前各组大鼠体质量比较均匀,无差异。各组大鼠体质量处于稳定增长,相比Con.组,高脂饲料喂养下的Mod.组大鼠体质量快速增长,给药结束后各给药组之间大鼠体质量无明显差异,但相比与Mod.组大鼠有所改善(见图1A);各给药组大鼠空腹血糖值与Mod.组大鼠血糖相比均显著性下降(P<0.01),见图1B;相比Mod.组,各给药组大鼠糖耐量显著增强(见图1C);从图1D、E可以看出,与Con.组相比,Mod.组大鼠脂肪质量和体脂指数显著升高(P<0.01),各给药组大鼠的脂肪质量和体脂指数显著降低(P<0.01)。各给药组之间无显著性差异。
2.2 血液生化指标结果
经过7周给药后,与Mod.组相比,无论山楂果叶单独给药还是配伍给药均可降低大鼠血清中TC、TG、LDL-C、ALT、AST、TBIL、ALP、CREA、UREA、UA含量,升高大鼠血清中HDL-C和INS含量,有统计学差异,FA调节T2DM大鼠血清中TG、AST、ALP、UA指标的作用效果与单独HLF和HOA有显著差异,结果见图2。
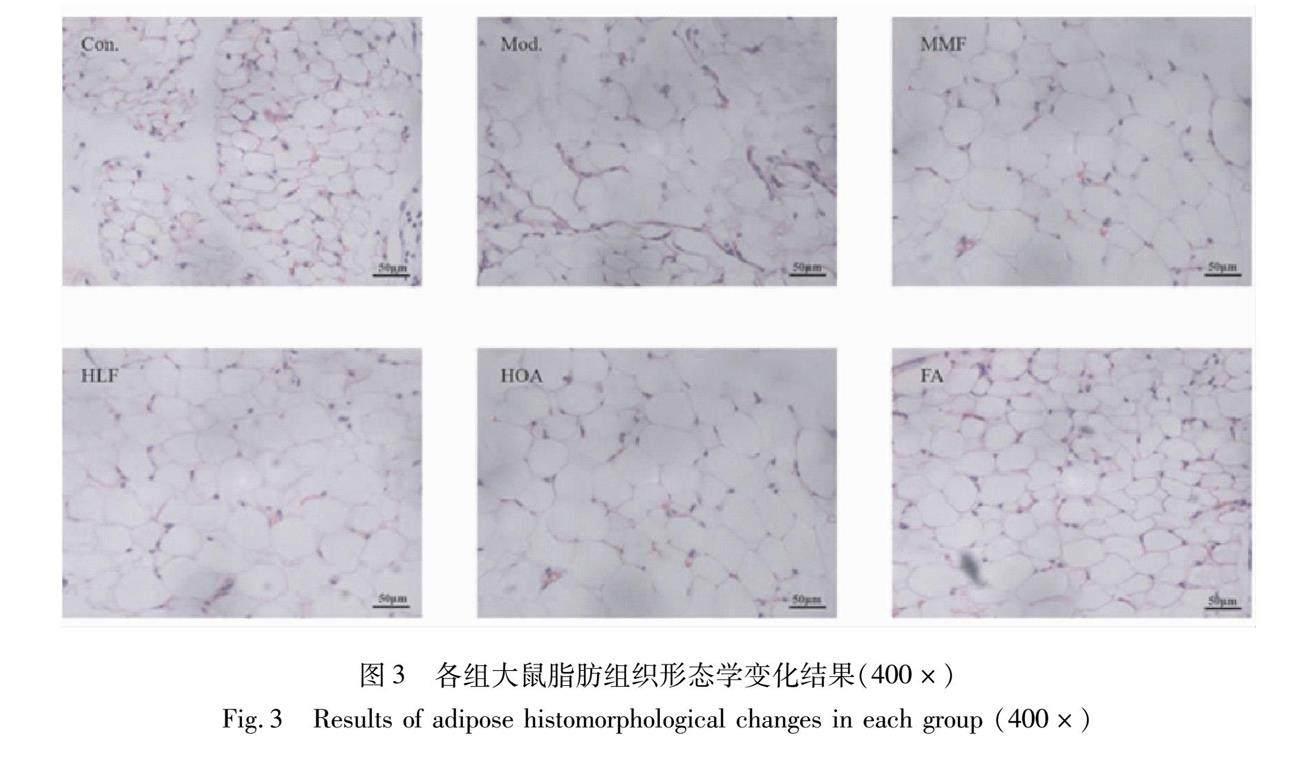
2.3 大鼠脂肪组织形态学观察
相比Con.组,喂养高脂饲料的Mod.组大鼠脂肪细胞的排列较为杂乱且细胞体积增大,同一视野下细胞数量相对于Con.组大鼠数量减少;与Mod.组相比,各给药组大鼠脂肪细胞的排列趋于整齐且大小较为一致,相同视野下给药组大鼠脂肪细胞明显增多,其中FA组大鼠脂肪细胞轮廓更清晰且细胞体积更为接近Con.组大鼠。结果表明,给药组对T2DM大鼠脂组织形态有一定的改善作用(见图3)。
2.4 AMPKα/SREBP-1/ACCα信号通路分析
由图4可知,与Con.组相比,Mod.组肝脏中p-AMPKα活性显著降低,提示T2DM大鼠肝脏AMPK信号通路可能受到抑制。与Mod.组相比,HLF和FA组p-AMPKα表达显著升高(P<0.05或P<0.01),表明HLF和FA具有激活AMPK活性的作用。与Mod.组比较,HLF、HOA和FA组大鼠肝脏中SREBP-1和ACCα蛋白的表达均显著降低(P<0.05或P<0.01),表明SREBP-1和ACCα的活性被抑制。各给药组对比结果发现FA对于p-AMPKα/AMPKα和ACCα的调节作用均强于HLF和HOA。此外,阳性药二甲双胍同样能够激活AMPK信号通路,但相比其调节通路相关蛋白水平的能力,山楂果有机酸提取物和山楂叶总黄酮提取物在调节AMPKα/SREBP-1/ACCα具有更好的调节作用。
2.5 网络药理学分析结果
网络药理学分析从山楂果叶中共筛选14个活性化合物(见表1)。通过查阅文献共筛选出包括黄酮类成分槲皮素、山奈酚、牡荆素,有机酸类成分绿原酸、山楂酸、咖啡酸,三萜类成分熊果酸等14种在山楂果叶中含量较高的有效成分。从SEA和Swiss Target服务器和数据库中预测到388个经过去重的靶点,Gene Cards数据库搜索到T2DM相关靶点9 812个,交集靶点150个。借助Cytoscape软件构建化合物-疾病-靶点多维调控网络,共包含165个节点,802条边,网络聚类系数0.866,网络中的节点分别代表着中药名、化学成分、疾病和作用靶点,连接线代表相互作用(见图5A)。150个共同靶点从STRINH数据库中得到PPI网络,经过Cytoscape软件分析并美化得到PPI网络图,该网络图中根据Degree值显示蛋白相互作用的紧密程度,节点的大小与Degree值呈正相关(见图5B)。Degree值较大的几个靶点被认为是在整个山楂果叶调节T2DM疾病过程中占据很重要的位置,如磷脂酰肌醇三激酶调节亚单位α(PIK3R1)、血管内皮生长因子A(VEGFA)、蛋白激酶1(AKT1)、核因子-κB亚基1(NFKB1)。GO分析确定了生物学过程258条,细胞组分26条,分子功能50条(见图5C)。结果显示,在生物学过程中,显著富集的过程有正向血小板激活、凋亡的负调控、ERK1和ERK2级联的正调控、RNA聚合酶Ⅱ启动子的转录正向调控、MAP激酶活性的正调控等条目;在细胞组分中,显著富集的有细胞质、细胞质膜、细胞溶质、细胞核等;在分子功能方面,最显著富集的包括酶结合、蛋白激酶活性、蛋白结合等功能。KEGG通路功能富集分析得到95条结果,从中筛选了与T2DM关联较大的且具有统计学意义(P<0.05)的15条通路,主要包括PI3K-Akt信号通路、MAPK信号通路、胰岛素抵抗等与糖脂代谢相关的多个信号通路(见图5D)。
3 结语
我国山楂资源丰富,于河北、陕西、山东等地均有种植,价格低廉。传统中医认为山楂果“药食同源”,具有化浊降脂的功效,而山楂叶近年来研究发现在心血管保护方面效果优异。Aierken等研究发现,山楂果提取物可以显著降低T2DM大鼠血清TC、TG及血糖水平,促进血浆INS的释放[13]。山楂果有机酸参与PI3K-Akt、MAPK等通路恢复H2O2诱导的H9c2心肌细胞损伤,抑制Caspase 3/9活性,降低磷酸化NF-κB蛋白表达,并且可能通过调节心肌组织缺氧诱导因子(HIF)1α、B细胞淋巴瘤/白血病2(Bcl-2)、Bcl-2相关蛋白(BAX)表达从而发挥抗心肌缺血再灌注损伤的作用[14]。Dong等发现山楂叶总黄酮提取物具有延缓高脂饮食下载脂蛋白E基因敲除小鼠动脉粥样硬化的发展,显著减少动脉粥样硬化斑块面积23.1%,通过降低血清TC、LDL-C/HLDL-C,增强SOD1和SOD2、谷胱甘肽过氧化物酶等基因的表达改善小鼠主动脉粥样硬化[15]。研究结果显示,HOA提取物提取率为49.82%,HLF提取率为29.4%,HOA和HLF的100 mg/kg给药剂量分别相当于1.73 g/kg原药材和2.93 g/kg原药材。相比山楂果或叶提取物单独给药,联合给药对于T2DM大鼠的糖脂代谢调节的效果更好,能够改善大鼠体质量、内脏脂肪质量、体脂指数、糖耐量水平,显著降低血糖血脂,提高大鼠INS敏感性,升高HDL-C含量,同时改善肝功能和肾功能。
AMPK信号通路的调节在胰岛素抵抗及相关代谢综合症发病机制中起着关键作用,是研究糖尿病及其他代谢相关疾病的核心。研究认为,激活AMPK信号通路在预防和治疗T2DM及其相关代谢疾病发挥重要的作用[16]。磷酸化的AMPK刺激脂肪酸的代谢,通过抑制AMPK的活性,有助于脂肪生成增加,并且通过增加肝脏中丙二酰辅酶A浓度降低脂肪酸氧化速度,被认为是重要的代谢“总开关”[17]。SREBPs属于碱性螺旋-环-螺旋-亮氨酸家族,参与脂质和葡萄糖稳态的调控,在糖尿病、肥胖症、癌症的发病机制中起着关键作用[18]。SREBP-1调控胆固醇与脂肪酸合成中相关酶基因的表达,调节脂肪酸合成酶[19]、低密度脂蛋白受体[20]、ACC[21]、葡萄糖激酶[22]、磷酸烯醇式丙酮酸激酶[23]等。SREBP-1蛋白的过表达会引起肝脏TC和TG的累积而导致脂肪肝、肥胖、胰岛素抵抗等代谢性疾病[24]。乙酰辅酶A羧化酶(ACC)是一种含有生物素的变构羧化酶,其中,ACCα主要存在于肝脏、脂肪等组织,参与脂肪酸的合成[25-26],ACCα水平的变化影响着脂肪的沉积情况和脂质代谢。
研究结果显示,HLF和HOA可通过上调T2DM大鼠肝脏p-AMPKα/AMPKα,下调SREBP-1和ACCα蛋白水平,且FA上调p-AMPKα/AMPKα效果显著优于单独使用HLF和HOA,说明HLF和HOA可协同增效;网络药理学分析表明,熊果酸、槲皮素、金丝桃苷、牡荆素鼠李糖苷等14种活性成分,可能作用于PIK3R1、VEGFA、AKT1、NFKB1等靶点,主要涉及正向血小板激活、凋亡的负调控、RNA聚合酶Ⅱ启动子的转录正向调控等生物学过程,参与到PI3K-Akt信号通路、MAPK信号通路、胰岛素抵抗等与糖脂代谢相关的多个通路,进一步说明山楂果叶的不同成分配伍后具有多靶点、多通路的治疗T2DM作用。本研究为山楂果、叶联合治疗糖脂代谢疾病的产品开发提供更详尽的基础数据支撑。山楂果和山楂叶的化学组成已基本明晰,其中,各自所含的单体成分对山楂提取物调节糖脂代谢作用的贡献和量效关系尚待进一步比较研究。
参考文献
[1] GUO J. Research progress on prevention and treatment of glucolipid metabolic disease with integrated traditional Chinese and Western medicine[J]. Chinese Journal of Integrative Medicine, 2017, 23(6): 403-409.
[2] KWOK A, ZVETKOVA I, VIRIUE S, et al. Truncation of Pik3r1 causes severe insulin resistance uncoupled from obesity and dyslipidaemia by increased energy expenditure[J]. Molecular Metabolism, 2020, 10(40): 101020.
[3] 宓伟, 王淇, 李小真, 等. 山楂原花青素及维生素C联合应用对胰岛素抵抗大鼠肾脏保护作用[J]. 中草药, 2017, 48(21): 4479-4484.
MI W, WANG Q, LI X Z, et al. Effects of hawthorn proanthocyanidins and vitamin C on kidney protection in insulin-resistance rats[J]. Chinese Traditional and Herbal Drugs, 2017, 48(21): 4479-4484.
[4] 國家药典委员会. 中华人民共和国药典(2020年版一部)[M]. 北京: 中国医药科技出版社, 2020: 33-34.
[5] GUO Q, YE P Z, QI X H, et al. Cardiovascular pharmacology research progress of hawthorn leaves extract[J]. Key Engineering Materials, 2015, 636: 167-169.
[6] 李澎, 王建农, 侯金才, 等. 山楂叶原花青素對血管内皮细胞钙活化作用的研究[J]. 中国中药杂志, 2018, 43(12): 2600-2606.
LI P, WANG J N, HOU J C, et al. Calcium mobilizing effect of hawthorn leaf procyanidins in vascular endothelial cells[J]. China Journal of Chinese Materia Medica, 2018, 43(12): 2600-2606.
[7] 周少英, 苏静, 阚敏宸, 等. 山楂叶总黄酮对2型糖尿病大鼠血糖血脂和抗氧化能力的影响[J]. 江苏中医药, 2016, 48(5): 79-82.
ZHOU S Y, SU J, KAN M C, et al. Effects of total flavonoids from hawthorn leaves on blood glucose and lipid and antioxidant capacity of type 2 diabetic rats[J]. Jiangsu Journal of Traditional Chinese Medicine, 2016, 48(5): 79-82.
[8] 张鹏, 张培新. 山楂叶总黄酮对2型糖尿病大鼠胰腺组织保护作用的研究[J].中药药理与临床, 2015, 31(5): 72-75.
ZHANG P,ZHANG P X.Protective effects of hawthorn leaves flavonoids on pancreatic tissue in diabetic rats[J].Pharmacology and Clinics of Chinese Materia, 2015, 31(5): 72-75.
[9] 杨文娟. 山楂叶总黄酮对游离脂肪酸损伤胰岛细胞保护作用的初步研究[D].西安:第四军医大学,2012.
[10]RU J L, LI P, WANG J N, et al. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6(1): 1-6.
[11]SHANNON P, MARKIEL A, OZIER O, et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks[J]. Genome Research, 2003, 13(11): 2498-2504.
[12]KANEHISA M, FURUMICHI M, TANABE M, et al. KEGG: New perspectives on genomes, pathways, diseases and drugs[J]. Nucleic Acids Research, 2017, 45(1): 353-361.
[13]AIERKEN A, BUCHHOLZ T, CHEN C, et al. Hypoglycemic effect of hawthorn in type II diabetes mellitus rat model[J]. Journal of the Science of Food and Agriculture, 2017, 97(13): 4557-4561.
[14]李露. 山楂有机酸组分抗缺血再灌注心肌细胞凋亡的机制研究[D].南昌:江西中医药大学, 2019.
[15]DONG P Z, PAN L L, ZHANG X T, et al. Hawthorn (Crataegus pinnatifida Bunge) leave flavonoids attenuate atherosclerosis development in apoE knock-out mice[J]. Journal of Ethnopharmacology, 2017, 198:479-488.
[16]RUDERMAN N B, CARLING D, PRENTKI M, et al. AMPK, insulin resistance, and the metabolic syndrome[J]. Journal of Clinical Investigation, 2013, 123(7): 2764-2772.
[17]YOU M, MATSUMOTO M, PACOLD C M, et al. The role of AMP-activated protein kinase in the action of ethanol in the liver[J]. Gastroenterology, 2004, 127(6): 1798-1808.
[18]MOSLEHI A, HAMIDI-ZAD Z. Role of SREBPs in liver diseases: A mini-review[J]. Journal of Clinical and Translational Hepatology, 2018, 6(3):332-338.
[19]BENNETT M K, LOPEZ J M, SANCHEZ H B, et al. Sterol regulation of fatty acid synthase promoter. Coordinate feedback regulation of two major lipid pathways[J]. Journal of Biological Chemistry, 1995, 270(43): 25578-25583.
[20]BRIGGS M R, YOKOYAMA C, WANG X D, et al. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter[J]. Journal of Biological Chemistry, 1993, 268(19): 14490-14496.
[21]LOPEZ J M, BENNETT M K, SANCHEZ H B, et al. Sterol regulation of acetyl coenzyme a carboxylase: A mechanism for coordinate control of cellular lipid[J].Proc Natl Acad Sci U S A, 1996, 93(3): 1049-1053.
[22]FORETZ M, GUICHARD C, FERRE P, et al. Sterol regulatory element binding protein-1c is a major mediator of insulin action on the hepatic expression of glucokinase and lipogenesis-related genes[J].Proc Natl Acad Sci U S A, 1999, 96(22): 12737-12742.
[23]CHAKRAVARTY K, LEAHY P, BECARD D, et al. Sterol regulatory element-binding protein-1c mimics the negative effect of insulin on phosphoenolpyruvate carboxykinase (GTP) gene transcription[J]. Journal of Biological Chemistry, 2001, 276(37): 34816-34823.
[24]UNGER R H, ZHOU Y T. Lipotoxicity of β-cells in obesity and in other causes of fatty acid spillover[J]. Diabetes, 2001, 50(S1):118-121.
[25]ABU-ELHEIGA L, JAYAKUMAR A, BALDINI A, et al. Human acetyl-CoA carboxylase: Characterization, molecular cloning, and evidence for two isoforms[J].Proc Natl Acad Sci U S A, 1995, 92(9): 4011-4015.
[26]BARBER M C, PRICE N T, TRAVERS M T. Structure and regulation of acetyl-CoA carboxylase genes of metazoa[J]. Biochimica et Biophysica Acta, 2005, 1733(1): 1-28.
(編 辑 张 欢)
