活性氧在红缘拟层孔菌杀伤白血病细胞中的作用研究
2023-04-29成晓霞王子见何凤琴成瀛
成晓霞 王子见 何凤琴 成瀛
摘要 红缘拟层孔菌抗肿瘤作用受到广泛关注,但其弱极性化合物对白血病细胞的增殖抑制及作用机制尚缺乏实验证据。采用MTT法评价红缘拟层孔菌不同极性组分抗肿瘤活性,结果显示氯仿组分(FPKc)可显著抑制U937细胞的增殖;进而结合流式细胞术分析FPKc杀伤白血病细胞的作用机制,发现其能够显著提升胞内活性氧含量,同时伴随细胞质膜电位下降、胞内钙离子浓度上升、线粒体膜电位崩解、细胞凋亡率增加,而活性氧抑制剂则能明显缓解细胞凋亡的发生,提高细胞存活率。因此,FPKc可能调控活性氧的过量生成促进U937细胞的死亡。
关键词 红缘拟层孔菌;人急性单核白血病U937细胞;活性氧;细胞凋亡
中图分类号:R932;Q28 DOI:10.16152/j.cnki.xdxbzr.2023-01-008
The role of reactive oxygen species (ROS) in Fomitopsis pinicola
(Sw.Ex Fr.m) Karst induced suppression to leukemia cells
CHENG Xiaoxia1, WANG Zijian1, HE Fengqin1, CHENG Ying2
(1.Xian Key Laboratory of Natural Product Development, Anticancer Innovative Drug Research in Qinling,
Genetic Engineering Laboratory in Xian University, College of Biology and Environmental Sciences, Xian University,
Xian 710065, China; 2.School of Life Science and Technology, Xian Jiaotong University, Xian 710049, China)
Abstract Fomitopsis pinicola (Sw. Ex Fr.m) Karst (FPK) is a traditional Chinese herb for treatment of fever, analgesic, anti-inflammatory and especially for antitumor, but the inhibitory effect of active compounds on the proliferation of leukemia cells and its potential mechanism remains unclear. The present study was to evaluate the possible anti-proliferative activity of three organic fractions from F. pinicola on three leukemia cells. MTT assay showed that FPK chloroform extract (FPKc) displayed higher anti-tumor effect on U937 cells than that of ethylacetate and butanol fraction. Flow cytometry studies revealed that FPKc induced ROS accumulation in U937 cells. Loss of plasma and mitochondrial membrane potential, increase of intracellular Ca2+ concentration and the rate of apoptosis were observed clearly after treatment with FPKc. However, NAC as ROS inhibitor, could significantly alleviate the occurrence of cell apoptosis and improve the ratio of viable cells. Therefore, ROS generated in U937 cells played an important role in F. pinicola induced apptosis.
Keywords Fomitopsis pinicola (Sw. Ex Fr. m) Karst; Human acute mononuclear leukemia U937 cells; reactive oxygen species; cell apoptosis
红缘拟层孔菌Fomitopsis pinicola (Sw. Ex Fr.m) Karst. 属担子菌纲Basidiomycetes、非褶菌目Aphyllophorales、多孔菌科Polyporaceae、拟层孔菌属Fomes,又名红缘层孔菌、红缘多孔菌、松生拟层孔菌、红缘树舌、红带菌等,为北半球针叶林区广泛分布的木腐真菌,多见于我国长白山及秦岭地区[1]。《中国药用真菌》记载,红缘拟层孔菌味微苦、性平、无毒,能祛风除湿、解热、强心、补肺益肾、和胃健脾、安神定志、扶正培本[2]。自1960年至今,国内外学者研究表明,红缘拟层孔菌含有多糖、萜类、脑苷脂类、油酸、亚油酸、棕榈酸等成分,且有抑菌、抗炎、抗肿瘤、抗氧化、降血糖等功效[3-7]。近年来,有学者陆续报道红缘拟层孔菌的弱极性化合物也表现出抗肿瘤、抗氧化、抗炎、解热、镇痛等生理活性[8-12],但具体作用机制研究尚不充分。因此,本研究以体外培养的白血病细胞为模型,评价红缘拟层孔菌各极性组分的抗肿瘤活性,进而分析活性组分对人急性单核白血病U937細胞内活性氧(reactive oxygen species, ROS)、线粒体膜电位、细胞质膜电位、Ca2+浓度和细胞凋亡率的影响,探讨ROS造成的膜损伤在红缘拟层孔菌杀伤U937细胞中的作用,以期为菌物药的研究与开发利用积累资料。
1 材料与方法
1.1 材料
1.1.1 细胞株人慢性髓系白血病K562细胞、人急性单核白血病U937细胞由中国北京协和医科大学引进,将其培养于含10%(体积分数)胎牛血清的RPMI-1640培养基中;小鼠白血病L1210细胞、人胚肾上皮HEK-293细胞由中国科学院上海生命科学研究院细胞资源中心引进,将其培养于含10%(体积分数)胎牛血清的DMEM培养基中;以上细胞均在5%(体积分数)CO2、37 ℃饱和湿度的培养箱中常规培养,使用对数生长期细胞进行实验。
1.1.2 药物及制备红缘拟层孔菌子实体采自陕西秦岭平河梁,海拔2 193~2 352 km,33°27′385N~33°27′960N,108°30′087E~108°30′093E。经陕西师范大学肖娅萍教授鉴定为红缘拟层孔菌Fomitopsis pinicola (Sw. Ex Fr.m) Karst.,标本存于西安文理学院标本馆(NO.201506001)。将红缘拟层孔菌子实体清洗、烘干、粉碎,称取400 g粉末,加入30倍体积的95%乙醇超声提取,滤液减压浓缩得浸膏122.7 g(得率30.68%),用蒸馏水混悬后依次用氯仿、乙酸乙酯、水饱和正丁醇萃取,得到红缘拟层孔菌氯仿组分(FPKc)、乙酸乙酯组分(FPKe)、正丁醇组分(FPKb),分别相当于生药量的16.98%、1.01%、0.94%。在生物安全柜中用DMSO配制浓度为100 mg/mL的储存液,由基础培养基稀释为工作液。
1.1.3 主要试剂胎牛血清(Gibco公司);RPMI-1640、DMEM、无菌PBS、谷氨酰胺、胰酶、双抗(HyClone公司);DMSO、MTT、罗丹明123、DCFH-DA、NAC、DiBAC4、Fluo4-AM(Sigma公司);细胞凋亡试剂盒(Millipore公司);其他试剂均为国产分析纯。
1.1.4 主要仪器超纯水仪、CO2培养箱(Thermo公司);生物安全柜(BAKER公司);酶标仪(BioTek公司);流式细胞仪(Millipore公司);高速冷冻离心机(Eppendorf公司);超声波清洗器(昆山禾创超声仪器有限公司);旋转蒸发仪(上海申生科技有限公司)。
1.2 方法
1.2.1 MTT法检测细胞存活率取对数生长期K562细胞、U937细胞、L1210细胞、HEK-293细胞,分别制成单细胞悬液,以1×104个/孔接种于96孔培养板,置于5%(体积分数)CO2、37 ℃饱和湿度的培养箱中培养。12 h后,分别加入0 ~ 250 μg/mL的FPKc、FPKe、FPKb含药培养基继续培养,分别于24、48 h向待测孔板中避光加入MTT(2.5 mg/mL, 20 μL/孔)溶液,孵育4 h后终止培养,平板离心机3 kr/min离心15 min后,弃去上清培养液,每孔加入150 μL DMSO,置摇床震荡15 min,待蓝紫色甲瓒完全溶解后,酶标仪测定570 nm吸光度值。以对照组的吸光值为空白对照调零,取至少6孔的平均值计算细胞的存活率,实验重复3次。按照公式:细胞存活率=(药物组OD570/对照组OD570)×100%计算经过药物处理后的细胞存活率,结合药物的作用剂量,推算出药物对相应肿瘤细胞的半数抑制浓度IC50,以此衡量药物的抗肿瘤活性。
1.2.2 细胞内活性氧检测荧光探针DCFH-DA是一种自身无荧光的亲脂性ROS指示剂,其进入细胞可被酯酶水解成无荧光形式的DCFH,后者可被胞内O-2·、OH·、H2O2 等氧化成具有熒光的DCF,在蓝光激发下产生绿色荧光,荧光的强弱与细胞内ROS水平呈正相关。实验组1:U937细胞经不同剂量FPKc处理,分别于1、2、4、8 h收集各组细胞;实验组2:U937细胞经5 mM的活性氧清除剂N-乙酰半胱氨酸(NAC)预孵育1 h后,加入40 μg/mL FPKc作用2 h;实验组3:HEK-293细胞经40 μg/mL FPKc分别作用2、8 h。以上实验组收集细胞经PBS洗涤、重悬,加入终浓度为4 μM DCFH-DA 37 ℃避光孵育20 min,在激发波长488 nm、发射波长530 nm条件下利用流式细胞仪检测,FCS Express V3软件分析各组细胞平均荧光强度值(mean fluorescence intensity, MFI)。试验重复3次。
1.2.3 细胞线粒体膜电位变化细胞线粒体具有内负外正的跨膜电位,能够摄入阳离子染料罗丹明123(rhodamine 123, Rh123),发出绿色荧光,当线粒体膜发生损伤时,跨膜电位降低或消失,摄入的荧光染料减少,荧光会减弱。取对数生长期的U937细胞,调节细胞密度为1×105cells/mL,向其中加入FPKc(10、20、40 μg/mL),分别于2、4、6、8 h离心收集各组细胞,PBS洗涤、重悬,加入终浓度为4 μg/mL的Rh123染液,37 ℃避光孵育20 min,流式细胞仪检测分析各组细胞MFI。试验重复3次。
1.2.4 细胞质膜电位检测DiBAC4是一种自身无荧光的亲脂性阴离子荧光染料,当细胞膜去极化时,膜电位下降,DiBAC4可进入细胞与胞浆蛋白结合发出荧光。U937细胞经FPKc(10、20、40 μg/mL)作用4 h后离心收集细胞,PBS洗涤、重悬,加入终浓度为1 μM的DiBAC4,37 ℃避光孵育20 min,流式细胞仪检测分析各组细胞MFI。试验重复3次。
1.2.5 细胞内钙离子浓度检测Fluo-4/AM进入细胞后可被脂解为Fluo-4,后者可与胞内游离的Ca2+特异性结合,产生的荧光强度与Ca2+浓度成正比。U937细胞经FPKc(10、20、40 μg/mL)处理4 h,离心收集细胞,基础培养基洗涤、重悬,加入终浓度为5 μM的Fluo-4/AM,37 ℃避光孵育20 min,流式细胞仪检测分析各组细胞MFI。试验重复3次。
1.2.6 细胞凋亡率测定FPKc诱导U937细胞凋亡率采用Guava Nexin Assay试剂盒进行定量分析。Annexin V-PE用来检测凋亡细胞的磷脂酰丝氨酸(phosphatidylserine,PS)外翻,而细胞膜非通透性染料7-AAD则作为细胞膜完整性受损导致细胞坏死的指示剂。密度为1×105cells/mL的U937细胞经FPKc(10、20、40 μg/mL)作用24 h后,收集细胞,按照试剂盒说明书要求,将100 μL工作液与100 μL细胞悬液混匀,37 ℃避光孵育20 min,立即进行流式细胞仪检测。试验重复3次,FCS Express V3软件分析流式细胞仪检测结果。
1.3 数据处理
试验数据以“平均值±标准差(±s)”表示,采用SPSS 25.0统计软件进行单因素方差分析,选用Duncan法进行显著性检验,P< 0.05为差异具有统计学意义,多重比较结果用字母法进行标记。
2 结果与分析
2.1 红缘拟层孔菌抗肿瘤活性组分筛选
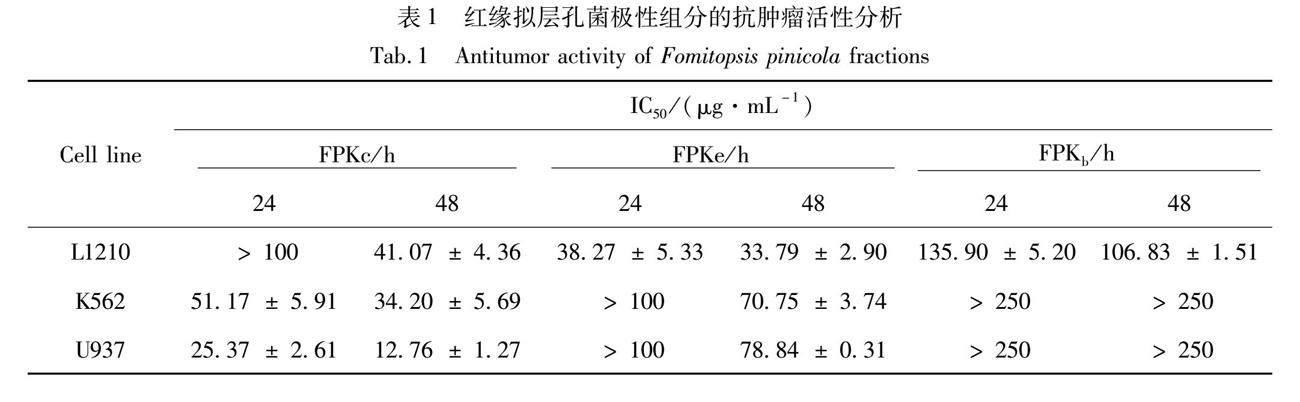
将FPKc、FPKe、FPKb分别与小鼠白血病L1210细胞、人慢性髓系白血病K562细胞、人急性单核白血病U937细胞在实验条件下共孵育,结果见表1。药物对细胞生长的半数抑制浓度与其细胞毒性呈反比,即IC50值越低,该药物的细胞毒性越强。对FPKb而言,其对3种白血病细胞的IC50值均大于100 μg/mL,故FPKc与FPKe的抗肿瘤活性优于FPKb。随着药物作用时间的延长,FPKc与FPKe对3种白血病细胞的增殖抑制能力均呈现不同程度的增加。药物作用48 h后,FPKc对U937细胞的IC50为(12.76±1.27) μg/mL,为供试药品中最小值,且其对K562细胞的杀伤能力也优于FPKe,推断FPKc是红缘拟层孔菌细胞毒性成分富集部位。
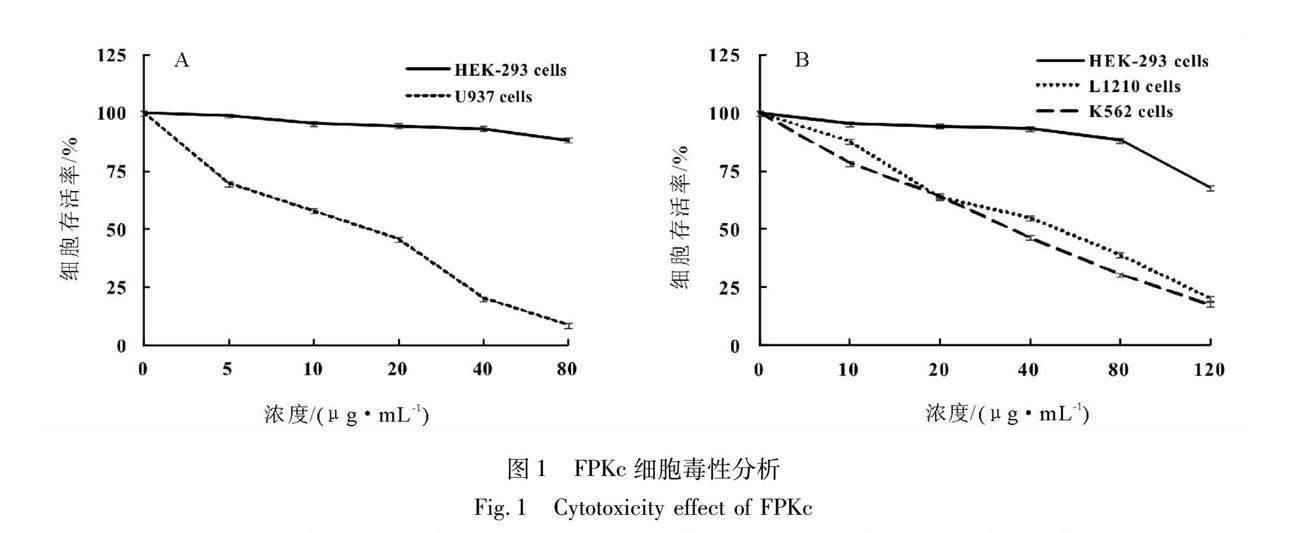
相同条件下,将FPKc与人胚肾上皮HEK-293细胞和3种白血病细胞共孵育(见图1),10 μg/mL的FPKc作用后,U937、L1210、K562细胞的存活率分别下降至57.85%、87.85%、78.26%,但HEK-293细胞的存活率为95.43%;当FPKc的剂量增加至40 μg/mL,3种白血病细胞的存活率均降至半数以下,而HEK-293细胞的存活率仍为93.30%;以上结果提示,白血病细胞对FPKc的作用更为敏感。
2.2 FPKc对U937细胞内ROS含量的影响
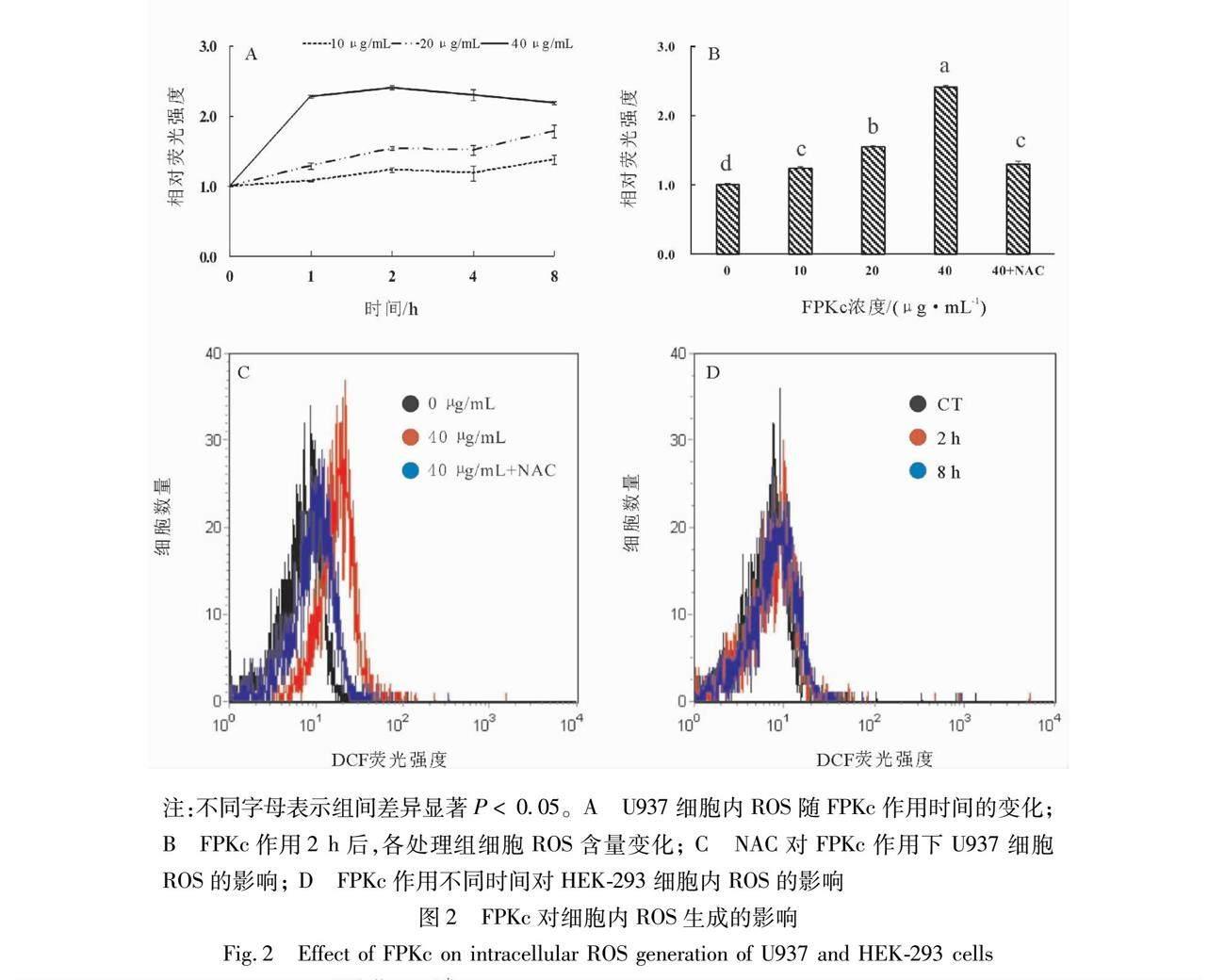
细胞内荧光强度与ROS含量呈正比,由图2A可见,FPKc可显著促进U937细胞内ROS的生成,40 μg/mL作用2 h,ROS的含量逐渐上升接近峰值,随着作用时间的延长逐渐回落,而当作用剂量下降为10 ~ 20 μg/mL时,药物作用8 h内,ROS生成量稳步上升。当FPKc作用2 h,U937细胞内ROS水平随FPKc剂量的增加逐步上升,差异显著(P< 0.05),40 μg/mL处理组细胞内ROS含量是对照组的2.28倍,而活性氧抑制剂NAC则可明显缓解细胞内ROS的增加(见图2B);这一趋势可通过直方图直观反映,与对照组相比,40 μg/mL的FPKc作用可使细胞内DCF的荧光强度呈上升趋势,表现为峰形右移且峰高上升趋向尖锐,加入NAC后,峰形左移且锐度下降,说明细胞内DCF的荧光强度下降(见图2C)。然而,40 μg/mL 的FPKc作用HEK-293细胞后,通过直方图观察到,3个实验组峰形重叠,通过MFI值进行分析,组间无显著性差异(P> 0.05),说明FPKc并未引起HEK-293细胞内ROS水平的波动。
2.3 FPKc对U937细胞线粒体膜电位的影响
U937细胞经FPKc處理2 h后,与对照组相比(见图3),细胞的荧光强度显著下降,说明药物处理后细胞线粒体膜电位快速丧失,外膜发生去极化;在不同剂量处理组中均能观察到,随着作用时间的延长,8 h内细胞荧光强度均呈现下降趋势(见图3A)。通过流式细胞术直方图可直观显示,随着FPKc剂量的增加,代表荧光强度的波峰明显左移,MFI值显著下降(P< 0.05),意味着细胞线粒体膜电位的下降与药物浓度呈正相关(见图3B)。
2.4 FPKc对U937细胞质膜电位的影响
U937细胞与FPKc共孵育4 h后(见图4),随着药物作用剂量的增加,代表荧光强度的波峰明显右移,细胞内荧光强度显著增加(P< 0.05)。表明FPKc能够促使膜电位绝对值下降,诱导细胞发生严重去极化,且此趋势具有剂量依赖性。
2.5 FPKc对U937细胞内钙离子含量的影响
FPKc作用U937细胞4 h后(见图5),与对照组相比,低剂量药物并不能影响细胞内钙离子的变化,而中高剂量作用后,直方图中的荧光峰明显右移,此时胞内平均荧光强度显著上升(P<0.05),说明20、40 μg/mL FPKc可显著提升细胞内钙离子浓度。
2.6 FPKc诱导U937细胞凋亡的分析
细胞凋亡是受到多基因调控的复杂生理过程,凋亡发生时位于细胞膜内侧的PS外翻至细胞膜表面,与被荧光素PE标记的Annexin V特异性结合,发出绿色荧光;而当细胞膜受损则可摄取7-AAD,呈现红色荧光。图6中活细胞因细胞膜完整呈现红绿荧光低染,位于点状图的左下角(LL);当细胞出现早期凋亡的时候会表现出绿高红低,此时细胞位于右下角(LR);随着细胞膜受损程度的加剧,细胞进入晚期凋亡,此时胞内红绿荧光强度均增加,细胞位于右上角(UR);当胞内荧光绿低红高则表明细胞已经不可逆转地走向死亡(UL)。该实验重复3次,对其结果进行统计学分析结果见表2,对照组细胞存活率为(97.93±1.17)%,随着FPKc作用剂量由10 μg/mL增加至40 μg/mL,活细胞比例降至(83.68±3.83)%、(59.70±0.85)%,此时凋亡细胞由(1.11±0.42)%骤增至(15.58±4.66)%、(32.53±6.10)%(P< 0.05);当NAC与高剂量药物组共孵育后,凋亡细胞的比例显著下降至(22.22±3.36)%(P< 0.05),同时伴随着细胞存活率明显回升到(75.37±1.56)%。
3 討论
肿瘤严重威胁着人类的健康,目前临床施用的手术、放疗、化疗等方法可在一定程度上缓解癌症患者的病情,但伴随而来的毒副作用也大大降低了患者的生存质量。随着科技的发展,层出不穷的分子层面个体化治疗方案也将部分患者从死神手中解救出来,但高昂的医疗费用也让许多患者及家庭望而却步[13]。中草药药源广泛、价格低廉、应用历史悠久,具有不良反应少、遗传毒性低等优点,可以在治疗癌症的同时对机体的功能从根本上进行恢复,增强病人免疫力,延长生存期,是当前防治肿瘤新药研发的热点[14]。本研究以体外培养的人慢性髓系白血病K562细胞、人急性单核白血病U937细胞、小鼠白血病L1210细胞为模型,通过MTT法测定细胞存活率,筛选出红缘拟层孔菌的氯仿组分(FPKc)是抗肿瘤活性物质富集部位,这一结果也与孙雪等的研究[15]相互印证。该研究曾报道红缘拟层孔菌氯仿提取物较石油醚和水层提取物而言,对H22荷瘤小鼠具有较高抑瘤率,且从氯仿提取物中分离出的化合物可显著抑制人肝癌细胞SMMC-7721和人乳腺癌细胞MCF-7的生长。同时,本研究提示FPKc对白血病细胞的毒性作用较正常组织来源的HEK-293细胞敏感。
中草药次生代谢产物在化合物类型、结构上表现出多样性和复杂性,是一个天然形成的“组合化学样品库”,因而具有多层次、多靶点、多环节的全方位调控网络,阐明中药的抗肿瘤机制可加快新药研发的进程,成为中药现代化发展的有利推手。对健康人群而言,体内低浓度的ROS可作为信号分子参与各种生理活动,但多数肿瘤患者体内的ROS水平升高,与正常细胞相比,肿瘤细胞处于相对较高的氧化应激状态[16-18]。因此,靶向调节细胞内ROS水平,选择性杀伤肿瘤细胞成为抗癌新思路,并得到公认和应用。本研究发现,FPKc可显著提升U937细胞内ROS水平,但未能引发HEK-293细胞内ROS水平的变化。结合MTT实验的结果,推测调节胞内ROS水平的变化是FPKc选择性杀伤U937细胞的可能机制。这与一些天然化合物,如冬凌草甲素[19-21]、木香烃内酯[22]等类似,即通过促进细胞内ROS的产生,诱导细胞凋亡。
细胞膜因其磷脂双分子层的特殊结构易成为ROS攻击的靶标,通过脂质过氧化作用,改变细胞膜结构,增加细胞膜通透性,进而影响到细胞膜对离子的选择透过,导致细胞质膜电位发生改变[23-24]。本研究通过试验发现,FPKc能够促使U937细胞膜电位绝对值下降,诱导细胞发生严重去极化,导致胞外Ca2+内流,造成细胞内Ca2+浓度显著上升。众所周知,Ca2+作为重要的第二信使参与细胞内基因表达、周期调控、细胞运动、细胞凋亡等生理活动。当胞内Ca2+浓度增加,可激活线粒体合成ATP,该过程伴随着ROS的产生,线粒体产生的ROS可通过特定的通透性转换孔(mitochondrial permeablity transition pore, mPTP)释放至胞质,维持线粒体内氧化还原平衡[24-27]。当线粒体钙超载时,高水平的ROS刺激mPTP持续开放,造成线粒体膜电位崩解,释放大量促凋亡蛋白进入胞质,诱导细胞发生凋亡[28-29]。本研究观察到,经FPKc处理后,U937细胞线粒体膜电位快速丧失,外膜发生严重去极化现象,同时细胞凋亡率显著上升,但活性氧抑制剂能显著缓解细胞凋亡的发生。
4 结语
综上,FPKc杀伤U937细胞可能通过促使白血病细胞内ROS的过量积累,影响细胞膜的功能,导致胞内维持高浓度Ca2+水平,进而继续促进线粒体过量生成ROS,刺激线粒体mPTP持续开放,释放促凋亡蛋白,诱导细胞发生凋亡;同时,大量Ca2+流入胞质,超载现象加剧,可能启动其他相关路径,导致细胞死亡,其具体调控机制还有待于进一步研究。
参考文献
[1] YING J Z,MAO X L,MA Q M,et al.Illustrated handbook for medicinal fungi from China[M].Beijing:Science Press,1987.
[2] WU X L,MAO X L,TOLGOR B,et al.Medicinal fungi of China[M].Beijing: Science Press,2013: 218.
[3] 赵兴华, 包海鹰, 崔宝凯. 红缘拟层孔菌化学成分与药理活性研究概述[J].菌物研究, 2010, 8(2): 119-124.
ZHAO X H, BAO H Y, CUI B K.Progress of researches on chemical constituents and pharmacogical actions of Fomitopsis pinicola[J].J Fun Res,2010,8(2):119-124.
[4] KELLER A C, MAILLARD M P, HOSTETTMANN K. Antimicrobial steroids from the fungus Fomitopsis pinicola [J]. Phytochem, 1996, 41(4):1041-1046.
[5] KAZUKO Y, MEGUMI I, YUKI M, et al.Lanostane triterpenoids and triterpene glycosides from the fruit body of Fomitopsis pinicola and their inhibitory activity against COX-1 and COX-2[J].J Nat Prod,2005,68(1):69-73.
[6] CHOI D B, PARK S S, DING J L,et al. Effects of Fomitopsis pinicola extracts on antioxidant and antitumor activities [J]. Biotec & Biopro Engi,2007,12(5):516-524.
[7] LEE S I, KIM J S, OH S H, et al.Antihyperglycemic effect of Fomitopsis pinicola extracts in streptozotocin-induced diabetic rats [J].J Med Food, 2008,11(3):518-524.
[8] GAO J S, CHEN X H, JIANG J H, et al.Antitumor effect of alcoholic extract from Formitopsis pinicola and its mechanism[J].Prog in Mod Biomed,2010,10(21):4055-4061.
[9] WANG Y Q, CHENG X X, WANG P, et al. Investigating migration inhibition and apoptotic effects of Fomitopsis pinicola chloroform extract on human colorectal cancer SW-480 cells[J].PLoS One,2014,9(7):e101303.
[10]WU H T, LU F H, SU Y C, et al. In vivo and in vitro anti-tumor effects of fungal extracts[J].Molecules, 2014, 19(2): 2546-2556.
[11]孙琦, 黄威, 包海鹰, 等. 红缘拟层孔菌固体发酵产物体内抗肿瘤和抗氧化作用研究[J].菌物学报, 2016, 35(8): 965-974.
SUN Q, HUANG W, BAO H Y, et al. Anti-tumor and antioxidation activities of solid fermentation products of Fomitopsis pinicola [J].Mycosystema,2016,35(8):965-974.
[12]赵秀红, 包海鹰. 红缘拟层孔菌子实体提取物的抗炎镇痛解热活性研究[J].食用菌学报, 2019, 26(3): 82-90.
ZHAO X H, BAO H Y. Study on anti-inflammatory, analgesic and antipyretic activities of extracts of Fomitopsis pinicola fruiting bodies[J].Acta Edulis Fungi,2019,26(3):82-90.
[13]XING X Y, WANG X C, HE W.Advances in research on tumor immunotherapy and its drug development[J].J China Pharm Univ,2021,52(1):10-19.
[14]LI X J, WU M X, KONG F M, et al.Review of anti-tumor activity and mechanism of Chinese materia medica active ingredients [J].Chinese Trad & Herb Drugs,2020,51(9):2587-2592.
[15]孫雪, 赵兴华, 包海鹰. 红缘拟层孔菌子实体中抗肿瘤活性成分研究[J].时珍国医国药, 2012, 23(7): 1634-1637.
SUN X, ZHAO X H, BAO H Y.Antitumor active constituent in fruiting body of Fomitopsis pinicola [J].Lish Med & Mat Med Res,2012,23(7):1634-1637.
[16]KARIHTALA P, SOINI Y. Reactive oxygen species and antioxidant mechanisms in human tissues and their relation to malignancies [J].APMIS, 2007, 115(2):81-103.
[17]MOLONEY J N, COTTER T G. ROS signalling in the biology of cancer [J].Semin Cell Dev Biol, 2018, 80:50-64.
[18]DIWANGI N, BERGMANN A. An unexpected friend-ROS in apoptosis-induced compensatory proliferation: Implications for regeneration and cancer[J].Semin Cell Dev Biol, 2018, 80:74-82.
[19]ZHANG Y H, WU Y L, TASHIRO S, et al. Reactive oxygen species contribute to oridonin-induced apoptosis and autophagy in human cervical carcinoma HeLa cells[J]. Acta Pharmacol Sin, 2011, 32(10):1266-1275.
[20]PI J, CAI H, JIN H, et al. Qualitative and quantitative analysis of ROS-mediated oridonin-induced oesophageal cancer KYSE-150 cell apoptosis by atomic force microscopy[J].PLoS One,2015,10(10):e0140935.
[21]KIM D H, PARK K W, CHAE I G, et al. Carnosic acid inhibits STAT3 signaling and induces apoptosis through generation of ROS in human colon cancer HCT116 cells[J].Mol Carcinog,2016,55(6):1096-1110.
[22]HUA P Y, SUN M, ZHANG G X, et al. Costunolide induces apoptosis through generation of ROS and activation of P53 in human esophageal cancer Eca-109 cells [J]. J Biochem Mol Toxicol, 2016, 30(9):462-469.
[23]ZEESHAN H M, LEE G H, KIM H R, et al. Endoplasmic reticulum stress and associated ROS[J]. Int J Mol Sci, 2016, 17(3):327.
[24]CUI C C, MERRITT R, FU L W, et al. Targeting calcium signaling in cancer therapy[J]. Acta Pharm Sin B, 2017, 7(1): 3-17.
[25]BROOKES P S, YOON Y, ROBOTHAM J L, et al. Calcium, ATP, and ROS: A mitochondrial love-hate triangle [J]. Am J Physiol Cell Physiol, 2004, 287(4):817-833.
[26]ADAM-VIZI V, STARKOV A A. Calcium and mitochondrial reactive oxygen species generation: How to read the facts [J]. J Alzheimers Dis, 2010, 20(S2): 413-426.
[27]VORONINA S, OKEKE E, PARKER T, et al. How to win ATP and influence Ca2+ signaling[J]. Cell Calcium, 2014, 55 (3):131-138.
[28]MADESH M, HAJNOCZKY G. VDAC-dependent permeabilization of the outer mitochondrial membrane by superoxide induces rapid and massive cytochrome c release [J]. J Cell Biol, 2001, 155 (6):1003-1015.
[29]MARCHI S, VITTO V M, PATERGNANI S, et al. High mitochondrial Ca2+ content increases cancer cell proliferation upon inhibition of mitochondrial permeability transition pore (mPTP) [J]. Cell Cycle, 2019, 18(8): 914-916.
(編 辑 张 欢)
